可变剪接经久不衰 Nature再次发文可变剪接在肿瘤中的关键作用
胰腺导管腺癌(PDA)的特点是较强的局部侵袭和转移性扩散,导致高致死率。虽然PDA进展过程中的驱动基因突变是保守的,但没有特定的突变与转移相关。在此,作者分析了大量原发性和转移性PDA肿瘤的RNA剪接数据,以确定与PDA进展相关的不同剪接事件。发现,RBFOX2的剪接调控功能是PDA的肿瘤抑制因子,并提出了一种治疗转移性PDA的方法。本文于2023年5月发表在《Nature》IF:69.5期刊。
技术路线:

主要实验结果:
1、PDA的AS事件整体情况
文献分析PDA基因组揭示的4个PDA驱动关键基因KRAS,SMAD4,CDKN2A,TP53,但它们都在PDA进展中保守,没有关于它们突变对PDA转移进展的报道。此外,AS事件在PDA中发挥重要作用,所以作者猜想AS事件可能在PDA转移中扮演某种未知作用。为此,作者对395个PDA患者样本的RNA测序数据进行AS事件的PCA分析,发现了两个cluster。基于临床和/或病理信息的集群注释显示,这两个集群与肿瘤部位相关性良好,61%的原发性胰腺肿瘤属于cluster 1,71%的转移性肿瘤属于cluster 2(图1a)。关注原发组和转移组之间最稳健的差异剪接事件,使用被正确注释为原发或转移肿瘤的样本进行进一步分析(图1a,方框小图)。在原发组和转移组之间鉴定了大约8000个显著差异的剪接事件。前20个剪接事件足以将PDA患者样本分为与临床分期高度相关的两组(图1b)。
对显著差异剪接事件的Reactome通路富集分析显示,参与细胞骨架组织和迁移的RHO GTPase通路基因富集(图1c)。然后,对RHO通路基因的差异剪接事件进行了无偏倚的从头基序分析。这些事件的5 '剪接位点上游最丰富的基序与RBFOX2结合序列具有高度同源性(图1d)。我们观察到在PDX衍生的转移性患者样本中,剪接因子RBFOX2的蛋白水平低于原发肿瘤样本,而mRNA水平没有明显差异(图1e-g)。这些结果表明一个可能的机制,即RBFOX2介导的剪接可能通过细胞骨架的变化调节转移过程。

图1 PDA的AS事件整体情况
2、RBFOX2是转移抑制因子
接下来研究RBFOX2是否直接影响PDA细胞的转移能力。为此,用表达RBFOX2的逆转录病毒转导PDX衍生的转移细胞X50和X139(图2a)。RBFOX2的过表达极大地降低了这些细胞的转移潜力,这可以从它们在伤口愈合试验中的迁移减少和与对照组细胞相比的菌落形成抑制中观察到,而不影响增殖(图2b-c)。为测试RBFOX2对体内侵袭的影响,将用RBFOX2 cDNA的mCherry标记的X50 PDX细胞静脉注射到NOD-SCID小鼠体内。与注射对照细胞的小鼠相比,观察到肺转移瘤的数量大幅减少(图2d)。这些结果表明,RBFOX2的过表达抑制PDA细胞的转移潜力。使用两种不同的CRISPR引导RNA对RBFOX2进行敲除,明显增加了BxPC3原代PDA细胞和原代PDX衍生的细胞系(X252)的集落形成和迁移率,同样,没有检测到对增殖的影响(图2a, e, f)。将GFP标记的RBFOX2耗尽的BxPC3原代PDA细胞静脉注射到NOD-SCID小鼠体内,发现与对照细胞相比,肺转移的数量增加,肿瘤体积明显增大(图2g)。为确认这些表型是否归因于RBFOX2的耗竭,设计一种针对RBFOX2中外显子-内含子交界处的sgRNA(RBFOX2 EIJ sgRNA),从而只沉默内源性的RBFOX2(图2a)。用RBFOX2 EIJ sgRNA处理的Cas9表达的BxPC3细胞具有与RBFOX2基因敲除细胞类似的表型,将RBFOX2的cDNA引入这些细胞可挽救其表型(图2h, i)。
RBFOX2蛋白含有一个RNA识别图案(RRM),它可以识别共识序列GCAUG。为确定RBFOX2的剪接调节活性是否是其对转移性PDA的影响的原因,用敲除RRM的RBFOX2 cDNA(RBFOX2ΔRRM)来拯救表达RBFOX2 EIJ sgRNA的X50转移性PDA细胞和BxPC3原生PDA细胞的表型。表达RBFOX2ΔRRM并没有减弱这两种细胞系的表型,这表明RBFOX2的RRM对其在PDA进展中的肿瘤抑制活性是必不可少的。

图2 RBFOX2在胰腺癌进展中作为转移性肿瘤抑制因子
3、RBFOX2介导局灶黏附
为确定调节PDA细胞转移过程的基本RBFOX2剪接目标,作者确定了114个RBFOX2依赖的交替剪接事件,这些事件在每个比较组中都是相互调节的,P值小于0.05,|ΔPSI|大于10%(图3a, b)。Reactome分析显示,87个RBFOX2调控的基因在RHO GTPase (RHOA、CDC42和RAC1)通路上的富集(图3c)。
4、RBFOX2抑制RHO GTPase通路
为研究RBFOX2对RHO GTP酶途径的调节是否对胰腺癌的进展至关重要,利用两种RHO GTP酶途径的抑制剂: MBQ167和硫唑嘌呤。对RBFOX2缺失的BxPC3细胞施用MBQ167可抑制其迁移率,但体外的存活率或增殖率没有变化(图3d-f)。对静脉注射GFP标记的RBFOX2耗尽的BxPC3细胞或GFP标记的PDX衍生的转移性X50细胞的小鼠体内给予MBQ167,可抑制肺部转移(图3g-h)。

图3 RBFOX2调控胰腺癌进展中的AS事件
5、RBFOX2调控的PDA进展与MPRIP 23号外显子跳跃异构体有关
在本研究中发现的RBFOX2调节的剪接事件之一是MPRIP的剪接。MPRIP最初被确定为一种RHOA结合蛋白,并被发现与F-actin和MYPT1结合。此外,据报道,MPRIP通过其RHO GTP酶激活蛋白的活性抑制RHOA,表明对RHOA-ROCK途径有抑制性调节活性。然而,还没有关于MPRIP的剪接异构体及其在转移中的作用的报道。过表达RBFOX2诱导MPRIP的23号外显子包含,而RBFOX2敲除则诱导跳跃该外显子(图4a,b)。与原发肿瘤相比,转移性PDA样本中MPRIP 23号外显子跳跃异构体的数量较高(PSI较低)(图4c)。根据PSI中值,MPRIP低组的患者生存结果更差(图4d)。这些结果支持这种MPRIP剪接事件在PDA进展中的临床意义。因此,作者预测MPRIP 23号外显子跳跃异构体与PDA进展中的致癌活性有关。
接下来测试MPRIP剪接的调控是否会影响PDA肿瘤细胞系的转移潜力。为诱导MPRIP 23号外显子跳跃异构体,设计了针对第23外显子的3′或5′剪接位点的CRISPR sgRNAs。这两种sgRNA都能触发23号外显子的有效跳转(图4e)。与对照组细胞相比,表达这些sgRNAs的BxPC3原代肿瘤细胞在软琼脂中表现出更强的迁移能力和菌落形成,但对增殖率没有影响(图4f,g)。将GFP标记的BxPC3原发肿瘤细胞用3′或5′剪接位点sgRNAs静脉注射到NOD-SCID小鼠体内,与对照细胞相比,肺转移灶的数量明显增加(图4h)。
为强制MPRIP的第23外显子包含在转移细胞中,设计一个sgRNA,破坏了位于第24外显子3′非翻译区的RBFOX2图案(GCAUG)。通过基于CRISPR的诱变中断RBFOX2图案,增加了外显子23的包含(图4i)。携带靶向RBFOX2图案的sgRNA(DS-24 MPRIP sgRNA)的X50转移细胞显示出明显减慢的迁移能力,软琼脂中的菌落形成减少,但对增殖率没有影响(图4j,k).9b)。为研究MPRIP剪接调制在体内的影响,将表达CRISPR对照或DS-24 MPRIP sgRNA的GFP标记的X50转移细胞静脉注射到NOD-SCID小鼠体内。值得注意的是,在注射表达MPRIP外显子23保留异构体的转移的X50细胞,抑制了体内的转移潜力(图4l)。
以上结果表明RBFOX2调控的PDA进展与MPRIP 23号外显子跳跃异构体有关。
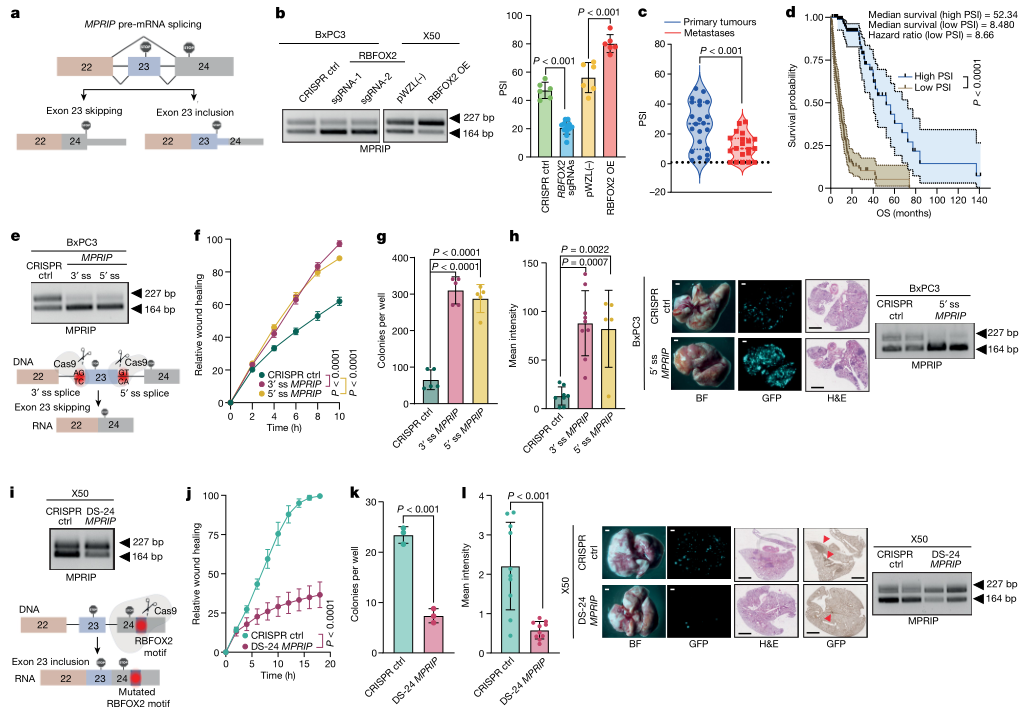
图5 调节MPRIP剪接调控胰腺肿瘤细胞的转移潜能
总之,本研究表明剪接因子RBFOX2在PDA中作为转移性抑制因子的作用,并确定了转移性PDA中RBFOX2调节的替代剪接特征。RBFOX2调节的剪接目标中检测到RHO GTP酶通路基因的富集,并证明它们在胰腺癌细胞入侵中的功能作用。对RHO-RAC途径的药理操作或对这些途径中的替代剪接事件的精确调控可以改变致癌性与肿瘤抑制性异构体的平衡,并可能具有作为PDA治疗目标的潜力。
实验方法:
RNA-seq,PCA分析,可变剪接(AS)分析,序列motif分析,裸鼠PDA PDX模型构建,细胞培养,免疫印迹,mRNA稳定性实验,蛋白稳定性实验,CRISPR–Cas9技术敲低或剪接调控,慢病毒和逆转录病毒感染,贴壁不依赖性生长实验,划痕实验,台盼蓝排除生存试验,RT–PCR,RT–qPCR,免疫荧光,小鼠转移模型构建,小鼠荷瘤模型,HE,IHC,IP,质谱
参考文献:
Jbara A, Lin KT, Stossel C, Siegfried Z, Shqerat H, Amar-Schwartz A, Elyada E, Mogilevsky M, Raitses-Gurevich M, Johnson JL, Yaron TM, Ovadia O, Jang GH, Danan-Gotthold M, Cantley LC, Levanon EY, Gallinger S, Krainer AR, Golan T, Karni R. RBFOX2 modulates a metastatic signature of alternative splicing in pancreatic cancer. Nature. 2023 May;617(7959):147-153. doi: 10.1038/s41586-023-05820-3. Epub 2023 Mar 22. PMID: 36949200; PMCID: PMC10156590.






