治疗帕金森病——响应性人工酶原位持续供给多巴
口服二羟苯丙氨酸(多巴)补充神经元多巴胺仍然是帕金森病(PD)最有效的治疗方法。然而,与正常神经元持续稳定的多巴胺信号不同,口服多巴引起血浆多巴水平剧烈波动,导致多巴诱导的运动障碍。在此,作者报道了一种基于功能核酸的响应性人工酶(FNA-Fe3O4)用于原位连续生产Dopa。FNA-Fe3O4可以跨越血脑屏障,依靠转铁蛋白受体适配体靶向病变神经元。然后,FNA-Fe3O4响应病变神经元中过表达的α -突触核蛋白mRNA进行反义寡核苷酸处理和荧光成像,同时转换为模拟酪氨酸羟化酶的酪氨酸适配体人工酶(Apt-Fe3O4)用于原位连续生产多巴。体内FNA-Fe3O4治疗导致PD小鼠模型中Dopa和多巴胺水平恢复,病理性过表达的α -突触核蛋白减少,从而改善运动症状和记忆缺陷。本文提出的基于功能核酸的响应性人工酶策略为PD的诊断和治疗提供了一种更神经元友好的方法。本研究于2023年5月发表于期刊《Nature Communications》上,IF:16.6。
技术路线:
主要研究结果:
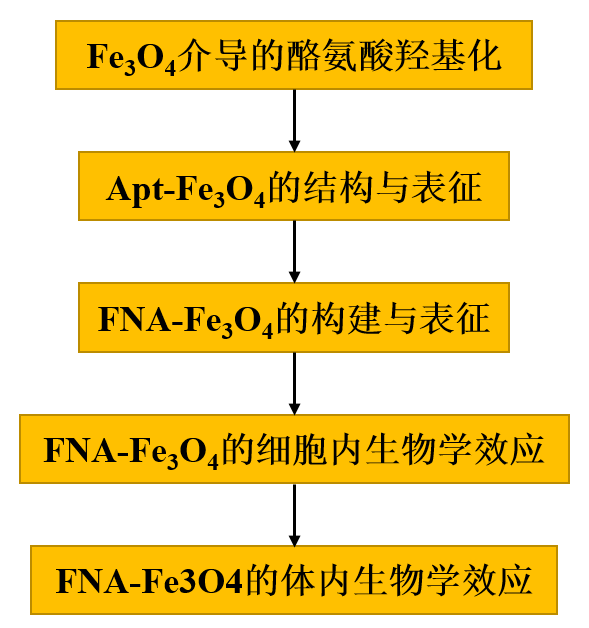
在本研究中,作者首先详细解释了Fe3O4纳米粒子在过氧化氢(H2O2)和抗坏血酸(AA)存在的情况下,对酪氨酸羟基化产生多巴(图1a,Phase I)。进一步构建了基于酪氨酸适配体的人工酶(Apt-Fe3O4),其中Fe3O4作为催化活性中心,酪氨酸适配体29作为底物结合位点(图1a,Phase II)。在病变神经元中,FNA-Fe3O4被转化为Apt-Fe3O4以响应高水平的SNCA mRNA,从而表现出类似于Dopa产生的酪氨酸羟化酶活性(图1a,Phase III)。

图1
1、Fe3O4介导的酪氨酸羟基化
Fe3O4纳米颗粒先前被报道可以催化酪氨酸的多步氧化,通过中间产物多巴(Dopa)生成最终产物多巴色素。然而,中间产品Dopa形成的详细机制尚未得到解释。因此,作者探究中间产物Dopa的稳定存在,以及在病理浓度的AA和H2O2存在下Fe3O4催化酪氨酸羟基化生成Dopa的过程。以市售15 nm水分散表面羧基修饰的Fe3O4纳米粒子为模型,考察其催化酪氨酸羟基化合成多巴的性能。图2a显示了在10 μg mL-1 Fe3O4、5 mM H2O2和5 mM AA存在下,100 μM酪氨酸羟化转变成多巴过程中的含量变化。反应混合物中的每个组分都是驱动酪氨酸羟基化为多巴所必需的(图2b)。根据这些组分的反应活性,可能存在多种活性自由基中间体。tert-Butanol倾向于主要淬灭·OH,而乙醇能有效清除·OH和Fe(IV)=O39。反应体系中tert-Butanol的加入在5 min后轻度抑制了反应39.4 %,而乙醇的加入诱导了更严重的抑制60.4 %(图2c)。这些差异可归因于羟基化过程中·OH和高自旋Fe(IV)=O的参与。
为进一步了解Fe3O4在H2O2和AA存在下催化酪氨酸羟基化生成Dopa的机理,作者进行了一系列电子自旋共振(ESR)实验,并将这些结果与反应的活性中间体进行了关联。图2d显示了Fe3O4与H2O2共存的混合体系中明显的羟基自由基(·OH)信号,这与Fe3O4纳米酶40固有的过氧化物酶活性一致。图2e表明,Fe3O4与AA共存时,没有检测到自由基的产生。而在Fe3O4、H2O2和AA存在下,观察到新的自由基信号为过氧自由基(·OOH),并且伴随着体系中·OH的完全消失(图2f)。H2O2与AA之间没有发生直接的自由基反应(图2g)。这些结果表明AA是·OOH形成的关键促进剂并导致·OH耗竭。进一步地,在·OOH的混合体系中加入酪氨酸底物后,·OOH的强度降低,自由基种类没有发生变化(图2h),暗示·OOH为酪氨酸向多巴的转化提供了关键物种。据报道,·OOH与Fe2+结合生成高自旋Fe(IV)= O中间体41,其结构与生物蛋白酪氨酸羟化酶的活性中心相似。以二甲基亚砜(DMSO)作为Fe(IV)=O的探针,通过氧原子转移与Fe(IV)= O反应生成二甲基砜(MSM)。根据图2i的气相色谱-质谱(GC-MS)分析结果,随着反应时间的延长,MSM的峰逐渐增强,表明可能发生了Fe(IV)= O。这些结果为酪氨酸羟基化的机理路径提供了有效的解释(图2j)。Fe3O4与H2O2反应产生的·OH在AA的催化作用下转化为·OOH。然后·OOH介导生成活性中间体Fe(IV)=O,最后羟基化酪氨酸生成多巴。

图2 Fe3O4纳米颗粒的酪氨酸羟化酶模拟活性
2、Apt-Fe3O4的结构与表征
适体结合位点与纳米酶的共价连接被引入作为一种通用的方法,通过将反应底物集中在催化纳米酶核心上来提高纳米酶的催化活性,从而模拟天然酶的结合和催化活性位点功能(图3a)。在确定Fe3O4纳米酶的酪氨酸羟化酶模拟活性后,通过EDC/NHS介导的酰胺缩合反应将Fe3O4纳米酶与5 '端氨基修饰的酪氨酸适体共价偶联,构建基于酪氨酸适体的人工酶Apt-Fe3O4。作者还制备了随机序列DNA偶联的Fe3O4(Ran-Fe3O4)用于对比。
作者考察不同浓度的酪氨酸(所有实验均使用5 mM H2O2和5 mM AA)在Fe3O4、Ran-Fe3O4和Apt-Fe3O4(10 μg mL-1)的催化作用下,酪氨酸羟化生成多巴的速率随酪氨酸浓度的变化,如图3b的动力学曲线所示。对于Apt-Fe3O4或对照,观察到Michaelis-Menten-type saturation kinetic曲线。与纯Fe3O4相比,Ran-Fe3O4的催化活性几乎相同,而Apt-Fe3O4的催化活性显著提高。Apt-Fe3O4催化活性的增强归因于靠近催化界面的底物的高局部浓度,这是由于适配体与酪氨酸底物的特异性结合。
值得注意的是,水溶液作为最简单的模型,无法模拟实际的细胞内大分子拥挤环境。因此,在以20 wt % PEG-20000作为拥挤剂的模拟拥挤环境中评估了Apt-Fe3O4和对照的催化能力。如图3c所示,与水溶液中的催化速率相比,Fe3O4和Ran-Fe3O4的催化速率明显下降,表明它们的催化功能在复杂的细胞环境中受到严重干扰。然而,Apt-Fe3O4令人满意地保留了其大部分催化效率,这无疑是适配体对酪氨酸的选择性捕获。酪氨酸与适配体的特异性结合,增加了酪氨酸在Apt-Fe3O4上的停留时间,有利于活性中间体的形成,使反应易于在拥挤的环境中进行。这一特性有利于基于酪氨酸适配体的人工酶Apt-Fe3O4在复杂的细胞内环境中执行催化任务。
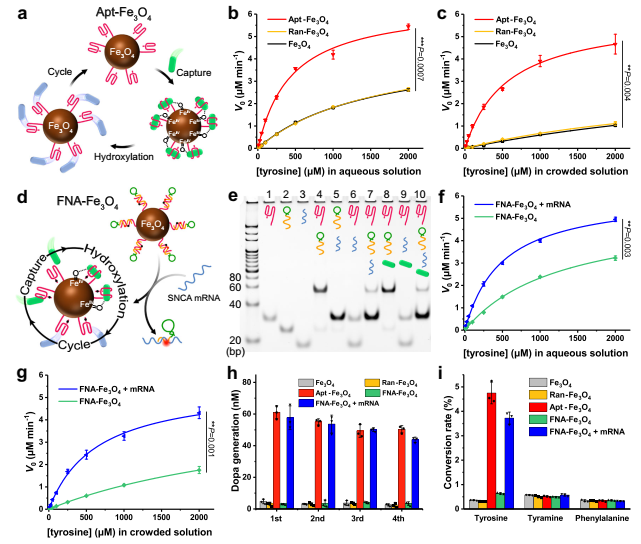
图3 人工酶的表征及其催化和荧光成像性能
3、FNA-Fe3O4的构建与表征
其次,为实现人工酶对PD治疗的高效BBB穿越和神经元特异性响应,设计了由SNCA反义寡核苷酸和TfR适配体组成的阻断链,并与Apt-Fe3O4上的酪氨酸适配体杂交,构建了基于功能核酸的响应型人工酶FNA-Fe3O4(图3D)。
通过聚丙烯酰胺凝胶电泳(PAGE)验证FNA-Fe3O4响应SNCA mRNA的链置换反应性。如图3e所示,嵌段链可以首先与酪氨酸适配体杂交(泳道4)。该双链在酪氨酸的生理浓度范围内稳定(泳道8)。然而,嵌段链随后被SNCA mRNA取代以释放游离的酪氨酸适体(泳道10)。同时,监测SNCA相关生物标志物的含量可以为PD的荧光成像提供有效手段。
随后测定了FNA-Fe3O4在SNCA mRNA存在和不存在时的酪氨酸羟化酶模拟活性。如图3f中的动力学曲线所示,在水溶液和拥挤溶液中,FNA-Fe3O4与SNCA mRNA发生链置换反应后表现出较高的催化活性。而单独的FNA-Fe3O4的催化活性保持在较低的水平,尤其是在拥挤溶液中。这一特性提供FNA-Fe3O4不会影响正常细胞中多巴胺稳态的潜力,仅在SNCA mRNA异常过表达的细胞中提供Dopa。
FNA-Fe3O4与SNCA mRNA反应后,能够连续捕获酪氨酸溶液中的酪氨酸,并在含有H2O2和AA的溶液中催化酪氨酸羟基化,反应5 min内的多巴生成在4次重复中保持稳定(图3h),这将是人工酶典型的循环催化过程的有力证明。此外,以几种常见的能够芳香环羟基化的胞内小分子(酪胺和苯丙氨酸)作为模型干扰物,测试人工酶对酪氨酸的底物选择性。如图3i所示,在反应5 min内,FNA-Fe3O4 + mRNA对酪氨酸的羟基化转化率远高于其他干扰物质,对酪氨酸表现出优异的选择性,证明了其胞内抗干扰能力。此外,在含有酪氨酸、H2O2和AA的Apt-Fe3O4、FNA-Fe3O4和FNA-Fe3O4 + mRNA(10 μg mL-1)溶液中,反应30 min后均未产生DNA片段,说明了反应过程中DNA链的稳定性。
4、FNA-Fe3O4的细胞内生物学效应
BBB是FNA-Fe3O4进入多巴胺能神经元的第一个障碍。因此,用表达TfR的永生化小鼠脑内皮细胞(bEnd.3)建立体外BBB模型,在顶端侧加入人工酶,考察其穿膜效率(图4a)。随着时间的推移,FNA-Fe3O4在基底侧逐渐累积,120 min后转运效率上升至21.8 %(图4b)。相比之下,Apt-Fe3O4,Ran-Fe3O4,和不含TfR适配体的Fe3O4在基底侧缓慢积累。这些结果表明FNA-Fe3O4可以高效地通过体外BBB模型,其中TfR适配体发挥了重要作用。
在验证了FNA-Fe3O4的跨BBB作用后,作者进一步检测其在神经元中的内化情况。作者使用TfR阳性的小鼠小胶质细胞BV2细胞作为PD的细胞模型。以Cy5修饰的不含BHQ2的FNA-Fe3O4为荧光探针,以Apt-Fe3O4和Ran-Fe3O4为荧光探针。与不含TfR适配体的Apt-Fe3O4和Ran-Fe3O4相比,FNA-Fe3O4对目标BV2细胞具有更好的结合位移(图4c)。代表FNA-Fe3O4的强烈Cy5荧光信号主要定位于BV2细胞的细胞质中,并在较长时间内保持在胞内高水平(图4d)。细胞活性测试结果表明FNA-Fe3O4对BV2细胞几乎没有明显的细胞毒性(图4e),表明其与脑内皮细胞具有良好的生物相容性。这些性质为FNA-Fe3O4的细胞内应用提供基础。
为评估核酸组分在FNA-Fe3O4上的功能,作者设计了两种对照纳米材料。Cat-Fe3O4代表酪氨酸羟化酶模拟活性的影响,ASO-Fe3O4代表反义寡核苷酸疗法(图5a-b)。作者通过其脱羧产物多巴胺的含量来监测。如图5c所示,FNA-Fe3O4处理的正常细胞内多巴胺含量变化不大,表明其不会干扰正常神经元内多巴胺稳态。在FNA-Fe3O4处理的PD细胞中,多巴胺含量在8 h内呈逐渐上升趋势,随后达到稳定平台期。这一结果证明,FNA-Fe3O4可以在细胞中发挥类似酪氨酸羟化酶的功能,以应对细胞特异性空间控制的SNCA mRNA的异常过度表达。同时,Cat-Fe3O4也表现出类似的酪氨酸羟化酶模拟活性,而ASO-Fe3O4则没有,这反映了酪氨酸适配体对人工酶催化的决定性作用。作者还尝试了直接多巴孵育(0.5、2、8 μM)对细胞内多巴胺水平的影响。孵育2 h后更换培养液模拟多巴胺短的血浆半衰期,细胞内多巴胺含量逐渐降低(图5d)。较高剂量的多巴维持了较长时间的多巴胺水平,但也导致了多巴胺含量更剧烈的波动。总的来说,多巴胺水平的长期增加意味着多巴治疗的时间更长,而多巴胺水平的剧烈波动预示着神经元中多巴胺的稳态失调。这是导致多巴的治疗效果和副作用控制无法平衡的根本原因。相比之下,FNA-Fe3O4提供的原位连续多巴产量表现出更长的持续时间和更可接受的多巴胺波动。需要指出的是,由于多巴和多巴胺的有效生理浓度远低于酪氨酸,因此应用FNA-Fe3O4进行酪氨酸羟基化不会影响细胞内酪氨酸稳态。
将阻断链与SNCA mRNA杂交也降低了SNCA的表达。人工酶共孵育36 h后,FNAFe3O4和ASO-Fe3O4降低PD细胞模型SNCA蛋白表达水平(图5e),有利于延缓神经元退变。同在图5f的荧光分析中,显示EGFP绿色荧光信号的细胞为SNCA mRNA过表达细胞。FNA-Fe3O4对共培养的正常细胞和PD细胞显示出不同的荧光信号强度,证明FNA-Fe3O4可以响应过表达的SNCA mRNA通过荧光成像区分正常和PD神经元(图5g)。相应的流式细胞仪获得了一致的荧光分析结果(图5h)。这些结果表明FNA-Fe3O4能够监测细胞内SNCA mRNA的表达水平。

图4 人工酶的细胞可利用性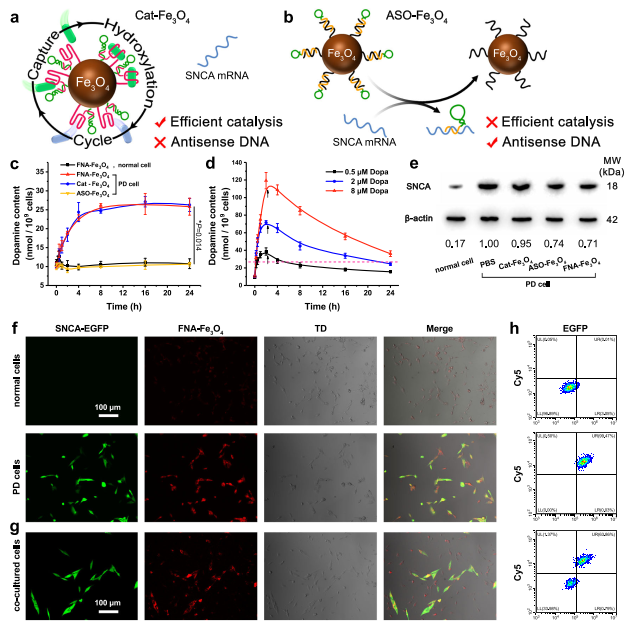
图5 人工酶的细胞内生物学效应
5、FNA-Fe3O4的体内生物学效应
研究分别以野生型小鼠和携带小鼠胸腺细胞抗原1(Thy1)启动子驱动的人野生型SNCA的Thy1-SNCA转基因小鼠作为正常和PD动物模型。与正常小鼠相比,尾静脉注射FNA-Fe3O4后4 h内,PD小鼠脑内可观察到逐渐增强的Cy5荧光信号(图6a),表明FNA-Fe3O4可实现PD动物模型的成像。
随后,在PD小鼠尾静脉注射Cat-Fe3O4、ASO-Fe3O4或FNA-Fe3O4(4 mg kg-1)时进行纹状体微透析,分析人工酶催化原位Dopa产生。具有类酪氨酸羟化酶特性的Cat-Fe3O4和FNA-Fe3O4使脑组织中多巴和多巴胺水平升高至略低于正常水平,而ASO-Fe3O4未引起多巴和多巴胺水平的变化(图6b-c)。这一趋势表明人工酶介导了脑内多巴胺系列神经递质生成的恢复。相应地,比较了Dopa给药期间的微透析结果。多巴胺的上升趋势只维持了(约4 h内)短暂的时间且波动较大(图6d),从而显示出人工酶策略的优越性。经过20天的治疗后(图6e),反义寡核苷酸ASO-Fe3O4和FNA-Fe3O4显著降低了脑组织中SNCA的表达,而Cat-Fe3O4对过表达SNCA的影响可以忽略(图6f)。这一结果揭示人工酶上反义寡核苷酸部分对于调控过表达SNCA的重要性。
持续的原位多巴生成和缓解异常的SNCA过表达共同作用于Thy1-SNCA小鼠的PD病理特征。因此,进一步通过爬杆实验和悬线实验(图6g-h)评价小鼠的运动协调能力。可见,PD小鼠的运动协调能力明显差于健康小鼠。Cat-Fe3O4和ASO-Fe3O4部分恢复了PD小鼠的运动能力,分别反映了酪氨酸羟化酶替代治疗和反义寡核苷酸治疗对PD症状的缓解。单独使用Cat-Fe3O4的治疗效果略优于ASO-Fe3O4,因为原位多巴供给可以直接作用于多巴胺能神经系统。反义寡核苷酸治疗的贡献在于缓解PD病理过程,因此FNA-Fe3O4治疗的小鼠表现出比单药治疗更好的性能。此外,PD小鼠可表现出学习记忆能力的下降,可通过被动回避实验进行检测。24 h滞留中更长的穿越潜伏期代表更完整的学习记忆。在PD小鼠中给予Cat-Fe3O4和ASO-Fe3O4在相似的水平上有助于改善学习和记忆的下降,并且FNA-Fe3O4治疗更明显。这些结果表明FNA-Fe3O4可以促进PD小鼠模型的运动障碍和记忆缺陷的恢复,其治疗作用来源于酪氨酸羟化酶模拟活性和反义寡核苷酸的协同作用。
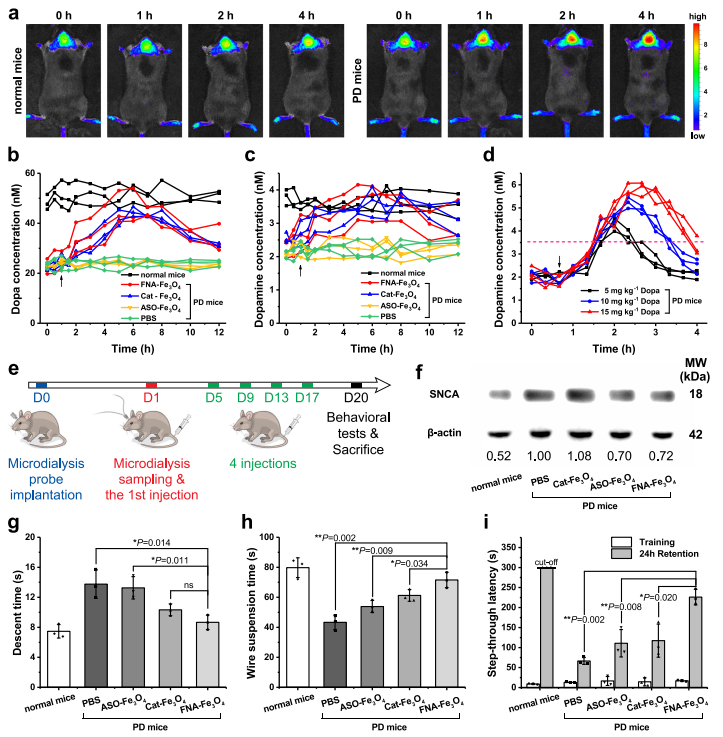
图6 人工酶的体内生物学效应
实验方法
SH-SY5Y和bEnd.3细胞培养,体外构建血脑屏障细胞模型,人工酶的细胞内化,CCK-8,细胞内多巴胺和酪氨酸含量的测定,qRT-PCR,免疫印迹,人工酶对细胞SNCA mRNA的荧光分析,C57BL/6 N(6个月)小鼠,Thy1-SNCA 转基因小鼠,FNA-Fe3O4中块链的质谱,离体成像,体内血液循环测定,免疫荧光,血清生化分析,溶血试验
参考文献
Fang X, Yuan M, Zhao F, Yu A, Lin Q, Li S, Li H, Wang X, Yu Y, Wang X, Lin Q, Lu C, Yang H. In situ continuous Dopa supply by responsive artificial enzyme for the treatment of Parkinson's disease. Nat Commun. 2023 May 9;14(1):2661. doi: 10.1038/s41467-023-38323-w. PMID: 37160866; PMCID: PMC10169781.






