姜黄素激活ROS/KEAP1/NRF2/miR-34a/b/c级联抑制结直肠癌转移
姜黄素是从姜黄根中分离出来的一种天然植物化学物质,是预防和治疗结直肠癌/CRC的候选药物。作者使用遗传方法来确定p53/miR-34通路作为姜黄素作用的中介作用。将三种p53、miR-34a和/或miR-34b/c基因缺失的等基因CRC细胞系暴露于姜黄素中并进行细胞生物学分析。通过siRNA介导的NRF2抑制和异位表达,并对其靶基因进行Western blot、qPCR和qChIP分析。将结直肠癌细胞静脉注射到NOD/SCID小鼠体内,通过纵向无创成像确定肺转移的形成。在结直肠癌细胞中,姜黄素诱导细胞凋亡和衰老,并以p53不依赖的方式抑制细胞的迁移和侵袭。姜黄素通过诱导ROS激活KEAP1/NRF2/ARE通路。此外,姜黄素以ROS/ NRF2依赖和p53独立的方式诱导miR-34a和miR-34b/c的表达。NRF2通过占据miR-34a和miR-34b/c启动子区域的多个ARE基序直接诱导miR-34a和miR-34b/c。姜黄素逆转了IL-6和缺氧诱导的miR-34a和miR-34b/c的抑制。缺失miR-34a和miR-34b/c可显著降低姜黄素诱导的细胞凋亡和衰老,阻止姜黄素或异位NRF2对迁移和侵袭的抑制。在结直肠癌细胞中,姜黄素诱导MET并以miR34a依赖的方式阻止小鼠肺转移的形成。此外,作者发现姜黄素可以增强5-FU对缺乏p53和miR-34a/b/c的CRC细胞的治疗作用。KEAP1/NRF2/miR-34a/b/c轴的激活可介导姜黄素的肿瘤抑制活性,为激活肿瘤中miR-34基因以达到治疗目的提供了一种新的途径。本文于2023年5月发表在《Cell Death & Differentiation》IF:12.4期刊。
技术路线

主要实验结果
1、姜黄素对结直肠癌细胞的p53非依赖性作用
姜黄素处理HCT116细胞后,p53蛋白的数量增加(图1A)。为了确定p53与姜黄素对CRC细胞影响的相关性,作者用野生型p53和纯合缺失p53的等基因HCT116细胞与姜黄素浓度增加一起处理48小时。存在p53的细胞显示IC50为21.49 μM,而缺乏p53的细胞的IC50为18.03 μM (图1B)。在p53存在或p53缺乏的RKO和SW48 CRC细胞系中观察到类似的效果。姜黄素浓度为15 μM,略低于p53缺陷细胞的IC50值,用于后续实验。通过阻抗测量(图1C)证明了暴露于姜黄素强烈降低了p53缺陷和p53存在的HCT116细胞的增殖,并且在最终时间点证实了细胞数量的变化(图1D)。姜黄素在结直肠癌细胞系RKO和SW48中也观察到类似的p53非依赖性作用。姜黄素诱导的细胞活力和增殖速度的下降在p53缺陷细胞中更为明显。因此,尽管p53在姜黄素治疗后会积累,姜黄素对CRC细胞的这些作用是独立于p53的。
接下来,作者分析了哪些过程可能是姜黄素介导的增殖抑制的基础。姜黄素导致细胞中sub-G1 DNA含量增加,表明凋亡增加,与p53状态无关(图1E)。姜黄素处理后24小时,p53缺陷细胞表现出更多的G2/ m -阻滞,而WT p53细胞的G0/G1积累更多。膜联蛋白V/ PI检测显示,与p53正常细胞相比,p53缺陷细胞的凋亡增加更为明显(图1F和S1G)。这些结果通过检测被切割的parp、被切割的Caspase-3、Bcl-2和Bax蛋白得到了证实(图1G、S1H和S1I):在p53缺失的细胞中,24小时检测到Bax和被切割的Caspase 3的增加,而p53成熟的细胞显示这些蛋白的诱导延迟了48小时。此外,通过检测β-gal pH 6,姜黄素在p53精通和p53缺乏的HCT116细胞中诱导HCT116细胞衰老的程度相似(图1H)。最后,姜黄素抑制了p53精通和p53缺乏的HCT116细胞的迁移和侵袭,后者显示出更高的基础迁移和侵袭水平(图1I, J)。综上所述,姜黄素抑制了细胞活力、增殖、迁移和侵袭,而以不依赖p53的方式诱导结直肠癌细胞的凋亡和衰老。

图1姜黄素对结直肠癌细胞的p53非依赖性作用
2、姜黄素在结直肠癌细胞中通过ROS激活NRF2
接下来,作者确定姜黄素对CRC细胞影响的机制。暴露于姜黄素48小时后,HCT116细胞的ROS水平显著升高(图2A)。以ROS诱导剂过氧化叔丁基(tBHP)为阳性对照,姜黄素的作用被抗氧化剂N-乙酰半胱氨酸(NAC)抑制(图2A,左)。在RKO和SW48细胞中观察到类似的结果。有趣的是,缺乏p53的HCT116细胞中的ROS水平高于p53存在的HCT116细胞,这表明p53抑制姜黄素产生ROS(图2A,右)。值得注意的是,在p53存在和p53缺乏的HCT116细胞中,姜黄素对细胞活力的抑制被NAC部分逆转(图2B)。在RKO和SW48细胞中观察到类似的结果。NAC完全抑制PARP的裂解,从而抑制姜黄素诱导的细胞凋亡(图2C)。KEAP1/ NRF2通路是细胞对氧化应激反应的中心介质。当暴露于ROS时,转录因子NRF2从Keap1释放,并从细胞质转运到细胞核,激活其靶基因的转录。姜黄素在p53存在和p53缺乏的HCT116细胞中诱导NRF2易位至细胞核(图2D)。。暴露于姜黄素后,NRF2蛋白在HCT116细胞的核部分增加,而在细胞质部分减少(图2E)。姜黄素不影响NRF2 mRNA的表达。NQO1是NRF2的保守靶基因,常用于监测NRF2通路的活性。与NRF2的激活一致,姜黄素处理后NQO1 mRNA和蛋白的表达增加(图2F, G)。重要的是,核易位和NRF2激活的诱导在很大程度上被NAC抑制ROS逆转(图2D、F、G)。在RKO和SW48细胞中都能观察到上述类似的结果。
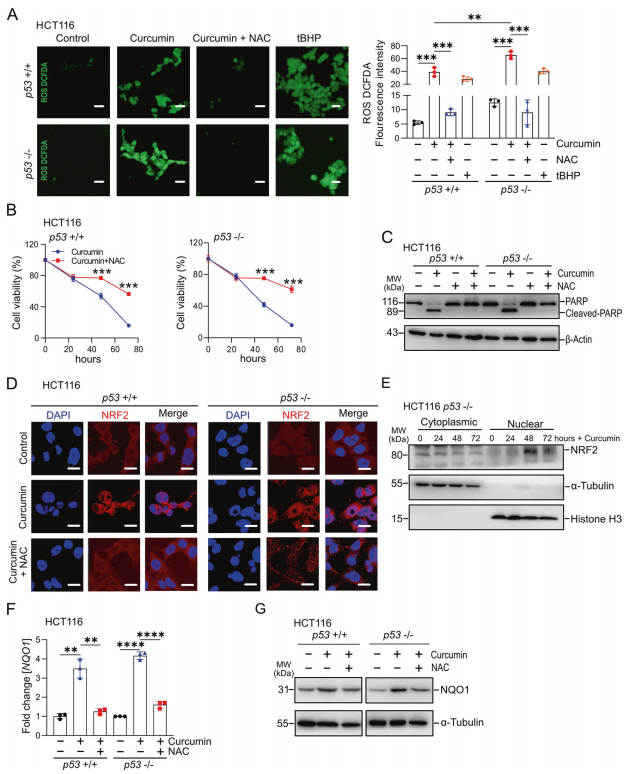
图2姜黄素在结直肠癌细胞中通过ROS激活NRF2
3、姜黄素不依赖于p53来上调miR-34a和miR-34b/c的表达
作者先前发表的观察结果表明,miR-34a是由姜黄素诱导的,因此,作者确定了姜黄素在一组p53缺失的等基因CRC细胞系中诱导miR-34基因是否需要p53。结果表明,姜黄素诱导了HCT116细胞中独立于p53状态的pri-miR-34a和pri-miR-34b/c初级转录本的表达(图3A-B)。在CRC细胞系SW48和RKO中也获得了类似的结果(图3C-F)。在p53存在和p53缺乏的HCT116细胞中,姜黄素也上调了成熟miR-34a的水平(图3G)。由于NAC可以阻止姜黄素对pri-miR34a和pri-miR34b/c的诱导,因此作者认为它是由ROS介导的(图3H, I)。综上所述,这些结果表明,姜黄素在结直肠癌细胞系中以p53独立和ROS依赖的方式诱导miR-34a和miR-34b/c的表达。

图3姜黄素不依赖于p53来上调miR-34a和miR-34b/c的表达
4、姜黄素诱导的NRF2直接激活miR-34a和miR-34b/c
接下来,作者假设被姜黄素诱导的ROS激活的NRF2可能是miR-34a和miR-34b/c表达的直接诱导因子。事实上,4种不同siRNA对NRF2的抑制阻止了姜黄素在p53缺陷HCT116细胞中诱导pri-miR-34a和pri-miR-34b/c的表达。相反,异位NRF2表达增加了携带突变型p53的SW480细胞中pri-miR-34a和pri-miR-34b/c的表达,以及成熟的miR-34a、NQO-1 mRNA和蛋白的表达(图4C- D)。通过检测miR-34a和miR-34b/c启动子区域的基因组序列,作者在miR-34a位点鉴定了三个潜在的NRF2结合位点(TGAG/CnnnGC),即所谓的ARE(抗氧化反应元件),在miR-34b/c位点鉴定了一个潜在的NRF2结合位点(图4E-G)。qChIP检测证实姜黄素处理48小时后,miR-34a和miR-34b/c启动子内四个ARE位点的NRF2占用增强(图4H)。因此,作者认为姜黄素通过激活NRF2诱导miR-34a和miR-34b/c基因的表达,NRF2直接结合miR-34a和miR-34b/c启动子并诱导其转录。并且miR-34的这种激活模式是与p53无关的。

图4姜黄素诱导的NRF2直接激活miR-34a和miR-34b/c
5、miR-34a和miR-34b/c介导姜黄素对结直肠癌细胞的作用
为了确定姜黄素的作用是否需要诱导miR-34a和miR-34b/c的表达,作者采用了使用CRSPR/CAS9方法使miR-34a和/或miR-34b/c基因缺失的等基因HCT116细胞。姜黄素处理后,miR34a-或miR-34a/b/c缺陷的HCT116细胞的活力显著高于miR-34-存在的HCT116细胞(图5A)。与miR-34a/b/c缺失的HCT116细胞相比,miR-34b/c缺失的细胞表现出中等的生存能力。与miR-34a/b/c精通的HCT116细胞相比,miR-34a/b/c缺乏导致姜黄素对细胞凋亡的增强减弱(图5B)。在miR-34a/b/c存在的HCT116细胞中,姜黄素处理诱导了caspase 3的强烈裂解,而在mir -34缺失的细胞中未检测到裂解的caspase 3(图5C)。在miR-34a/b/c存在的HCT116细胞中,姜黄素抑制了已知的miR-34靶点抗凋亡蛋白Bcl-2的表达,并诱导了促凋亡蛋白BAX的表达(图5C)。单独或联合缺失miR-34a和miR-34b/c的HCT116细胞显示Bcl-2的表达升高,姜黄素处理后Bcl-2的表达超过未处理的WT细胞,这种影响在miR-34a/b/c缺陷的HCT116细胞中最为明显。此外,在miR34a/b/c缺乏的HCT116细胞中,姜黄素对BAX的诱导作用减弱(图5C)。因此,miR-34a/b/c对Bcl-2的抑制有助于姜黄素诱导细胞凋亡。
通过测定在pH 6.0下检测β-半乳糖苷酶活性来检测,结果表明,姜黄素处理后miR-34a、miR-34b/c和miR-34a/b/c缺陷细胞的衰老没有增加,而WT HCT116细胞的衰老明显增加(图5D)。最后,姜黄素诱导的对miR-34a、miR-34b/c和miR-34a/b/c缺陷细胞的迁移和侵袭的抑制明显低于miR-34存在的HCT116细胞(图5E-F)。在所有这些实验中,联合灭活miR-34a和miR-34b/c的细胞对姜黄素表现出最强的抗性。siRNA敲低NRF2部分阻止了姜黄素抑制细胞活力(图5G)、迁移(图5H)和侵袭(图5I)。此外,在没有姜黄素处理的情况下,NRF2的异位表达抑制了miR-34存在的HCT116细胞的迁移和侵袭(图5J-K)。然而,在miR-34a/b/c缺陷的HCT116细胞中,异位NRF2对迁移和侵袭没有影响,这表明miR-34a和miR-34b/c是NRF2功能所需的介质。综上所述,作者的研究结果表明NRF2介导的miR-34a和miR-34b/c基因的激活是姜黄素影响细胞凋亡、衰老、迁移和侵袭的必要介质。
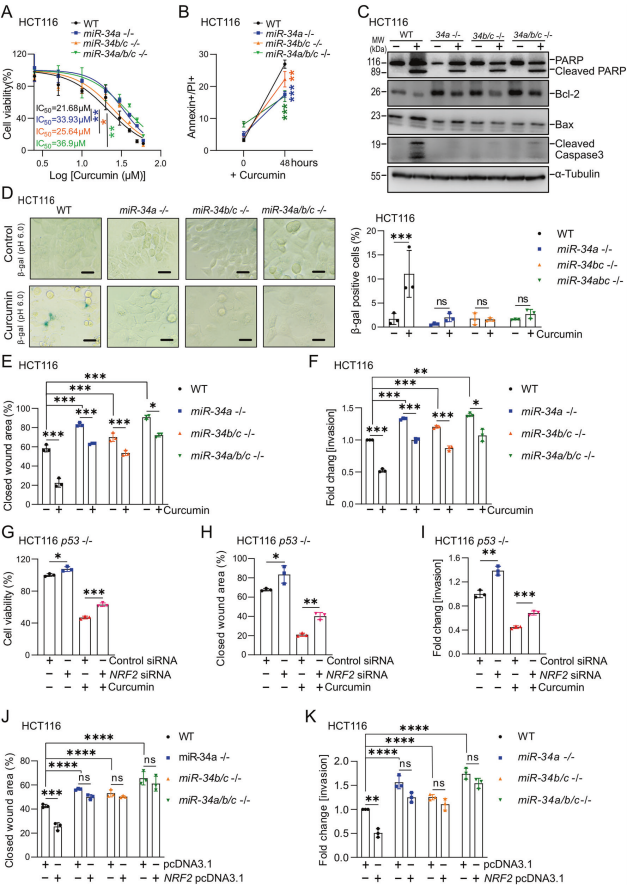
图5 miR-34a和miR-34b/c介导姜黄素对结直肠癌细胞的作用
6、NRF2介导H2O2和tBHP对miR-34a/b/c的诱导
先前有研究表明,H2O2处理诱导的ROS可诱导miR-34a的表达。因此,作者验证了这种调节是否由NRF2介导。首先,作者分析了H2O2处理后CRC细胞系的细胞活力,并测定了表达p53突变体的HCT116细胞、p53缺失HCT116细胞和SW620细胞的IC50值分别为92.61、48.35和61.52µM。用H2O2或tBHP处理p53存在和p53缺乏的HCT116细胞以及SW620细胞,导致NRF2靶基因NQO1的诱导,表明H2O2和tBHP激活NRF2(图6A)。并且,H2O2和tBHP诱导miR-34a/b/c的表达,而siRNA介导的NRF2抑制可以阻止miR-34a/b/c的表达(图6B-C)。
7、姜黄素诱导的NRF2逆转缺氧或IL-6对miR-34a/b/c的抑制作用
作者之前已经证明缺氧和IL-6介导的STAT3激活抑制了p53缺陷的CRC细胞中miR-34a/b/c的表达。为了确定姜黄素是否可以逆转缺氧介导的miR-34a/b/c的抑制,作者在缺氧条件下培养p53缺陷的HCT116细胞并用姜黄素处理它们。结果表明,姜黄素完全逆转了缺氧介导的miR-34a/b/c表达抑制(图6D-E)。然而,当siRNA抑制NRF2时,这种逆转明显减弱(图6D-E),表明姜黄素的这种作用在很大程度上是由NRF2激活介导的。另外,IL-6介导的miR-34a和miR-34b/c的抑制被姜黄素完全逆转(图6F-G)。
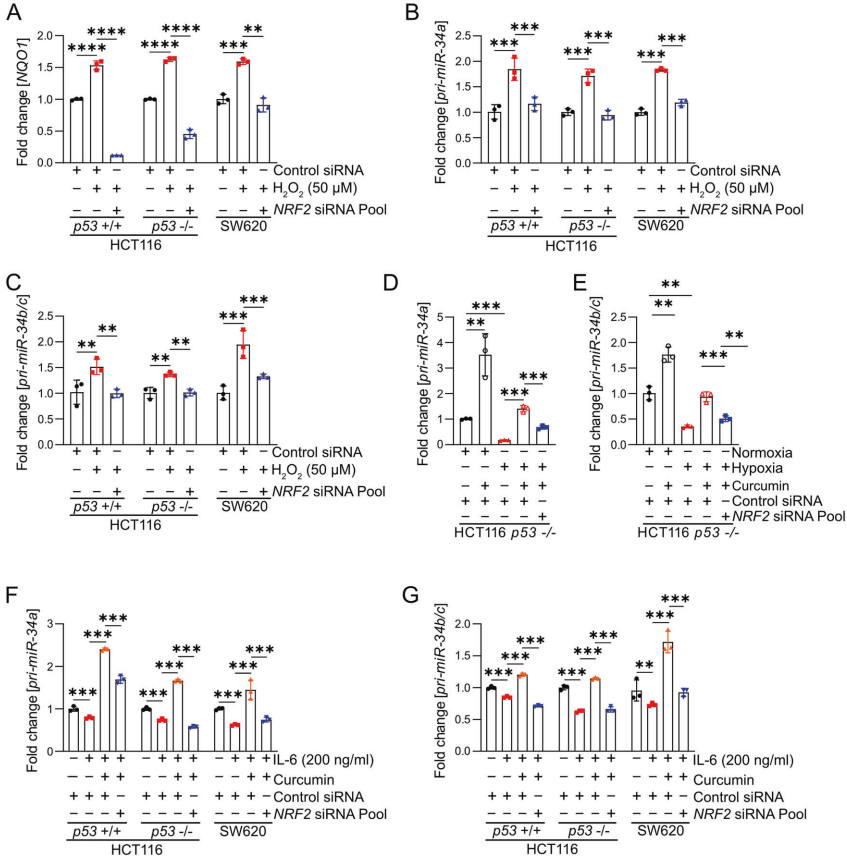
图6 NRF2轴对H2O2、姜黄素、缺氧和IL-6调控miR-34a/b/c的影响
8、姜黄素诱导MET并通过诱导miR-34a抑制肺转移形成
接下来,作者打算在移植到小鼠体内后研究这些细胞,作者表征了姜黄素对SW620-Luc2细胞的影响,SW620-Luc2细胞稳定表达荧光素酶。结果表明,姜黄素以剂量依赖性的方式抑制SW620-Luc2细胞的活力。MTT法测定IC50为14.49 μM。随后使用了这种浓度的姜黄素,在SW620-Luc2细胞暴露于姜黄素48小时后,pri-miR-34a和成熟的miR-34a的表达上调(图7A-B)。与成熟的miR34a相比,成熟的miR-34b和miR-34c在暴露于姜黄素的SW620-Luc2细胞中的表达水平非常低。因此,作者重点分析了miR-34a在姜黄素对SW620-Luc2细胞的影响中的作用。作者之前的研究表明,miR-34a在p53诱导的CRC细胞间充质-上皮转化(MET)中起关键作用。因此,作者验证姜黄素诱导的miR-34a是否可能介导MET。结果表明,姜黄素处理SW620-Luc2细胞导致间质标记物Vimentin (VIM)、SNAIL、SLUG和ZEB1的抑制(图7E)。此外,姜黄素的这种抑制作用被miR-34a特异性拮抗剂所消除。使用拮抗剂沉默miR-34a来确定姜黄素以miR-34a依赖的方式抑制SW620-Luc2细胞的入侵和迁移 (图7C-D)。
最后,作者进行了小鼠异种移植实验,以确定姜黄素是否会影响结直肠癌细胞形成肺转移的能力。因此,作者在体外用姜黄素或/和miR-34a特异性拮抗剂处理SW620-Luc2细胞48小时。随后,将这些细胞注射到NOD/SCID小鼠的尾静脉中,以评估肺转移的形成。纵向无创成像显示,姜黄素治疗SW620-Luc2细胞在注射后5周内完全消除了转移形成(图7F-G)。然而,拮抗剂同时抑制miR-34a部分恢复姜黄素治疗后的转移形成(图7F-G)。注射后5周,注射姜黄素处理的SW620-Luc2细胞的小鼠,切除的肺部没有宏观可见的转移(图7H)。HE染色证实姜黄素处理的细胞注射小鼠中没有转移结节(图7H-I)。然而,当SW620-luc2细胞同时接受miR-34anantagomirs和姜黄素处理时,会形成肺转移(图7H-I)。综上所述,这些结果表明姜黄素通过诱导miR-34a抑制转移的形成。

图7姜黄素诱导MET并通过诱导miR-34a抑制肺转移形成
9、p53和miR-34a/b/c调节对姜黄素和/或5-FU的敏感性
最后,作者研究了姜黄素联合化疗药物5-氟尿嘧啶(5-FU)对结直肠癌细胞活力的影响,该药物被广泛用于结直肠癌的治疗。为此,作者使用临床相关且可耐受浓度的5-FU (2mg /L)和姜黄素(15µM)。姜黄素和5-FU联合处理HCT116细胞,与单独处理任何一种化合物相比,显示出更强的细胞活力抑制(图8A)。与存在p53的细胞相比,缺乏p53的细胞对姜黄素更敏感,但对5-FU的抗性更强。然而,姜黄素和5-FU处理后,p53缺失细胞和p53存在细胞之间没有差异(图8A)。与wt细胞相比,miR-34a-和miR-34a/b/c缺陷细胞对姜黄素的抗性更强,但对5-FU的抗性仅略强。然而,miR34a-和miR-34a/b/c缺乏导致对姜黄素和5-FU联合的抵抗力明显提高(图8B)。miR-34a-或miR-34a/b/c缺陷细胞中p53的进一步缺失增加了它们对5-FU的抗性。另外,p53的失活逆转了miR-34a-或miR-34a/b/c缺陷细胞对姜黄素和姜黄素与5-FU联合的耐药性(图8C, D)。人结肠上皮细胞(HCEC-1CT)和人肠成纤维细胞(CCD-18Co细胞)对姜黄素和5-FU的敏感性低于HCT116细胞(图8E-F)。综上所述,这些结果表明姜黄素可能增强5-FU对CRC细胞的治疗作用。
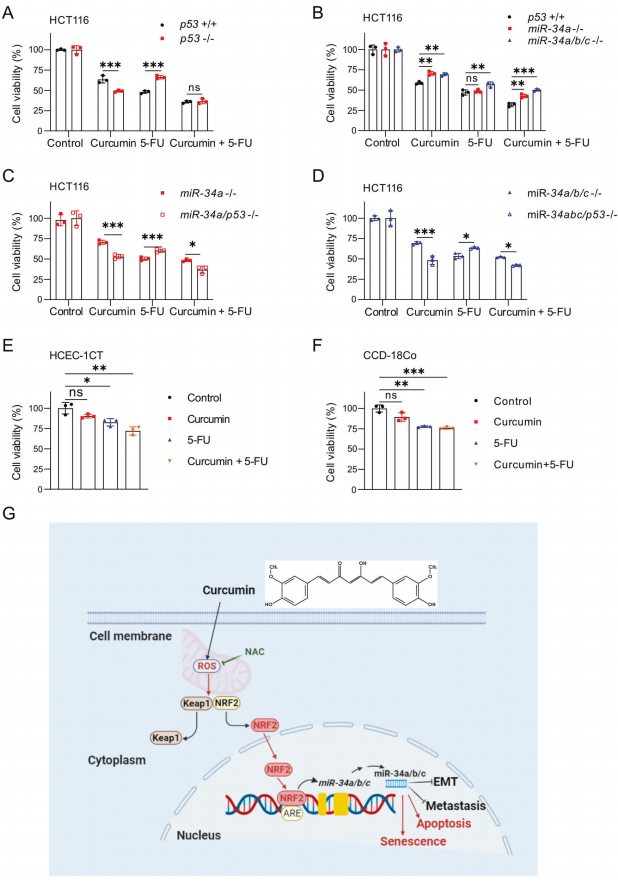
图8 p53和miR-34a/b/c调节对姜黄素和/或5-FU的敏感性
实验方法
MTT实验,RNA分离,qRT-PCR,Western blot,染色质免疫沉淀反应,细胞ROS检测,异种移植小鼠模型的转移形成,细胞迁移实验,细胞划痕实验,RNA敲降,荧光素酶报告实验
参考文献
Liu CF, Rokavec M, Huang ZK, Hermeking H. Curcumin activates a ROS/KEAP1/NRF2/miR-34a/b/c cascade to suppress colorectal cancer metastasis. 2023, May. doi: 10.1038/s41418-023-01178-1.






