单细胞和空间测序确定角质形成细胞和成纤维细胞放大银屑病炎症反应的过程
银屑病是一种常见的皮肤慢性炎症性疾病,其免疫发病机制尚不完全清楚。在这里,我们使用单细胞和空间RNA测序相结合的方法,证明了在没有中性粒细胞蛋白酶的情况下,IL-36依赖性放大了IL-17A和TNF炎症反应,这主要发生在银屑病表皮的角质层上部。我们进一步展示了在银屑病中,SFRP2+成纤维细胞的一个亚群通过转变为促炎状态而促进免疫网络的放大。SFRP2+成纤维细胞通讯网络涉及CCL13、CCL19和CXCL12的产生,通过配体-受体相互作用与其他空间上邻近的细胞类型连接:CCR2+髓系细胞、CCR7+LAMP3+树突状细胞和CXCR4分别在CD8+Tc17细胞和角质形成细胞上表达。SFRP2+成纤维细胞也表达组织蛋白酶S,通过激活角质形成细胞中的IL-36G进一步放大炎症反应。这些数据提供了对银屑病发病机制的深入看法,这扩大了我们对关键细胞参与者的理解,包括炎性成纤维细胞及其细胞相互作用。
该研究于2023年6月发表在《Nature communications》,IF:16.6。
技术路线

1、对正常人和银屑病患者皮肤单细胞的普查显示了皮肤细胞群体的多样性
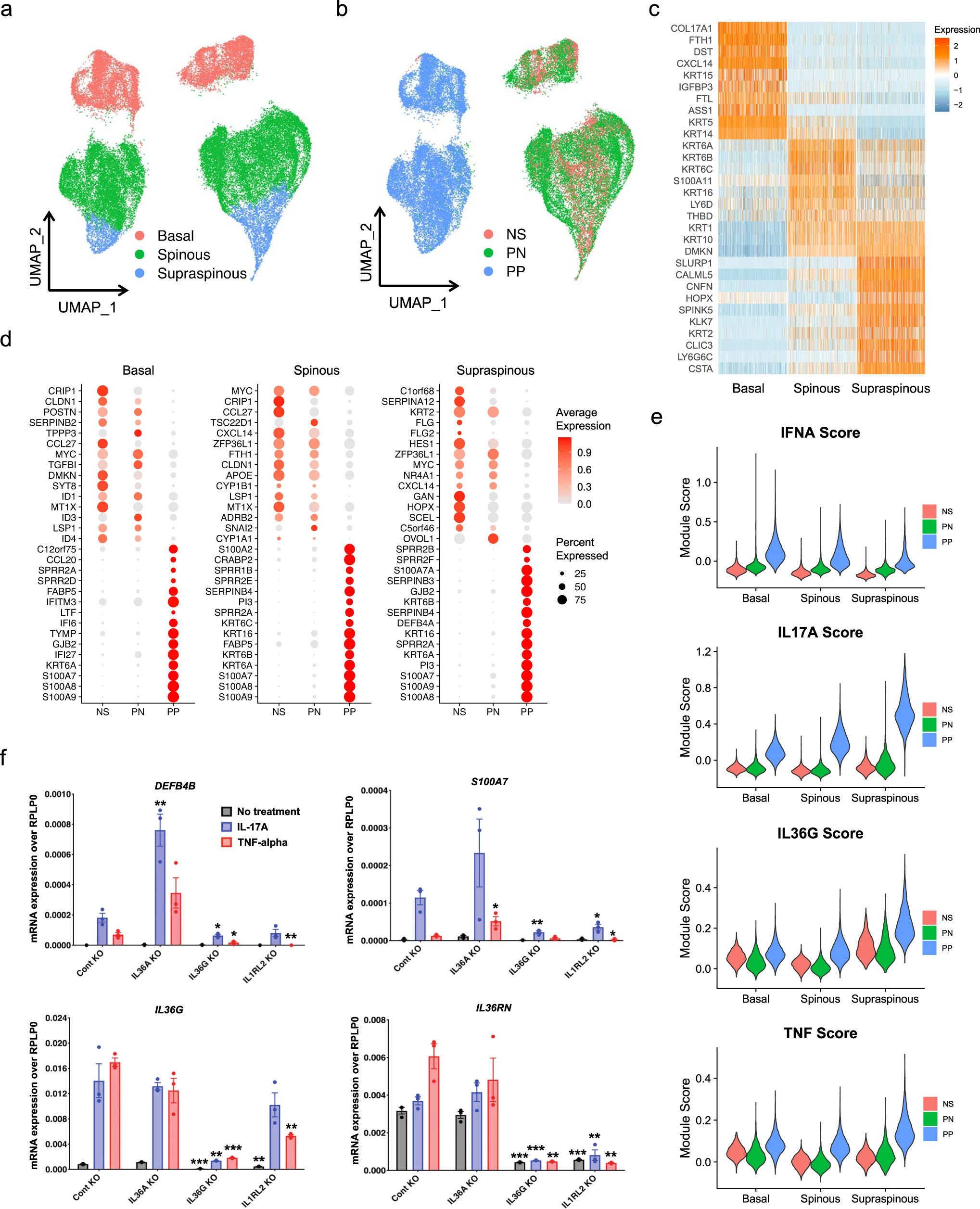
为了了解健康和银屑病人皮肤的无偏细胞组成和细胞状态,我们从8个健康人和14个银屑病活检标本中分离了皮肤细胞的单细胞悬液。我们还收集了来自同一批银屑病患者的11个活检标本中损伤周围的皮肤细胞,总共得到了33个10X Chromium单细胞文库(8个健康皮肤文库(NS),11个银屑病病变周围皮肤文库(PN)和14个银屑病病变皮肤文库(PP))。经过质量控制的银屑病单细胞图谱包括67,378个细胞,每个细胞检测到的平均基因数为2421个,转录本数为10,953个(图1a、b)。为了研究这些细胞的异质性,我们挑选可变基因,并使用统一的流形逼近和投影(UMAP)进行降维和R软件包Seurat进行细胞聚类。通过将聚类标记基因与经典细胞类型定义的特征基因重叠,对聚类进行了验证。我们鉴定出了10个主要的细胞类型,包括角质形成细胞(KC;KRT14、KRT1、DMKN)、黑素细胞(MLNC;DCT、TYRP1、PMEL)、汗腺细胞(ECG;PIP、DCD、MUCL1)、内皮细胞(EC;PECAM1、CDH5、CLDN5)、成纤维细胞(FB;DCN、COL1A1、COL1A2)、平滑肌细胞(SMC;ACTA2、TAGLN、MYL9)、神经细胞(Nerve;MPZ、PLP1、S100B)、T细胞(TC;CD3D、CD3E、TRAC)、髓系细胞(ML;CD74、HLADRA、HLA-DPB1)和肥大细胞(Mast;CPA3、TPSAB1、CTSG)(图1c)。
在UMAP中,PP角质形成细胞与NS和PN角质形成细胞完全分离,这表明银屑病角质形成细胞的基因转录组发生了根本性的改变(图1b)。在获得的细胞数量方面,最丰富的细胞类型是角质形成细胞,其次是成纤维细胞和T细胞。对每种细胞类型的疾病组成分析显示,PP中免疫细胞和内皮细胞的比例增加,而汗腺细胞、神经细胞和黑素细胞的比例减少。这些结果表明,银屑病特征包括明显的角质形成细胞转录组变化和免疫细胞(包括T细胞和髓系细胞)的积累。
为了定位银屑病皮肤中的各种细胞类型,我们对银屑病皮肤进行了空间测序。我们从一个20微米厚的冰冻切片上收集RNA,并将其放置在一个含有空间条形码捕获寡核苷酸的55微米孔阵列上,用于转录组分析。在经过质量控制步骤后,我们检测到987个空间定义的区域,每个区域平均检测到2782个基因和11,779个转录本(图1d)。我们通过将空间基因表达与单细胞RNA测序中主要细胞类型的基因表达进行反卷积,为每个区域标注了细胞类型组成。反卷积结果显示在散点饼图中,每个空间阵列中含有一个饼图。K-means聚类显示出六个具有不同平均细胞类型组成的聚类,代表了角质形成细胞、平滑肌细胞、成纤维细胞、汗腺细胞、内皮细胞、髓系细胞和T细胞的聚集体(图1d)。空间测序中每个聚类的标记基因与通过单细胞RNA测序确定的细胞类型标记基因一致,表明注释准确(图1e)。角质形成细胞位于表皮中。髓系细胞、T细胞和内皮细胞位于靠近表皮的浅表真皮,而成纤维细胞、平滑肌细胞和汗腺细胞位于更深层的真皮(图1d)。我们还观察到一些空白区域,其中捕获到的mRNA数量较少,代表真皮内无细胞区域。同时,我们对另外三个银屑病和两个健康皮肤活检标本进行了空间测序,观察到类似的细胞类型和空间细胞聚集。

2、银屑病皮肤中不同的角质形成细胞分化状态反映了银屑病中不同的细胞因子反应
PP与NS和PN角质形成细胞的明显分离表明在患有银屑病的皮肤中存在重大的表皮功能变化(图1b)。为了进一步描述这一点,我们对角质形成细胞进行了亚群聚类,并通过分化状态对其进行了注释。我们的分析在基底层(COL17A1、DST、KRT15)、棘层(KRT6A、KRT6B、KRT16)和表棘层(SLURP1、KLK7、KRT2)定义了三个不同的角质形成细胞分化状态(图2a-c)。我们对每个表皮分化状态内的PP和NS角质形成细胞进行差异表达分析,并确定了在银屑病皮肤的表棘层中不同表达的基因(DEGs)数量最多。我们绘制了每个分化状态的前15个上调和下调基因,并发现PN角质形成细胞在所有三个表皮层中表现出介于NS和PP角质形成细胞之间的中间表达模式(图2d)。S100A7、S100A8和S100A9在PP的所有三层中明显过表达,与之前的银屑病研究结果一致。有趣的是,I型干扰素诱导的基因IFITM3、IFI27和IFI6在PP上调基因中排名靠前,主要定位于银屑病皮肤的基底表皮层。KRT6基因和KRT16在棘层和表棘层中排名靠前。值得注意的是,C1orf68,在以前的基因组关联研究(GWAS)中被确定为银屑病的靶基因,特异地在表棘层中表达(图2d)。
接下来,我们使用Ingenuity通路分析(IPA)评估了每个表皮层内差异表达基因(DEGs)的富集通路和上游调控因子的细胞因子。这表明在银屑病皮肤中,干扰素信号通路在基底层和棘层中是最重要的调控因子,而在表棘层中的作用较小。IL-17通路主要富集在表棘层中,而在棘层和基底层中富集较少。银屑病皮肤中其他上游炎症反应的富集包括OSM、TNF、IL-36、IL-6、IL-1、IL-18、IL-21、IL-22和IL-27。
为了追踪这些细胞因子的来源,我们计算了每种细胞类型在不同疾病状态(NS、PN、PP)下这些基因的平均表达水平。这些炎症介质的大多数由特定的细胞类型表达,例如,角质形成细胞表达IL18和IL36G;T细胞表达IL17A、TNF、IL21和IL22;髓系细胞表达IFNB1、IL1A、IL1B和IL27。值得注意的是,与PN和NS相比,IL36G、IL17A、IL21、IL22和IL27在相应的细胞类型中在PP中的表达最高。为了验证这些关键上游调控因子,我们计算了通过单个促炎细胞因子(包括I型干扰素(IFN-α)、IL-17A、IL-36γ和TNF)刺激培养的角质形成细胞中诱导基因的模块得分(图2e)。与DEGs的富集分析一致,IFN-α得分在所有三个层次中从NS逐渐增加到PN再到PP,在基底层得分最高,棘层略有下降,表棘层进一步下降。IL-17A得分在NS和PN中在所有三个层次上相似,但在PP角质形成细胞中从基底层到棘层再到表棘层有显著增加。类似地,在PP表皮中,IL-36γ得分在表棘层中比基底层和棘层更高。为了验证这些反应的空间特异性,我们计算了角质形成细胞亚型模块得分以及IL-17A和IL-36γ模块得分。与scRNA-seq结果一致,IL-17A和IL-36γ模块得分与表棘层模块得分最高相关,而与棘层或基底层模块得分的相关性较低。这些结果表明,在银屑病中,不同的表皮组织受促炎细胞因子的影响程度不同。
为了研究IL-36在激活IL-17和TNF反应中的作用,我们使用CRISPR-Cas9在角质形成细胞中敲除(KO)IL36A、IL36G和IL1RL2(IL-36R),并测量IL-17和TNF诱导的四个抗菌和促炎基因的表达:DEFB4、S100A7、IL36G和IL36RN(图2f)。敲除IL36G或IL1RL2都导致角质形成细胞中这四个基因的显著减少,表明在中性粒细胞蛋白酶不存在的情况下,IL-36G和IL-36R直接增强表皮中IL17A和TNF的反应(图2f)。值得注意的是,与之形成鲜明对比,从抗菌基因DEFB4和S100A7的mRNA表达来看,IL36A KO导致增强IL-17A和TNF的反应(图2f)。
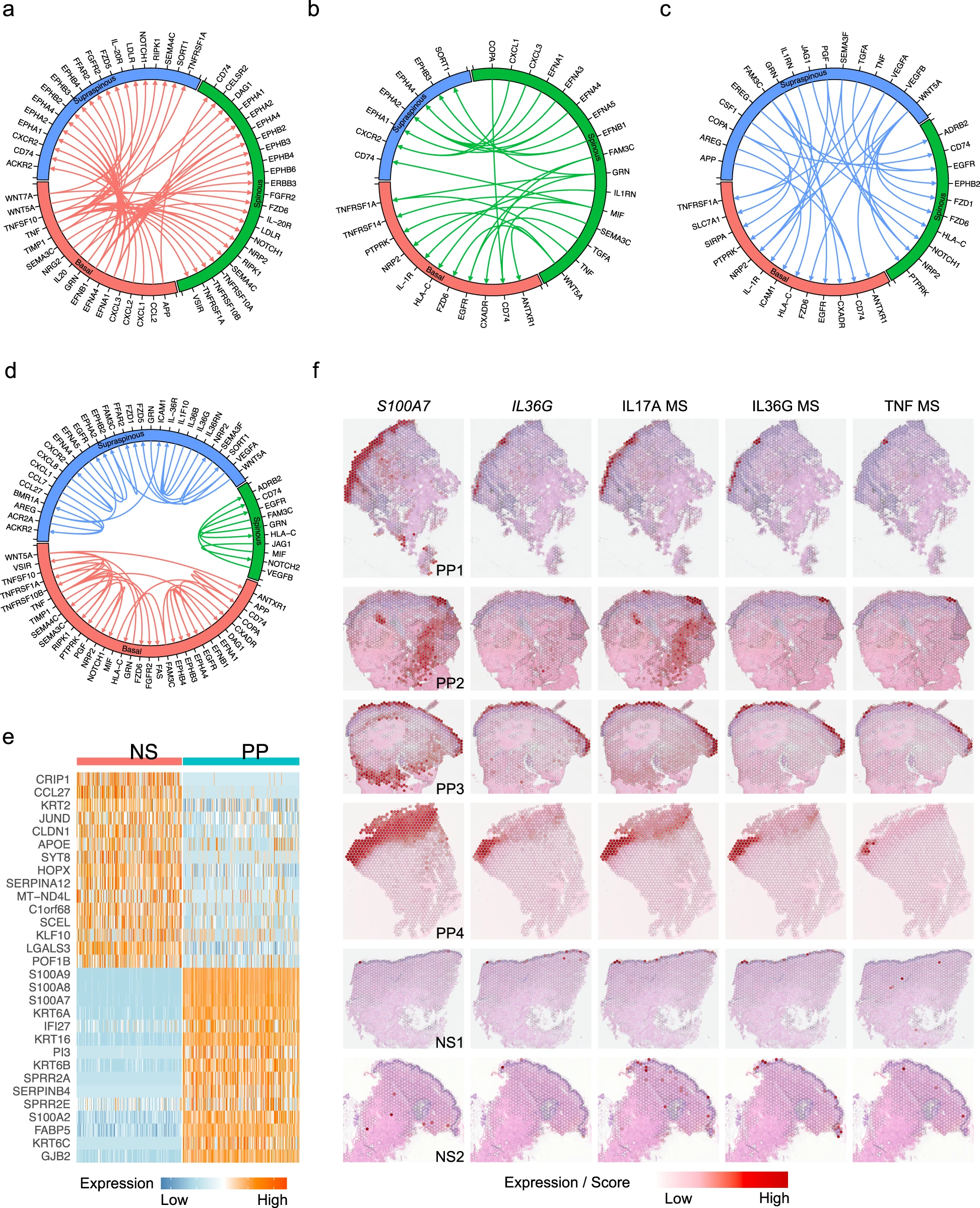
鉴于角质形成细胞在银屑病炎症反应中的重要性,我们试图确定银屑病皮肤中三个表皮层之间的配体-受体相互作用。为此,我们对所有NS角质形成细胞亚型和所有PP角质形成细胞亚型运行了CellPhoneDB,并分析了在PP中与NS相比具有较高相互作用得分的配对。三个层次中最丰富的配体-受体对出现在ephrin配体家族和其受体之间,这在表皮内稳态中起到关键的信号传导作用(图3a-c)。Notch信号通路在角质形成细胞层之间也是显著的,并且已经报道在表皮生长和分化中发挥重要功能。有趣的是,IL-36信号仅在银屑病患者的表棘层观察到,与scRNA-seq和空间-seq的表达数据一致,它通过诱导表棘层角质形成细胞产生的趋化因子CXCL1和CXCL8进一步促进白细胞浸润,尤其是中性粒细胞的浸润到表皮中(图3d)。
为了确定三种角质形成细胞亚型的空间位置,我们试图通过scRNA-seq分析中定义的亚型表达特征来解析spatial-seq中的角质形成细胞斑点。预测得分准确反映了表皮三个层次的空间位置,棘上角质形成细胞位于最外层,棘状角质形成细胞位于中间层,基底层角质形成细胞位于最内层。我们对PP角质形成细胞斑点和NS角质形成细胞斑点进行差异表达分析,并得到了与scRNA-seq相似的一组DEGs(图3e)。两个代表性基因S100A7和IL36G的空间定位图显示了它们在PP中的上调表达和在表皮中的特定位置(图3f),这一结果也得到了scRNA-seq数据集的验证。值得注意的是,IL36G主要在被预测为表棘层角质形成细胞的斑点中被检测到,与我们的scRNA-seq分析中观察到的细胞因子反应结果一致。体外培养的银屑病皮肤活检标本中迁移的角质形成细胞的scrna-seq检测也检测到了IL36G。我们还在spatial-seq样本中绘制了IL-17、IL-36和TNF模块得分,并验证了IL36G和S100A7表达与这些细胞因子反应的共定位(图3f)。
UMAP分析将NS和PP角质形成细胞分开,显示了在健康和疾病条件下存在不同的角质形成细胞分化途径(图2b)。为了表征这些分化途径,我们分别对NS和PP角质形成细胞进行了Monocle的拟时序分析。Monocle拟时序分析将细胞排列成一个线性轨迹,其方向沿着从基底层到棘层再到表棘层的方向排列,这对于NS和PP角质形成细胞都适用。为了确定推动分化的潜在细胞因子,我们将可变基因沿着拟时序分成五个表达模式,分别针对NS和PP轨迹。接下来,我们使用IPA推断了每个表达模式中基因的上游调控因子。对于每个上游调控因子,我们使用五种表达模式的所有目标基因计算模块得分。然后,我们计算了每个上游调控因子的模块得分与Monocle分析定义的拟时序之间的相关性。我们发现,只有OSM和IL-4模块得分与NS角质形成细胞的拟时序呈正相关,而包括IL-22、IL-1β、IL-17A、IL-13和TNF在内的多种细胞因子的模块得分与PP角质形成细胞的拟时序高度相关。为了验证驱动PP角质形成细胞分化的关键细胞因子,我们使用由单个细胞因子(包括IL-1β、IL-17A、IL-13和TNF)刺激培养的角质形成细胞中诱导的基因计算了模块得分。这四种细胞因子的模块得分与PP角质形成细胞的拟时序高度相关,与IPA推断的结果一致。这些结果表明,在银屑病中,角质形成细胞的分化受到多种细胞因子的局部产生的驱动,尤其是IL-1β、IL-22、IL-17A、IL-13和TNF。
角质形成细胞的过度增殖是银屑病的一个显著特征。为了解决角质形成细胞的增殖问题,我们研究了NS、PN和PP之间的细胞周期效应,通过添加被排除在我们最初评估之外的增殖角质形成细胞,以便于分析细胞的异质性。预期地,与NS或PN样本相比,来源于PP样本的增殖角质形成细胞超过50%。我们在spatial-seq样本中绘制了细胞周期得分,发现表皮的增殖效应最强,特别是在表皮的基底层。我们还发现,在PP样本中存在着比NS样本更厚的增殖角质形成细胞层,从而证实了我们的spatial-seq数据中PP的高增殖表型。
3、SFRP2+成纤维细胞在银屑病炎症中的作用与其促纤维化作用不同
考虑到根据scRNA-seq数据定义的银屑病病变中第二常见的细胞类型是成纤维细胞。我们将所有成纤维细胞分成了12个亚群(图4a-c)。基于先前发表的皮肤成纤维细胞标记基因,我们将亚群注释为四个亚型:SFRP2+、COL11A1+、SFRP4+和RAMP1+成纤维细胞(图4b)。我们通过免疫组织化学(IHC)在银屑病皮损中确认了主要成纤维细胞亚型的存在。SFRP2+成纤维细胞是皮肤中最大的成纤维细胞亚群,与先前的研究结果一致。尽管SFRP2+成纤维细胞包含来自PP、PN和NS的细胞,值得注意的是,使用UMAP进行降维时,PP成纤维细胞主要与PN和NS成纤维细胞分开(图4c)。为了确定推动这种在银屑病成纤维细胞中的转变的机制,我们确定了PP和PN成纤维细胞之间的差异表达基因,并使用IPA进行富集分析。激活的上游调控因子分析确定了I型干扰素、干扰素-γ和TNF作为促进SFRP2+成纤维细胞亚群中银屑病相关变化的top级介导因子(图4d)。有趣的是,通过比较PP和PN细胞,我们发现这些上游调控因子在三个角质形成细胞亚型中也被激活,这表明这些是促使成纤维细胞和角质形成细胞从PN到PP转变的共同驱动因子。
在SFRP2+成纤维细胞中,有四个亚群主要由PP成纤维细胞组成,分别是亚群3、0、6和2(图4c,e)。有趣的是,差异表达分析显示PP SFRP2+成纤维细胞存在显著的异质性,亚群3标记物中包括胶原基因(例如COL1A1和COL3A1),而亚群6标记物中则包括一组促炎细胞因子(例如CCL19、IL33、IL34)以及蛋白酶CTSS(图4f)。这些趋化因子和蛋白酶在上皮表皮层和真皮乳头尖部的成纤维细胞中表达最为明显,这是通过空间-seq映射和免疫荧光(图4g)揭示的。对成纤维细胞亚群3和亚群6标记基因的上游调控因子分析显示,关键的银屑病相关细胞因子IFN-γ、TNF、IL-1β、OSM和IL-17A的激活z分数增加最多,而与纤维化相关的IL-5、EDN1和IL-4的激活z分数降低(图4h)。综上所述,这些结果揭示了PP SFRP2+成纤维细胞的异质性,包括胶原基质成分的产生者以及细胞因子诱导的非基质产生的促炎区域。

4、CD8+Tc17是银屑病皮肤中IL17A的主要来源
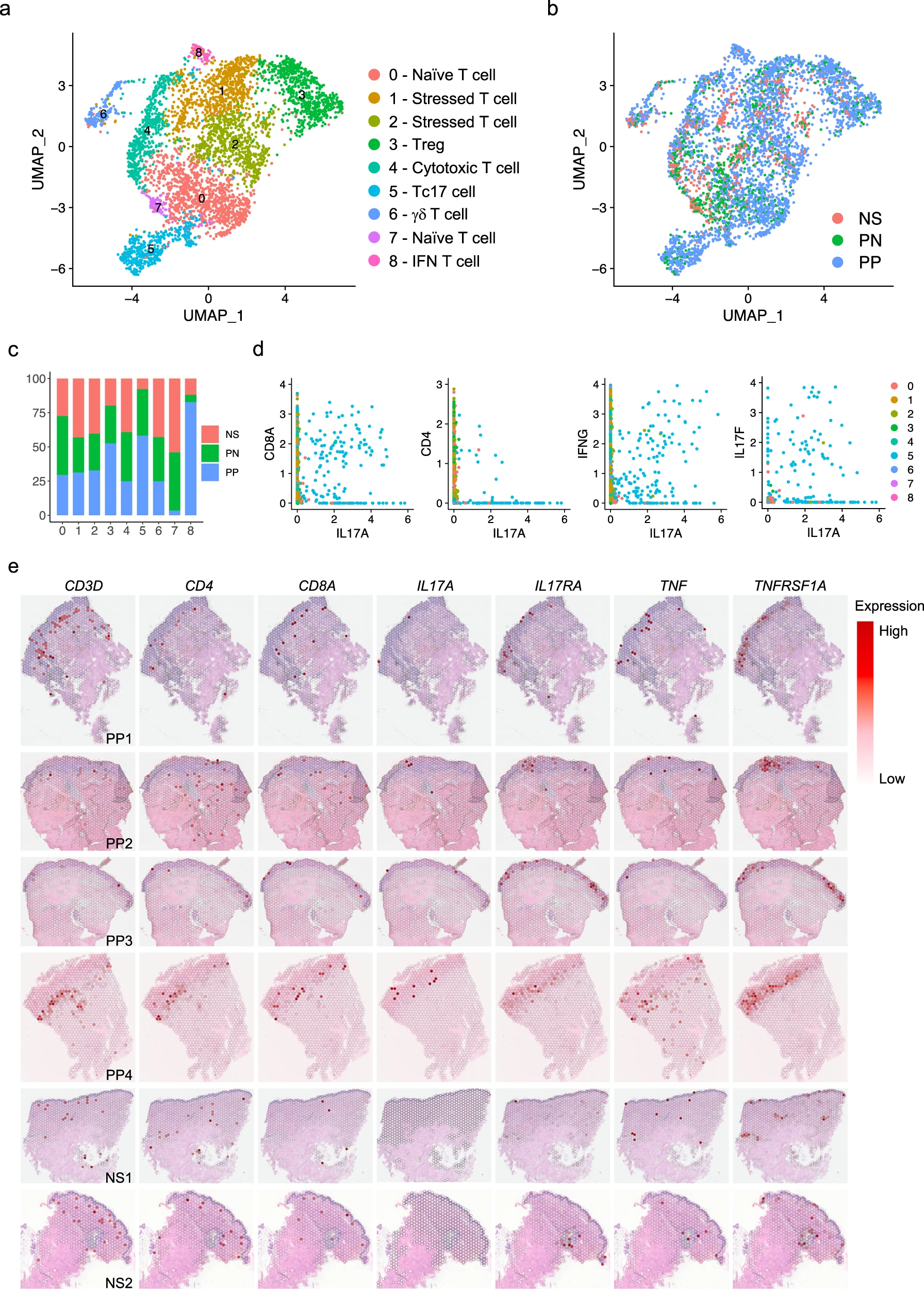
长期以来,产生IL-17的T细胞一直被认为是银屑病发病机制的核心。为了定义T细胞亚型在银屑病中的作用,我们对T细胞进行了亚群聚类,并使用经典的T细胞谱系标记对亚群进行了注释(图5a、b)。我们在正常皮肤(NS)、健康对照皮肤(PN)和银屑病皮肤(PP)中鉴定出了七种T细胞亚型:原始T细胞(亚群0和7;RGCC、CCR7、IL7R)、应激T细胞(亚群1和2;DNAJB1、HSPA1A、HSPH1)、调节性T细胞(Tregs)(亚群3;FOXP3、TIGIT、BAFT)、细胞毒性T细胞(亚群4;CCL5、NKG7、GZMK)、分泌IL17的CD8 T细胞(Tc17细胞)(亚群5;IL17A、IL17F、CCL20)、γδT细胞(亚群6;TRDC、FCER1G、TYROBP)和IFN T细胞(亚群8;IFI6、MX1、IFIT3)。值得注意的是,大部分T细胞来源于银屑病皮肤样本,与已知T细胞在银屑病皮肤中的大量渗入一致(图5b)。对每个亚群的疾病组成分析显示,在银屑病中,Tregs、Tc17细胞和IFN T细胞的比例增加(图5c)。与角质细胞的发现一致,PP中呈现出IFN特征的T细胞比例增加,表明在银屑病皮肤中,强烈的IFN反应不仅影响角质细胞,还影响其他细胞类型。我们检查了之前报道与银屑病有关的细胞因子的表达情况,发现IL17A、IL17F、IL26、CCL20、CXCL13、IL22和IL23R专门由Tc17细胞表达。传统上,认为产生IL-17的T细胞主要是CD4+ T细胞,然而最近的观察为银屑病中产生IL-17的CD8+ T细胞提供了越来越多的证据。从皮肤中鉴定到CD4+和CD8+ T细胞使得我们能够直接比较这些T细胞亚群及其在银屑病皮肤中对IL-17反应的贡献。在这里,我们的数据表明CD8+ T细胞是银屑病中IL17A的主要来源。为了进一步表征这一点,我们检查了IL17A与CD4、CD8A和IFNG的共表达情况,发现IL17A表达细胞与CD8A和IFNG表达细胞呈正相关,但很少观察到CD4+ IL17A+细胞(图5d)。此外,我们的数据表明,IL17A产生的T细胞数量比IL17F产生的多,尽管大部分细胞同时表达这两个因子(图5f)。我们将T细胞标记基因映射到空间测序样本中,并揭示出尽管在表皮中鲜有检测到IL-17或TNF产生的T细胞,大部分T细胞在皮肤真皮表皮交界处检测到(图5e),这一结果在免疫荧光染色中得到了验证。有趣的是,我们发现IL-17受体基因(IL17RA)和TNF受体基因(TNFRSF1A)在PP样本的表皮中高表达(图5e),与在角质细胞中发现的局部细胞因子反应结果一致。
5、单细胞RNA测序确定银屑病患者独特的髓系亚群
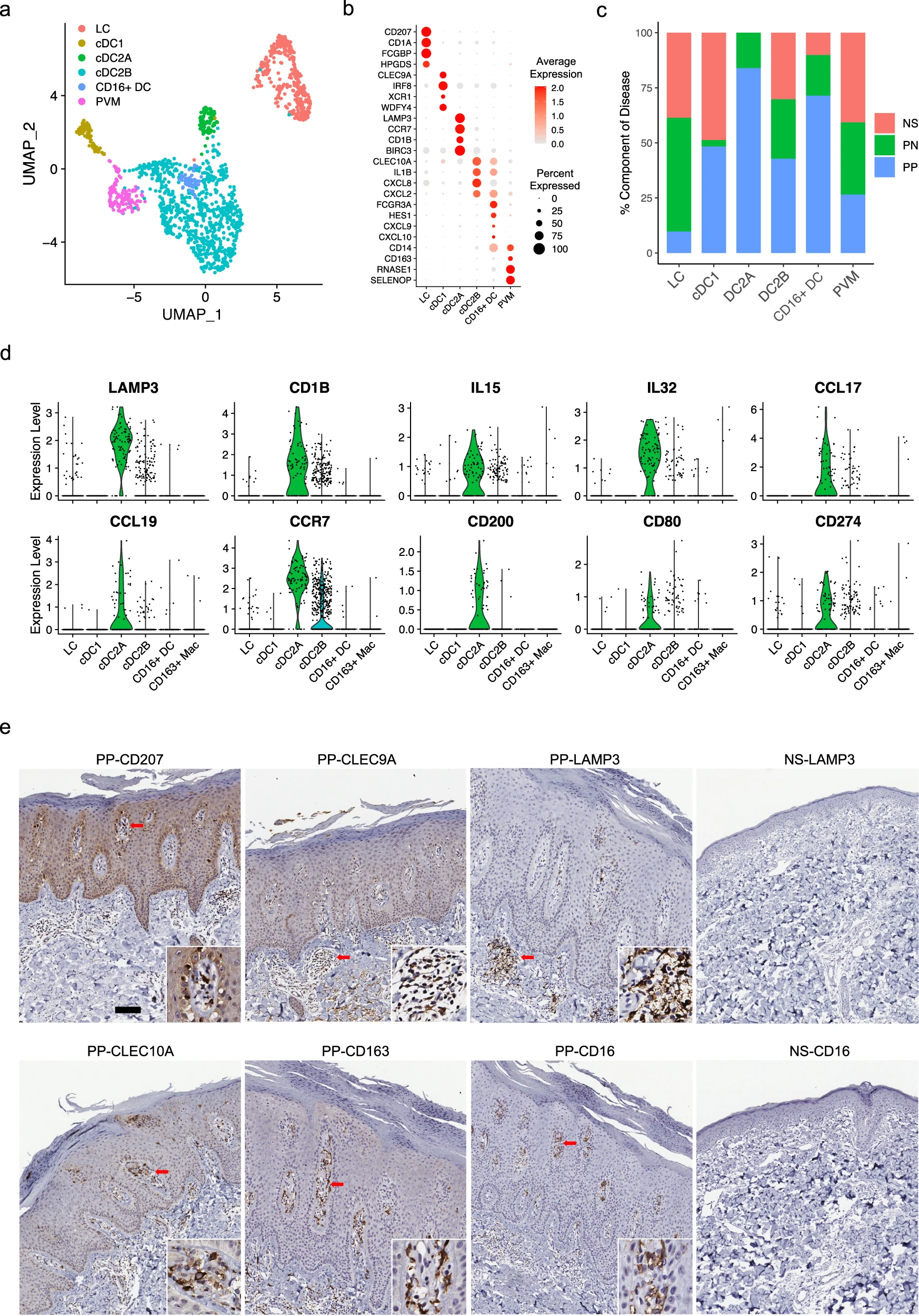
为了检查银屑病皮肤中髓系细胞的细胞异质性,我们对髓系细胞进行了亚群聚类,并注释了六个髓系亚群:朗格汉斯细胞(LC;CD207和CD1A)、经典1型树突状细胞(cDC1;CLEC9A和IRF8)、经典2型树突状细胞A亚群(cDC2A;LAMP3和CD1B)、经典2型树突状细胞B亚群(cDC2B;CLEC10A和IL1B)、CD16+树突状细胞(CD16+ DC;FCGR3A和HES1)和周围血管巨噬细胞(PVM;CD163和SELENOP)(图6a、b)。对每个亚型的疾病组成分析显示,在PP中LC的比例减少(图6c)。先前的研究表明在银屑病皮肤中LC的迁移和功能受损,我们的分析结果与此一致,显示PP中LC的数量减少。值得注意的是,cDC2A仅来源于PN和PP皮肤,其中PP皮肤中的数量更多。先前的研究报告显示IL15和IL32在银屑病中表达增加,这两种细胞因子都作为促炎介质,并且主要由cDC2A髓系细胞表达(图6d)。我们还发现CCL17、CCL19及其受体CCR7主要由cDC2A表达(图6d)。抑制CCL19/CCR7轴在病损皮肤中被报道为TNF阻断诱导的银屑病患者临床缓解的关键事件。此外,cDC2A高表达共刺激分子CD200、CD80和CD274,表明这些细胞可能在银屑病皮肤中引导和推动T细胞活性和扩增(图6d)。CD16+ DC主要来源于PP样本(图6c)。CD16+ DC具有与cDC2B类似的表达模式,包括CLEC10A、IL1B和CXCL2,但也表达FCGR3A(CD16)、CD14和HES1,这表明它们可能起源于循环CD14+ CD16+单核细胞(图6b)。值得注意的是,我们发现CXCL9和CXCL10主要由CD16+ DC表达,这两种趋化因子已被证明通过STAT1、STAT4和STAT5激活驱动效应性Th1/Th17细胞极化(图6b)。这些数据在银屑病和正常皮肤中通过免疫组织化学染色得到验证,并显示了这些亚群在银屑病皮肤中的不同定位,CLEC9A和LAMP3主要定位于真皮中的淋巴样结构中,CLEC10A和CD16主要位于真皮乳头的顶部(图6e)。在正常皮肤中找不到LAMP3+和CD16+细胞。PVM位于真皮乳头的周血管位置,而LC主要位于真皮乳头的真皮-表皮交界处(图6e)。
6、单细胞RNA测序突出银屑病相关遗传风险变异的细胞类型特异性
为了确定与银屑病相关的遗传变异相关的基因及其细胞位置,我们检查了GWAS在银屑病中检测到的65个单核苷酸多态性(SNP)位点。使用人体皮肤的表达定量性状位点(eQTL)数据库,共鉴定了与这些SNP相关的46个基因。为了增加与SNP位点相关的基因数量,我们还考虑了人类基因组中与SNP位点最近的基因,共得到65个相关基因。在去除低表达基因后,我们得到27个与eQTL相关的基因和57个最近基因。我们计算了这些基因在NS、PN和PP中每个细胞类型中的平均表达,并确定了表达每个基因的细胞类型。值得注意的结果包括C1orf68基因在角质细胞中的主要表达,且从NS到PN再到PP呈递减趋势。IL23R基因在PN和PP的T细胞中主要表达,已被证明促进银屑病中的IL-17反应。这些结果为功能研究提供了宝贵的资源,旨在了解与银屑病相关的遗传位点及其关键细胞群体的机制。
7、配体-受体分析显示银屑病的细胞类型特异性网络
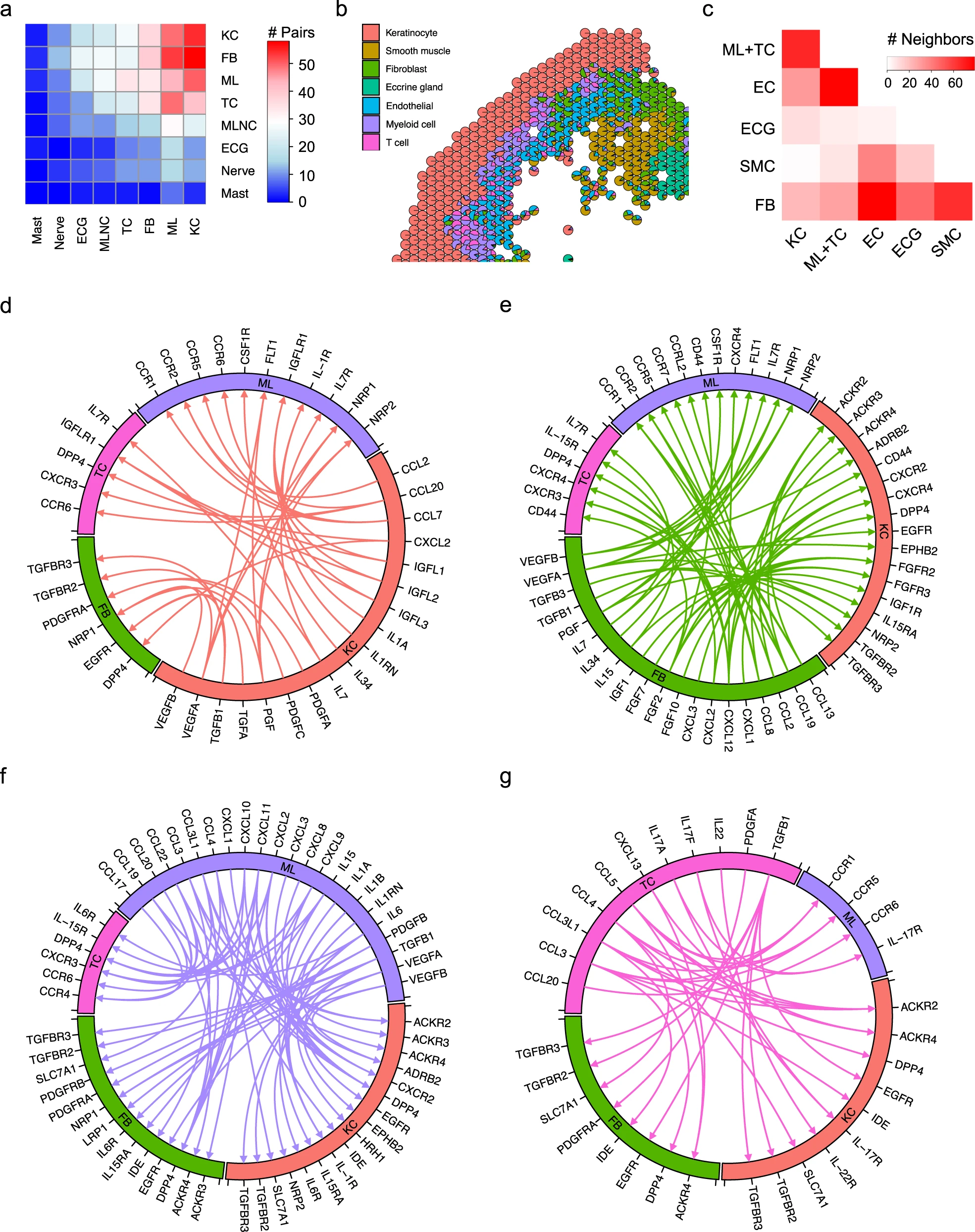
鉴于观察到与健康皮肤相比,银屑病皮肤中的细胞类型和亚型组成发生了变化,我们分析了随着银屑病的发展细胞间的相互通讯如何改变。为此,我们首先进一步对内皮细胞、平滑肌细胞和黑素细胞进行了亚群聚,并分别使用CellPhoneDB在NS特定的亚群聚和PP特定的亚群聚上进行配体-受体分析。为评估银屑病中发生的变化,我们分析了在PP中与NS相比具有更高相互作用分数的配体-受体对。在银屑病皮肤中,配体-受体对变化最多的细胞类型有四种:角质细胞、成纤维细胞、髓样细胞和T细胞(图7a)。我们认为空间位置上的邻近性将促进细胞间的通讯。为此,我们统计了每对细胞类型的相邻斑点数,如散点-饼图所示(图7b)。结果表明,角质细胞具有最多的免疫细胞邻居(T细胞和髓样细胞),成纤维细胞分布在许多其他细胞类型中,内皮细胞与免疫细胞相邻(图7c)。通过汇总配体-受体对变化的数量和空间邻近性分析,我们将分析重点放在角质细胞、成纤维细胞、髓样细胞和T细胞之间的相互作用上。
值得注意的是,角质细胞预测的相互作用包括CCL2和CCL7与髓样细胞中的CCR2的相互作用,CCL20与髓样细胞和T细胞中的CCR6和IL7与IL7R的相互作用,以及类胰岛素生长因子家族配体(IGFL1、IGFL2、IGFL3)与其受体(IGFLR1)在T细胞上的相互作用(图7d),这表明角质细胞在调控银屑病中的免疫反应中起着重要作用。此外,角质细胞表达了血小板源性生长因子(PDGFA、PDGFC)、转化生长因子(TGFB1)、表皮生长因子(TGFA)和血管内皮生长因子(VEGFA、VEGFB),这些因子能够与成纤维细胞上的相应受体发生相互作用(图7d)。
令人惊讶的是,成纤维细胞通过推测的配体-受体相互作用与许多细胞类型相连接。成纤维细胞产生了许多趋化因子(CCL13、CCL19、CCL2、CCL8、CXCL1、CXCL12、CXCL2、CXCL3),与髓样细胞和T细胞表达的受体相结合,提示成纤维细胞在银屑病中招募免疫细胞方面起着重要作用(图7e)。成纤维细胞还产生细胞因子IL-7和IL-15,与T细胞上的IL-7受体和IL-15受体相互作用,促进T细胞增殖和成熟。成纤维细胞通过表达与其受体结合的成纤维细胞生长因子(FGF10、FGF2、FGF7),具有诱导角质细胞过度增殖的能力。我们通过免疫组织化学(IHC)在银屑病斑块皮肤中验证了成纤维细胞生长因子FGF2和FGF7以及它们的受体FGFR2和FGFR3的表达。
髓样细胞表达多种趋化因子,进一步促进其他白细胞向银屑病部位的招募(图7f)。这些趋化因子还与角质细胞和成纤维细胞表达的非典型趋化因子受体(ACKR2、ACKR3、ACKR4)相互作用,引发过度的Th17反应并放大皮肤炎症。此外,髓样细胞表达的细胞因子(IL15、IL1A、IL1B、IL6)抑制角质细胞的凋亡。T细胞表达与角质细胞和成纤维细胞表达的非典型趋化因子受体相互作用的细胞因子(CCL3、CCL3L1、CCL4、CCL5、CXCL13)(图7g)。此外,T细胞表达的IL17A、IL17F和IL22与髓样细胞和角质细胞表达的受体结合,已知在银屑病中促进炎症。
因此,通过整合单细胞转录组测序数据、上游调节因子分析、配体-受体结果以及不同细胞类型的空间位置,我们能够创建一个突出成纤维细胞在银屑病皮肤中作用的模型。在银屑病中,SFRP2+成纤维细胞从纤维化状态转变为炎症状态。这些炎症性成纤维细胞表达CCL13和CCL19,能够招募表达相关趋化因子受体的细胞:CCR2+髓样细胞和CCR7+LAMP3+经典型2型树突状细胞A。这些炎症性成纤维细胞还高水平表达CXCL1,已知能够招募中性粒细胞,以及CXCL12,已知能够招募CXCR4+Tc17细胞。CXCL12还可以通过其在表皮上的受体CXCR4作用诱导角质细胞增殖。在表皮中,Tc17分泌的IL-17引发炎症,通过上皮角质层内的IL-36循环进一步放大,触发CCL20的释放,CCL20可以招募CCR6+Tc17以及CXCL1和CXCL8可以招募中性粒细胞,与上皮角质层中的微脓肿一致。
实验方法
免疫组织化学、scRNA-seq、Seurat、亚型细分、拟时序分析、银屑病相关遗传风险变异分析、配体-受体相互作用分析、Spatial-seq、CRISPR/Cas9、qRT-PCR、Seq-Scope样品处理和分。
参考文献
Ma, F., Plazyo, O., Billi, A.C. et al. Single cell and spatial sequencing define processes by which keratinocytes and fibroblasts amplify inflammatory responses in psoriasis. Nat Commun 14, 3455 (2023).






