快看过来 这里有铁死亡的研究新思路
铁失调已被牵涉到多种神经退行性疾病,包括帕金森病(PD)。受影响的大脑区域经常发现铁负荷的小胶质细胞,但铁的积累如何影响小胶质细胞的生理功能并促进神经退行性疾病的发生,目前还不太清楚。在这里,作者表明在一个三联培养系统中生长的人类iPSC衍生的小胶质细胞对铁有高度的反应,并容易受到铁死亡的影响。此外,铁过载导致小胶质细胞转录状态的明显转变,与PD死后大脑小胶质细胞中发现的转录组特征相重叠。这种小胶质细胞的反应有助于神经退行性改变,因为将小胶质细胞从三联培养系统中移除极大延迟了铁诱导的神经毒性。为阐明调节小胶质细胞中铁反应的机制,进行了全基因组CRISPR筛选,并确定了铁死亡的新调节因子,包括囊泡贩运基因SEC24B。这些数据表明,小胶质细胞铁超载和铁摄取作用在神经退行性中起着关键作用。本文于2023年1月发表在《Nature Neuroscience》IF:28.771期刊。
技术路线

主要实验结果
1、人iPSC来源的三联培养物对铁死亡敏感
为更好地了解铁信号传导和铁死亡在脑中的作用,作者建立了一个由人类iPSC衍生的神经元、星形胶质细胞和小胶质细胞的三联培养体系(Tri-culture),如图1A所示。在2周内,所有的细胞形成了一个复合网络(图1B)。为研究铁过载和铁死亡的作用,用铁和RSL3(铁+RSL3)处理培养物,RSL3是GPX4的抑制剂和已知的铁死亡诱导剂。通过细胞死亡染料Draq7检测,虽然单独使用铁或RSL3导致的细胞死亡很少,但抑制GPX4和外源性铁在处理20小时后诱导了大量的细胞死亡,这表明该培养系统可以发生铁死亡(图1C-1D)。铁+RSL3诱导的细胞死亡可被两种抗氧化剂铁死亡抑制剂lip-1和benzothiazine抑制至铁单独处理发水平,这支持铁死亡是死亡机制(图1C-1D)。在处理后18小时,有明显的小胶质细胞死亡,但神经元死亡多发生在20小时左右(图1C)。星形胶质细胞在任何时间点均未观察到铁死亡,这可能与抗铁死亡的NF2-Hippo通路相关基因的高表达有关。这些结果表明,人三联培养系统可作为与神经退行性疾病相关的细胞类型的铁反应和铁死亡的模型。
为更好地阐明不同类型的细胞是如何对铁诱导作出反应的,通过scRNA-seq测量了三联培养系统中细胞特定的转录组变化。分析了刺激后6小时的细胞,这个时间点在铁+RSL3条件下的明显死亡诱导之前(图1c)。在制备细胞的过程中,使用了转录抑制剂来保持细胞状态。总共对109,100个细胞进行了测序,每个细胞的中位深度为~40,000个读数。在五种条件下确定了17个聚类(图1f)。利用集群基因表达特征和每种细胞类型的几个已知标记,能够在所有条件下区分小胶质细胞、神经元和星形细胞(图1e-g)。进行pseudo-bulk分析,与对照相比,在铁+RSL3条件下确定了一个铁蛋白诱导的特征(图1h)。然后用UCell21检测了所有17个亚群的铁诱导特征的富集情况。发现,小胶质细胞亚群2的每个细胞的特征富集程度最大(图1i)。KEGG途径分析确定铁死亡和谷胱甘肽代谢是受影响最大的途径。此外,几个免疫相关和骨髓相关的途径失调,包括趋化因子信号和吞噬体(图1j)。这些结果表明,与神经元和星形胶质细胞相比,小胶质细胞对铁过载最敏感,可能是铁中毒级联中的一个关键角色。
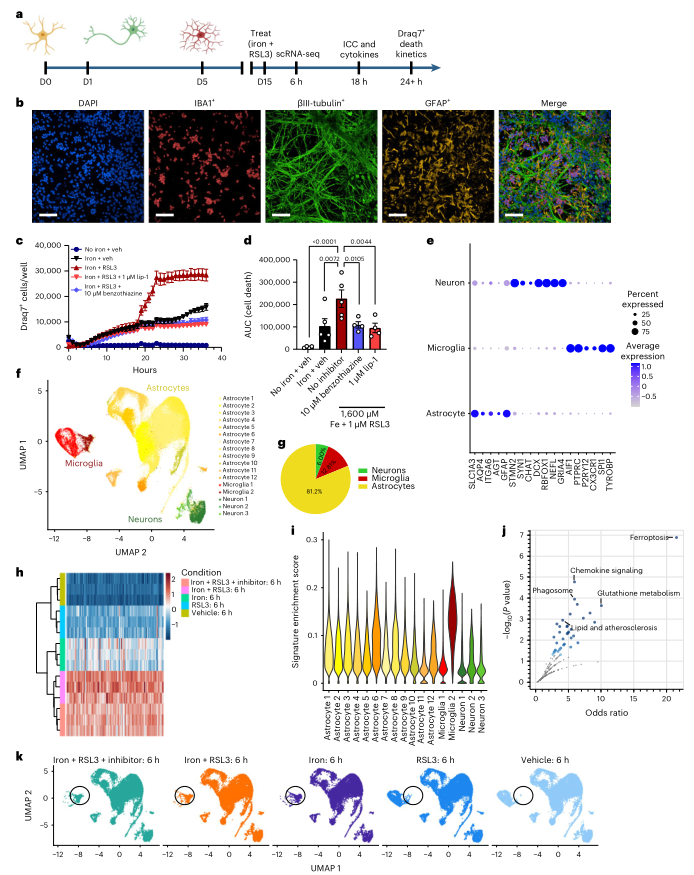
图1在iPSC三联培养中,诱导铁死亡可引起独特的转录反应和细胞死亡
2、铁过载和铁死亡改变小胶质细胞的状态
为了解铁刺激对小胶质细胞状态的直接影响,对小胶质细胞进行了进一步分析,发现了三个独特的亚群(图2a-c)。通过检查富集的基因和使用KEGG途径分析,确定第2群是一个独特的铁死亡相关转录组标签(FAS)亚群。该簇中的细胞富集了铁死亡和脂质途径以及p53信号、自噬和内质网(ER)压力(图2d,e)。FAS亚群在纯铁、铁+RSL3、铁+RSL3+benzothiazine的条件下高度富集,并具有pseudo-bulk特征有最高的富集分数(图1i,k)。FAS小胶质细胞在铁+RSL3+benzothiazine条件下持续存在,表明这种抗氧化剂抑制剂作用于铁的下游,尽管在很大程度上阻止了铁死亡。 在对照组中富集的另外两个小胶质细胞亚群包括一个稳态亚群(簇1)和一个增殖亚群(簇3)(图2a-b)。
尽管小胶质细胞对铁过载有明显的反应,但通过计算每种细胞类型中铁+RSL3和无铁+对照组的差异表达基因(DEGs)来研究神经元和星形细胞的转录反应。在FAS小胶质细胞中被上调的几个与铁相关的基因在星形胶质细胞和神经元中也差异表达,包括GCLC、GCLM、SLC7A11和TFRC。然而,FAS小胶质细胞的top标记CXCL8在其他细胞类型中没有表达,总体而言,不同细胞类型的DEGs重叠有限(图2f)。然而,在神经元和星形胶质细胞中,铁死亡是最主要的激活途径。FAS小胶质细胞中最显著的DEG之一是FTH1(图2d)。FTH1在小胶质细胞中上调,但在神经元中不变,在星形胶质细胞中下调(图2g),表明暴露于诱导铁中毒的刺激后,铁的存储有差异。为证实这一点,进行IHC实验,发现暴露于铁+RSL3后,FTH蛋白水平在小胶质细胞中明显增加,而不是在星形胶质细胞(图2h,i)。这些发现表明,小胶质细胞对铁暴露有最大的反应,并且在三联培养中的铁存储量最大。
虽然铁螯合是小胶质细胞反应的关键部分,FAS小胶质细胞也上调CXCL8/IL-8 mRNA(图2D)。为评估铁过载是否引起细胞因子分泌的变化,在处理后18小时测定细胞培养上清液中的一系列炎性细胞因子。发现,与对照组相比,铁处理后IL-8增加了6.8倍,但不显著,铁+ RSL3条件下分泌的IL-8显著增加了7.8倍,benzothiazine或lip-1可部分阻断IL-8的产生(图2J)。这些结果表明,铁过载引起小胶质细胞细胞因子产生和释放的变化,可能参与了疾病的病理环境。

图2与星形胶质细胞和神经元相比,诱导铁死亡引起小胶质细胞状态的深刻改变
3、小胶质细胞加剧铁死亡驱动的神经变性
神经退行性疾病中含铁小胶质细胞的存在以及铁过载后小胶质细胞状态的转变提出了它们可能导致神经元死亡的可能性。为研究FAS小胶质细胞在神经退行性疾病中的作用,在有或没有小胶质细胞的情况下建立了星形细胞-神经元共培养物(图3a)。值得注意的是,没有小胶质细胞的培养物具有明显的延迟和减少的铁死亡(图3b, c)。
为直接评估这种差异是否由神经元丢失引起,进行了IHC,发现只有在含有小胶质细胞的共培养中,神经元表面积才显著丢失(图3d, e)。还发现,只有当小胶质细胞存在时,神经元脂质过氧化才会显著增加(图3d, f)。值得注意的是,自由基捕获抗氧化剂lip-1和fer-1以及铁螯合剂DFO均可挽救神经元丢失,并部分挽救神经元和小胶质细胞的脂质过氧化(图3e, f)。神经元表面积与脂质过氧化呈负相关(图3g),处理24小时后的小胶质细胞存活数量和铁死亡处理与神经元表面积减少呈正相关,与神经元脂质过氧化呈负相关,表明小胶质细胞死亡在神经毒性中的作用(图3h,i)。总之,这些结果表明,小胶质细胞表型的改变和小胶质细胞的死亡产生了一个导致神经元毒性的环境。

图3小胶质细胞使神经元对铁死亡依赖性变性敏感
4、铁死亡特征在神经退行性疾病中富集
目前缺乏明确的生物标志物来确定铁的积累是否导致患者的铁死亡。作者探讨了是否能从iPSC三联培养系统中发现PD和ALS患者样本中富集的铁死亡特征。分析了3PD患者和3名健康对照组的死后putamen脑组织的snRNA-seq(图4a)。无偏聚类确定了小胶质细胞、少突胶质细胞前体细胞(OPCs)、少突胶质细胞、神经元、星形胶质细胞和内皮细胞在测序样品中的数量相似(图4b)。对FAS小胶质细胞数据集进行了单细胞加权基因共表达网络分析(hdWGCNA),以确定五个与铁死亡有关的基因模块(图4c)。FAS小胶质细胞在模块3、4和5中显著富集,而稳态小胶质细胞在模块2中显著富集(图4d)。模块4富集了与铁失调、谷胱甘肽转移酶活性、铁结合和花生四烯酸结合有关的基因(图4d-f)。与健康对照相比,与铁相关的模块4和模块3在PD小胶质细胞中显著富集(图4g)。此外,许多在FAS小胶质细胞中上调的基因在PD小胶质细胞中也上调,包括CXCL8、FTH1、ATG4C和EDEM1。
数据显示,铁死亡相关途径,包括那些与FAS小胶质细胞相关的途径,在死后的脑组织中是上调的,但是,为了研究这种特征是否可以在活着的病人中检测到,作者分析了健康人和PD参与者的血液RNA-seq数据,这些参与者参加了加速帕金森病药物伙伴关系(AMP PD)、帕金森病进展标志物计划(PPMI)的队列研究(n = 1,433; 816名帕金森病患者和617名对照组)和帕金森病生物标志物计划(PDBP)(n = 1,284; 780名帕金森病患者和504名对照组)(图4h)。PD病例和健康对照组之间的差异性基因表达分析发现了明显上调和下调的铁死亡相关基因,其中许多在三联培养FAS小胶质细胞签名中发现,包括GCLC、GPX4、HMOX1、SQSTM1和SLC7A11(图4i)。事实上,铁死亡和IL-8信号传导是IPA确定的最高失调路径之一(图4j)。这些发现表明,在来自PD患者的血液样本中存在一个铁死亡基因特征,并且铁失调可能在患者体内发生。此外,这些发现表明,血液样本有可能被用作外周生物标志物,用于PD和其他神经退行性疾病的铁死亡患者识别和分层。
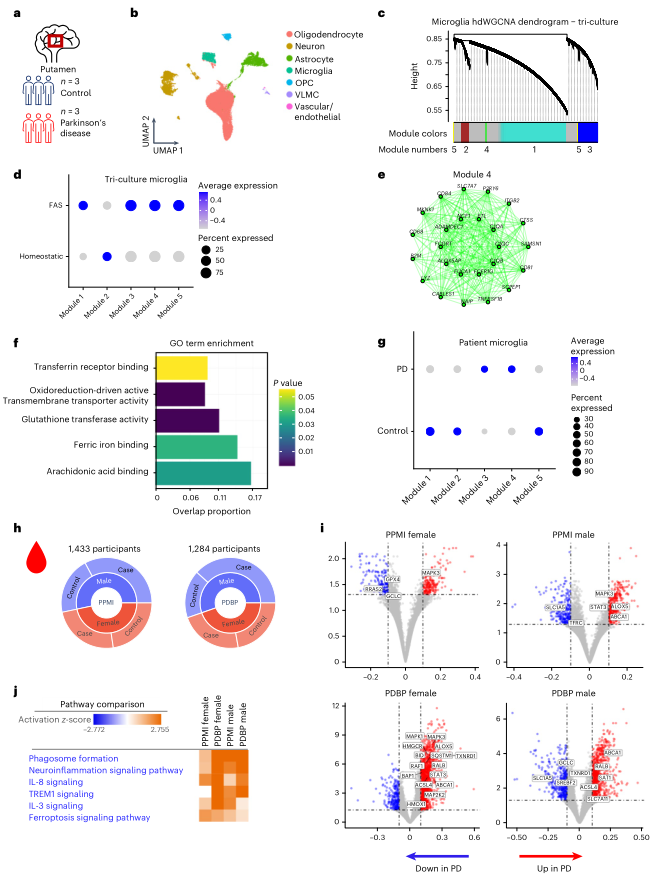
图4检测PD患者小胶质细胞的FAS标签和AMP PD患者血液样本中的铁死亡基因标签
5、CRISPR筛选鉴定小胶质细胞铁死亡调节因子
作者使用表达cas9的永生化人类小胶质细胞进行了正向选择的全基因组CRISPR筛选,以实现全基因组分析所需的可扩展性。使用针对19114个基因的76,612个向导库,每个基因有四个向导。用两个单独生成的病毒库转导细胞,用对照或铁+RSL3处理8小时或24小时,进行较少和较严格的选择(图5a)。从8小时暴露中发现了61个命中(图5b),从24小时暴露中发现了65个命中(图5e)。这些数据表明,在多种细胞类型中存在一个铁死亡调节器的核心网络,但调节器可能是细胞类型特定的。
GO分析在两个时间点都发现了与ER压力和运输以及ER-Golgi囊泡运输有关的基因(图5c、d、f、g)。有趣的是,这些途径在FAS小胶质细胞中也是富集的(图2d,e)。ACSL4是一个成熟的铁死亡调节因子,而SEC24B是本研究中发现的一个新因子,是唯独两个在两个时间点和库中都存在的基因(图5b,e)。SEC24B是COPII介导的从ER到高尔基体的蛋白调节器。自噬、溶酶体和内体途径也被富集(图5c、d、f、g)。SEC24B与ER-高尔基体中间室(ERGIC)中的自噬体形成有关,而自噬也与铁死亡有关通过铁噬。ER-高尔基体和自噬相关途径的这种关联以及与SEC24B的联系促使作者研究SEC24B调节铁死亡的潜在机制。
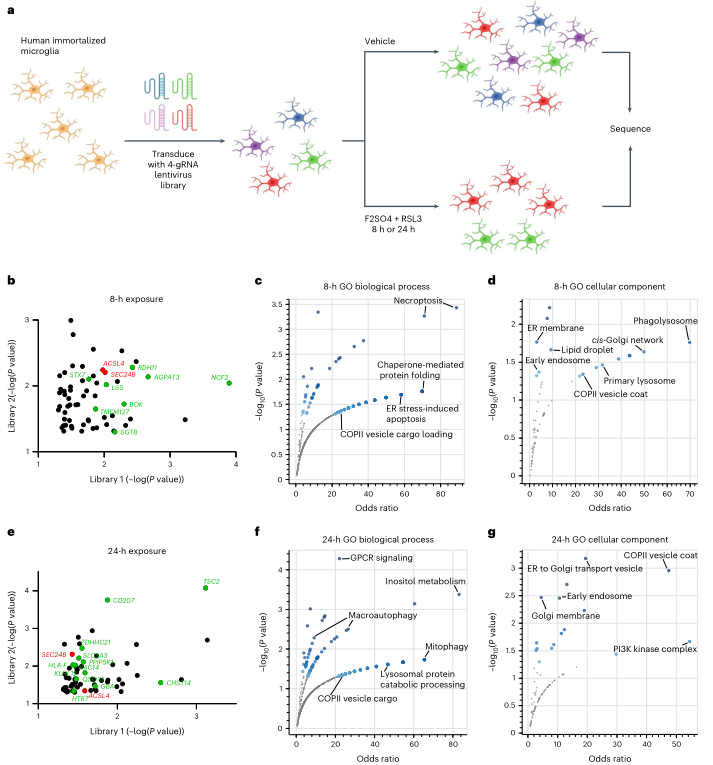
图5全基因组CRISPR筛选鉴定SEC24B是小胶质细胞铁死亡的一种新型调节剂
6、SEC24B敲除可阻止小胶质细胞的铁死亡
为探索SEC24B作为铁死亡调节器的作用,评估了SEC24B基因敲除(KO)的骨髓细胞系对铁死亡的敏感性。通过qRT-PCR和WB证实了SEC24B缺失,(图6a,b)。为评估铁死亡的敏感性,将细胞暴露在铁+RSL3下,通过Draq7的摄取量测量24小时内的细胞死亡。SEC24B KO细胞对铁死亡有很强的抵抗力,与对照的同源系相比,铁死亡减少了4倍(图6c)。SEC24B KO细胞在暴露于铁中毒刺激2-4小时后,脂质过氧化也明显减少,脂质过氧化没有基础差异(图(Fig.6d)。这些结果表明,SEC24B是小胶质细胞和巨噬细胞中诱死亡的一个强有力的调节器。
SEC24B通过结合SEC24A和SEC23B并定位于ERGIC来响应饥饿,从而在自噬流中发挥作用。一旦形成,该复合体可帮助产生自噬体。有趣的是,SEC24B-COPII定位到ERGIC依赖于PI3K,这是CRISPR筛选中富集的通路(图5f, g)。为了探索SEC24B和自噬在铁死亡易感性中的潜在作用,将SEC24B KO HAP1细胞和对照HAP1细胞暴露于自噬抑制剂氯喹,发现在SEC24B KO细胞中LC3 I/II比值降低,表明自噬流显著受损(图6e, f)。为了探索SEC24B是否也调节铁自噬,测定自噬条件下的铁蛋白水平,但发现铁蛋白水平没有变化(图6g)。为使用更多与铁死亡相关刺激,将细胞暴露于erastin,这是一种强烈的铁死亡诱导剂,已被证明可以驱动铁平衡的改变和铁蛋白吞噬。SEC24B KO细胞对erastin诱导的铁死亡有很强的抵抗力(图6h),erastin处理导致同源对照组中铁蛋白和游离易耗铁明显增加,但铁蛋白的增加减少,SEC24B KO细胞中的易耗铁没有差异(图6i,j)。这些发现表明,虽然SEC24B的缺失导致自噬通量受损,但它很可能没有通过铁蛋白自噬来调节铁蛋白的摄取。然而,这些结果表明,SEC24B确实改变了易耗铁池,这是铁死亡级联的一个关键上游触发因素,这可以解释SEC24B KO的保护作用。
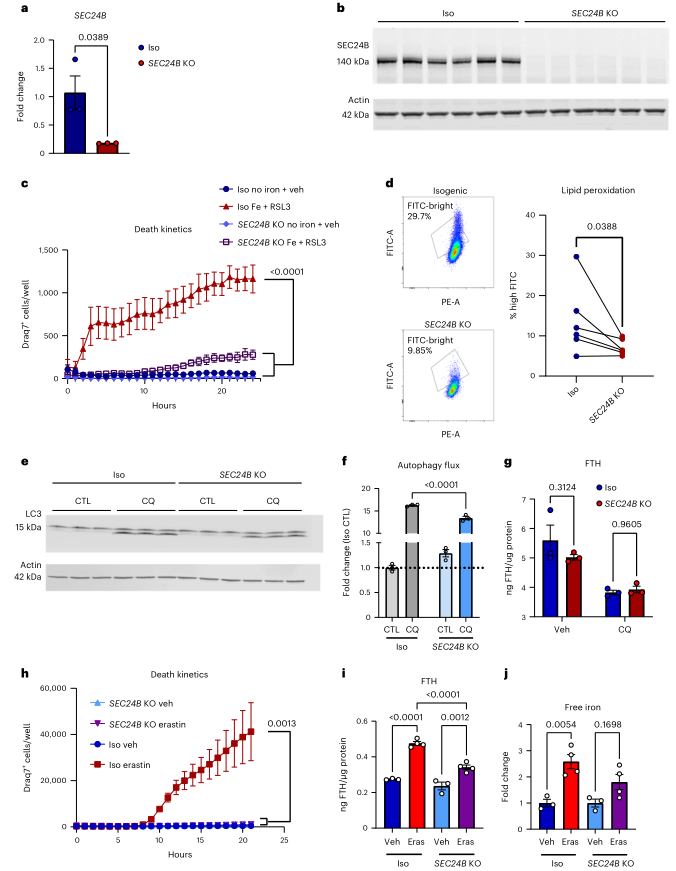
图6 SEC24B是铁死亡的有效调节因子
7、靶向CRISPR的化合物可抑制铁死亡
鉴于小胶质细胞的铁死亡在神经退行性中的潜在作用,作者试图找出能抑制小胶质细胞铁死亡的化合物。为做到这一点,用一个市售的、与铁死亡有关的库进行了有针对性的小分子筛选,该库由546个化合物组成,包括一些已经在临床使用的化合物。将表达Cas9的小胶质细胞系暴露于铁+RSL3,并与10µM(535/546)或2µM(11/546)的化合物共同处理。与对照相比,任何导致细胞存活率≥70%的化合物都能抑制铁诱导作用。在546个化合物中,发现有39个化合物抑制了小胶质细胞的铁死亡(图7a-c)。在生物活性数据库ChEMBL57上对这39个化合物进行了分析,以确定它们被预测为作用于哪些途径。这一分析表明,PI3K信号传导、GPCR信号传导和坏死循环途径被富集(图7d)。这些途径也在CRISPR筛选中被发现(图5c,d,f,g)。其他几个CRISPR目标也与化合物命中的目标有关。例如,两个细胞色素P450抑制剂(高良姜素和异水杨酸)在化学筛选中被命中,许多细胞色素P450相关基因,包括CYP3A43、CYP46A1和CYP1B1,在CRISPR筛选中被命中。还有多个炎症相关的基因,如HIF1A、CNR2和NFKBIZ,来源CRISPR筛选的也分别被BAY 87-2243、olivetol和姜黄素及JSH-23命中(图7e)。因此,药理筛选确定了一系列的化合物,并验证了CRISPR筛选中确定的多种途径和基因。
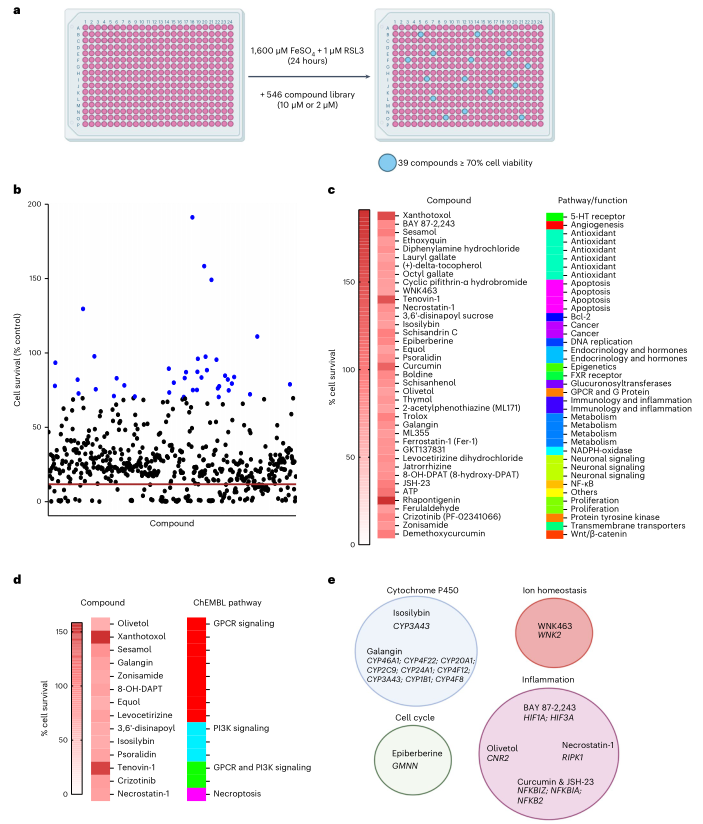
图7铁死亡药物抑制剂的小分子筛选
实验方法
Tri-culture组装,Tri-culture铁死亡处理,单细胞RNA测序(scRNA-seq),Tri-culture的Draq7死亡动力学,永生化小胶质细胞和HAP1细胞系的Draq7死亡动力学,全基因组CRISPR筛选,商业铁死亡相关化合物的筛选,
参考文献
Ryan SK, Zelic M, Han Y, Teeple E, Chen L, Sadeghi M, Shankara S, Guo L, Li C, Pontarelli F, Jensen EH, Comer AL, Kumar D, Zhang M, Gans J, Zhang B, Proto JD, Saleh J, Dodge JC, Savova V, Rajpal D, Ofengeim D, Hammond TR. Microglia ferroptosis is regulated by SEC24B and contributes to neurodegeneration. Nat Neurosci. 2023 Jan;26(1):12-26. doi: 10.1038/s41593-022-01221-3. Epub 2022 Dec 19. PMID: 36536241; PMCID: PMC9829540.






