P. gingivalis感染上调树突状细胞PD-L1表达,抑制CD8+ T细胞反应,加重口腔癌
栏目:最新研究动态
发布时间:2023-09-19
研究表明靶向Pg和/或其介导的信号通路可能是一种提高检查点阻断免疫疗法疗效的治疗策略......
越来越多的证据表明,树突状细胞(DC)上PD-L1的表达对癌症免疫治疗至关重要,牙龈卟啉单胞菌(Porphyromonas gingivalis, Pg)的定植加剧了上胃肠道癌症的进展。然而,在口腔癌感染环境中,Pg感染对DC中PD-L1表达的影响以及相关的免疫后果仍未研究。在培养细胞和全身感染实验中,我们发现Pg感染以牙龈素依赖的方式增强了DC上PD-L1的表达。Pg感染通过上调卵清蛋白(OVA)脉冲DC上的PD-L1表达来抑制抗原特异性CD8+ T细胞。这种抑制表现为IFNγ、穿孔素、颗粒酶B和CD107a的减少。进一步分析表明,Pg显著降低了CD8+ T细胞裂解OVA脉冲靶细胞的能力。此外,Pg感染增加了Akt和STAT3的磷酸化,导致PD-L1表达显著增加。通过使用siRNA、过表达质粒和药物抑制剂证实了这一点。与体外观察结果一致,在同基因小鼠口腔癌模型中,Pg感染显著增强了瘤内组织和颈部淋巴结DC上PD-L1的表达,并加速了口腔癌的进展,而Pg赖氨酸特异性、牙龈缺陷突变体则没有这样做。当用抗生素或STAT3抑制剂预处理肿瘤细胞时,Pg的这些影响在很大程度上减弱。因此,我们证明Pg感染通过Akt-STAT3信号通路上调DC上PD-L1的表达,抑制CD8+ T细胞的细胞毒性,并加剧口腔癌的生长,这表明靶向Pg和/或其介导的信号通路可能是一种提高检查点阻断免疫疗法疗效的治疗策略。本文于2023年3月发表于Cancer Immunology Research (IF=12.02)。
技术路线:
结果:
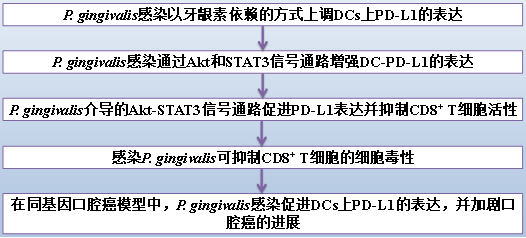
(1) P. gingivalis感染以牙龈素依赖的方式上调DCs上PD-L1的表达
据报道,PD-L1在DCs表面组成性表达以抑制效应T细胞的激活。使用培养10天的GMDCs和Flt3l-DCs,我们首先检查牙龈卟啉单胞菌感染是否影响DCs的频率和成熟。与未受刺激的对照组相比,牙龈卟啉单胞菌感染提高了CD80/CD86的表达,但没有显著改变两种DCs上CD11b和CD11c的表达(补充图S1),这表明牙龈卟啉单胞菌感染可能影响DC的成熟,但对DCs的数量影响不大。接下来,我们检测了PD-L1在GMDCs上对牙龈卟啉单胞菌感染的表达。我们发现,与未受刺激或共生菌S. sanguinis刺激的细胞相比,牙龈卟啉单胞菌感染显著增加了GMDCs上PD-L1的表达(图1A-C),Western blot进一步证实了这一点(图1D)。我们未观察到DCs上PD-L2的表达有任何显著变化(图1E)。因为GM-CSF刺激优先扩展2型常规DC (cDC2)亚群,而Flt3l刺激扩展1型DC (cDC1),我们接下来研究了牙龈卟啉单胞菌感染是否促进了Flt3l-DCs上PD-L1的表达。P. gingivalis侵袭后,Flt3l-DCs上PD-L1的表达显著增加(图1F-J)。
考虑到与CD8+ T细胞相比,Flt3l介导的cDC1细胞在肿瘤抗原交叉呈递方面更有效,我们在整个研究中都使用了Flt3l-DCs。为了研究牙龈卟啉单胞菌的毒力因子对PD-L1表达的调控,我们接下来研究了感染△Kgp突变体是否会影响Flt3-DCs上PD-L1的表达。缺乏gingippain使P. gingivalis上调PD-L1表达的能力丧失(图1F-J),Western blot进一步证实了这一点(图1J)。由于干扰素是DCs上PD-L1表达的主要因素,我们还利用中和抗体阻断I型IFN受体2和II型干扰素,以检验牙龈卟啉单胞菌是否通过干扰素的重新合成促进PD-L1表达。在使用中和抗体和同型对照治疗的树突状细胞中,PD-L1未发生实质性变化(图1K),表明干扰素可能不参与牙龈卟啉单胞菌增强PD-L1表达。综上所述,我们的研究结果表明,牙龈卟啉单胞菌感染促进了DCs上PD-L1的表达,而牙龈蛋白酶是这一过程的关键因素。
接下来,我们检测了PD-L1在脾DCs中的表达(MHC-II+ CD11c+;图2A,B),小鼠接种牙龈卟啉单胞菌或其突变体△Kgp 24小时。同样地,S. sanguinis被用作共生控制菌。与感染共生菌相比,P. gingivalis显著增强了CD11c+MHC-II+细胞上PD-L1的表达,而△Kgp在很大程度上失去了这种能力(图2C-E)。此外,我们使用了体内牙龈卟啉单胞菌慢性感染模型,正如我们在之前的研究中所做的那样,来检查感染小鼠中DC表型的可能改变。我们发现口腔牙龈卟啉单胞菌感染导致CLNs DCs上PD-L1表达显著增加,而△Kgp突变体和共体对照则没有这样做(图2F-H)。总之,这些结果首次证明,牙龈卟啉单胞菌在体外和体内促进DCs上PD-L1的表达,其方式依赖于赖氨酸特异性牙龈蛋白酶的存在。
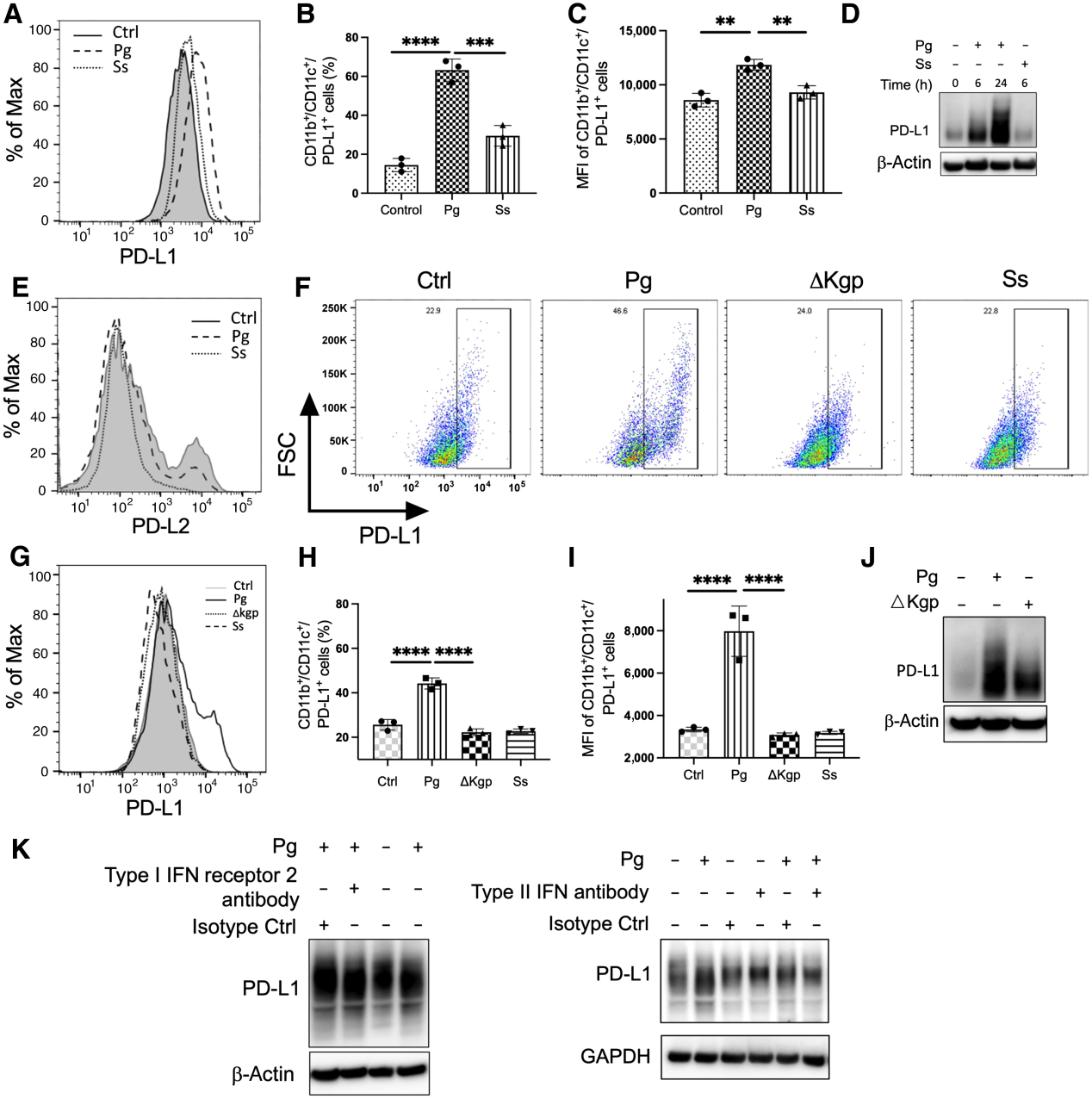
图1:牙龈卟啉单胞菌感染增强PD-L1在GMDCs和Flt3l-DCs上的表达,并以牙龈素依赖的方式增强

图2:体内牙龈卟啉单胞菌感染可促进DCs上PD-L1的表达
(2) P. gingivalis感染通过Akt和STAT3信号通路增强DC-PD-L1的表达
牙龈卟啉单胞菌感染激活了大量的信号级联反应,导致炎症免疫反应。鉴于Akt和STAT3都是PD-L1表达的关键驱动因素,我们接下来研究了牙龈卟啉单胞菌感染介导的DC-PD-L1上调是否通过Akt和STAT3进行。正如所料,P. gingivalis感染强劲增加一种蛋白激酶的磷酸化和STAT3(图3A,B),但△Kgp变异仅略增强磷酸化STAT3和未能产生一种蛋白激酶磷酸化(图3C)。考虑到Akt和STAT3磷酸化的趋势(图3A-C)与PD-L1表达的趋势(图1G-J)相似,P. gingivalis和△Kgp的挑战下,PD-L1的升高可能是通过Akt和STAT3的调节。为了进一步证明这一点,我们使用特异性Akt抑制剂MK2206治疗DCs,并检测PD-L1在牙龈卟啉单胞菌侵袭下的表达。我们发现,抑制Akt可使牙龈卟啉单胞菌刺激的DC中PD-L1的表达呈剂量依赖性降低(图3D-F),并通过Western blot证实了这一点(图3G)。此外,Akt抑制可导致磷酸化和总STAT3减少(图3G),这表明STAT3可能是Akt的下游靶点(图3G)。通过观察,STAT3抑制未能影响牙龈卟啉单胞菌刺激的DC中Akt的磷酸化,这一点得到了相反的证实(图3H)。此外,我们发现通过siRNA对STAT3进行化学抑制或基因沉默,可导致牙龈卟啉单胞菌刺激的DC中PD-L1表达显著降低(图3I,J)。为了排除siRNA可能的脱靶效应,并验证STAT3对PD-L1表达的影响,我们将编码STAT3的质粒转染到DC中,发现STAT3过表达(图3K)会导致PD-L1在牙龈卟啉单胞菌攻击后显著升高(图3K,L)。这些数据表明,P. gingivalis诱导DC上PD-L1表达升高是通过调节Akt-STAT3信号传导。

图3:P. gingivalis感染激活Akt-STAT3信号通路,从而促进DCs上PD-L1的表达
(3) P. gingivalis介导的Akt-STAT3信号通路促进PD-L1表达并抑制CD8+ T细胞活性
接下来,我们研究了牙龈卟啉单胞菌对CD8+ T细胞活化的可能影响。为此,用抗原OVA肽(SIINFEKL)预脉冲Flt3l-DCs,浓度为0.1至10 ng/mL,然后用牙龈卟啉单胞菌攻毒,并与来自OT-I小鼠的OVA特异性脾CD8+ T细胞共培养3天。因为观察到1 ng/mL的OVA刺激产生最高水平的IL2 (补充图S2),我们在接下来的实验中使用这个浓度。P. gingivalis处理显著提高了DC上PD-L1的表达,这与我们在图1中的观察结果一致,表明P. gingivalis感染在不同情况下促进PD-L1的表达(图4A)。此外,OVA脉冲DC有效地激活了CD8+ T细胞,其表现为显著增加的效应分子,包括Prf、GrB和CD107a,以及标志细胞因子IFNγ和IL2 (图4B-G)。然而,当抗原脉冲DC受到牙龈卟啉单胞菌攻击时,效应分子和标记细胞因子的产生显著减少(图4B-G),ELISA进一步证实了这一点(图4D,E)。这些结果表明,牙龈卟啉单胞菌感染增强了PD-L1的表达,抑制了CD8+ T细胞活性。
为了进一步确定P. gingivalis是否通过调节STAT3和PD-L1介导CD8+ T细胞的抑制,我们首先使用STAT3抑制剂WP-1066治疗抗原脉冲DC,然后用P. gingivalis攻击并与CD8+ T细胞共培养。72小时后,我们发现WP-1066显著降低了PD-L1的表达,同时提高了CD8+ T细胞中IFNγ、Prf、CD107a和GrB的表达(图5A-E)。此外,我们还利用PD-L1拮抗剂结合肽(D)-PPA阻断PD-L1/PD-1的结合,以确定PD-L1在牙龈卟啉单胞菌抑制CD8+ T细胞活性中的作用。正如预期的那样,用(D)-PPA肽阻断PD-L1对DC的抑制作用显著减弱了牙龈卟啉单胞菌感染对Prf、IL2和GrB产生的抑制作用(图5F-H)。综上所述,这些数据表明牙龈卟啉单胞菌感染通过STAT3介导的DC细胞上PD-L1的表达抑制CD8+ T细胞活性。

图4:牙龈卟啉单胞菌感染可促进DC-PD-L1并抑制CD8+ T细胞活性
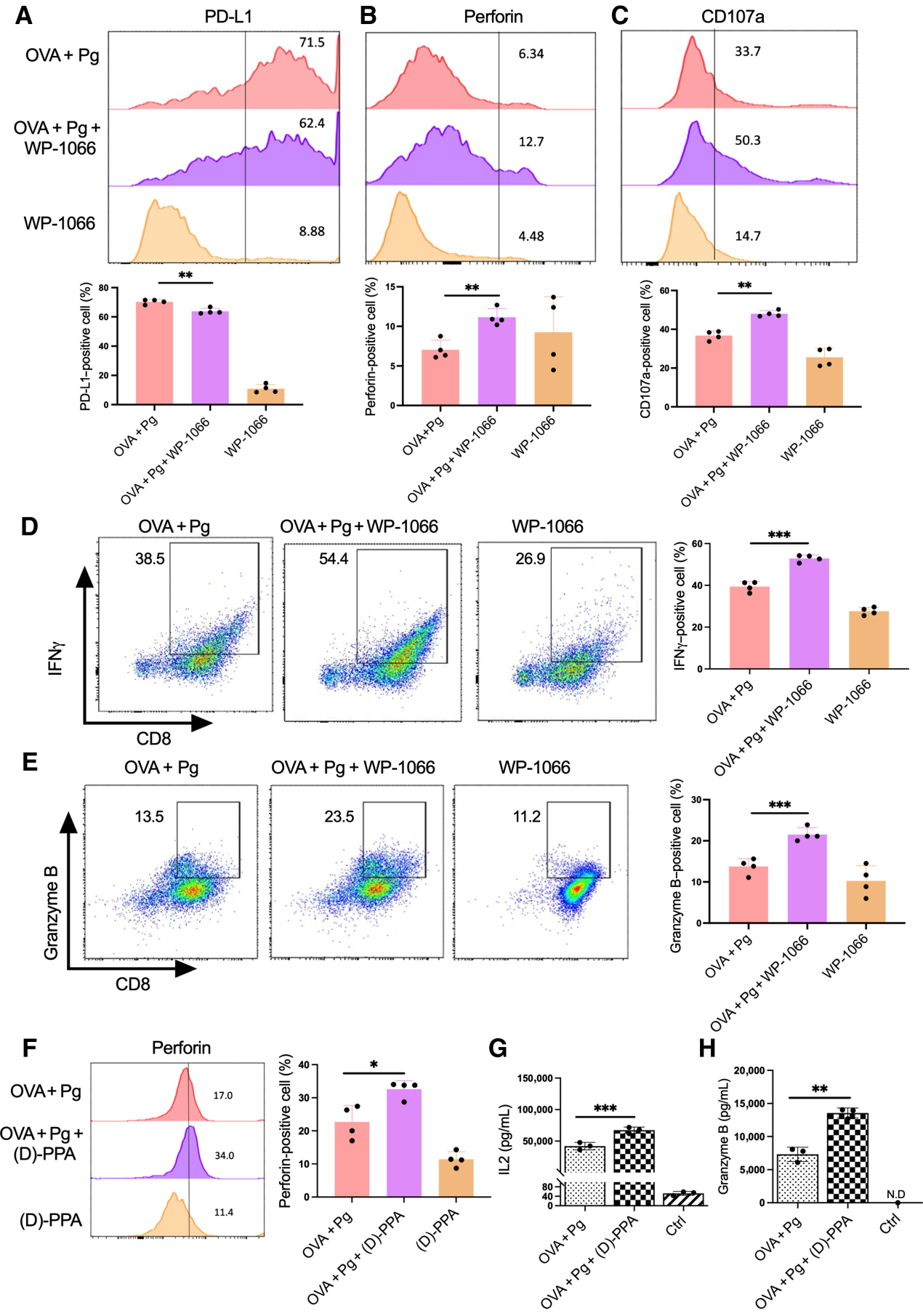
图5:牙龈卟啉单胞菌感染通过调节STAT3活性抑制CD8+ T细胞活性
(4) 感染P. gingivalis可抑制CD8+ T细胞的细胞毒性
为了进一步评估牙龈卟啉单胞菌感染对CD8+ T细胞毒性的影响,我们接下来将CD8+ T细胞与靶细胞(EL4细胞系)共培养,靶细胞用两种不同浓度的CFSE (1和0.1 mmol/L)。通过控制CFSE+CD8−细胞,我们在进一步分析中排除了可能的死细胞干扰(图6A)。P. gingivalis在所有组(三种不同的效应/靶比)中显著降低了CD8+ T细胞的细胞毒性,以裂解靶细胞的数量表示(图6B,C)。经牙龈卟啉单胞菌预处理的DC细胞组的靶细胞裂解率显著低于未处理的DC细胞组(图6C)。此外,STAT3抑制显著提高了CD8+ T细胞在牙龈卟啉单胞菌侵染下的细胞毒性(图6D)。值得注意的是,与野生型亲本菌株相比,感染△Kgp突变体显著增加了裂解的靶细胞(图6E)。总之,这些结果表明,牙龈卟啉单胞菌感染通过调节DC中STAT3激活和PD-L1表达来损害CD8+ T细胞的细胞毒性,这种能力至少部分地依赖于赖氨酸特异性牙龈蛋白酶的存在。
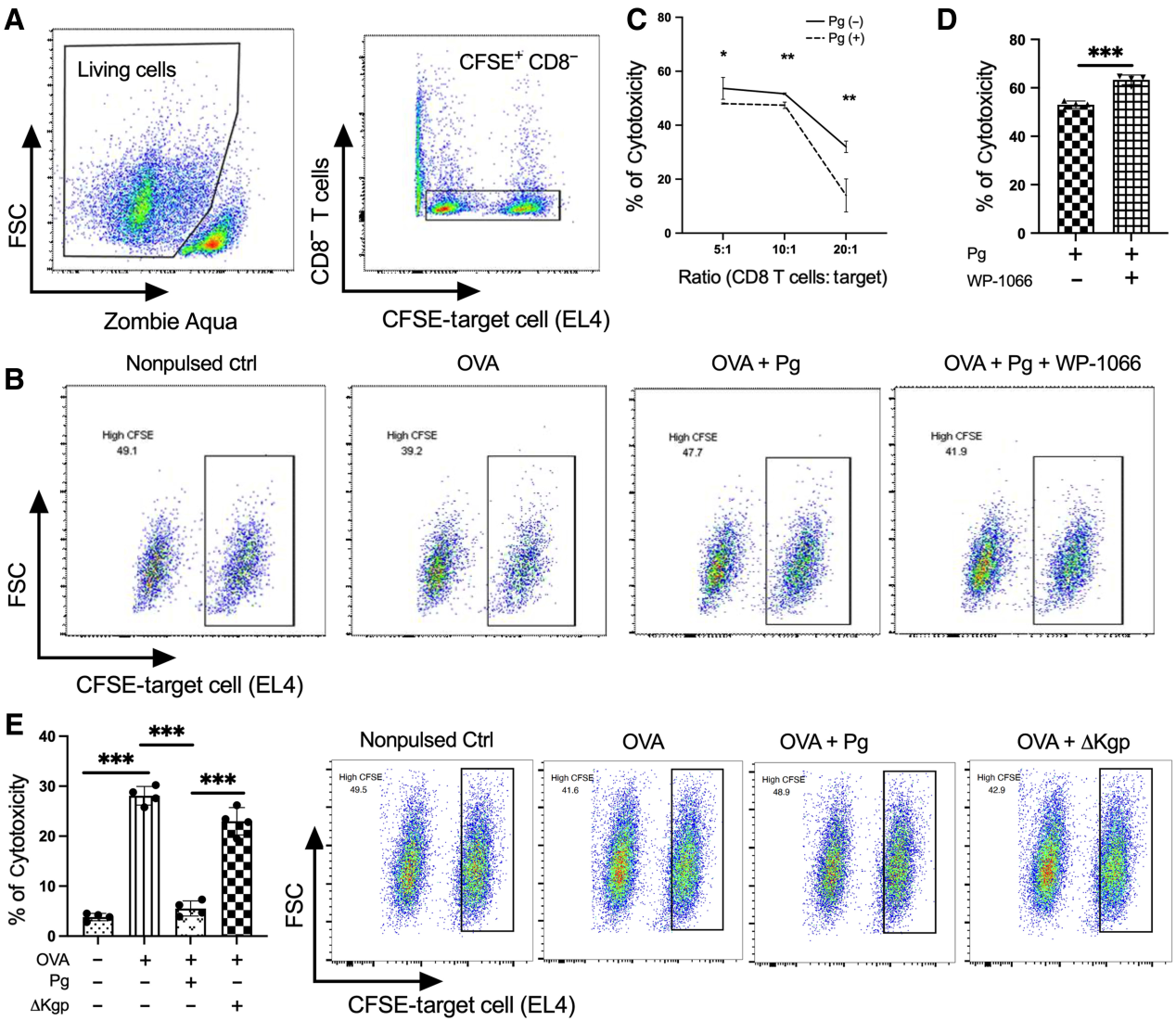
图6:牙龈卟啉单胞菌感染抑制CD8+ T细胞的细胞毒性
(5) 在同基因口腔癌模型中,P. gingivalis感染促进DCs上PD-L1的表达,并加剧口腔癌的进展
为了评估牙龈卟啉单胞菌感染对口腔癌中DC-PD-L1表达和CD8+ T细胞活性的影响,我们接下来使用了一种同源小鼠模型,其中将经过或不经过牙龈卟啉单胞菌预处理的MOC1细胞接种到小鼠舌头中(图7A)。我们发现,来自牙龈卟啉单胞菌感染小鼠淋巴结的CD11c+MHC-II+ DCs比来自对照小鼠的DC的PD-L1表达明显更高(图7B;P<0.001)。然而,用STAT3抑制剂治疗或喂食抗生素水可显著降低PD-L1的表达(图7B)。此外,牙龈卟啉单胞菌感染导致CD8+ T细胞上PD-1表达显著增加(补充图S2),这表明PD-L1和PD-1都可能是牙龈卟啉单胞菌调节CD8+ T细胞活性的靶点。PD-L1在DC上的过度表达已被证明会降低免疫治疗的疗效并加剧癌症进展。因此,我们研究了牙龈卟啉单胞菌感染是否会加剧口腔癌的进展。与未处理的MOC1细胞相比,经牙龈卟啉单胞菌预处理的MOC1细胞发育成更大的肿瘤,根据先前研究中描述的舌组织肿瘤肿块面积估计(图7C)。然而,与仅感染牙龈卟啉单胞菌或假对照组相比,感染牙龈卟啉单胞菌的小鼠在接受抗生素或WP-1066治疗后,肿瘤质量显著下降(图7C)。这些结果与先前大量研究一致,表明牙龈卟啉单胞菌感染促进肿瘤生长,恶化癌症患者的预后。考虑到目前还没有一种被广泛接受的测量方法来估计MOC1介导的同基因模型中的肿瘤体积,我们使用临床RECIST 1.1指南,并使用肿瘤肿块的最长尺寸来估计肿瘤体积。正如预期的那样,通过测量H&E染色图像中肿瘤肿块的最大直径(图7D,E),我们观察到各组肿瘤体积变化的趋势与测量肿瘤肿块面积(图7D,E)相似。此外,我们还使用免疫荧光检测浸润肿瘤组织的DC中PD-L1的表达。P. gingivalis感染显著促进肿瘤内DC上PD-L1的表达,但抗生素或STAT3抑制显著降低PD-L1的表达(图7F,G, P<0.001),这与淋巴结DC上PD-L1表达的改变是一致的。
为了研究在口腔自然感染环境下牙龈卟啉单胞菌感染与肿瘤进展的临床相关性,我们首先用口腔感染了牙龈卟啉单胞菌,然后将未感染的MOC1细胞接种到小鼠的舌头中。如上所述,我们检测了PD-L1在来自CLNs和肿瘤组织的DC上的表达以及肿瘤的生长情况。我们发现,口腔预感染牙龈卟啉单胞菌的小鼠的DC-PD-L1表达显著高于未感染的对照组,尽管略低于接种预感染的MOC1细胞并随后口腔感染牙龈卟啉单胞菌的小鼠(图7H-J, P<0.001)。此外,肿瘤体积改变的趋势与DC-PD-L1表达的趋势相似(图7K-M, P<0.001),表明牙龈卟啉单胞菌感染可能通过改变肿瘤微环境中的免疫景观参与肿瘤进展。此外,在MOC1细胞中感染牙龈卟啉单胞菌△Kgp突变体未能显著促进PD-L1表达和肿瘤进展(图7H-M, P<0.001)。总之,这些数据验证了我们的体外实验结果,并表明在同基因小鼠模型中,牙龈卟啉单胞菌感染增强了PD-L1的表达并加剧了口腔癌的进展。

图7:在同基因口腔癌模型中,牙龈卟啉单胞菌感染促进DCs上PD-L1的表达,并加剧口腔癌的进展
结论
我们首次证明了牙龈卟啉单胞菌感染可提高DCs表面PD-L1的表达,抑制CD8+ T细胞的细胞毒性,并加剧口腔癌的进展。此外,我们发现牙龈疼痛和P. gingivalis介导的Akt-STAT3信号的激活对于DC-PD-L1的上调和随后CD8+ T细胞毒性的抑制至关重要。鉴于针对PD-1及其配体的抗体在癌症免疫治疗中的成功应用,我们的研究结果为进一步了解牙龈卟啉单胞菌的免疫抑制特性提供了更多的见解,并确定了操纵免疫反应的潜在靶点,从而提高癌症免疫治疗的疗效。
实验方法
小鼠、细菌和细胞培养,ELISA,Western blots,Stat3 siRNA和质粒转染,淋巴细胞分离,DCs和OT-I T细胞共培养,细胞染色及流式细胞术,交叉呈递试验和CD8+ T细胞毒性试验,全身细菌感染试验,MOC1细胞接种诱导同源口腔癌模型及免疫组化
参考文献
Ren, J., Han, X., Lohner, H., Hoyle, R. G., Li, J., Liang, S., & Wang, H. (2023). P. gingivalis Infection Upregulates PD-L1 Expression on Dendritic Cells, Suppresses CD8+ T-cell Responses, and Aggravates Oral Cancer. Cancer immunology research, 11(3), 290–305. https://doi.org/10.1158/2326-6066.CIR-22-0541.






