衣康酸盐通过代谢和表观遗传重编程调节T细胞失衡来改善自身免疫
自身免疫性疾病的特点是丧失自我耐受性和针对重要器官的全身炎症。免疫抑制剂在自身免疫性疾病的治疗中起着核心作用。包括皮质类固醇在内的常规药物作用广泛,会增加严重感染的风险,而严重感染是导致死亡的主要原因。Th17细胞在几种自身免疫性疾病中发挥致病作用,而Treg细胞维持免疫稳态并抑制自身免疫。Th17和Treg细胞的失调导致许多自身免疫性疾病,包括多发性硬化症(MS)、系统性红斑狼疮和类风湿性关节炎。
2023年3月30日,一篇发表在国际杂志《Nature Communications》上题为“Itaconate ameliorates autoimmunity by modulating T cell imbalance via metabolic and epigenetic reprogramming”的研究报告中,来自北海道大学等机构的科学家们通过研究揭示了抗炎性代谢产物衣康酸(itaconate,ITA)对机体辅助T细胞和调节性T细胞的调节效应,相关研究或有望帮助开发治疗某些自身免疫性疾病的新型治疗性策略。
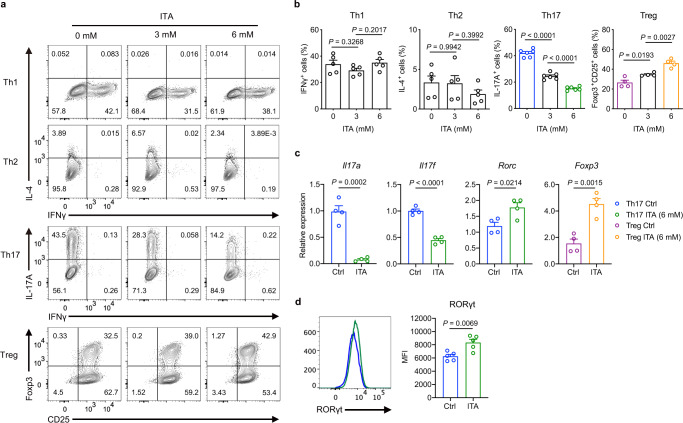
衣康酸调节Th17和Treg细胞分化
ITA以剂量依赖的方式抑制Th17并促进Treg细胞分化,而不影响其细胞活力、绝对数量和增殖。相反,ITA不影响Th1和Th2细胞的分化。ITA降低了Th17相关基因的表达,包括Il17a和Il17f,而ITA增强了Rorc的表达。此外,ITA增强了Foxp3在Treg细胞中的表达。在Th17中,RORγt的蛋白质水平也升高。这些结果表明,ITA调节Th17和Treg细胞的分化。
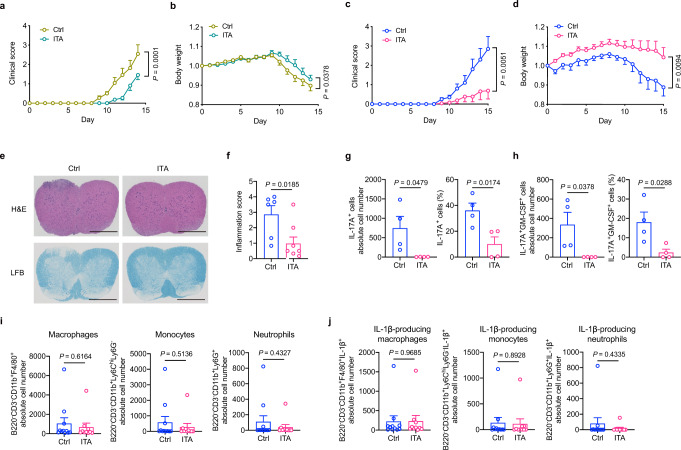
衣康酸盐改善了EAE模型
为了研究ITA作为治疗自身免疫性疾病候选药物的潜力,构建了实验性自身免疫性脑脊髓炎(EAE)模型。与PBS治疗相比,ITA治疗显著降低了EAE小鼠的临床评分和体重减轻。这些结果表明ITA有可能降低EAE的疾病活性。为了进一步研究ITA对Th17体内功能的作用,使用ITA处理的细胞的Rag1-/-小鼠的临床评分和体重减轻显著降低。脊髓的组织学切片显示,在给予ITA处理的细胞的小鼠中,细胞浸润和脱髓鞘显著减少。此外,与对照小鼠相比,给予ITA处理的Th17细胞的小鼠在EAE诱导15天后,脊髓中产生IL-17A的CD4 T细胞以及产生IL-17A和GM-CSF的CD4 T细胞的数量和百分比显著降低。给予ITA处理的Th17细胞的受体小鼠中这些浸润细胞或产生IL-1β的细胞的绝对数量与其对应物中的细胞没有显著差异。这些发现表明ITA是治疗T细胞驱动的自身免疫性疾病的潜在治疗剂。
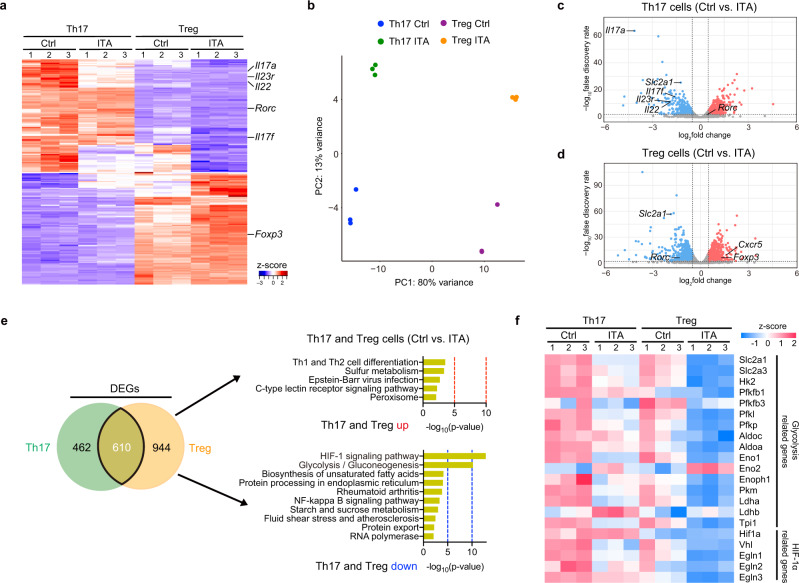
衣康酸盐在Th17和Treg极化条件下抑制糖酵解和OXPHOS
使用Th17-和Treg极化T细胞进行了RNA测序(RNA-seq),无论是否进行ITA处理。在ITA处理的和对照的Th17极化T细胞之间共鉴定出1072个差异表达基因(DEG)。在ITA处理的Treg极化T细胞中,1554个基因被鉴定为DEG,其中610个DEG也被鉴定为Th17极化T细胞。在Th17和Treg条件下,对ITA处理的T细胞和对照T细胞之间重叠的DEG的KEGG通路分析显示,“糖酵解”和“HIF-1信号通路”显著富集。这些结果表明,ITA广泛抑制糖酵解相关基因的表达。
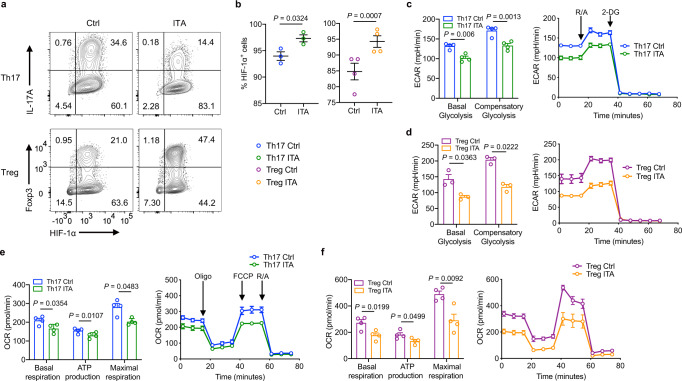
ITA增加Th1和Treg极化条件下的HIF-17α蛋白水平。接下来,使用细胞外通量分析仪进行糖酵解速率测定,以评估T细胞分化的代谢功能。在ITA处理的Th17和Treg极化T细胞中抑制基础糖酵解和代偿性糖酵解,如细胞外酸化速率(ECAR)所示;线粒体耗氧率(OCR)的分析显示,ITA处理的Th17和Treg极化T细胞的基础呼吸和最大呼吸以及ATP产生减少。总体而言,这些结果表明ITA抑制Th17和Treg极化T细胞中的糖酵解和OXPHOS。
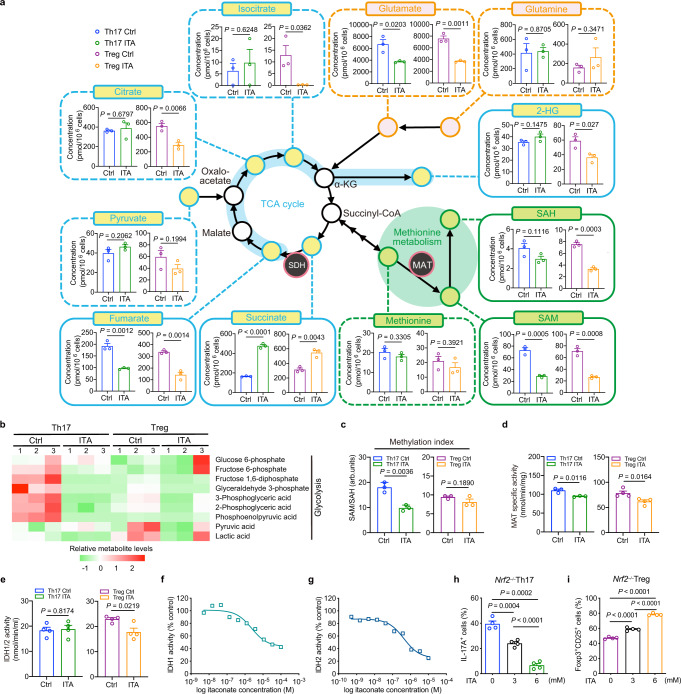
衣康酸盐通过抑制MAT和IDH1/2酶活性诱导关键代谢变化
为了进一步揭示代谢谱,使用毛细管电泳飞行时间质谱(CE-TOF MS)进行了代谢组学分析,与RNA-seq结果一致,在ITA处理的Th17和Treg极化细胞中,糖酵解途径代谢物的水平显着降低。ITA处理显着降低了SAM的水平。SAM/SAH值在ITA处理的Th17极化T细胞中减少,但在ITA处理的Treg极化T细胞中没有减少。我们发现ITA降低了Treg极化T细胞中的2-HG水平,但没有降低Th17极化T细胞中的2-HG水平. 这些数据表明SAM或2-HG水平分别影响ITA处理的Th17或Treg细胞的极化程序。在ITA处理的Th17和Treg极化细胞中抑制MAT的酶活性。此外,IDH1/2的酶活性在Treg极化T细胞中受到抑制,但在ITA处理的Th17极化T细胞中不受抑制。ITA直接抑制了纯化的野生型IDH1和2的活性。表明ITA通过与关键酶和代谢物的相互作用调节Th17和Treg细胞分化之间的平衡。
代谢变化与Th17和Treg细胞分化中必需转录因子的染色质可及性改变有关
尽管ITA增加了RORγt和HIF-1α的表达,但观察到IL-17A的表达显着降低。因此,假设ITA改变了关键基因位点的染色质可及性。为了验证这一假设,使用染色质免疫沉淀(ChIP)分析检查了ITA处理的Th17极化T细胞中RORγt与Il17a启动子的结合。幼稚CD4 T细胞作为阴性对照进行分析。我们的结果表明,ITA抑制了RORγt与Il17a启动子的结合。在Th17分化过程中,诱导RORγt和IL-17A需要多种转录因子。因此,进行了转座酶可访问染色质测序(ATAC-seq)的测定,以揭示ITA是否改变了Th17和Treg极化T细胞中转录因子的染色质可及性。由于RNA表达取决于DNA的可及性,我们整合了ATAC-seq和RNA-seq数据集。总体而言,在Th17或Treg条件下,703个DEGs显示出ITA处理的T细胞和对照T细胞之间的可及性差异。这些基因包括Il17a,糖酵解相关基因和foxp3,但不包括编码GM-CSF的csf2。染色质在ITA处理的Th17细胞中更封闭,染色质在ITA处理的Treg细胞中更开放。转录因子结合基序分析表明,Th17基团的峰富集了调控Il17a基因表达的基序,包括BATF、STAT3、IRF4、RUNX1和HIF-1α。此外,基序发现还表明,Treg群的峰富集了ETS1、RUNX1、SMAD3、STAT5和AP-1。这些结果表明,ITA处理导致染色质可及性在Il17a位点中闭合,在Foxp3位点中打开关键转录因子。






