动脉粥样硬化的”元凶“--GSDME介导的焦亡

动脉粥样硬化是一种进行性炎症性疾病,其特征是大动脉或大动脉内的脂质积聚和细胞死亡,可导致心脏、大脑和四肢缺血。巨噬细胞死亡是动脉粥样硬化病变的决定因素。焦亡是一种炎症性细胞死亡,能够促进晚期动脉粥样硬化病变,然而,具体的分子机制尚不完全清楚。在此,作者通过单细胞RNA测序(scRNA-seq)分析发现GSDME主要在巨噬细胞中表达,揭示GSDME在动脉粥样硬化发展过程中的转录机制,同时也发现GSDME介导的细胞焦亡促进动脉粥样硬化,因此,GSDME介导的动脉粥样硬化进展中的焦亡可能是动脉粥样硬化的潜在治疗方法。该研究于2023年2月发表在《Nature Communications》IF:16.6。
技术路线

主要研究结果
1、焦亡与人和小鼠动脉粥样硬化有关
为研究动脉粥样硬化的超微结构,作者从接受颈动脉内膜切除术的患者身上获得动脉粥样硬化斑块组织,通过透射电镜观察,发现大量巨噬细胞由于高吞噬负荷而死亡或破碎(图1a)。病变组织垂死的巨噬细胞中的溶酶体内充满未完全降解的细胞残留物,质膜上形成孔(图1b)。以上结果说明大部分巨噬细胞死于细胞焦亡而非细胞凋亡。免疫组化结果显示,与对照血管相比,动脉粥样硬化组织IL-1β、caspase3和GSDME表达水平升高(图1c)。随后,作者使用原位邻近连接技术观察动脉粥样硬化斑块中GSDME和Caspase3之间的相互作用,并评估GSDME激活和Caspase3介导的焦亡,发现总体蛋白相互作用和免疫组织化学IL-1β染色信号的分布模式相似(图1d),说明焦亡可能与炎症相关。此外,作者还观察到在高脂饮食喂养的ApoE−/−小鼠中, TUNEL阳性细胞核通常位于主动脉根部的动脉粥样硬化病变处。以上结果共同说明GSDME介导的焦亡参与动脉粥样硬化炎症。
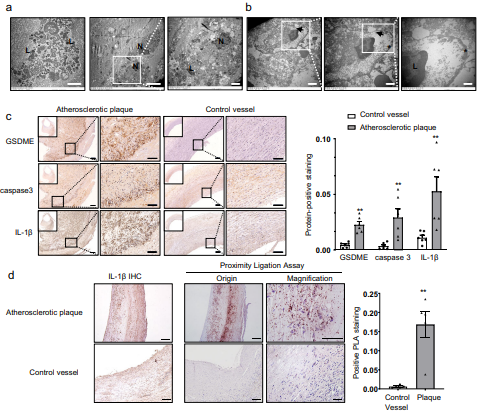
图1 人和小鼠动脉粥样硬化斑块中发生焦亡
2、GSDME主要在动脉粥样硬化巨噬细胞中表达
为研究人动脉粥样硬化斑块的转录组以及GSDME在动脉粥样硬化中的定位,作者对钙化或出血的晚期人颈动脉粥样硬化斑块的细胞进行scRNA-seq,发现GSDME主要在M1巨噬细胞中表达(图2a和2b)。GSDME和巨噬细胞标志物CD68的共染色的结果说明GSDME定位在CD68标记的巨噬细胞,与测序结果一致(图2d)。作者对巨噬细胞的发育时间进行分析发现巨噬细胞处于细胞发育的后期(图2c),说明GSDME主要在巨噬细胞的后期发挥作用。
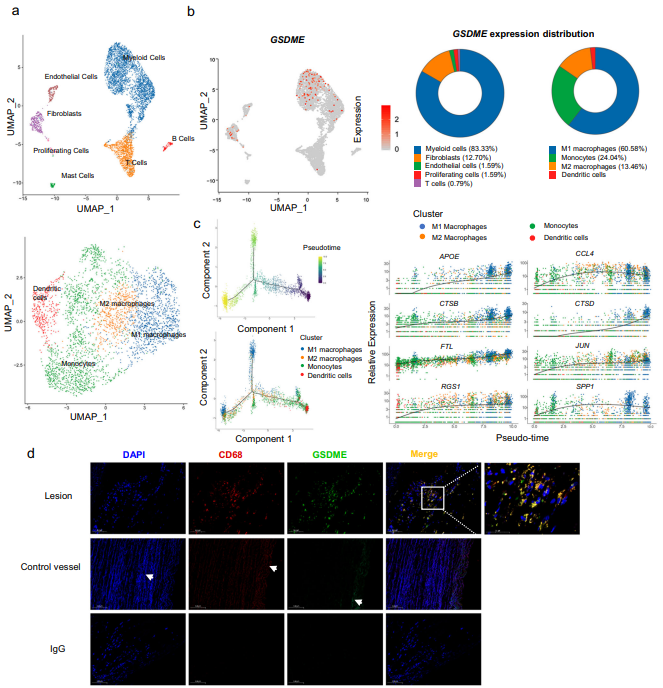
图2 GSDME主要在动脉粥样硬化巨噬细胞中表达
3、GSDME在人和小鼠动脉粥样硬化斑块中的表达增加
为探索GSDME表达是否在人动脉粥样硬化斑块中发生改变,作者对GSE43292数据库中32个病人动脉粥样硬化斑块和邻近正常组织的基因表达进行分析,发现GSDME在人动脉粥样硬化斑块中的表达显著增加(图3a)。Western blot结果表明,与正常血管和早期动脉粥样硬化斑块相比,晚期动脉粥样硬化斑块中完整的GSDME和活化的GSDME(N-GSDME)蛋白水平显著增加(图3b)。此外,作者在动脉粥样易硬化易发的ApoE−/−小鼠中,发现在喂食高脂饮食12周后,GSDME的蛋白和mRNA水平显著升高(图3c和3d)。与 GSDME mRNA 水平升高一致,ApoE−/−小鼠主动脉促炎基因IL-1β、TNF、MCP-1 和 IL-6 的 mRNA 水平也显著升高,说明GSDME在调节动脉粥样硬化斑块形成方面至关重要。
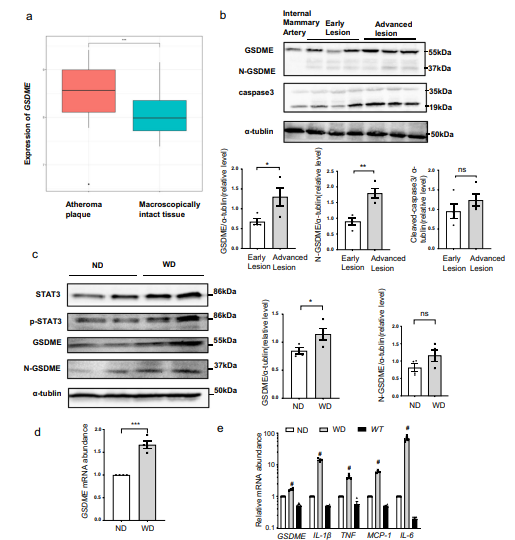
图3 动脉粥样硬化时GSDME表达增加
4、GSDME缺失可减轻ApoE−/−小鼠饮食诱导的动脉粥样硬化
结合之前的结论GSDME在动脉粥样硬化中的表达增加,作者想知道缺失GSDME是否会抑制动脉粥样硬化的发展。因此,作者设置ApoE−/−对照小鼠和GSDME −/−/ApoE−/−小鼠高脂饮食喂养,发现两组小鼠血清中总胆固醇、HDL(高密度胆固醇)和LDL(低密度胆固醇)水平没有明显差异(图3a-3c)。但是油红O染色和HE染色实验结果表明,与对照组相比,GSDME −/−小鼠动脉粥样硬化病变面积减少28%(图4d),主动脉窦和头臂动脉病变大小和面积也显著减少(图4e和4f)。除此之外,作者还发现与对照组相比,GSDME −/−小鼠主动脉促炎因子TNF,IL-1β,IL-6和MCP-1的mRNA水平显著降低。综上所述,说明GSDME缺失减轻ApoE−/−小鼠饮食诱导的动脉粥样硬化和炎症。
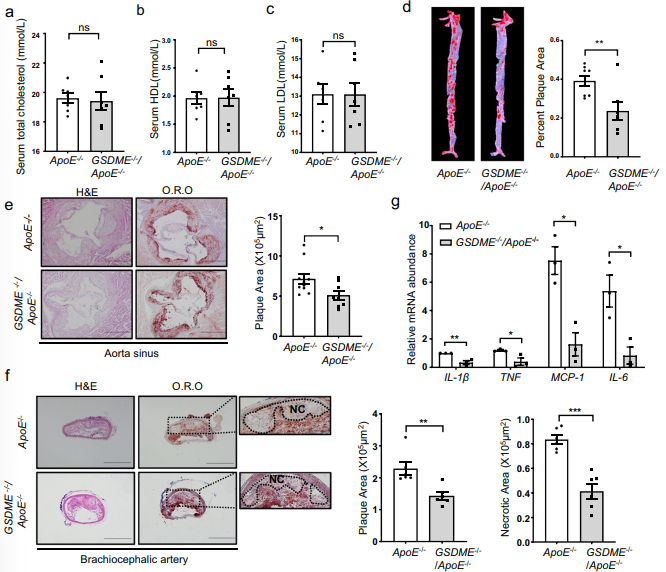
图4 GSDME缺失减弱动脉粥样硬化病变面积和大小
5、ox-LDL诱导巨噬细胞中的GSDME表达和焦亡
为进一步评估动脉粥样硬化刺激对体外GSDME表达的影响,作者将原代腹膜巨噬细胞(PMs)和骨髓来源巨噬细胞(BMDMs)与ox-LDL孵育,在体外模拟动脉粥样硬化的条件。发现经ox-LDL处理后,PMs和BMDMs细胞中GSDME蛋白表达水平和mRNA显著升高(图5a-5d)。有研究表明GSDME在被Caspase3切割后在质膜上形成孔,进而驱动细胞从凋亡到焦亡的转变。IP实验表明GSDME和Caspase3之间存在明显结合(图5e),说明GSDME的确能够被Caspase3所切割。为评估ox-LDL诱导的巨噬细胞焦亡的程度,作者测量释放到培养基中的乳酸脱氢酶(LDH)的活性来表征焦亡程度。发现ox-LDL以剂量依赖性方式促进细胞死亡,GSDME缺失减弱LDH的释放,说明GSDME是ox-LDL诱导的焦亡所必需的。综上所述,ox-LDL可以上调GSDME的表达,诱导巨噬细胞焦亡,进而促进动脉粥样硬化的进展。
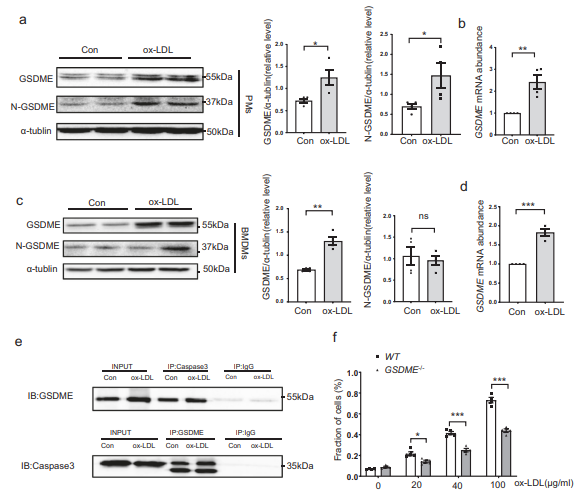
图5 ox-LDL诱导巨噬细胞GSDME表达
6、GSDME缺失抑制巨噬细胞迁移和炎症反应
基于上述的实验结果,GSDME缺失抑制动脉粥样硬化的发展,GSDME结合Caspase 3诱导ox- LDL处理的巨噬细胞焦亡,作者进一步提出假设,GSDME缺失是否能够减轻巨噬细胞的炎症行为。作者用ox-LDL处理WT或GSDME - / -小鼠的腹腔巨噬细胞,结果显示,与对照组相比,GSDME - / -小鼠的细胞粘附相关基因Lama2、Pcdhb和Itga7表达显著下降(图6a和6b),GO分析也证实这一结论(图6c)。前人的研究表明通过特定的粘附点粘附到底物上在细胞迁移过程中是必不可少的。Transwell和划痕实验结果表明GSDME缺失显著减少巨噬细胞的迁移能力(图6d和6e)。由于动脉粥样硬化相关炎症是由促炎细胞因子、炎症信号通路和粘附分子所介导的,作者检测WT和GSDME - / -小鼠PMs细胞经ox-LDL处理后的炎症反应,结果显示ox-LDL处理后,GSDME - / -组PMs细胞的TNF, IL-1β 和 MCP-1的mRNA表达水平显著降低(图6f)。WB结果显示GSDME - / -组PMs细胞释放成熟IL-1β的水平降低(图6g),说明GSDME是IL-1β释放的通道。除此之外,作者使用TNF 和环己亚胺诱导的细胞死亡,测量不同时期PMs培养基中的LDH活性,发现GSDME - / -组死亡率显著降低(图6h),说明GSDME决定细胞从凋亡到焦亡的转变。综上所述,GSDME缺失抑制巨噬细胞炎症反应和焦亡。
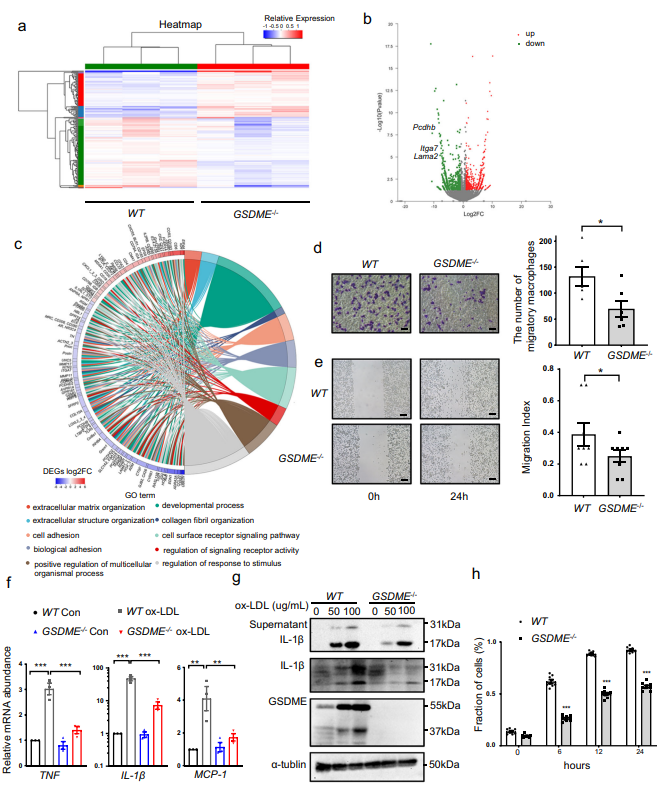
图6 巨噬细胞GSDME缺失抑制巨噬细胞炎症和焦亡
7、STAT3上调GSDME表达
前人研究表明STAT3在动脉粥样硬化过程中是必须的,并且STAT3激活参与动脉粥样硬化的炎症反应,因此,靶向抑制STAT3可能是一种潜在治疗策略。前期结果表明高脂饮食喂养的ApoE−/−小鼠主动脉中p-STAT和GSDME蛋白表达水平都显著升高(图3c),说明二者之间可能存在某种联系。随后作者发现与GSDME一样,STAT3也能在人动脉粥样硬化巨噬细胞中表达(图7a),在ox-LDL或Caspase3激活剂TNF处理的PMs细胞中,GSDME和p-STAT3蛋白水平同时升高(图7b和7c),说明STAT3可能参与GSDME的转录调节。为验证这一猜想,作者设计敲低和过表达STAT3实验,发现STAT3和GSDME的表达直接相关(图7d-7g)。对GSDME基因启动子序列进行分析,发现存在4个STAT3的结合位点(图7h)。染色质免疫沉淀结果证实STAT3与包含一致序列TTCTGAGAAG的4个结合位点的结合增加(图7i)。此外,STAT3还增加GSDME启动子驱动的荧光素酶活性(图7j)。综上所述,STAT3 在 GSDME 转录调控过程中发挥重要功能。
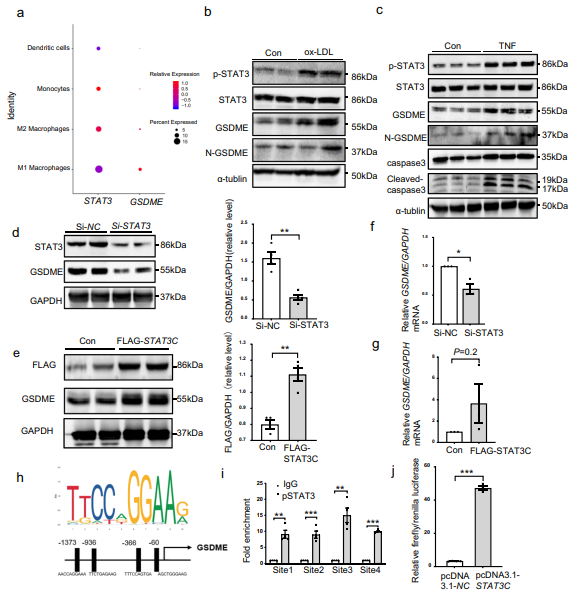
图7 STAT3靶向GSDME启动子并激活GSDME转录
结论
GSDME表达在动脉粥样硬化过程中上调,GSDME缺失减少动脉粥样硬化斑块中焦亡相关的促炎细胞因子释放。ox-LDL或TNF通过磷酸化激活STAT3,活化的STAT3促进GSDME转录。随后上调的GSDME增强Caspase3活性并促进细胞凋亡转化为焦亡(图8)。
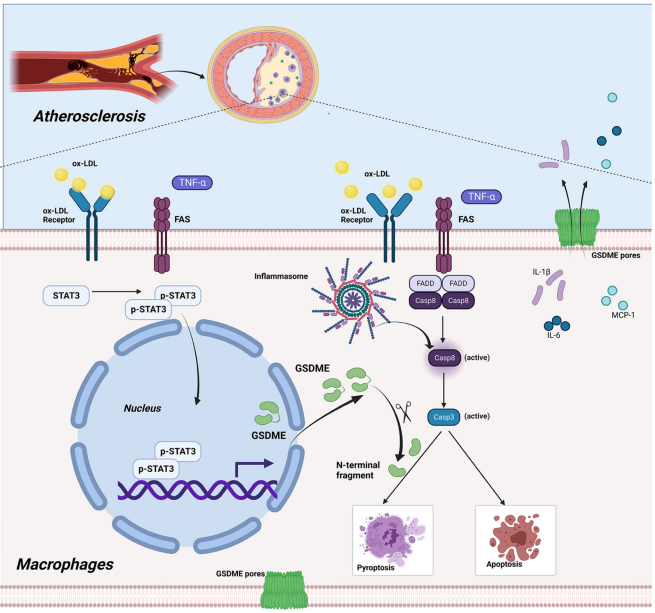
图8 GSDME促进动脉粥样硬化炎症反应的机制
实验方法
邻近连接实验、免疫组化、免疫荧光染色、RT-PCR、Western blot、Co-IP、ChIP、TUNEL细胞凋亡测定、乳酸脱氢酶(LDH)活性测定、Transwell、划痕实验、油红O染色、HE染色。
参考文献
Wei Y, Lan B, Zheng T, Yang L, Zhang X, Cheng L, Tuerhongjiang G, Yuan Z, Wu Y. GSDME-mediated pyroptosis promotes the progression and associated inflammation of atherosclerosis. Nat Commun. 2023 Feb 18;14(1):929.






