BaP/BPDE的新发现—促进滋养细胞焦亡,诱导流产
环境苯并(a)芘(BaP)及其最终代谢产物BPDE(苯并(a)芘-7,8-二氢二醇-9,10-环氧化物)是典型的持久性有机污染物和内分泌干扰物。BaP/BPDE暴露可引起人滋养细胞功能障碍并诱发流产。然而,潜在的机制在很大程度上仍然难以捉摸。在本研究中,我们发现BPDE暴露通过上调NLRP3/Caspase1/GSDMD通路诱导人滋养细胞焦亡。我们还发现lnc-HZ14在暴露于BPDE的滋养细胞和复发性流产(RM)绒毛组织中高表达。Lnc-HZ14通过促进IRF1介导的ZBP1转录,增加METTL3介导的m6A甲基化NLRP3 mRNA及其稳定性,增强ZBP1/NLRP3蛋白相互作用,促进滋养细胞焦亡。lnc-HZ14/ZBP1/NLRP3轴下调可有效缓解BPDE诱导的滋养细胞焦亡。从lnc-HZ14/ZBP1/NLRP3轴的上调可以看出,RM比HC的绒毛组织有更高水平的焦亡。在BaP暴露小鼠模型中,BaP暴露通过上调小鼠Zbp1/Nlrp3轴诱导胎盘组织焦亡和流产,敲低NLRP3可有效减少胎盘焦亡,减轻BaP诱导的小鼠流产。血清IL-1β蛋白水平可能是预测流产风险的一个有希望的指标。这些发现为BaP/BPDE诱导的滋养细胞焦亡和流产提供了新的认识,并可能有助于进一步评估BaP/BPDE对雌性生殖的毒理学影响。本文于2023年5月发表于“Journal of Hazardous materials”(IF=13.6)上。
技术路线

结果
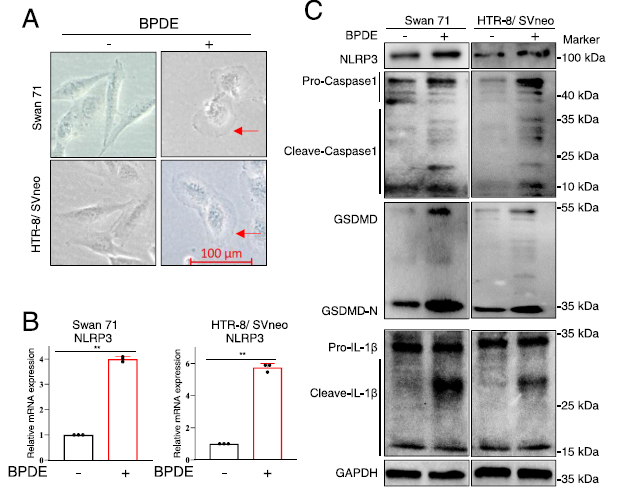
1)BPDE暴露通过上调NLRP3通路诱导滋养细胞焦亡
我们用BPDE处理人滋养层细胞(Swan 71和HTR-8/ SVneo),并探讨BPDE暴露是否会导致滋养层细胞焦亡。我们发现BPDE暴露导致滋养细胞肿胀(图1A),这是一种典型的细胞焦亡形态。然后,我们检测了BPDE暴露的人滋养细胞中焦亡通路的表达水平。BPDE暴露增加了暴露于BPDE的人滋养细胞中NLRP3的mRNA水平(图1B)以及NLRP3、Pro-Caspase 1、cleave-Caspase 1、GSDMD和GSDMD-N的蛋白水平(图1C)。此外,BPDE暴露的滋养细胞中裂解-IL-1b水平也升高(图1C)。综上所述,BPDE暴露通过上调NLRP3/Caspase1/GSDMD途径诱导滋养细胞焦亡。
2)Lnc-HZ14在BPDE暴露的人滋养细胞中表达上调,通过上调NLRP3通路促进滋养细胞焦亡
在我们最近的研究中,我们对暴露于BPDE的Swan 71细胞进行了全转录组测序,并鉴定出一组新的lncRNA。在这项工作中,我们重点研究了lnc-HZ14。我们进一步验证了lnc-HZ14在BPDE暴露的Swan 71和HTR-8/SVneo细胞中高表达(图2A)。CCK8结果显示,BPDE暴露诱导滋养细胞死亡,lnc-HZ14的敲低减少了BPDE诱导的滋养细胞死亡(图2B),表明BPDE暴露至少部分通过上调lnc-HZ14诱导滋养细胞死亡。为了进一步探索其调控作用,我们以空载体细胞为对照组,在人滋养细胞Swan 71细胞中过表达lnc-HZ14,并通过RT-qPCR验证其效率。然后对这些细胞进行mRNA测序,得到1128个下调mRNA和589个上调mRNA (图2C)。对这些差异表达mRNA的GO(图2D)分析显示,lnc-HZ14可能调节滋养细胞免疫系统、先天免疫反应以及生长和死亡,这些都与细胞焦亡有关。在测序数据中,我们还发现lnc-HZ14过表达的Swan 71细胞中,NLRP3、Caspase1、GSDMD和IL-1 β等焦亡相关基因的mRNA水平均显著升高(图2E),这表明lnc-HZ14可能调节滋养层细胞的焦亡。为了进一步验证这一点,lnc-HZ14在Swan 71和HTR-8/ SVneo细胞中过表达或沉默。lnc-HZ14过表达导致滋养层细胞焦亡(图2F)。lnc-HZ14过表达也降低了滋养层细胞的活力,这种降低可以通过用VX765(一种典型的细胞焦亡抑制剂)处理细胞来逆转(图2G)。过表达lnc-HZ14使NLRP3、Caspase1、GSDMD mRNA水平升高,NLRP3、Pro-Caspase1、cleave-Caspase1、GSDMD、GSDMD-N蛋白水平升高(图2H、J);而lnc-HZ14的敲低则降低了NLRP3和Caspase1的mRNA和蛋白表达水平,而对cleaved-Caspase1和GSDMD-N的表达水平影响不大(图2I,K)。与此同时,lnc-HZ14过表达的滋养细胞中,cleave-IL-1β蛋白水平也较高,而lnc-HZ14沉默的细胞中,cleave-IL-1β蛋白水平没有进一步下降(图2J,K)。综上所述,lnc-HZ14在BPDE暴露的人滋养细胞中高表达,通过上调NLRP3/Caspase1/GSDMD通路促进滋养细胞焦亡。

3)Lnc-HZ14增强了METTL3介导的NLRP3 mRNA的稳定性
随后,我们探讨了lnc-HZ14如何调节NLRP3 mRNA水平。首先,我们评估了lnc-HZ14对NLRP3 mRNA稳定性的影响。Lnc-HZ14过表达增强了两种滋养细胞中NLRP3 mRNA的稳定性(图3A)。MeRIP实验证实了NLRP3 mRNA的m6A修饰(图3B)。随后,我们发现lnc-HZ14过表达增加了NLRP3 mRNA的m6A修饰水平(图3B)。我们检测了过表达或敲低METTL3或METTL14的滋养细胞中NLRP3的mRNA水平。结果显示,METTL3的过表达增加,而METTL3的敲低降低NLRP3的mRNA水平降低(图3C)。然而,NLRP3的mRNA水平在METTL14的过表达或敲低后没有显著变化。因此,我们利用METTL3研究了NLRP3 mRNA的m6A修饰。NLRP3 mRNA的m6A修饰水平随着METTL3过表达而升高,随着METTL3敲低而降低(图3D)。因此,METTL3过表达上调,而METTL3敲低则下调NLRP3蛋白水平(图3E)。此外,lnc-HZ14过表达也上调,而lnc-HZ14敲低则降低METTL3蛋白水平(图3F)。过表达lnc-HZ14进一步增加了NLRP3 mRNA上m6A修饰水平(图3B)。综上所述,lnc-HZ14上调了METTL3表达水平,增加了METTL3介导的NLRP3 mRNA上m6A修饰水平,从而增强了NLRP3 mRNA的稳定性。

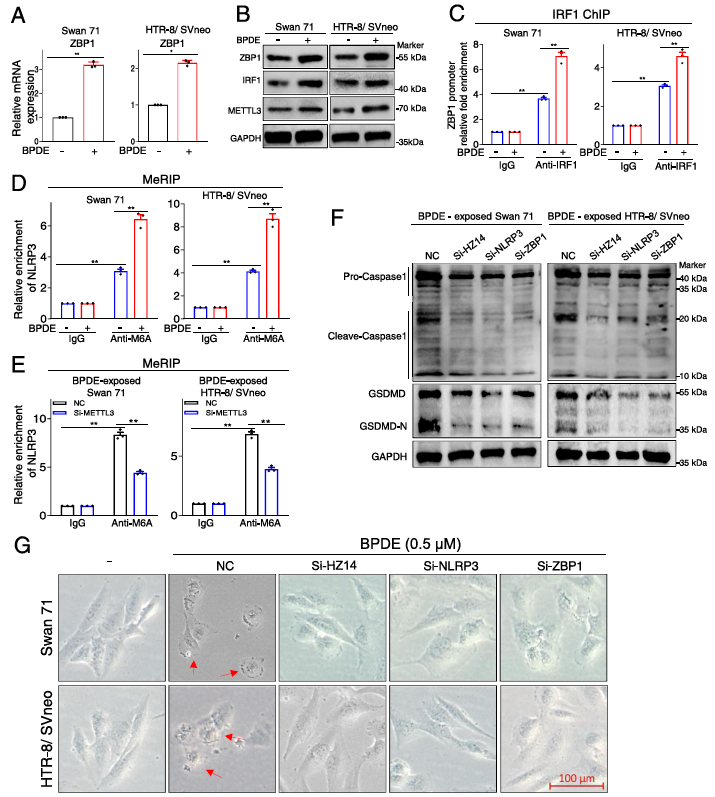
4)Lnc-HZ14促进了IRF1介导的ZBP1转录及其蛋白与NLRP3的相互作用
有报道称ZBP1可诱导NLRP3活化,形成ZBP1-NLRP3炎性体,诱导细胞焦亡。然而,其在滋养细胞焦亡中的形成及其作用尚未被研究。因此,我们探索lnc-HZ14是否以及如何调节ZBP1的表达水平。有报道称,在原代骨髓源性巨噬细胞(BMDM)和肺成纤维细胞中,IRF1是ZBP1的转录因子。在Swan 71细胞中,IRF1过表达上调,而IRF1敲低下调ZBP1 mRNA和蛋白水平(图4A,B)。此外,lnc-HZ14过表达也增加,而lnc-HZ14沉默减少IRF1蛋白水平(图4C)。mRNA测序数据显示,在lnc-HZ14过表达的Swan 71细胞中,ZBP1 mRNA水平显著升高(图2E)。随后,我们发现lnc-HZ14过表达上调ZBP1 mRNA和蛋白水平(图4C,D);而lnc-HZ14的敲除下调了它们的表达水平(图4C,D)。IRF1 ChIP实验进一步表明,IRF1可以结合ZBP1的启动子区域,lnc-HZ14过表达进一步增强了这种结合(图4E)。双荧光素酶报告基因实验还显示,IRF1对ZBP1的野生型启动子序列具有转录活性,而对ZBP1的突变型启动子序列没有活性;lnc-HZ14过表达进一步增强了这种转录活性(图4F)。虽然有报道称ZBP1和NLRP3可以形成ZBP1-NLRP3炎性体,但它们之间是否存在物理相互作用尚不清楚。在滋养细胞中,我们发现ZBP1和NLRP3之间存在蛋白相互作用,并且这种相互作用随着lnc-HZ14的过表达而进一步增强(图4G)。因此,lnc-HZ14上调ZBP1和NLPR3的表达水平,也增强了它们之间的蛋白相互作用,从而促进ZBP1-NLRP3炎症小体的形成和滋养细胞的焦亡。

5)BPDE暴露通过上调lnc-HZ14/ZBP1/NLRP3轴诱导滋养细胞焦亡
BPDE暴露还上调了ZBP1的mRNA和蛋白水平(图5A、B)以及IRF1的蛋白水平(图5B),并在IRF1 ChIP检测中增强了IRF1在ZBP1启动子区域的占据(图5C),从而促进了IRF1介导的ZBP1 mRNA在BPDE暴露的滋养细胞中的转录。同时,BPDE暴露还增加了METTL3蛋白水平(图5B)和NLRP3 mRNA上的m6A修饰水平(图5D)。在BPDE暴露的Swan 71细胞中,METTL3的再敲低降低了NLRP3 mRNA上的m6A修饰(图5E)。此外,lnc-HZ14、NLRP3或ZBP1的敲除降低了BPDE暴露的滋养细胞中cleaved-caspase 1和GSDMD-N的表达水平(图5F)。在细胞表型上,BPDE暴露导致滋养细胞大量死亡,细胞肿胀、膜破裂等典型的焦亡形态;lnc-HZ14、NLRP3或ZBP1的敲低均可减少滋养层细胞的焦亡(图5G)。综上所述,BPDE暴露通过上调lnc-HZ14/ZBP1/NLRP3轴诱导滋养细胞焦亡,下调lnc-HZ14/ZBP1/NLRP3轴可有效缓解BPDE诱导的滋养细胞焦亡。
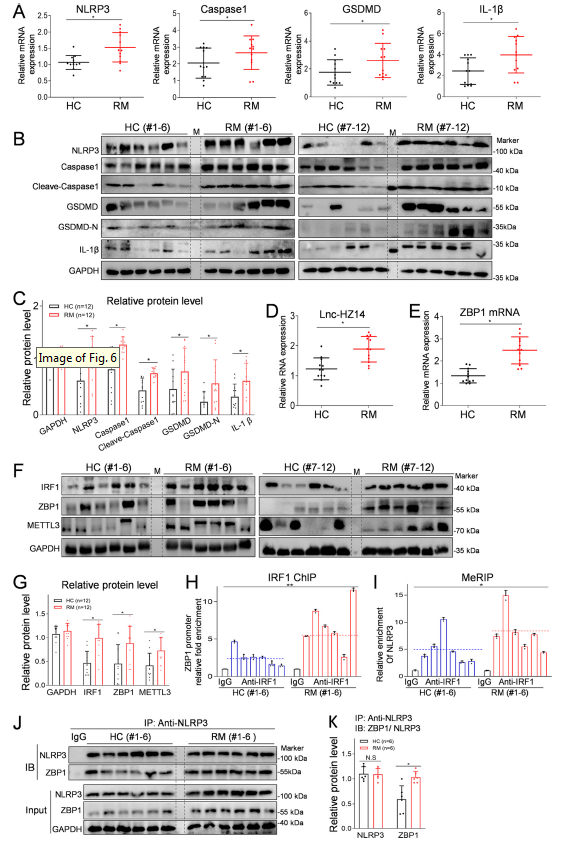
6)Lnc-HZ14/ZBP1/NLRP3轴与RM绒毛组织焦亡有关
为了探讨绒毛组织是否可能发生焦亡,以及这种焦亡是否与流产相关,我们收集了原因不明复发性流产(RM)组和与其匹配的健康对照组(HC)组的绒毛组织样本,并评估了几种典型焦亡基因的表达水平。我们发现,与HC组相比,RM组NLRP3、Caspase1、GSDMD和IL-1β的mRNA水平(图6A)以及NLRP3、Caspase1、cleave -Caspase1、GSDMD、GSDMD-N和IL-1β的蛋白水平均较高(图6B、C)。随后,在绒毛组织中分析lnc-HZ14/ZBP1/NLRP3轴。首先,通过RT-qPCR分析证实,lnc-HZ14和ZBP1 mRNA在RM和绒毛组织中高表达(图6D,E)。其次,RM组织中IRF1和ZBP1蛋白水平高于HC组织(图6F,G)。IRF1 ChIP实验进一步显示,相对于HC绒毛组织,RM中更多的ZBP1启动子区域被IRF1富集(图H)。第三,与HC组织相比,RM组织的METTL3蛋白水平也更高(图6F,G)。因此,在RM组织中,NLRP3 mRNA的m6A修饰水平也增加了(图6I)。最后,随机使用6个RM和HC绒毛组织样本进行Co-IP检测,结果显示RM组被NLRP3拉下的ZBP1蛋白水平明显高于HC组(图6J,K)。因此,这些数据都支持RM组织相对于HC绒毛组织存在更高水平的焦亡,这可以通过lnc-HZ14/ZBP1/NLRP3轴的上调来证明。
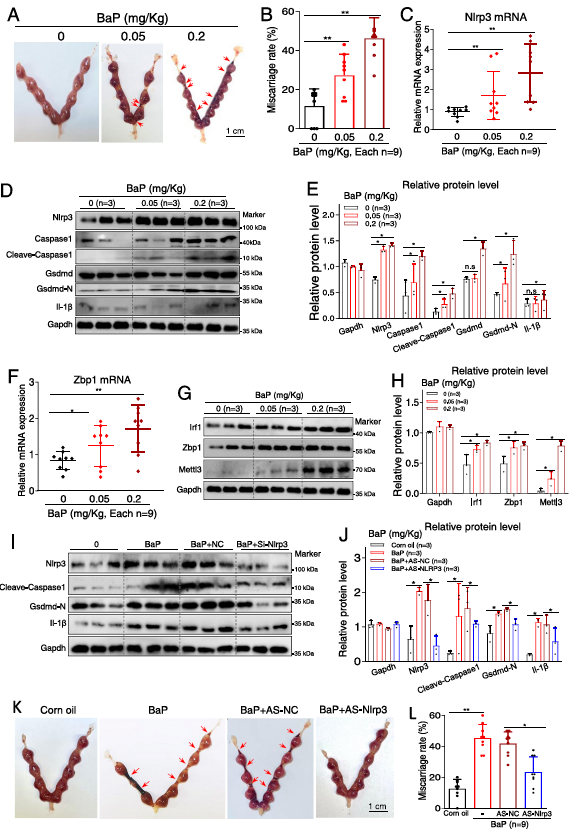
7)BaP暴露诱导小鼠胎盘组织焦亡和流产
为了直接评估BaP暴露导致胎盘组织焦亡进而导致流产的因果关系,我们构建了一个小鼠模型,将妊娠小鼠暴露于BaP诱导流产。BaP暴露增加胚胎吸附,提高流产率(图7A, B)。BaP暴露小鼠胎盘组织中Nlrp3 mRNA水平(图7C)以及Nlrp3、Caspase1、cleaved -Caspase1、Gsdmd-N和Il-1β蛋白水平(图7D、E)均高于对照组,表明BaP暴露导致BaP暴露小鼠胎盘组织焦亡并诱导流产。BaP暴露上调了BaP暴露小鼠胎盘组织中Zbp1 mRNA水平(图7F)以及Irf1和Zbp1蛋白水平(图7G,H)。此外,BPDE暴露也上调了Mettl3蛋白水平(图7G,H)。我们还构建了以AS-Nlrp3(敲低小鼠Nlrp3)治疗BaP暴露小鼠的流产干预模型。BaP暴露可上调Nlrp3、cleaved-Caspase1、Gsdmd-N和Il-1β蛋白水平,而敲低Nlrp3可下调其在BaP暴露小鼠胎盘组织中的表达水平(图7I、J)。敲低Nlrp3进一步有效地减少了BaP暴露小鼠的胚胎吸附,降低了流产率(图7K,L)。因此,这些结果表明,BaP暴露引起胎盘组织焦亡,进而导致BaP暴露小鼠流产。
8)血清IL-1β可作为预测流产风险的检测指标
IL-1β是一种典型的分泌性蛋白,是提示强烈炎症反应的关键炎症因子。然后,我们探讨血清IL-1β是否可以作为预测流产风险的检测指标。结果表明,HC组IL-1β水平范围为9.99 ~ 43.6 pg/mL,平均±SD为27.1±9.56 pg/mL;RM组IL-1β水平范围为16.7 ~ 69.8 pg/mL,平均±SD为44.7±15.6 pg/mL(图8A,B)。与HC血清样品相比,RM血清样品中IL-1β水平显著升高。HC血清中IL-1β蛋白水平呈正态分布(图8C、D)。随着血清IL-1β水平的升高,RM在总女性中的比例呈上升趋势(图8E),表明血清IL-1β水平越高,流产风险越高。条件logistic回归进一步证实了这一点(图8F)。ROC曲线分析显示,血清IL-1β水平在95%置信区间内的曲线下面积(AUC)值为0.830,表明IL-1β可能具有较好的预测能力,具有较高的特异性和敏感性(图8G)。这些数据表明血清IL-1β蛋白水平可能是反映流产风险的有希望的指标。

结论
我们的研究结果揭示了BaP/BPDE诱导滋养细胞焦亡和生殖毒性的潜在机制,指出了BaP/BPDE对雌性生殖的潜在风险。
实验方法
细胞焦亡形态的显微镜成像,CCK-8,RT-qPCR,RNA稳定性分析,WB,ELISA,ChIP,荧光素酶报告基因实验,Co-IP,MeRIP。
参考文献
Wang R, Xu X, Yang J, Chen W, Zhao J, Wang M, Zhang Y, Yang Y, Huang W, Zhang H. BPDE exposure promotes trophoblast cell pyroptosis and induces miscarriage by up-regulating lnc-HZ14/ZBP1/NLRP3 axis. J Hazard Mater. 2023 Aug 5;455:131543. doi: 10.1016/j.jhazmat.2023.131543.






