国自然热点之一tsRNA——5′-tiRNA-Gln控制肝细胞癌发展

tRNA衍生的小RNA(tsRNA)是新型的非编码RNA,参与各种疾病的发生和发展。然而,它们在肝细胞癌(HCC)中的确切存在和功能仍不清楚。本研究中,对HCC中差异表达的tsRNA进行分析。发现一种新的tsRNA,tRNA Gln-TTG衍生的5′-tiRNA-Gln明显下调,其表达水平与患者的病情发展相关联。5′-tiRNA-Gln通过结合真核启动因子4A-I(EIF4A1)发挥其功能,导致翻译受到部分抑制,控制HCC的发展。该研究于2023年3月发表在《Frontiers of Medicine》,IF:8.1。
技术路线
主要研究结果
1. HCC和正常组织中tsRNA特征普分析
为了确定特定的tsRNA在原发性HCC中的表达,作者通过RNA-PAGE分析4对肿瘤和邻近的非肿瘤肝组织tiRNA的水平。HCC组织的总tiRNA低于邻近组织(图1A)。通过高通量测序对这些样本的小RNA转录组进行分析。结果显示,无论在肿瘤还是邻近的非肿瘤组织中,reads数都在20-24 nt和31-33 nt富集(图1B)。miRNA占总reads数的绝大部分,其次是tsRNA和前体tRNA(图1C)。肿瘤组织中有77个tsRNA,非肿瘤组织中有67个tsRNA,共有tsRNA 有208个(图1D)。无论是在肿瘤还是邻近的非肿瘤组织中,5-tRF所占比例最高,其次是3-tRF和5′-tiRNA(图1E和1F)。
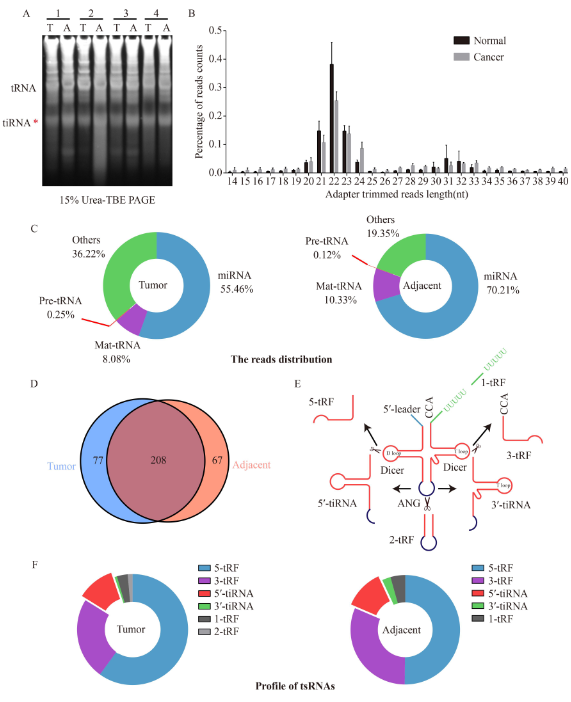
图1. HCC组织中的小ncRNA概况
2. 5′-tiRNA-Gln在肿瘤组织中下调,负向调节HCC转移和肿瘤大小
对差异表达的tsRNA进行分析,总共发现80个上调的和74个下调的tsRNA(图2A)。其中包括19个tiRNA(图2B),只有5′-tiRNA-Gln的表达与数据库中一致。通过RT-qPCR在76个HCC组织对中验证了5′-tiRNA-Gln的表达水平。结果显示,与差异分析结果一致,5′-tiRNA-Gln在肿瘤组织中明显下调,表明具有肿瘤抑制作用(图2C)。Northern blot实验也得到了类似的结果(图2D)。作者还发现,转移组的5′-tiRNA- Gln的相对平均水平明显低于非转移组(图2E)。且5′-tiRNA-Gln表达水平的降低与大肿瘤呈正相关(图2F)。这些结果表明,5′-tiRNA-Gln在HCC中明显下调,在HCC转移和肿瘤大小中起着负向调节作用。
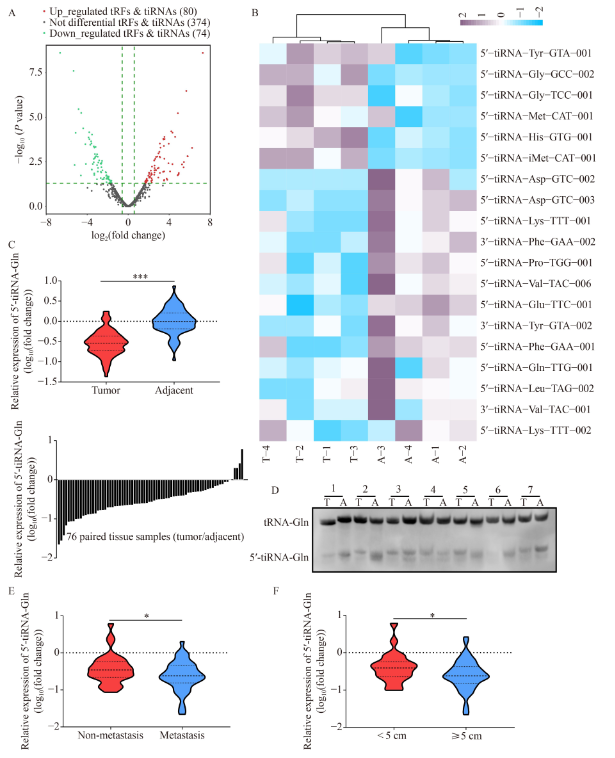
图2. 5′-tiRNA -Gln在HCC组织中下调并与HCC进展有关
3. 过表达5′-tiRNA-Gln抑制HCC细胞增殖、迁移和侵袭
5′-tiRNA-Gln mimics转染24小时后,分析它对HCC细胞生长、迁移和侵袭的影响。CCK-8实验显示,5′-tiRNA-Gln mimics降低细胞的活力(图3A)。Transwell实验显示,5′-tiRNA-Gln mimics的过表达降低了Huh-7细胞的迁移和侵袭能力(图3B)。siRNA进行功能缺失实验,之后对细胞活力、迁移和侵袭进行研究(图3C和3D),结果表明,5′-tiRNA-Gln的敲除增强SK-Hep-1细胞的生存能力、迁移和侵袭。将稳定转染5′-tiRNA-Gln或对照RNA的Huh-7细胞皮下注射到裸鼠体内,6周后,与对照组相比,5′-tiRNA-Gln肿瘤重量更少(图3E)。菌落形成实验也得到类似的结果(图3F)。这些结果表明,过表达5′-tiRNA-Gln抑制HCC细胞的活力。
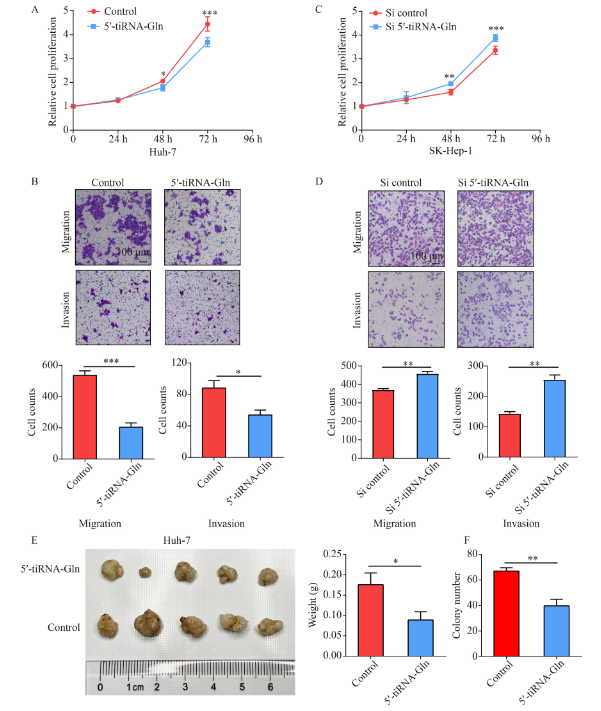
图3. 5′-tiRNA-Gln可抑制HCC细胞在体外和体内的增殖、迁移和侵袭。
4. 5′-tiRNA-Gln与EIF4A1选择性互作
将生物素标记的5′-tiRNA-Gln转染到Huh-7细胞中48小时,MS鉴定出84个特异性结合的蛋白质。根据蛋白质的得分,EIF4A1被选为候选人(图4A),它是翻译启动过程中的一个关键酶。根据GEPIA生存曲线分析,HCC中较高的EIF4A1表达水平意味着较低的生存率(图4B),表明其具有肿瘤蛋白作用。RNA pull-down实验证明,EIF4A1与5′-tiRNA- Gln有更强的结合力(图4C)。RIP实验证实,5′-tiRNA-Gln在EIF4A1免疫沉淀物中明显富集(图4D)。RNA FISH和免疫荧光检测显示,5′-tiRNA-Gln和EIF4A1在细胞质中发生共定位(图4E)。因此,作者推断5′-tiRNA-Gln通过与细胞质中的EIF4A1相互作用来抑制HCC肿瘤发展。
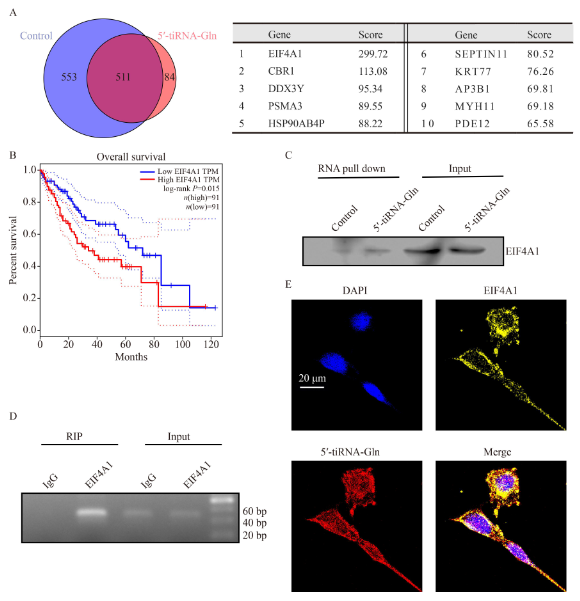
图4. 5′-tiRNA-Gln与EIF4A1选择性互作
5. 5′-tiRNA-Gln过表达抑制翻译
通过嘌呤霉素捕获,确定新生蛋白合成水平(图5A),验证5′-tiRNA-Gln对EIF4A1功能的影响。结果显示,5′-tiRNA-Gln抑制蛋白质的合成率。COG/KOG功能分类分析表明,下调的蛋白主要与转录和翻译、核糖体结构和生物生成过程有关(图5C)。对下调蛋白的KEGG分析显示,乙型肝炎、MAPK信号传导、丙型肝炎和癌症的途径发生显著变化(图5D)。Western blot表明,通过过表达5′-tiRNA-Gln和下游的磷酸化蛋白(p-ERK1/2和p- STAT3),ARAF、MEK1/2和STAT3的表达被下调。然而,在BID的表达中没有观察到明显的差异(图5E)。这些结果表明,5′-tiRNA-Gln的过量表达直接针对EIF4A1的功能,而不是其表达水平,从而抑制了EIF4A1相关翻译。

图5. 5′-tiRNA-Gln在Huh-7细胞中抑制翻译
6. G-四链体结构是5′-tiRNA-Gln的必要条件
根据QGRS Mapper构建了没有能力形成G-四联体的突变体5′-tiRNA-Gln。通过过表达突变体5′-tiRNA-Gln,研究了Huh-7细胞的活力、迁移和侵袭能力(图6A和6B)。突变体与5′-tiRNA-Gln有明显差异。RNA pull-down实验表明突变体5′-tiRNA-Gln未能特异性地下拉EIF4A1(图6C)。接下来测定了多聚核糖体的情况,结果显示,与突变体相比,5′-tiRNA-Gln减少了mRNA与多聚核糖体的结合(图6D)。进一步, 检测了ARAF、MEK1/2和STAT3的表达。ARAF、MEK1/2和STAT3的mRNA没有明显差异(图6E),而与突变体相比,过表达5′-tiRNA-Gln明显降低了它们与EIF4A1的mRNA(图6F)和蛋白质结合水平(图6G)。这些结果表明,5′-tiRNA-Gln形成G-四链体的潜力,是其调节EIF4A1介导的翻译和抑制HCC进展的必要条件。
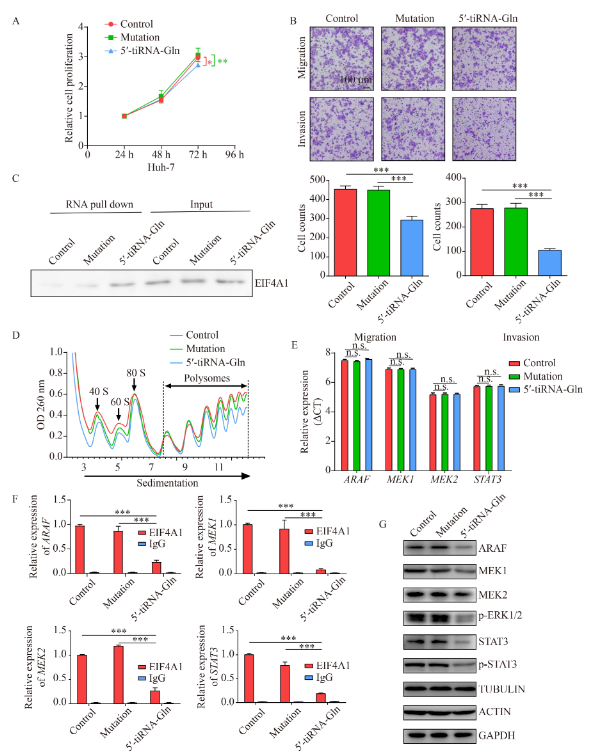
图6. 突变的5′-tiRNA-Gln失去了抑制Huh-7细胞活力的功能
7. HCC肿瘤中5′-tiRNA-Gln的表达水平与ARAF、MEK1/2或STAT3的免疫表达负相关
IHC染色和Spearman相关性分析显示,HCC组织中5′-tiRNA-Gln和ARAF、MEK1/2或STAT3的表达水平有明显的负相关(图7A)。图7B为5′-tiRNA-Gln在HCC进展中的作用示意图。
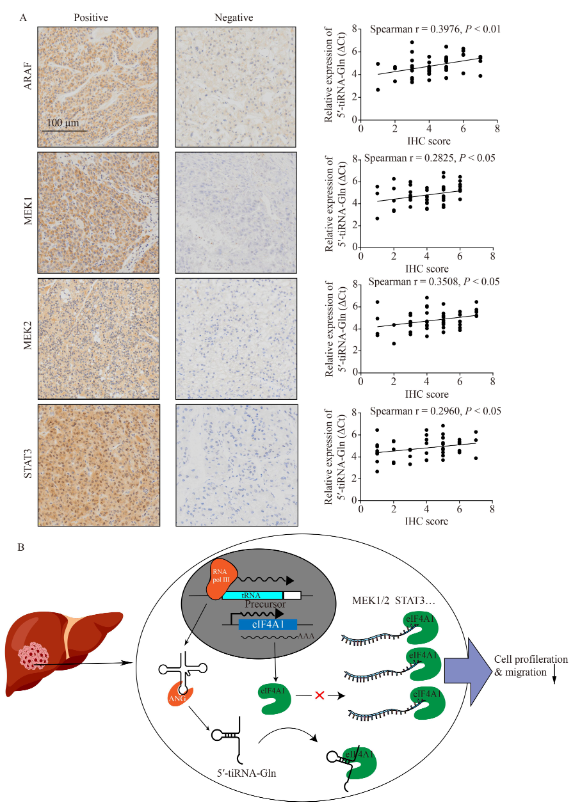
图7. HCC组织中5′-tiRNA-Gln与ARAF、MEK1/2和STAT3的表达呈负相关
结论
综上所述,该研究分析了HCC中差异表达的tsRNA,并发现了一种新的tiRNA,即5′-tiRNA-Gln,它是一种肿瘤抑制因子。5′-tiRNA-Gln与EIF4A1相互作用,通过分子内G-四链体结构负向调节相关蛋白的翻译,抑制了HCC细胞的增殖、迁移和侵袭。
实验方法
RNA-PAGE,RT-qPCR,Northern blot,siRNA干扰,Transwell,裸鼠成瘤,菌落实验,RNA pull-down,RIP,RNA FISH,Western blot,多聚核糖体分析,质谱分析,IHC染色
参考文献
Wu C, Liu D, Zhang L, Wang J, Ding Y, Sun Z, Wang W. 5'-tiRNA-Gln inhibits hepatocellular carcinoma progression by repressing translation through the interaction with eukaryotic initiation factor 4A-I. Front Med. 2023 Mar 28. doi: 10.1007/s11684-022-0966-6. Epub ahead of print. PMID: 36973570.






