7张图揭示泛素化在癌症中突变型p53积累和功能性获得中的新角色

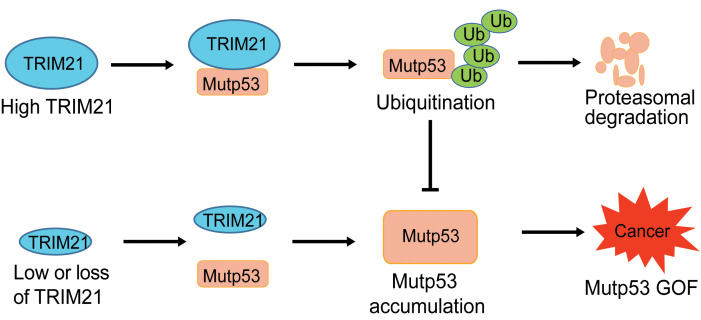
突变型p53(mutp53)蛋白通常在人类癌症中积累到非常高的水平,以通过功能获得(GOF)机制促进癌症进展。目前,mutp53积累和GOF的潜在机制尚未完全了解。TRIM21作为mutp53的一个关键的E3泛素连接酶,mutp53通过筛选特定的mutp53相互作用的蛋白质。本研究通过CO-IP和LC-MS/MS实验确定了TRIM21直接靶向结合mutp53,且TRIM21能够通过影响mutp53的泛素化负性调控mutp53的表达,抑制癌细胞的锚定非依赖性生长,并且能够抑制原位和皮下瘤的生长,TRIM21的低表达了也逆转了mutp3介导的癌症的不良预后。本文章于2023年3月发表在《Journal Clinical Investigation》上,IF=15.9
技术路线







主要研究内容
1.TRIM21是mutp53相互作用的蛋白
在表达异位热点R175H mutp53或wtp 53的人结直肠癌p53−/− RKO细胞中使用co-IP与p53抗体筛选特异性mutp53相互作用蛋白,然后进行LC-MS/MS分析。TRIM21被鉴定为优先结合R175H mutp53但不结合wtp 53的潜在蛋白质。R175H、G245S、R248Q和R273H热点mutp53已显示出GOF活性并广泛用于mutp 53 GOF研究。因此,在表达异位TRIM21-Flag和mutp53的p53-/-RKO细胞中,使用co-IP,随后进行Western印迹分析,研究了TRIM21和这四个热点GOF mutp53之间的相互作用(图1A)。在p53+/+ RKO细胞中没有观察到内源性TRIM21和wtp53之间的明显相互作用(图1B),但观察到内源性TRIM21和不同mutp53之间的相互作用(图1C和D)。为了确定TRIM21-mutp53相互作用所需的TRIM21结构域,构建表达TRIM21-Flag系列缺失突变体的载体(图1 E),并与R175H mutp53载体共转染到p53-/-RKO细胞中用于共IP测定。结果显示SPRY和PRY结构域是TRIM21与R175H mutp53相互作用的重要位点(图1 E)。同时,R175H mutp53的DBD结构域是R175H mutp53与TRIM21相互作用的位点(图1F)。使用重组GST-TRIM21和His-mutp53或His-wtp53蛋白的体外谷胱甘肽S-转移酶(GST)下拉实验显示,TRIM21在体外直接与mutp53相互作用,但不与wtp53相互作用(图1H)。此外,SPRY和PRY结构域的缺失消除了GST-TRIM21在体外与His-mutp53直接相互作用的能力(图1H)。总之,这些结果表明TRIM21直接且特异性地与细胞中的mutp53相互作用。

图1:TRIM21是一种特定的mutp53结合蛋白
2.TRIM21抑制了mutp53在癌症细胞中的积累
通过对TRIM 21稳定敲低检测癌细胞中的mutp53蛋白水平,发现TRIM 21-Flag的异位表达显著下调SK-BR3、HT29、LS1034和HCC70细胞中不同内源mutp53蛋白的水平,而wtp53蛋白的表达水平并无明显改变(图2A)。此外,TRIM21-KO分别明显增加SK-BR3和HT29细胞中R175H和R273H mutp53的蛋白质水平(图2B)。类似地,通过不同shRNA载体的TRIM21敲低分别明显增加了LS1034和HCC70细胞中的G245S和R248Q mutp53蛋白水平,但对MCF 7和p53+/+ RKO细胞中的wtp53蛋白水平影响较小(图2C)。通过将R172H mutp53敲入小鼠,提取源自TRIM21+/+ p53R172H/R172H和TRIM21-/-p53R172H/R172H小鼠的小鼠胚胎成纤维细胞(MEF),发现TRIM21-/-p53R172H/R172H MEF显示出比TRIM21+/+ p53R172H/R172H MEF高得多的mutp53蛋白水平(图2D)。然而,在TRIM21+/+ p53+/+和TRIM 21-/- p53+/+ MEF之间没有观察到wtp53蛋白水平的明显差异(图2D)。RT-qPCR测定的结果显示,TRIM21没有明显影响上述细胞系中mutp53或wtp53的mRNA水平(图2E-H)。这些结果表明,TRIM21优先下调mutp53而不是wtp53的蛋白水平,并且TRIM21缺陷导致mutp53在癌细胞中积累。
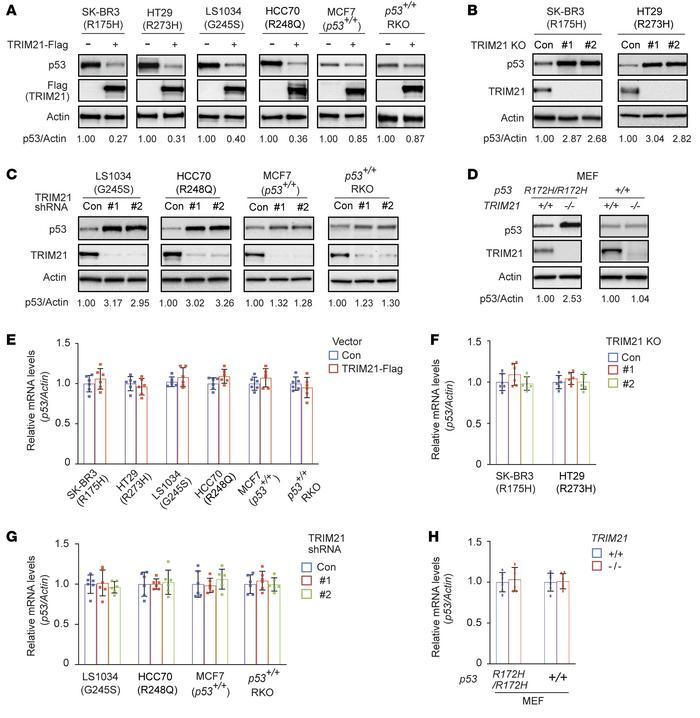
图2:TRIM21抑制了mutp53在癌症细胞中的表达
3.TRIM21促进mutp53的泛素化和降解
用表达R175H或R273H mutp53的载体连同表达WT TRIM21-Flag或缺失RING结构域(ΔRING)的突变TRIM21-Flag的载体共转染p53-/-RKO细胞。发现WT而非ΔRING TRIM21-Flag明显下调p53−/− RKO细胞中的外源mutp53蛋白水平,而用蛋白酶体抑制剂MG132处理细胞后这种变化又被消除(图3A和B)。为了研究TRIM21是否泛素化mutp53,在不同细胞中进行体内泛素化测定。WT而非ΔRING TRIM21-Flag的异位表达显著促进了p53−/− RKO细胞中外源R175H和R273H mutp53的泛素化(图3C)。此外,TRIM21 KO分别降低SK-BR3和HT29细胞中内源性R175H和R273H mutp53的泛素化(图3D)。TRIM 21介导的mutp53泛素化通过使用重组蛋白的体外泛素化测定进一步证实; WT GST-TRIM 21诱导His-mutp53的泛素化,但不诱导Hiswtp53的泛素化,其通过TRIM21 RING结构域的缺失而消除(图3E)。验证TRIM21是否使mutp53不稳定,在内源性R175H mutp53蛋白水平的蛋白质印迹分析之前,用蛋白质合成抑制剂环己酰胺(CHX)处理具有TRIM 21-Flag表达或TRIM21 KO的SK-BR3细胞及其对照细胞不同的时间段。R175H mutp53蛋白的半衰期通过TRIM21-Flag的异位表达而明显降低(图3F),并且通过TRIM21 KO而增加(图3G)。这些结果表明TRIM21直接结合mutp53以泛素化和降解mutp53,并且TRIM21缺陷导致mutp53稳定和积累。
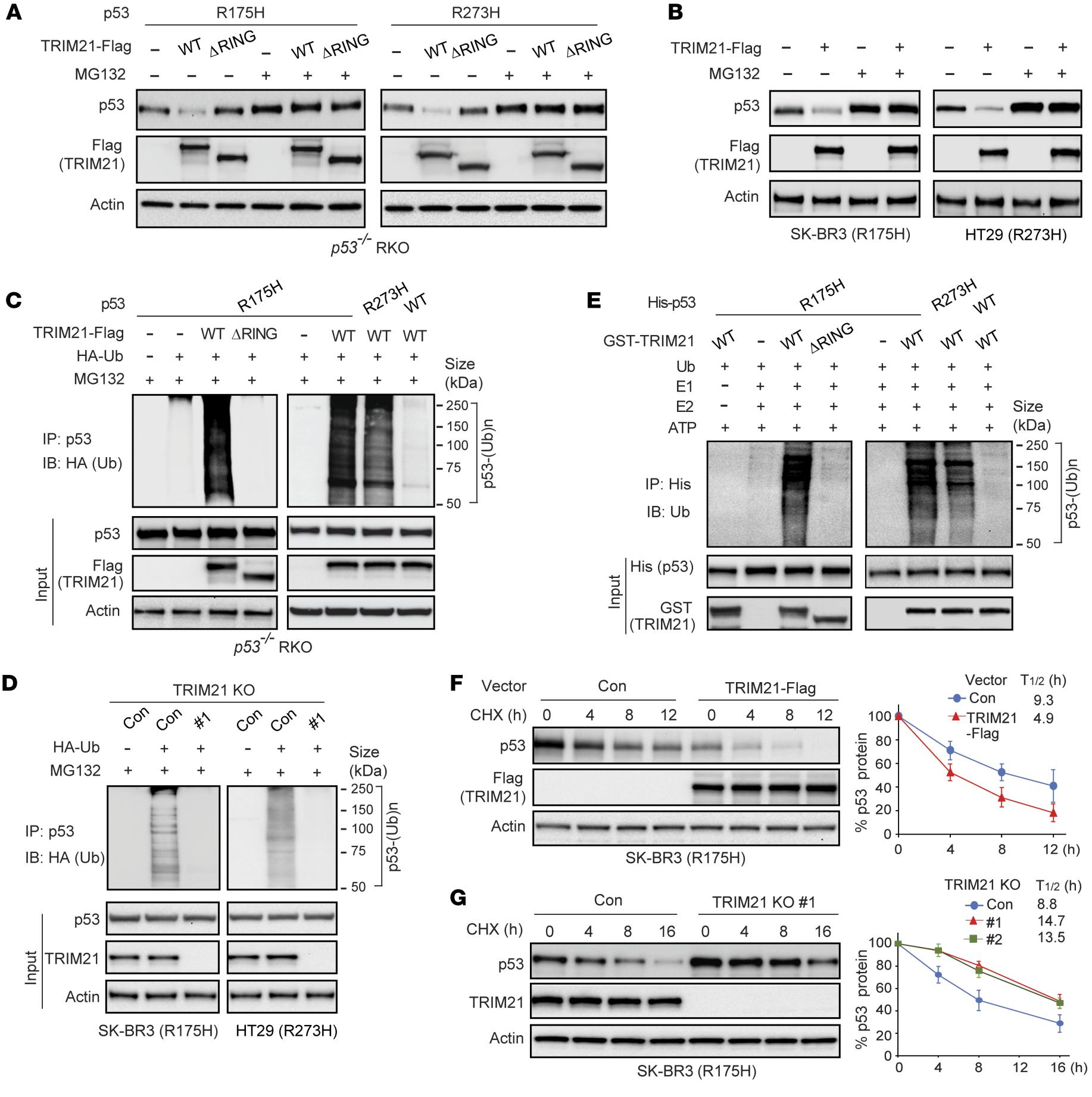
图3:TRIM21通过泛素化促进mutp53蛋白的降解
4.TRIM21抑制mutp53积累以抑制癌细胞的锚定非依赖性生长
验证TRIM21是否影响mutp53 GOF活性,促进锚定非依赖性细胞生长。发现癌细胞中mutp53的敲低显著抑制了锚定非依赖性细胞生长,mutp53在癌细胞中的GOF活性(图4A和B)。癌细胞中的TRIM21 KO显著促进非贴壁依赖性细胞生长,但这种效应在很大程度上被mutp53 KO消除(图4A和B)。异位TRIM 21-Flag表达显著抑制细胞的贴壁非依赖性生长,但对其相应的mutp53 KO细胞中抑制作用减弱(图4C)。转化的MEFs的锚定非依赖性生长被wtp53显著抑制(p53 +/+ vs p53-/-),但被R172H mutp53促进(p53R172H/R172H vs p53-/-)。另外,TRIM21缺失显著促进p53R172H/R172H MEFs的锚定非依赖性生长,但不促进p53 +/+或p53−/− MEFs的锚定非依赖性生长(图4D)。这些结果共同表明,TRIM21通过抑制mutp53积累和GOF来抑制贴壁非依赖性细胞生长。

图4:TRIM21抑制mutp53 GOF,促进癌细胞的非锚定生长
5.TRIM21抑制mutp53积累以抑制原位和皮下肿瘤的生长
通过SKBR3细胞构建的原位乳腺肿瘤和在无胸腺裸鼠中皮下注射HT29细胞形成的结肠直肠异种移植肿瘤,SK-BR3细胞中的TRIM21 KO显著促进SK-BR3原位肿瘤的生长,而R175H mutp53 KO显著抑制肿瘤生长并在很大程度上消除了TRIM21 KO对肿瘤生长的促进作用(图5A)。SK-BR3肿瘤组织的蛋白质印迹分析和IHC染色显示TRIM21 KO明显增强mutp53蛋白水平(图5B和C)。同样,HT29细胞中的TRIM21 KO显著促进肿瘤生长并明显增加肿瘤中mutp53蛋白水平,但HT29细胞中的mutp53 KO显著抑制肿瘤生长并在很大程度上消除了TRIM21 KO对肿瘤生长的促进作用(图5D和E)。另外,TRIM21-Flag表达大大降低了SK-BR3和HT29肿瘤中的mutp53水平(图5G和I)。这些结果共同证明了TRIM21抑制mutp53积累以抑制mutp53 G0F促进肿瘤生长。
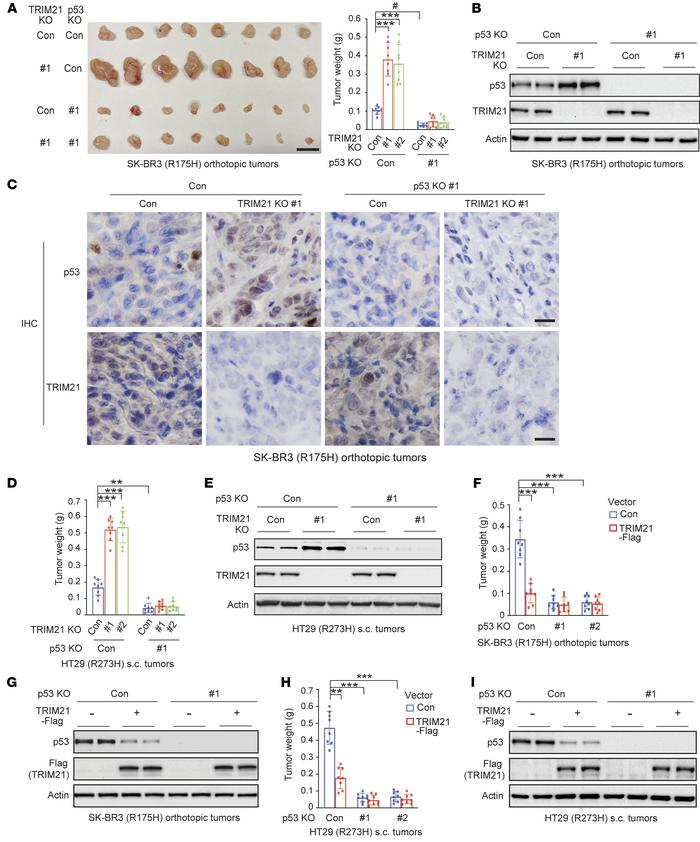
图5:TRIM21抑制mutp53积累促进肿瘤生长
6.TRIM21的低表达校正mutp53癌症中的不良预后
组织芯片的结果显示,TRIM21的表达在两个不同的结肠直肠癌组中,分别有63%(n=57/90)和44%(n=22/50)的结肠直肠癌下调(图6A),在50%(n=20/40)的乳腺癌中下调(图6 B)。此外,与其匹配的相邻非肿瘤组织相比,结直肠癌和乳腺癌中TRIM21的平均蛋白水平显著降低(图6A和B)。同样,与非肿瘤乳腺组织相比,TRIM21蛋白水平在这些乳腺癌中显著下调(图6C)。TCGA数据库中的TRIM21表达的分析显示,几种类型的肿瘤中的低TRIM21表达与患有mutp53癌症而非wtp53癌症的患者中的不良临床结果显著相关(图6D)。这些结果表明TRIM21在一些携带mutp53的癌症中的肿瘤抑制功能。
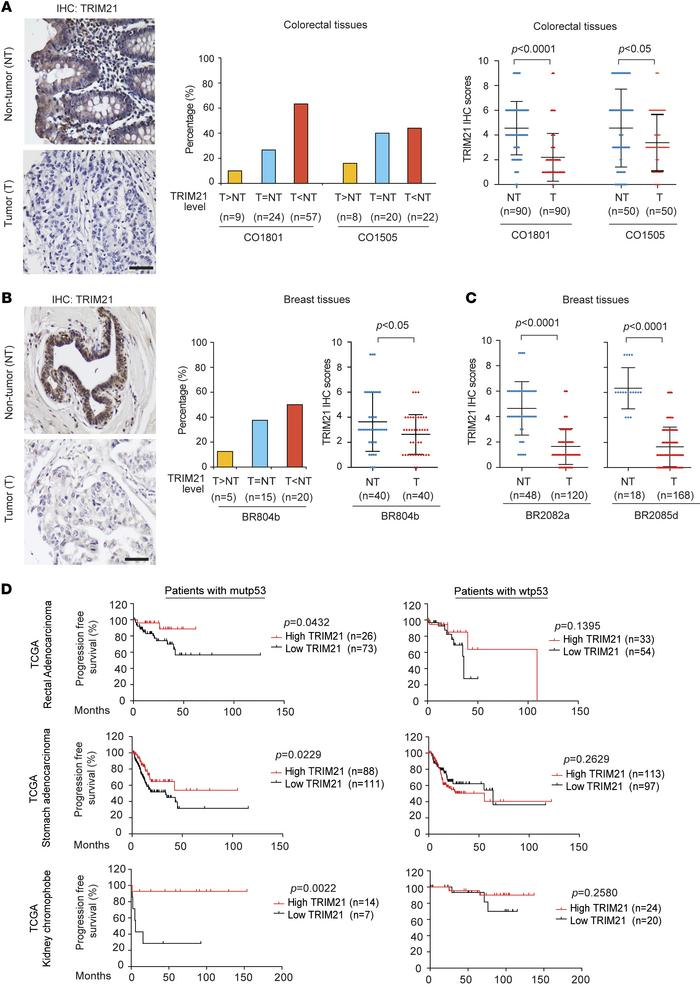
图6:TRIM21的低表达校正mutp53癌症中的不良预后
7.TRIM21缺失导致mutp53在正常组织中积累并促进p53R172H/R172H小鼠的肿瘤发生
构建TRIM21+/+ p53R172H/R172H和TRIM21-/-p53R172H/R172H小鼠,发现TRIM21缺失没有明显影响p53-/-或p53+/+小鼠的寿命,但TRIM21缺失导致肿瘤发病更早,这显著降低了p53R172H/R172H小鼠的寿命。TRIM21+/+ p53R172H/R172H和TRIM21-/-p53 R172H/R172H小鼠的中位生存期分别为157天和134天(p=0.0002;图7A)。在p53 R172 H/R172H小鼠的正常组织(包括脾、胸腺、小肠和结肠组织)中未观察到mutp53蓄积,通过Western印迹和IHC分析,在TRIM21-/-p53R172H/R172H小鼠的这些正常组织中mutp53蛋白蓄积至高水平(图7B和C)。而在正常(非应激)条件下,wtp53蛋白水平在正常组织中保持在非常低的水平(图7D)。尽管mutp53在TRIM21+/+ p53R172H/R172H和TRIM21-/-p53R172H/R172H小鼠的肿瘤中积累,但与TRIM 21+/+ p53R172H/R172H肿瘤相比,在TRIM21-/-p53R172H/R172H肿瘤中观察到更高水平的mutp53积累(图7 E)。通过co-IP测定证实了肿瘤中TRIM21和R172H mutp53蛋白之间的相互作用,表明TRIM21与mutp53在体内相互作用(图7 F)。总之,这些结果表明TRIM 21缺失导致mutp53在正常组织中积累,并且mutp53在肿瘤中进一步积累,导致p53R172H/R172H小鼠的更早的肿瘤发作和寿命缩短。
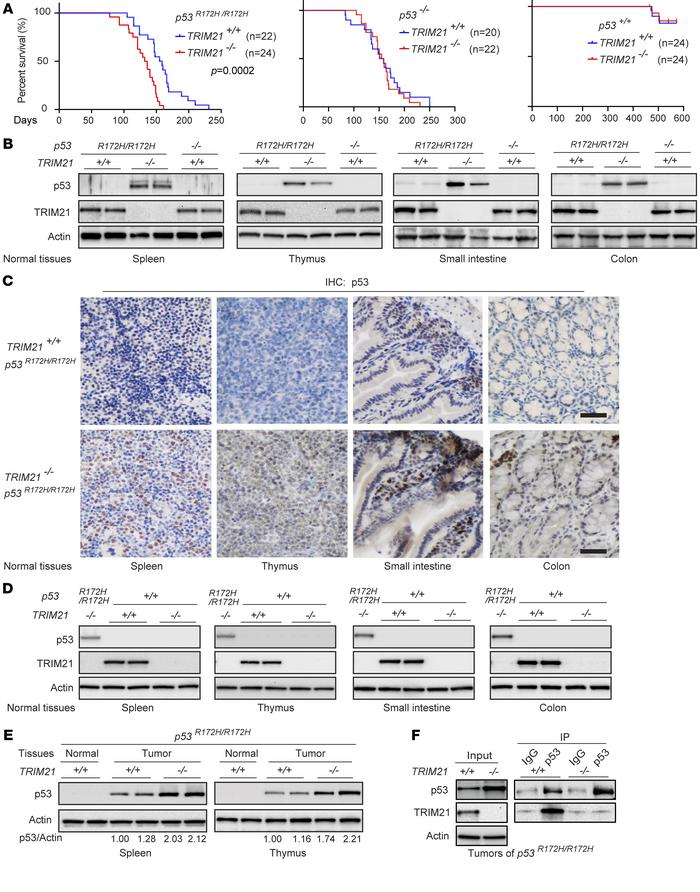
图7:TRIM21缺失导致mutp53积累并促进p53R172H/R172H小鼠的肿瘤发生
结论
总之,这个研究揭示了癌症中mutp53积累和GOF的关键机制,并且还鉴定了TRIM21在癌症中的肿瘤抑制功能的重要机制。更好地理解肿瘤中mutp53积累和GOF的机制将为开发针对携带mutp53的癌症的有效治疗策略提供新的机会。
实验方法
细胞培养和载体构建,CRISPR/Cas9构建 KO细胞系,LC-MS/MS测定,western blot,免疫共沉淀实验,GST pull-down,RT-qPCR,泛素化测定,半衰期分析,锚定非依赖性生长测定,小鼠成瘤实验,免疫组化,TCGA数据库分析。
参考文献:
Liu, J., Zhang, C., Xu, D., Zhang, T., Chang, C. Y., Wang, J., Liu, J., Zhang, L., Haffty, B. G., Zong, W. X., Hu, W., & Feng, Z. (2023). The ubiquitin ligase TRIM21 regulates mutant p53 accumulation and gain of function in cancer. The Journal of clinical investigation, 133(6), e164354. https://doi.org/10.1172/JCI164354






