T细胞耗竭经久不衰的热点:Runx3 DNA甲基化的作用
以PD-1或PD-L1抗体治疗为代表的检查点阻断免疫疗法在临床实践中取得了巨大的成功。然而,低的临床反应率和缺乏预测免疫反应的生物标志物限制了抗PD-1免疫疗法的临床应用。作者此前发现低剂量DAC和PD-1-ab的联合治疗可以显著提高cHL患者的完全反应(CR)率,从32%提高到71%,这表明表观遗传调控和免疫治疗的临床反应之间存在着明显的相关性。本文证明Runx3的DNA甲基化在DAC刺激的PD-1-ab免疫治疗过程中对CD8+T细胞的浸润和分化起着关键作用,这为外调在免疫治疗中的重要作用提供了一个支持机制。本文于2023年5月发表在《Molecular Cancer》IF:37.3杂志上。
技术路线

主要实验结果
1、临床样本组学分析揭示抗PD-1/DAC免疫治疗引发CD8+ T细胞的大规模甲基化重编程
作者招募了两组患者,分别接受抗PD -1和抗PD -1/DAC (DP)治疗。按照工作流程进行DNA甲基化EPIC和RNA-seq(Fig. 1a)。为探索患者CD8+ T细胞的DNA甲基化重编程谱,获得了抗PD -1治疗患者和预处理DAC患者的CD8+ T细胞的DNA甲基化谱(Fig. 1a)。与抗PD -1治疗患者比较,在DAC刺激的抗PD-1治疗的患者中检测到大规模的去甲基化,并评估了与治疗相关的临床反应(Fig. 1a-c)。此外,确定了295个低甲基化的差异DNA甲基化位点(DMSs),而高甲基化的DMSs数量为951,发现在DP联合治疗组中,低甲基化位点的数量明显增加(Fig. 1d)。
为了进一步探索DNA甲基化重编程的动态特征及其与临床结果的相关性,比较了C1D6(DAC治疗后5天)阶段与C1D0(治疗前基线)阶段以及C2D0(抗PD-1治疗一个周期后)阶段与C1D6(DAC治疗后5天)阶段的DMSs。结果显示,DAC治疗后发生了大规模的去甲基化,相反,在PD-1阻断单药治疗组没有观察到动态的DNA甲基化重编程。此外,为确认个别患者的DNA甲基化重编程,定量分析了每个患者的全基因组甲基化水平和差异性甲基化水平(Fig. 1e)。结果显示,DP组所有患者的所有CD8+T细胞在C2D0期间(抗PD-1治疗一个周期后)都有明显的去甲基化特征,这意味着DAC引起的去甲基化没有表现出个体差异。此外,用统计分析法分析甲基化水平,在用抗PD-1与抗PD-1/DAC治疗时,观察到明显的差异(Fig. 1f)。对DNA甲基化分布的分析显示,在进行抗PD-1/DAC治疗时,高甲基化位点发生了明显的DNA去甲基化(Fig.1g)。
然后对DMSs进行了Ingenuity Pathway分析,结果显示DMSs主要富集在T细胞衰竭和T细胞激活相关的通路中,包括T细胞衰竭信号通路、Th1和Th2激活通路,以及NFAT在免疫反应调节中的作用(Fig.1h)。此外,还分析了DP组CD8+T细胞的C2D0(抗PD-1治疗一个周期后)与C1D0(治疗前基线)的状态。DMSs也主要富集在T细胞衰竭信号通路、细胞毒性T淋巴细胞的CTLA4信号、干扰素信号和干扰素信号中(Fig.1h)。上述结果表明,DAC治疗可能导致T细胞衰竭的逆转,增强T细胞的激活和浸润。

图1 DAC可以引发CD8+ T细胞的大规模重编程
2、Runx3是低剂量抗PD-1/DAC免疫治疗改善临床反应的关键介质
为研究DNA甲基化重编程是否与基因表达相关,作者进行了RNA-Seq并分析了CD8+T细胞的表达谱。结果显示,两组CD8+T细胞中存在大量的差异表达基因(DEGs)。如火山图所示,DEGs的表达倍数变化在C2D0(抗PD-1治疗一个周期后)时期明显增加(Fig. 2a)。通过分析DP组的差异,比较C2D0(抗PD-1治疗一个周期后)与C1D0(治疗前的基线),发现CCR2、TNFSF14和TNFSF4等基因下调,CCL3、TIGIT IFNG和CD69等基因上调,CCR3和CCR5等细胞因子在DAC治疗后明显上调,而TOX在DAC治疗后则下调。这些数据表明,耗竭T细胞可以被DAC逆转,即与浸润相关的细胞因子被DAC上调,而不是被抗PD-1上调。进一步进行IPA途径富集分析(Fig. 2b)来探索这些发现可能的生物学意义。结果显示,这些差异在T细胞衰竭途径、Th1和Th2激活途径和T细胞受体途径中富集,这与DNA甲基化分析中DMSs的富集结果高度一致。通过tSNE分析,发现抗PD-1治疗后的CD8+T细胞由两个不同的群体组成(Fig. 2c)。
通过对DEGs和DMSs的多组学联合分析,发现有3729个基因在DNA甲基化和表达谱方面有交集(Fig. 2d)。通过通路分析,发现这些通路主要富集在T细胞激活的调控、免疫系统中的细胞因子信号、免疫系统发育和白细胞细胞粘附通路的调控等方面,这表明DP的组合可能在免疫系统的发育、激活和对细胞因子的反应中起核心作用。
由于DMSs和DEGs之间的一致性,作者对这两个omics数据集进行了联合分析。发现Runx3是受调控最明显的基因。用DAC治疗后,所有CR患者的Runx3启动子上都保持稳定的去甲基化水平和Runx3的高表达水平(Fig. 2e)。DNA甲基化和表达的相关性被证实(Fig. 2f)。以上数据表明在DAC刺激的抗PD-1治疗过程中,Runx3启动子的表观遗传重编程在调控Runx3表达方面起着关键作用。
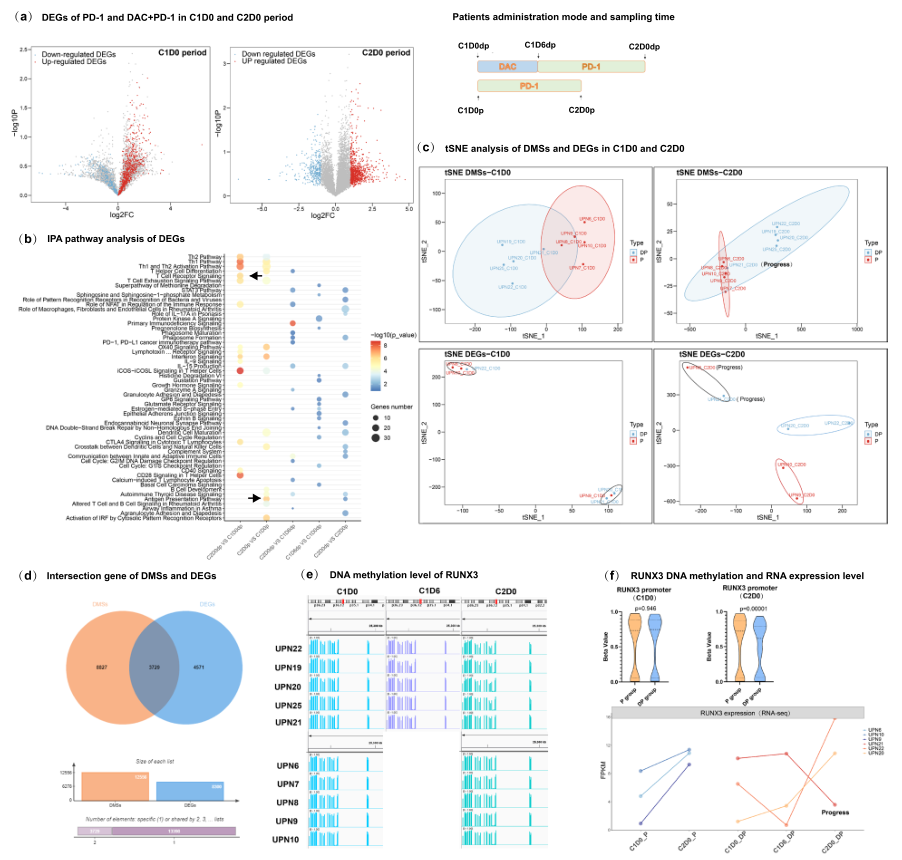
图2 CD8 + T细胞的表达谱和多组学分析确定了DAC对CD8 + T细胞应答的重要信号通路
3、在小鼠体内DAC治疗促进T细胞的浸润,并下调T细胞的衰竭程度
为进一步研究DAC免疫疗法 "表观遗传致敏 "作用的内在机制,作者旨在在小鼠身上重现临床观察。为建立体内小鼠模型,将MC38细胞植入C57BL/6小鼠,在指定时间用DAC、抗PD-1或抗PD-1/DAC治疗,模拟患者的临床情况(Fig. 3a)。如Fig. b-c所示,在MC38肿瘤移植小鼠中,发现DAC联合抗PD-1明显抑制肿瘤生长,促进TILs的浸润。在MC38模型中,抗PD-1治疗对肿瘤生长的抑制作用不明显,但DAC和抗PD-1的联合治疗明显抑制了肿瘤的生长。进一步用流式细胞仪分析CD8+T细胞的功能。如Fig. 3c所示,增殖型T细胞的比例明显增加(ki67+CD8+T)。杀伤性(GranB+CD8+T,proferin+CD8+T)和分泌性细胞(IFN-γ+CD8+T)细胞的比例也明显提高。
结果还显示,Runx3的DNA甲基化状态在DAC-和DAC/抗PD-1处理的小鼠CD8+T细胞中明显下降,但在WT和抗PD-1处理的小鼠CD8+T细胞中没有下降(Fig. 3d)。为探索外周免疫系统和肿瘤微环境的免疫状态,检查了淋巴结、脾脏、外周血和肿瘤中T细胞的数量和功能。结果显示,联合治疗组的血液、脾脏和淋巴腺中的CD3+T细胞数量减少。联合治疗中,CD8+T细胞在脾脏和血液中的数量减少,在淋巴腺中的数量增加。这表明肿瘤浸润性T细胞的增殖、杀伤和分泌干扰素的能力都明显增强,表明肿瘤微环境中T细胞功能的整体恢复(Fig. 3c)。流式细胞仪显示,当细胞用DAC处理时,Runx3+CD8+T细胞的比例比用抗PD-1处理时增加得更多,当细胞同时用DAC和抗PD-1处理时达到峰值(Fig. 3D)。
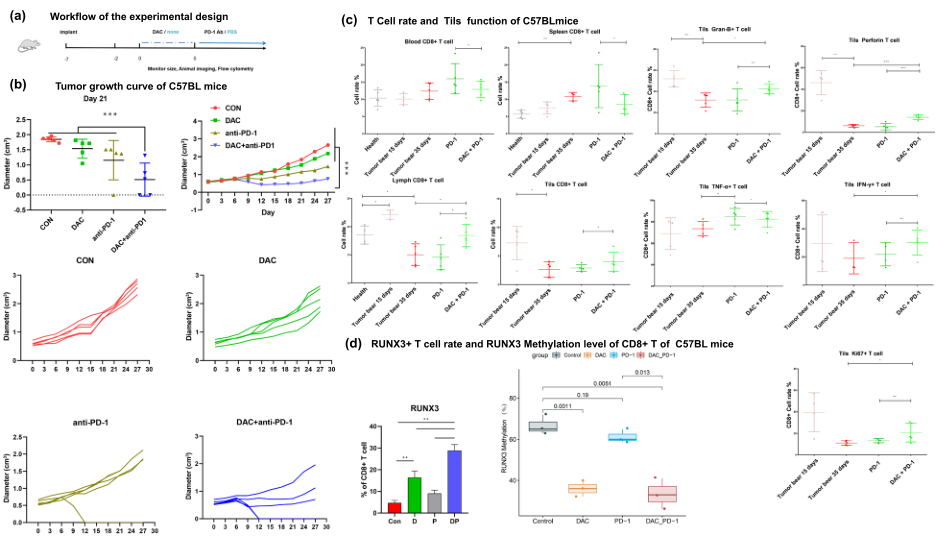
图3 DAC通过去甲基化Runx3和促进Runx3表达,下调T细胞衰竭和上调T细胞浸润
4、条件敲除Runx3证明Runx3对于DAC发挥抗PD-1耐药的“表观遗传增敏剂”作用是必不可少的
为排除Runx3在肿瘤细胞中的抗肿瘤作用,构建了条件敲除小鼠,以证明Runx3在T细胞和免疫治疗中的特异性功能。Runx3 flox小鼠是通过基于CRISPR/Cas9的方法产生的。用CRISPR设计工具(http://www.sanger.ac.uk/)设计了两个sgRNAs,针对小鼠Runx3的NM_019732.2转录本第4外显子的上游或下游区域。通过随后与Lck-cre小鼠的杂交和基因型鉴定,最终构建了Runx3fl/fl;Lck-Cre小鼠。Runx3fl/fl小鼠在体重和发育方面没有表现出差异。没有观察到自身免疫性疾病。然后,Runx3fl/fl和Runx3fl/fl;Lck-Cre小鼠都被分为三组:对照组、抗PD-1治疗组和抗PD-1/DAC治疗组(Fig. 4a)。
Runx3fl/fl;Lck-Cre小鼠的抗肿瘤免疫力下降(Fig. 4a,b)。在对照组Runx3fl/fl小鼠中,抗PD-1组和DAC/抗PD-1组之间有显著差异(Fig. 4c,d)。此外,在Runx3fl/fl;Lck-Cre小鼠中,DAC刺激的抗PD-1组和抗PD-1组小鼠的肿瘤生长曲线没有显著差异。肿瘤体积和质量没有明显差异,这表明条件性敲除Runx3基因后,DAC的影响被消除了。
为进一步研究Runx3在CD8+T细胞中的作用,作者应用单细胞流式质谱分析(CyTOF),发现CD8+肿瘤浸润淋巴细胞(TILs)的比例,发生了明显变化。综合分析表明,Runx3增加了Teff和TRM细胞的比例,干扰了免疫细胞亚型的平衡(Fig. 4c, d)。

图4 免疫治疗的表观遗传增敏作用在Runx3 fl/fl;Lck-Cre小鼠中被消除
5、Runx3在T细胞浸润和效应和记忆T细胞分化中发挥关键作用,并具有削弱T细胞衰竭的功能
肿瘤免疫治疗由T细胞功能反应的多个步骤组成。首先,T细胞分化为效应T细胞,然后是记忆T细胞,以发挥抗肿瘤功能。其次,T细胞浸润到肿瘤中以杀死肿瘤细胞是至关重要的。肿瘤微环境中缺乏免疫细胞是反应低下的一个重要原因。第三,T细胞经常处于衰竭或功能障碍状态,T细胞的衰竭也会影响PD-1抗体反应率。为阐明Runx3的具体作用,进行CyTOF来比较条件性敲除小鼠和对照小鼠的T细胞功能。采用42种标记物,涵盖了细胞因子、T细胞衰竭标记物、T细胞增殖和T细胞杀伤能力。由于观察到DAC治疗后CCR明显增加,而且发现DAC促进T细胞在小鼠模型中的浸润,因此在这42个标志物中包括了几个CCR。
首先,观察到Runx3缺乏的小鼠外周血、脾脏、肿瘤组织中CD8+T细胞和效应T细胞的明显下调(Fig. 5a, b)。此外, Runx3的缺失明显下调CCR3和CCR5,从而影响了T细胞的浸润(Fig. 5c)。Runx3的缺乏也通过影响T细胞分化和T细胞衰竭而损害T细胞功能(Fig. 5d)。观察到Lag3、Tim3和CTAL4的水平增加,但IFNγ、TNFα和IL-2的水平下降。有趣的是,没有发现Runx3缺陷的小鼠中PD-1的水平增加。以前的工作表明,PD-1只在T细胞被激活后表达,而Runx3缺陷明显下调效应T细胞和记忆T细胞,这反过来可能平衡PD-1的表达水平以增加耗竭的T细胞。
在对照组Runx3fl/fl小鼠中,发现DAC联合PD-1抗体促进了T细胞的浸润和TILs的分泌能力(IFN,TNF-α)。增殖能力(Ki67)和杀伤能力(GranB、Perforin等)明显增加,这种促进作用在使用DAC后明显增强。对于Runx3基因敲除的小鼠,T细胞的分泌、增殖和杀伤能力受到抑制,表明Runx3可能是DAC表观遗传致敏功能的关键媒介(Fig. 5c, e)。

图5 Runx3缺失阻碍ccr的表达和CD8+ T细胞的肿瘤浸润
6、Runx3预测抗PD-1免疫疗法在一系列肿瘤类型中的反应
作者认为研究Runx3水平是否能预测抗PD-1的免疫反应将是有趣的。免疫疗法已经改变了各种肿瘤的治疗格局,并在一些难治性肿瘤中表现出持久的反应率,然而在一些接受治疗的患者中却出现了无反应性和严重的免疫相关副作用。因此,迫切需要生物标志物来筛选能从免疫疗法中受益的人。从此前的临床研究中,作者发现,Runx3的表达与临床反应之间有很强的相关性(Fig. 6a)。ROC曲线是评估生物标志物预测性能的一个有用的图形工具(Fig.6a),表明生物标志物小组可以区分两组:反应组和非反应组。绘制了Runx3与临床反应的ROC曲线,发现Runx3水平可以关键性地预测临床反应。Fig. 6b显示,Runx3水平与效应T细胞水平和记忆T水平相关,而不是整体CD8+T细胞水平。因此,Runx3通过影响功能分化而不是CD8+T细胞的整体水平,对临床ICB反应做出贡献。上述数据表明,功能性T细胞的数量,而不是T细胞的整体水平对临床反应起着重要作用。
作者探索了TISIDB数据库,分析了Runx3水平和抗PD-1治疗的临床预后的相关性。发现,Runx3水平与临床预后和生存率有很好的相关性。在结直肠癌、乳腺癌和淋巴癌患者中,Runx3的高表达与抗PD-1治疗方案的良好预后有关(Fig.6c)。这表明Runx3是抗PD-1免疫疗法的一个重要调节因素,也是预测预后的潜在生物标志物。综上所述,这些数据表明,Runx3不仅是DAC和CD8+T细胞功能的关键媒介,也是临床免疫反应的潜在生物标志物。
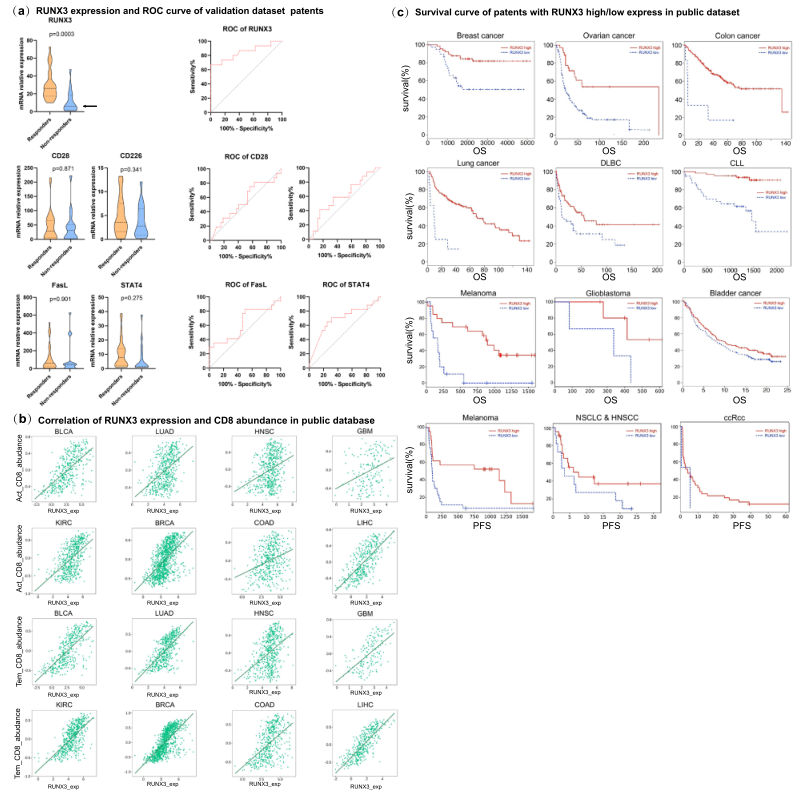
图6 Runx3是临床免疫治疗反应的关键分子标志物
本研究证明Runx3的DNA甲基化在DAC刺激的PD-1-ab免疫疗法中对CD8 + T细胞的浸润和分化起着关键作用,这为外调在免疫疗法中的重要作用提供了一个支持机制。
实验方法
构建小鼠模型,DNA和RNA样本制备,EPIC BeadChip methylation,RNA测序,Real-time PCR,MSRE-qPCR,小鼠荷瘤和药物(Decitabine)处理以及免疫治疗实验,流式细胞术(FACS),单细胞流式质谱分析(CyTOF)。
参考文献
Liu, Z., Li, X., Gao, Y. et al. Epigenetic reprogramming of Runx3 reinforces CD8 + T-cell function and improves the clinical response to immunotherapy. Mol Cancer 22, 84 (2023). https://doi.org/10.1186/s12943-023-01768-0






