靶向IGF1R信号可增强食管鳞状细胞癌顺铂的敏感性
以顺铂(DDP)为基础的化疗是食管鳞状细胞癌(OSCC)患者常用的一线治疗方案,但其较高的耐药率限制了其临床应用,其作用机制尚不清楚。本研究旨在阐明缺氧条件下异常信号传递和代谢在OSCC耐药中的作用,并寻找增强DDP化疗敏感性的靶向药物。通常,肿瘤细胞存在于缺氧微环境中。通过基因组分析,我们确定IGF1R在低氧条件下在OSCC中上调。临床上,IGF1R表达增强与OSCC患者肿瘤分期高、预后差相关,其抑制剂linsitinib在体内和体外均与DDP治疗有协同作用。由于缺氧经常导致代谢重编程,我们通过代谢组学分析进一步了解到,异常的IGF1R通路通过c-MYC的转录活性促进代谢酶ASS1和PYCR1的表达。具体而言,ASS1的表达增强促进精氨酸代谢以进行生物合成代谢,而PYCR1则激活脯氨酸代谢以维持氧化还原平衡,从而在缺氧条件下维持DDP治疗期间OSCC细胞的增殖能力。靶向IGF1R信号的Linsitinib可能为DDP耐药的OSCC患者带来有希望的联合治疗选择。本文于2023年3月发表于Journal of Experimental & Clinical Cancer Research(IF=11.3)上。
技术路线

结果
1)IGF1R在OSCC中过表达,与疾病进展和不良预后相关
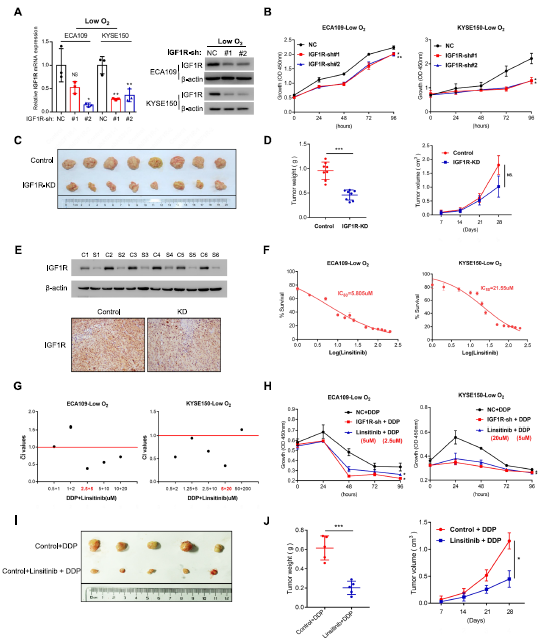
我们首先分析了TCGA的数据。其中,IGF1R、MET、EGFR、FGFR2、FGFR3、PDGFRB的表达水平在OSCC中较非癌组织显著上调,其中IGF1R表达差异最显著(图1A)。同时,通过RNA-seq,在OSCC患者组织中也发现MET和IGF1R过表达(图1B左)。为了进一步分析在模拟缺氧(1%)条件下RTKs失调对化学耐药的作用,我们最初考虑选择对DDP具有最大抗性的OSCC细胞系。最近的研究表明KYSE150细胞对DDP的药物敏感性最低。我们选择IC50值最高的KYSE150和ECA109细胞进行后续RNA测序(图1B右)。在缺氧条件下,只有IGF1R显著上调。通过整合临床组织和细胞系样本的RNA-seq,我们将后续的研究重点放在了IGF1R上(图1C)。与上述RNA-seq结果一致,在缺氧条件下,RTKs中只有IGF1R以浓度(图1D)和时间(图1E)依赖的方式持续表达水平升高。
在临床上,TMA(图1F-H)和WB(图1I)分析结果反映了上述差异,其中肿瘤组织中IGF1R蛋白表达高于癌旁组织。此外,在79例OSCC患者中,IGF1R高表达水平与肿瘤分期呈正相关(图1F-G),与总生存期预后不良正相关(图1H)。具体而言,与邻近正常组织相比,早期食管癌组织中IGF1R蛋白丰度中度升高(图1J-K),这可能为早期诊断和治疗提供指导。综上所述,这些数据表明IGF1R在人类OSCC中过表达,这可能具有预后意义,并与缺氧下DDP抵抗有关。

2)抑制IGF1R可增强OSCC在体内和体外对DDP的敏感性
为了探索异常表达的IGF1R在DDP耐药中的作用,我们最初干扰了IGF1R的表达(图2A),在体外(图2B)和体内(图2C-E)均发现了适度抑制OSCC增殖的能力。此外,IGF1R抑制剂linsitinib可以在接近IC50的浓度下有效抑制p-IGF1R的表达(图2F)。随后,将linsitinib与DDP联合治疗(图2G),说明linsitinib与DDP联用可协同抑制OSCC细胞的增殖。这些协同效应在体外(图2H)和体内(图2I-J)也有体现。总的来说,抑制IGF1R表达可能显著增加OSCC细胞对DDP的敏感性。接下来,我们将探讨潜在的机制。
3)缺氧条件下,代谢酶ASS1/PYCR1在OSCC中上调
代谢适应有助于癌细胞在缺氧微环境中的发育。具体来说,代谢酶的改变是整个代谢途径异常的关键。因此,通过整合代谢组学和基因组分析(图3G),我们有望在缺氧条件下找到活化的代谢酶。一方面,作为精氨酸代谢关键酶的ASS1和负责脯氨酸合成的PYCR1在肿瘤组织(图3A左)和限氧条件下的细胞系(图3A右)中均有高表达。另一方面,我们进行了非靶向代谢组学分析(图3B),在缺氧条件下的KYSE150细胞中发现了45种异常积累的代谢物(图3C)。通过the Small Molecule Pathway Database分析,发现这些代谢物与多种代谢途径密切相关(图3D)。我们发现TCA循环和FAO被抑制,同时伴随着糖酵解的增强(图3E)。值得注意的是,天冬氨酸-精氨酸-脯氨酸代谢也增强了(图3F)。我们主要关注通过ASS1和PYCR1改变的精氨酸/脯氨酸代谢(图3G)。

4)ASS1和PYCR1的表达改变与IGF1R相关
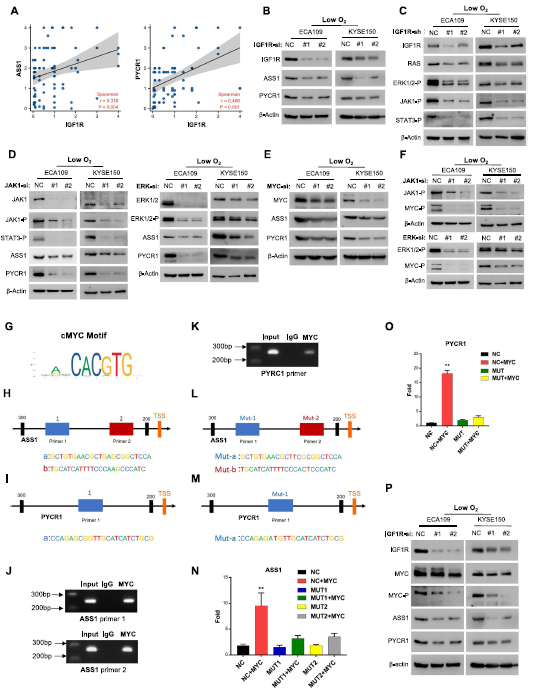
我们初步验证了ASS1和PYCR1在OSCC中的表达水平。与IGF1R一致,ASS1和PYCR1在KYSE150和ECA109细胞系中表达最高(图3H-I)。此外,缺氧也以时间依赖性的方式刺激了这两种酶的表达(图3J-K)。此外,TMA(图4A-D)和WB(图F)显示,与癌旁组织相比,OSCC患者组织中ASS1/PYCR1蛋白表达上调。临床上,ASS1/PYCR1的高表达与肿瘤分期相关(图4A-D),即使在EOC中与正常组织样本相比(图4G-H),以及OSCC患者的无进展生存期(图4E)。此外,我们发现TMA中ASS1和PYCR1的表达与IGF1R呈正相关(图5A)。因此,我们想知道ASS1和PYCR1是否受IGF1R的调节。

5)IGF1R通过相关信号通路- cMYC轴调控ASS1和PYCR1的表达
为了进一步探索IGF1R调控ASS1和PYCR1表达的机制,我们首先抑制IGF1R的表达,发现ASS1/PYCR1下调(图5B)。此前,IGF1R已被证明在促进多种细胞功能的两个主要信号通路(即PI3K/AKT和Ras/MAPK通路)中负责下游级联蛋白的磷酸化。因此,我们抑制IGF1R表达来检测各种信号通路,发现Ras/MAPK通路和JAK/STAT通路(图5C)的磷酸化水平显著降低。此外,JAK和ERK1/2的下调伴随着ASS1/PYCR1表达的降低(图5D),证实IGF1R通过这两条信号通路调控ASS1/PYCR1。为了确定IGF1R通路与ASS1/PYCR1之间的桥梁,多种转录因子(TF)引起了我们的注意,并且它们的转录活性可以通过RTK通路的磷酸化而增强。因此,在几种常见的TF中,只有磷酸化的c-MYC与ASS1/PYCR1 (图5E)和IGF1R通路(图5F)表现出明确的调控关系。为了确定c-MYC与ASS1/PYCR1之间的直接调控,我们进行了JASPAR分析(图5 G),结果表明ASS1 (图5H)和PYCR1 (图5I)在启动子区域都有c-MYC结合序列。对c-MYC进行ChIP检测,然后进行定量PCR,证实c-MYC直接与ASS1(图5J)和PYCR1(图5K)启动子结合。此外,双荧光素酶报告基因检测显示,c-MYC可以促进ASS1(图5L, N)和PYCR1(图5M, O)的转录激活。综上所述,这些结果表明,缺氧条件下ASS1和PYCR1表达的改变是由IGF1R信号通路- c-MYC轴诱导的(图5P)。
6)IGF1R通过靶向精氨酸代谢降低OSCC细胞对DDP的敏感性
为了进一步研究ASS1和PYCR1增强在DDP耐药中的作用,我们首先干扰ASS1(图6A)和PYCR1(图6C)的表达,分别观察到体外(图6B, D)和体内(图6E-G)的增殖能力略有抑制。与IGF1R抑制剂linsitinib的作用一致,shASS1/PYCR1在体外(图H-I)和体内(图6J-L)均表现出与DDP协同抑制肿瘤增殖的作用。接下来,我们还进行了代谢组学分析,以研究ASS1(图7A)和PYCR1(图7D)在代谢重编程中的作用。ASS1(图7B、C、G)和PYCR1(图7E、F、H)抑制诱导的异常与精氨酸/脯氨酸代谢密切相关。更具体地说,shRNA-PYCR1细胞中的脯氨酸水平降低,shRNA-ASS1细胞中的精氨酸水平降低(图7I)。此外,为了揭示精氨酸的作用,我们进行了拯救实验。与对照+ DDP组相比,shASS1 + DDP或linsitinib + DDP组被抑制的增殖能力通过补充外源性精氨酸得到部分恢复(图7J)。这些数据表明,IGF1R通过在缺氧条件下调节ASS1促进精氨酸代谢,导致精氨酸积累,作为维持化疗期间增殖能力的生物合成前体。
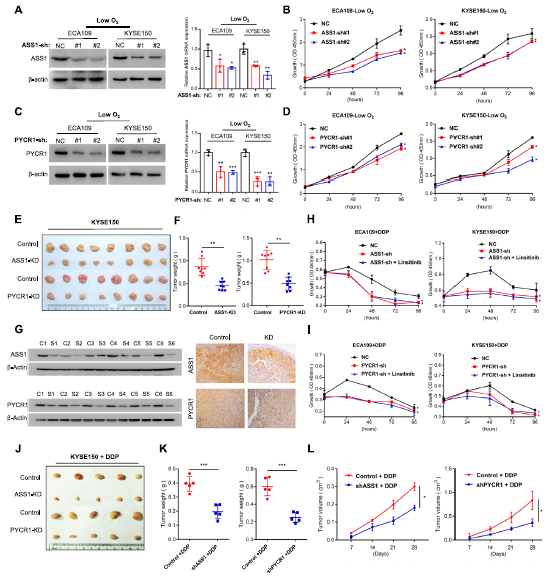
7)IGF1R通过靶向脯氨酸代谢降低OSCC细胞对DDP的敏感性
与精氨酸相比,外源性脯氨酸在shPYCR1 + DDP或linsitinib + DDP组中未能挽救增殖(图7K)。众所周知,PYCR1催化脯氨酸合成伴随着NAD+的生物合成,在维持氧化还原平衡中起着关键作用。我们想知道通过PYCR1增强脯氨酸代谢的NAD +是否补偿了TCA循环。正如预期的那样,PYCR1表达减弱抑制了NAD +水平(图7L)。最后,我们在DDP + shPYCR1组中添加了额外的外源性丙酮酸,它可以支持TCA循环中中间代谢物的积累;结果,外源性丙酮酸逆转了shPYCR1 + DDP处理引起的增殖抑制(图7K)。综上所述,IGF1R通过调节PYCR1促进脯氨酸代谢,提供足够的NAD +维持TCA循环中的氧化还原平衡,最终支持化疗期间的细胞增殖。

结论
我们发现激活的IGF1R通路在低氧微环境下的OSCC化疗耐药中发挥重要作用。靶向IGF1R和相关的精氨酸/脯氨酸代谢可能是减轻DDP耐药的关键方法。这些发现提高了我们对DDP耐药性中的信号传递和代谢重编程的理解。DDP和IGF1R抑制剂联合治疗可能有利于OSCC的治疗。
实验方法
CCK-8,RT‑qPCR,RNA测序,WB,ChIP,荧光素酶报告实验,IHC,TMA,代谢组学分析,NAD +和ATP水平的测定。
参考文献
Fang K, Sun M, Leng Z, Chu Y, Zhao Z, Li Z, Zhang Y, Xu A, Zhang Z, Zhang L, Chen T, Xu M. Targeting IGF1R signaling enhances the sensitivity of cisplatin by inhibiting proline and arginine metabolism in oesophageal squamous cell carcinoma under hypoxia. J Exp Clin Cancer Res. 2023 Mar 28;42(1):73. doi: 10.1186/s13046-023-02623-2.






