USP48的药理激活——USP48-GSDME轴促进癌细胞焦亡

焦亡是一种细胞程序性死亡,其特征是炎症caspase的激活和Gasdermin蛋白的裂解。焦亡可以抑制肿瘤发展,诱导抗肿瘤免疫,激活焦亡是一种潜在的治疗癌症的策略。本研究中,作者通过CRISPR-Cas9筛选,发现USP48(一种去泛素化酶)的缺失显著抑制了细胞焦亡。USP48通过Gasdermin E (GSDME)促进焦亡。该研究于2023年4月发表在《Cancer Research》,IF:11.2。
技术路线
主要研究结果
1. USP48参与焦亡的调控
显微镜下观察人宫颈癌HeLa细胞经raptinal处理后的形态学变化,发现HeLa细胞中出现焦亡的球囊细胞膜,证实raptinal可以诱导HeLa细胞焦亡(图lA)。在HeLa细胞中进行CRISPR-Cas9基因筛选,以raptinal处理后LDH的分泌量为读取值,并通过单siRNA筛选技术进一步筛选和验证获得的基因(图1B)。根据转染sgRNA后LDH分泌的倍数变化,选择36个基因作为主要基因。其中,17个候选基因的沉默使LDH的分泌增加2倍以上,而其他19个基因的沉默则抑制了LDH的分泌(图1C-D)。干扰USP48对细胞内LDH的释放有明显的抑制作用(图1E)。用raptinal处理细胞,检测USP48沉默对HeLa细胞LDH、IL-1β和IL-18的影响(图1F-H)。结果表明,USP48沉默可显著抑制HeLa细胞中LDH、IL-1β和IL-18的释放。通过延时显微镜观察转染USP48特异性siRNA (si-USP48)的HeLa细胞,结果显示USP48沉默显著抑制raptinal诱导的焦亡和SYTOX Green吸收(图1I-J)。USP48沉默抑制raptinal诱导的HMGB1释放(图1K)。综上所述,初步确认USP48可能参与焦亡调控。

图1. USP48参与焦亡的调控
2. USP48调控GSDM的表达
检测6种不同人源性细胞系中USP48的表达,发现USP48在293T细胞中低表达,在HeLa细胞中高表达(图2A)。在293T细胞系中稳定过表达USP48,在HeLa细胞系中稳定敲低USP48(图2B)。将质谱和蛋白质组学结果结合分析,获得8个相关蛋白(图2D和E)。检测过表达USP48和敲低USP48后这8种蛋白的表达水平变化,发现GSDME相比其他几种蛋白的变化更为显著和稳定(图2F和G)。图2H进一步证实GSDME的表达与USP48的表达呈正相关,但GSDMD和USP48的表达状态不存在显著相关。催化失活突变体USP48 (USP48/C98A)的过表达不会影响GSDME的表达(图2I)。通过CO-IP进一步证实USP48与GSDME之间的相互作用(图2J-K)。此外,作者还发现USP48不影响GSDME的裂解(图2L)。综上,USP48可以调节GSDME的表达(但不影响其裂解),并且与GSDME有直接的相互作用。

图2. GSDME是USP48的下游靶蛋白
3. USP48通过调控GSDM的表达影响焦亡
建立一个同时表达USP48和靶向GSDME的shRNA的293T细胞系(图3A)。GSDME的下调大大挽救了raptinal处理后293T细胞中USP48过表达对LDH(图3B)、IL-1B(图3C)和IL-18(图3D)的促进作用。相反,在同时表达shUSP48和GSDME的HeLa细胞系中(图3E),也证实了过表达GSDME可以恢复USP48敲低对293T细胞经raptinal处理后产生LDH(图3F)、IL-1β(图3G)和IL-18(图3H)的抑制作用。用延时显微镜观察表达USP48和shRNA靶向GSDME的293T细胞系经raptinal处理后SYTOX Green的形态和吸收情况,得到了一致的结果(图3I-J)。综上所述,证实USP48可能以不依赖于caspase-3的方式促进GSDME的表达,从而促进GSDME的表达发生焦亡。

图3. USP48通过GSDME调控焦亡
4. USP48通过去泛素化防止GSDME降解
为进一步确认USP48是否会影响GSDME的稳定性,作者发现蛋白酶体特异性抑制剂MG132可以有效逆转USP48敲低对GSDME的影响(图4A),通过环已酰亚胺(CHX)追踪分析评价USP48调节GSDME蛋白肿瘤速率的潜力,结果表明USP48水平的降低与GSDME半衰期的缩短明显相关(图4B)。用Dox诱导的野生型USP48 (USP48/WT)和催化失活突变型USP4S (USP48/C98A)建立293T细胞,发现只有野生型USP48以Dox剂量依赖的方式逐渐增加GSDME水平(图4C),而表达USP48/C98A的细胞中未检测到GSDME蛋白水平的显著变化(图4D)。进一步的实验发现过表达野生型USP48显著降低GSDME的泛素化水平,而表达USP48/C98A的293T细胞对GSDME的泛素化没有影响(图4E)。相反,敲低USP48会导致泛素化GSDME的积累(图4F)。作者还发现USP48影响GSDME中K48连接的泛素,但对K63连接的泛素化没有影响(图4G)。体外泛素化实验表明,泛素K48在K30、K120和K189位点使GSDME泛素化 (图4H和I)。接下来,为鉴定USP48修饰的GSDME的靶残基,在GSDME的K30、K120和K189位点构建相应的点突变体(图4J),结果显示,USP48在K120处抑制GSDME的K48连锁泛素化(图4K)。综上所述,USP48通过抑制GSDME K120位点的K48连锁泛素化来阻止GSDME的降解。
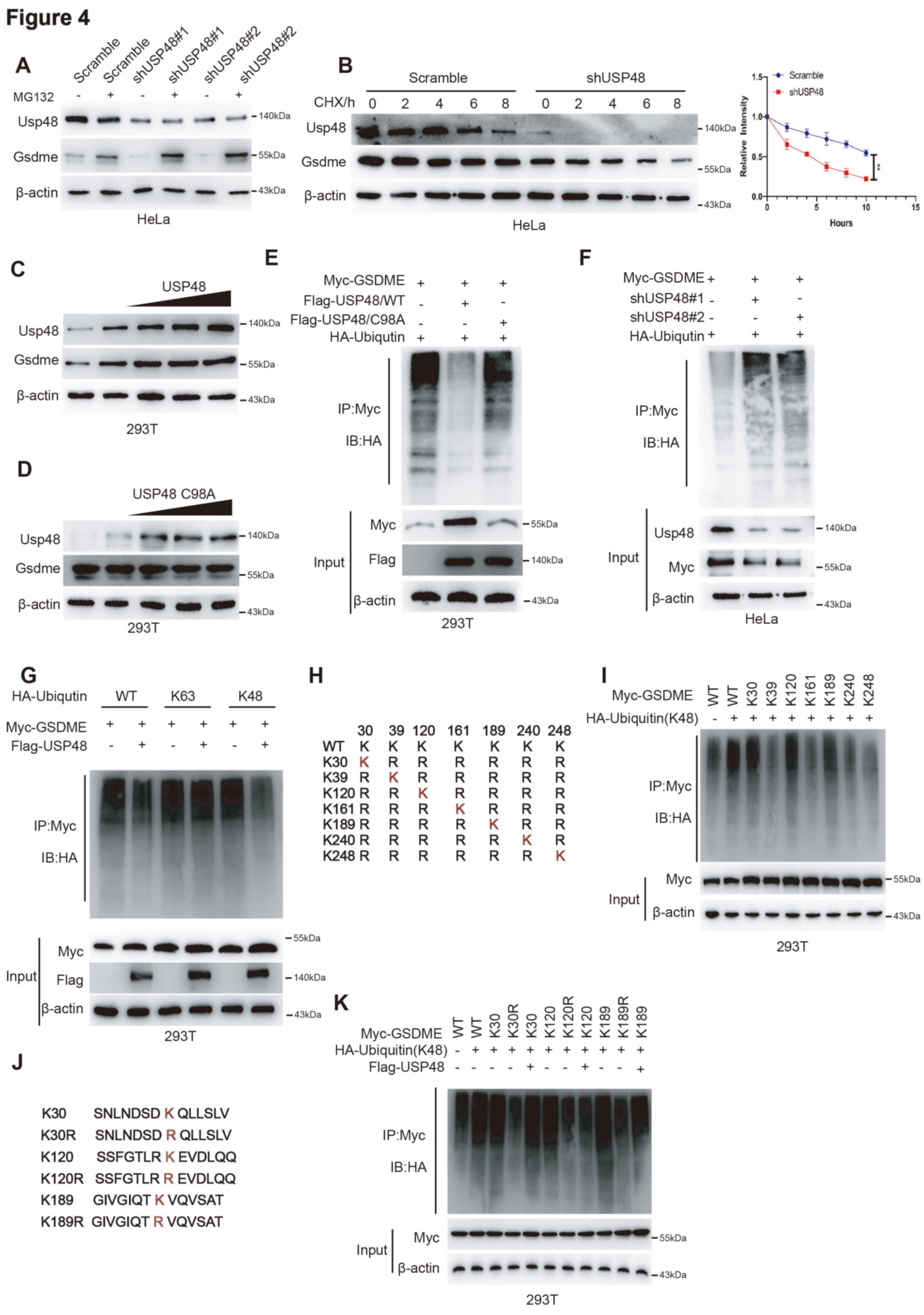
图4. USP48通过去泛素化抑制GSDME的降解
5. USP48通过调节GSDME的表达影响抗肿瘤免疫
为了进一步证明USP48的功能,建立USP48缺陷小鼠自发性胰腺肿瘤发生(KUC)模型。免疫组化和免疫荧光结果显示USP48的表达水平与GSDME的表达呈正相关(图5A-F)。此外,小鼠组织中USP48的缺失对GSDMD的表达也没有影响(图5G和H)。免疫荧光结果显示,KUC小鼠肿瘤浸润性CD8+和CD4+T细胞明显减少(图5I-J)。自然杀伤细胞和CD8+细胞毒性T杀伤细胞的比例明显降低,而肿瘤相关巨噬细胞和Treg细胞的比例则显著增加(图5K)。综上所述, USP48可以通过调节GSDME的表达来影响细胞的抗肿瘤免疫。

图5. USP48参与抗肿瘤免疫的调节
6. 单细胞测序实验阐明USP48对抗肿瘤免疫的调控作用
对KC和KUC小鼠的胰腺组织进行单细胞测序,所有细胞CD45基因(PTPRC)均呈阳性(图6A)。大小聚类算法显示KC和KUC小鼠胰腺肿瘤组织中的细胞分布(图6B)。将细胞分组,定义捕获TAM的5个细胞群,即树突状细胞(dc)、T细胞、单核细胞-1细胞和单核细胞-2细胞(图6C)。比较KC和KUC胰腺癌组织中细胞亚群的差异,发现USP48表达的下调显著增加了TAM和单核细-2的数量(图6D)。通过热图和点阵图 (图6E和F),得到KC和KUC胰腺癌组织中各细胞亚组的数量和比例(图6G)。对KC和KUC胰腺癌组织中的T细胞进行亚群分析(图7A)。结果发现, Tex细胞和Treg细胞在KUC胰腺癌组织中的比例显著增加,表明USP48表达的降低抑制肿瘤免疫的发生(图7B)。使用UMAP显示T细胞亚群分类标准标记基因的表达以及T细胞亚群在KC和KUC胰腺癌组织中的比例,进一步证实上述结果(图7C-D)。使用多色免疫荧光实验检测KC和KUC小鼠胰腺癌组织中Tex细胞和Treg细胞的分布,得到的结果与测序结果一致(图7E和F)。敲低USP48显著增加TAM亚群的比例(图7G和H)。多色免疫荧光实验证实USP48的缺失增加TAM在胰腺癌组织中的分布(图7I)。综上所述, USP48缺失抑制胰腺癌细胞的抗肿瘤免疫。
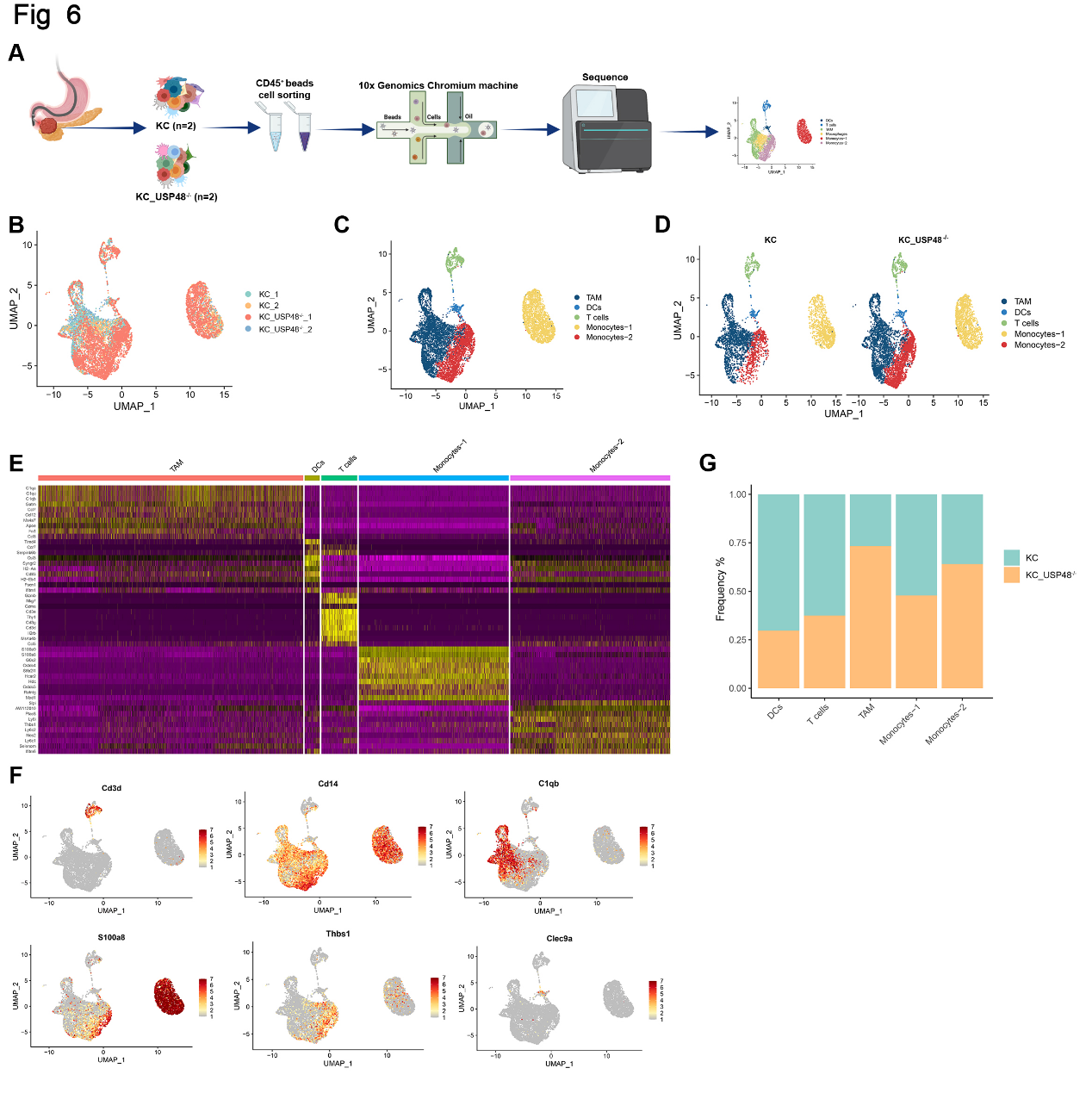
图6. 胰腺癌中KC和KC;USP48-/-CD45+细胞的单细胞分析

图7. 敲除USP48可增加浸润胰腺癌的去势T细胞、Treg和TAM的比例
7. USP48-GSDME调节小鼠对抗PD -1免疫治疗的敏感性
将过表达USP48的Pan02细胞或空载体皮下植入C57/B6小鼠。在第7天、第11天和第15天用抗aPD-1处理小鼠,连续观察小鼠的生长情况,并在第30天处死小鼠(图8A)。结果表明,过表达USP48可显著抑制小鼠体内肿瘤的生长,而过表达USP48突变体(USP48/C98A)对小鼠体内肿瘤生长无抑制作用。过表达USP48也显著提高小鼠对抗PD -1治疗的敏感性(图8B-E)。在过表达USP48的Pan02细胞中表达shGSDME或scramble,并皮下注射到C57/B6小鼠体内。与预期结果一致,在USP48过表达的Pan02小鼠中,敲低GSDME的表达可有效逆转USP48过表达对肿瘤生长的抑制作用和促进抗PD -1治疗的敏感性(图8F-I)。对小鼠肿瘤进行流式细胞术检测,结果与之前的结果一致 (图8J-K)。这些结果进一步证实USP48-GSDME通路在抗肿瘤免疫中的重要作用,并发现其在肿瘤免疫治疗中的关键调控作用。
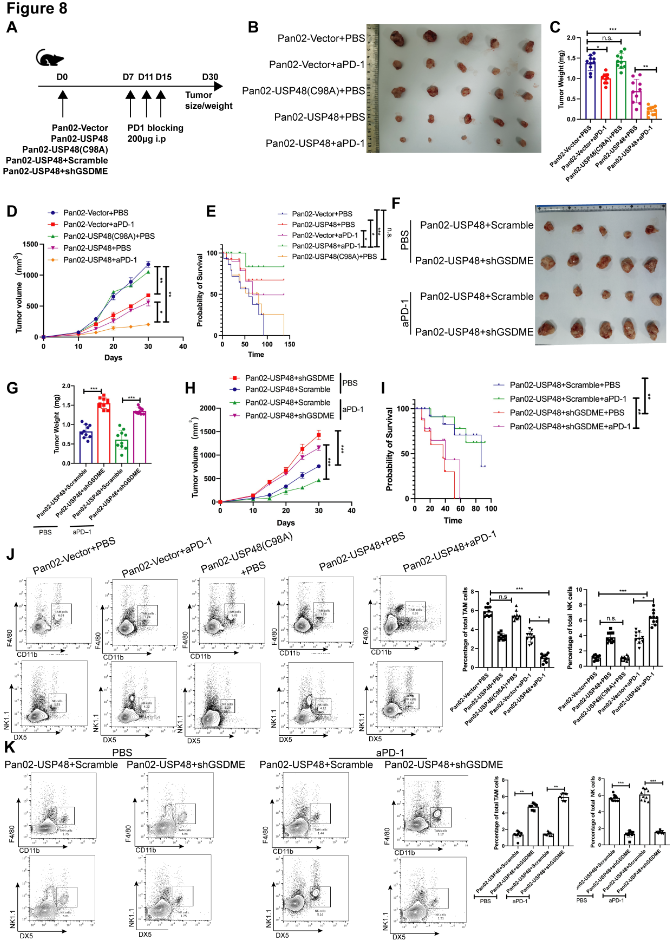
图8. USP48-GSDME影响小鼠对抗PD-1免疫疗法的敏感性
结论
综上所述,本研究确定了USP48对焦亡的关键调控作用,并阐明了其分子机制以及USP48在抗肿瘤免疫和免疫治疗中的作用。因此,特异性靶向USP48或USP48-GSDME轴可能是未来潜在的治疗策略。
实验方法
细胞培养,逆转录病毒转染, CRISPR敲除,免疫组化,多重免疫荧光,WB,Co-IP,体外泛素化实验,qRT-PCR,流式细胞术,SYTOX green 染色,LDH检测,IL-18和IL-1β检测,RNA-seq文库构建,肿瘤异种移植。
参考文献
Ren Y, Feng M, Hao X, Liu X, Li J, Li P, Gao J, Qi Q, Du L, Wang C, Wang Q, Wang Y. USP48 Stabilizes Gasdermin E to Promote Pyroptosis in Cancer. Cancer Res. 2023 Apr 4;83(7):1074-1093. doi: 10.1158/0008-5472.CAN-22-1812. PMID: 36607699.






