Nature子刊—干扰相分离促进抗肿瘤免疫

靶向PD-1/PD-L1轴的免疫疗法已成为多种癌症的一线治疗。然而,由于调控PD-1/PD-L1的难以捉摸的机制,只有有限的一部分个体实现了持久的益处。生物分子缩合物涉及广泛的生理过程,并且也已报道控制癌症相关的失调。详细研究生物分子冷凝物形成的机制可能为开发有效的靶向策略提供机会,因为肿瘤细胞中的靶向相分离过程有益于临床。本文首先通过质谱、CHIP和空间共定位的方法确定了KAT8与IRF1之间能发生相分离。同时,KAT8在K78处乙酰化IRF1以促进其DNA结合,这与H4 K16乙酰化协同作用以增强PD-L1 的表达。又基于KAT8-IRF1缩合物的形成机制,开发了一种细胞穿透阻断肽2142-R8,其能破坏KAT8-IRF1缩合物,抑制PD-L1的表达,增强体内和体外抗肿瘤免疫。
本文章于2023年3月发表于《Nature cancer》上,IF=22.7 。
技术路线














主要研究内容
1.KAT8能够调控PD-L1的转录
使用全基因组CRISPR-Cas9基因敲除筛选来鉴定IFNγ暴露后肿瘤细胞中PD-Ll表达的调节因子。发现了编码组蛋白乙酰转移酶KAT8的基因是我们筛选中最显著富集的基因之一(图1a,b)。KAT8敲低后在多个细胞系(骨肉瘤细胞系143B,恶性黑色素瘤细胞系A375和肺癌细胞系A549)PD-L1的总蛋白和mRNA水平显著降低(图1c,d)。更重要的是,野生型(WT)KAT8,而不是其C316S催化缺陷突变体,挽救了KAT8耗尽细胞中PD-Ll和H4 K16 ac的下调,表明KAT8的乙酰转移酶活性对于PD-L1表达的调节是关键的(图1e,f)。接下来,研究了KAT8耗竭导致的PD-L1表达下调是否影响抗肿瘤反应。体外细胞毒性测定显示耗尽KAT8显著增强T细胞杀伤(图1g)。在体内,KAT8耗竭抑制肿瘤生长并降低肿瘤重量(图1h,i)同时增加小鼠中CD3+ CD8+ T细胞的肿瘤浸润(图1j-m)。KAT8消耗不能进一步延缓用抗PD-1治疗的小鼠中的肿瘤生长(图1n,o)。此外,免疫组织化学(IHC),表明在人类癌症中KAT8和PD-L1之间存在正相关性(图1p)。

图1:KAT8在体内外调控PD-L1的转录
2.KAT8与IFR1相互作用并形成动态凝聚物
为了研究KAT8如何调节PD-L1 mRNA转录,我们应用邻近标记方法,通过引入TurboID-tagged KAT8进入A375细胞以标记潜在的相互作用蛋白。使用质谱法,我们鉴定IRF1为标记的蛋白质之一。通过内源和外源水平的免疫沉淀进一步证实了KAT8和IRF1之间的相互作用(图2b)。用单体增强型绿色荧光蛋白-KAT8(mEGFP-KAT8)和IRF1-mCherry转染的细胞在细胞核中显示小滴样凝聚物(图2c,左)。然而纯化的mEGFP-KAT8或IRF1-mCherry单独显示出液滴形成的弱能力,而将两者混合在一起显著增强液滴形成(图2c)。液滴形成不依赖于荧光蛋白标签也不依赖于KAT8乙酰转移酶活性(图2d)。此外,液滴能够随时间融合,并且在体外和细胞中在光漂白后部分恢复(光漂白后荧光恢复(FRAP))(图2e-g),这些液滴可被1,6-己二醇和高浓度NaCl破坏(图2h,i)。总之,这些结果表明KAT 8-IRF 1凝聚物的动态和可逆性质。超分辨率成像显示内源性KAT8和IRF1在细胞中形成小的凝聚物,并且观察到共定位的凝聚物(图2j-n)。此外,当两种蛋白质浓度高于75 nM时,KAT8-IRF1液滴在体外形成(图2o-q)。更重要的是,在来自患有癌症(肺癌、黑色素瘤、乳腺癌和胃癌)的个体的样品中,还观察到KAT8和IRF1缩合物,并且两种蛋白的荧光强度与PD-Ll表达呈正相关(图2r )。总之,这些结果表明KAT8和IRF1可以在体内和体外形成缩合物。

图2:KAT8与IRF1在体内外形成动态凝聚物
3.KAT8-IRF1的缩合依赖于多价互相作用
为了探索KAT8-IRF1缩合物的结构基础,使用IUPred 2分析了这两种蛋白质的氨基酸序列。将KAT8的氨基酸1-68(KAT81-68)和IRF1140-325(其包括反式激活结构域35)评分为IDR(图3a,b)。KAT81 -68或IRF11140 -325的耗尽破坏了冷凝物的形成(图3c,d),而不是预测的IRFl的IDR,负责KAT8相互作用(图3e)。IRF1 DBD(即IRF1115 -325片段)的缺失也损害了与KAT8的缩合物形成(图3c,d),表明IRF1的DBD介导与KAT8的相互作用,也是冷凝物形成所必需的。此外,将IRF11 -140与来自不相关转录因子MYC或OCT4的IDR融合恢复了与KAT8的缩合物形成,而单独来自MYC或OCT4的IDR构建体则不能(图1A)。3f)。光液滴测定还显示,当KAT8和IRFl IDR与Cry 2融合时,蓝光诱导增强了两种蛋白质的IDR之间的缩合物形成(图3g,h )。.总的来说,这些观察结果表明多价相互作用模型,其中IRF1 DBD和KAT8之间的相互作用可能是冷凝物引发的先决条件,并且IRF1和KAT8两者的IDR之间的弱混杂相互作用促进冷凝物形成。
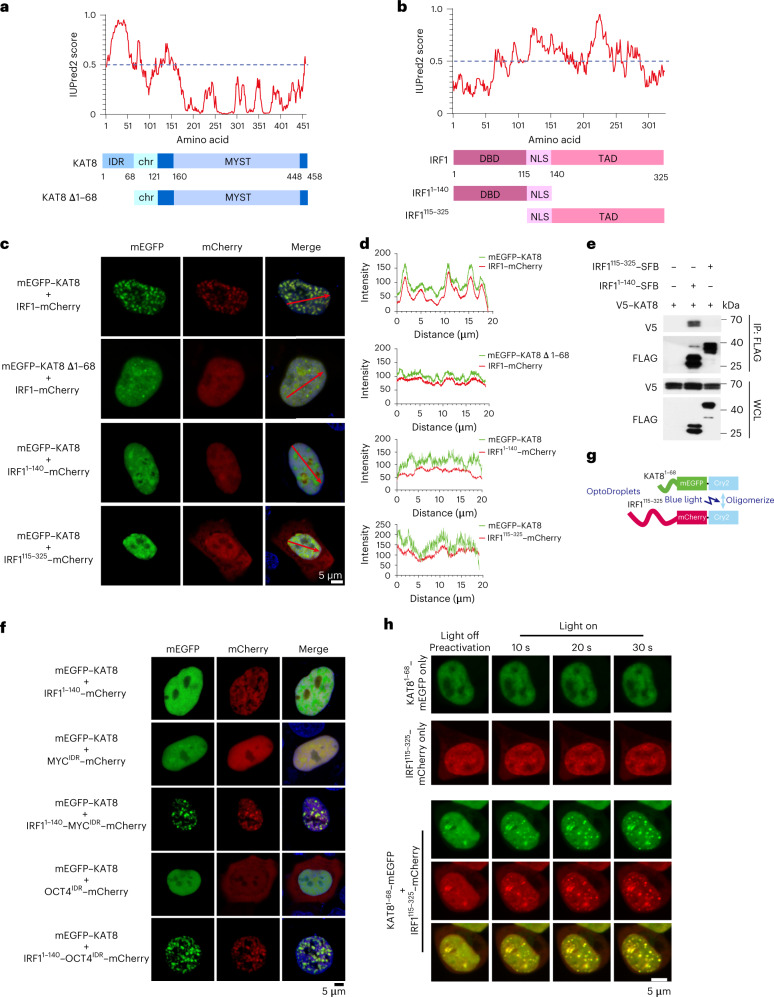
图3:KAT8-IRF1缩合中的多价相互作用
4.KAT8-IRF1缩合物促进PD-L1 mRNA反式激活
接下来,研究了KAT8-IRF 1缩合物是否可以增强转录。转录机器组分,包括MED 1 IDR、CDK7、CDK9、BRD4和在丝氨酸5处磷酸化的活性RNA聚合酶II(RNA Pol II-S5 P),在KAT8-IRF1缩合物中富集(4a,b)。为了测试IDR介导的KAT8-IRF 1缩合在转录增强中的作用,设计了雷帕霉素诱导的相互作用系统,以通过将KAT8 IDR或IRF1 IDR与FKBP 12或FRB-Gal4 DBD融合来解偶联结构化的IRF1 DBD-KAT8相互作用和混杂的IDR相互作用。雷帕霉素处理后,用KAT8 IDR-FKBP12和IRF1 IDR-FRB-Gal4 DBD共转染的细胞在细胞核中显示小的凝聚物(图4c),表明该系统可以模拟由KAT8和IRF1 IDR相互作用引起的冷凝。然后,使用Gal4上游活化位点(UAS)报告基因测定评估了IDR缩合的反式激活作用(图4d)。IRF1 IDR-FRB-Gal4 DBD的转染增加了报告基因表达,而无IDR对照和KAT8 IDR-FKBP12显示无活性,并且雷帕霉素诱导不能进一步增强报告基因表达。用KAT 8 IDR-FKBP12和IRF1 IDR-FRB-Gal4 DBD共转染的细胞显示出与在不存在雷帕霉素的情况下仅用IRF1 IDR-FRB-Gal 4 DBD转染的细胞相似的报道基因表达水平,而报道基因表达在雷帕霉素处理后显著增强(图4 e)。此外,雷帕霉素剂量-反应曲线在KAT8 IDR-FKBP12和IRF1 IDR-FRB-Gal4 DBD稳定整合的UAS报告细胞中显示非线性活化模式(图4f)。这些结果表明IDR介导的KAT8-IRF1缩合促进反式激活。此外,在进行dCas 9-SunTag-sgARRAY介导的原位标记之后,观察到内源性KAT8和IRF1在细胞中的PD-Ll启动子处形成缩合物(图4g-k)。总之,KAT8-IRF1缩合物促进PD-L1 mRNA反式激活。

图4:KAT8-IRF1缩合物促进PD-L1 mRNA反式激活
5.KAT8乙酰化并促进IRF1的活性
接下来,测试了KAT8是否可以乙酰化IRF1。WT KAT8(但不包括其催化缺陷型C316S突变体)与IRF1的共转染显著增强了其乙酰化(图5a)。.在应用针对乙酰化IRF1K78(K78ac)的特异性抗体后,通过体内和体外乙酰化测定进一步证实了WT KAT8而不是C316S突变体对IRF1K78的直接催化活性(K78ac)(图5b,c)。更重要的是,耗尽KAT8导致内源IRFl在K78处的乙酰化降低(图5d)。总之,这些数据表明KAT8特异性乙酰化IRF1K78。为了探索KAT8-IRF1缩合是否促进IRF1K78ac,进行有或没有液滴形成的体外组蛋白乙酰转移酶活性测定。IRF1K78ac在液滴中显著增加(图5e,f),并且液滴中的KAT8的乙酰化能力比本体中的高约39.67 ± 1.997倍(图5g)。这些结果提供了KAT8通过共缩合促进IRFl乙酰化的证据。接下来,评估了IRF1 K78ac对PD-L1表达的影响。IRF1 K78R突变体未能上调PD-L1表达,并且在PD-L1启动子处显示出降低的丰度(图5 h)。这些结果表明K78处的乙酰化对于IRFl的DNA结合是重要的。与这些数据一致,通过sgRNA处理消除KAT 8显著降低IRFl在PD-Ll启动子处的丰度(图5i,j)。K78 R细胞表现出PD-Ll mRNA和蛋白质表达的显著降低(图5 k)。IRF1在PD-Ll启动子处的丰度在经受IFNγ处理的K78R细胞中也显著降低(图5l)。同样,由KAT8-IRF1 K78R形成的细胞内缩合物显示出大的不规则和较低动态的簇,而不与RNA Pol II-SSP共定位(图5m,n)。尽管K78 R突变体在体外显示出与KAT8相互作用和共缩合的类似能力(图5 o,p)。与WT液滴相比,由KAT8-IRF1 K78R形成的液滴显示来源于PD-L1启动子的DNA探针的募集显著减少(图5o)。总之,这些结果表明KAT8在K78处乙酰化IRF1,这增强了IRF1的DNA结合活性及其对PD-L1启动子的定位和随后的PD-L1 mRNA转录的激活。
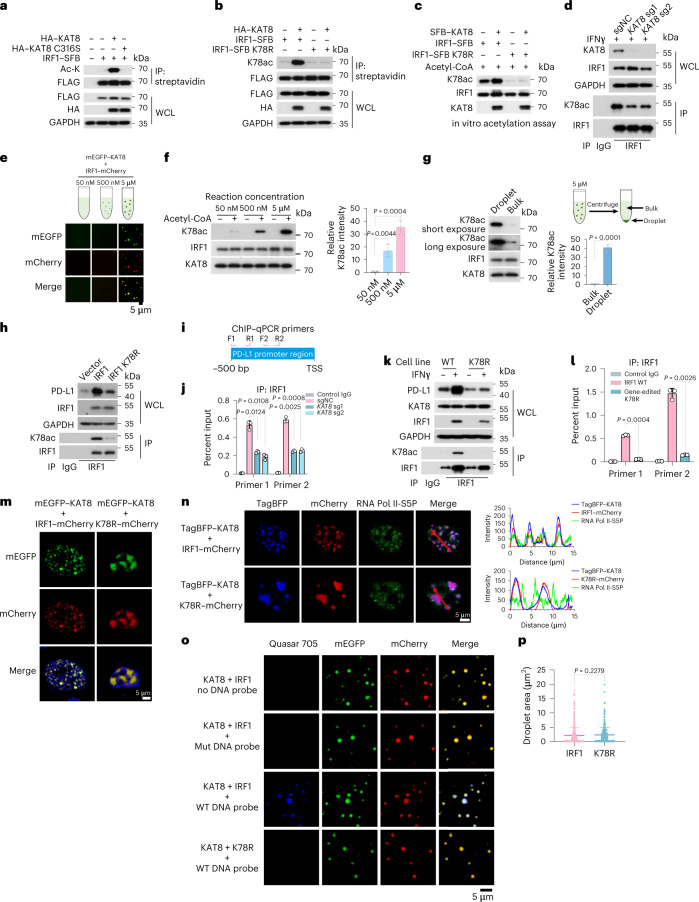
图5:KAT8乙酰化并促进IRF1的活性
6.IRF 1乙酰化将KAT 8募集至PD-L1启动子
KAT8是哺乳动物细胞中H4K16ac所需的主要乙酰转移酶,研究KAT 8是否调节PD-Ll启动子中的H4K16ac。KAT 8敲低细胞显示出H4K16ac的总体减少,而其他H4乙酰化位点(H4K5ac、H4K8ac和H4K12ac)保持不受影响(图6a)。来自ENCODE数据库的染色质免疫沉淀测序(ChIP-seq)数据显示KAT 8和IRF 1在PD-L1的启动子区域富集(图6 b)。ChIP-qPCR显示,当KAT 8表达被sgRNA耗尽时,PD-L1启动子处的H4K16ac也显著降低(图6c)。鉴于KAT8和IRF1的共缩合,评估了IRF1是否进而增强响应IFNγ的PD-L1启动子处的KAT 8募集。具有IRFl耗竭的细胞在IFNγ处理后具有PD-Ll启动子处的KAT 8和H4 K16 ac的丰度显著降低(图6d,e)。此外,K78R细胞在IFNγ暴露后还显示出降低的KAT8定位和PD-Ll启动子处的H4K16ac(图6 f,g),表明IRF 1乙酰化增强PD-L1启动子处的KAT 8募集和H4K16ac修饰作为正反馈。
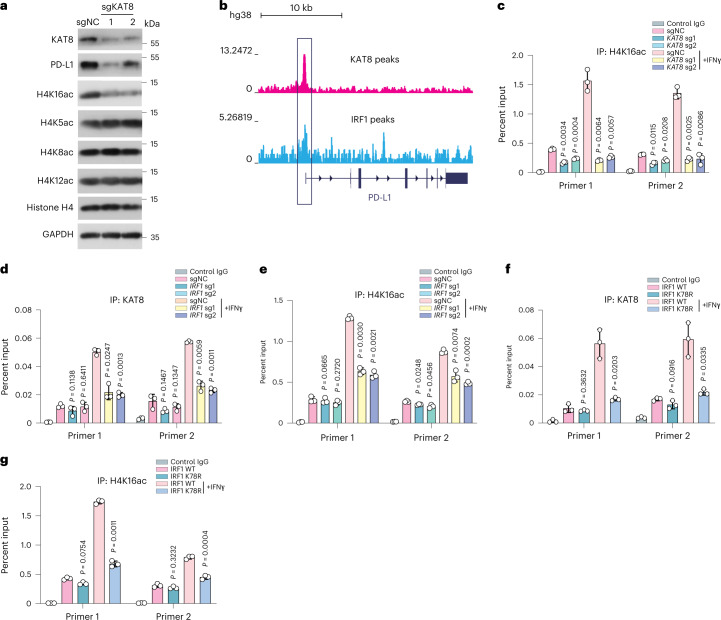
图6:IRF 1乙酰化将KAT 8募集至PD-L1启动子
7.破坏KAT 8-IRF 1缩合物抑制PD-L1表达
IRF1 DBD和KAT8之间的结构化结构域相互作用在缩合物形成中的重要作用,表明靶向结构化结构域相互作用也可能破坏KAT8-IRF1缩合物,而不是靶向非结构化IDR。为了测试该假设,构建了一系列IRF1 DBD截断(图7a)并各自在细胞中与KAT8共转染以鉴定负责与KAT8相互作用的IRF1的最小区域。然后将人和小鼠中的完全保守的N-末端区域鉴定为负责IRF1-KAT 8相互作用的主要区域(图7 b-d),并且预测的β-片层的关键残基47、48(Mut)的突变消除了相互作用(图7c-f)。接下来,合成了两种肽,2142-R8和Mut-R8,其衍生自2142和Mut,其中8个精氨酸残基融合到它们的C末端(R8)。为了评估2142-R8在细胞中的生理条件下对KAT8-IRF 1缩合物的破坏能力,使用具有V5-TurboID标记的KAT 8的邻近标记系统(图2a)。在用2142-R8处理细胞后,生物素标记的IRF1的水平显著降低(图7 g),表明细胞中IRF 1和KAT 8之间的相互作用被抑制。因此,IRF1 K78的乙酰化被抑制,并且PD-L1启动子处的H4K16ac减少(图7h,i)。同样,在细胞中和体外2142-R8处理后,KAT 8-IRF 1缩合物减少(图7j,k)。最重要的是,2142-R8有效地抑制了用IFNγ处理的细胞中PD-Ll表达的上调(图7l,m)。此外,RNA测序分析显示,2142-R8处理下调PD-Ll,而主要组织相容性复合物I类(MHCI类)相关基因和大多数IRFl下游的表达保持不变,这与来自KAT 8耗尽细胞的数据一致(图7 n,o)。总之,这些结果表明了2142-R8破坏KAT 8-IRF 1缩合物抑制PD-L1表达。

图7:2142-R8破坏KAT 8-IRF 1缩合物抑制PD-L1表达
8.2142-R8肽增强抗肿瘤免疫
评估2142-R8在增强抗肿瘤免疫中的功效,体外细胞毒性测定显示2142-R8而非Mut-R8增强T细胞杀伤(图8a)。在体内,用2142-R8而不是Mut-R8处理减少了荷瘤小鼠中KAT 8-IRF1斑点的共定位、肿瘤体积和肿瘤重量(图8b-e)。同样,肿瘤PD-Ll表达降低,并且活性CD8 + T细胞的浸润通过2142-R8而不是Mut-R8增加(图8f-l)。总之,这些结果说明2142-R8肽抑制PD-L1表达并增强体内抗肿瘤免疫。

图8:2142-R8肽增强抗肿瘤免疫
结论
越来越多的证据表明生物分子缩合物在调节癌症发展,这表明靶向这一过程可能是有希望的。这篇文章在KAT8-IRF1缩合物的背景下,证明了IRF1 DBD和KAT8之间的特定结构化相互作用是缩合物引发的先决条件,而IRF1和KAT8 IDR的弱混杂相互作用促进缩合物形成。基于这种机制,鉴定了2142-R8肽,其可以阻断IRF1 DBD和KAT8相互作用并破坏KAT8-IRF1缩合物的形成,随后抑制PD-L1表达和增强体外和体内抗肿瘤免疫。总之,这些的数据表明,抑制癌症相关冷凝物的形成可能是一种潜在的癌症治疗策略。
实验方法
构建质粒,免疫共沉淀实验,共转染实验,细胞免疫荧光实验,组织IHC和荧光IHC,体外乙酰化测定,液滴和大量样品的乙酰化,体外毒性试验,肽下拉实验,蛋白表达和纯化实验,相分离实验,optoDroplets实验,Gal 4-UAS-mEGFP报告基因实验,质谱,邻近标记分析,流式细胞术,dCas9-SunTag PD-L1启动子可视化,全基因组CRISPR-Cas9基因敲除筛选,RNA测序和分析流水线,westernblot,RT-qPCR,体内成瘤实验,荧光漂白恢复实验。
参考文献
Wu, Y., Zhou, L., Zou, Y., Zhang, Y., Zhang, M., Xu, L., Zheng, L., He, W., Yu, K., Li, T., Zhang, X., Chen, Z., Zhang, R., Zhou, P., Zhang, N., Zheng, L., & Kang, T. (2023). Disrupting the phase separation of KAT8-IRF1 diminishes PD-L1 expression and promotes antitumor immunity. Nature cancer, 4(3), 382–400. https://doi.org/10.1038/s43018-023-00522-1






