可变剪接介导新circRNA生物发生揭示KRAS突变介导的胰腺癌淋巴转移

在约90%的胰腺导管癌癌(PDAC)患者中鉴定出KRAS突变,并且KRASG12D是PDAC中最常见的等位基因。靶向KRASG12D突变的基因疗法在转移性PDAC中实现了70%的消退,表明靶向KRASG12D在转移性PDAC中的治疗潜力。本文找到了一个新的circRNA,其在KRASG12DPDAC中上调,并且与KRASG12D PDAC淋巴结(LN)转移正相关。在机制上,KRASG12D PDAC中的circARFGEF生物发生被选择性剪接因子QKI-5显著激活,促进了circARFGEF生物发生。并探讨了circARFGEF海绵化miR-1205并促进JAK 2的活化,JAK2将STAT3磷酸化触发KRASG12D PDAC淋巴管生成和LN转移。本文于2023年6月,发表于《Cancer Research》上,IF=11.2。




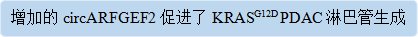










1.circARFGEF在LN转移的KRASG12DPDAC中高表达
为了研究circRNA是否参与KRASG12D驱动的LN转移,在3个配对的PDAC组织和9个正常的邻近组织(NAT)(GSE234760)中进行了二代测序,发现了circARFGEF2在KRASG12D PDAC组织中最显著上调,与具有其他KRAS亚型的PDAC组织相比(KRASG12C、KRASG12V、KRASWT)(图1A和B)。此外,circARFGEF2 在LN阳性KRASG12D PDAC 患者或具有高度病理性肿瘤淋巴结转移(TNM)阶段的患者中过表达,并且与原发性肿瘤相比,转移性LN具有更高的circARFGEF2 表达(图1C和D)。原位杂交(ISH)和免疫荧光分析显示,circARFGEF2过表达伴随着KRASG12DPDAC组织中的微淋巴管密度(MLD)增加(图1 E和F)。此外,荧光原位杂交(FISH)揭示了在LN阳性KRASG12D PDAC组织中的circARFGEF2富集,与LN阴性相比(图1G和H),表明circARFGEF 2与KRASG12D PDAC的LN转移正相关。Kaplan-Meier存活分析表明,在患有KRASG12D PDAC的患者中,circARFGEF2过表达与总存活(OS)和无病存活(DFS)呈负相关(图1 I和J)。此外,在使用互补DNA(cDNA)而不是基因组DNA(gDNA)作为模板的PCR产物中检测到circARFGEF 2(图1 K)。与ARFGEF2 mRNA相比,circARFGEF2表现出对RNaseR的更强抗性,而Actinomycin D测定表明circARFGEF2具有比ARFGEF2 mRNA更长的半衰期(图1 M和N)。总之,这些发现证明circARFGEF2在KRASG12D PDAC患者中高表达且具有高度稳定的结构。
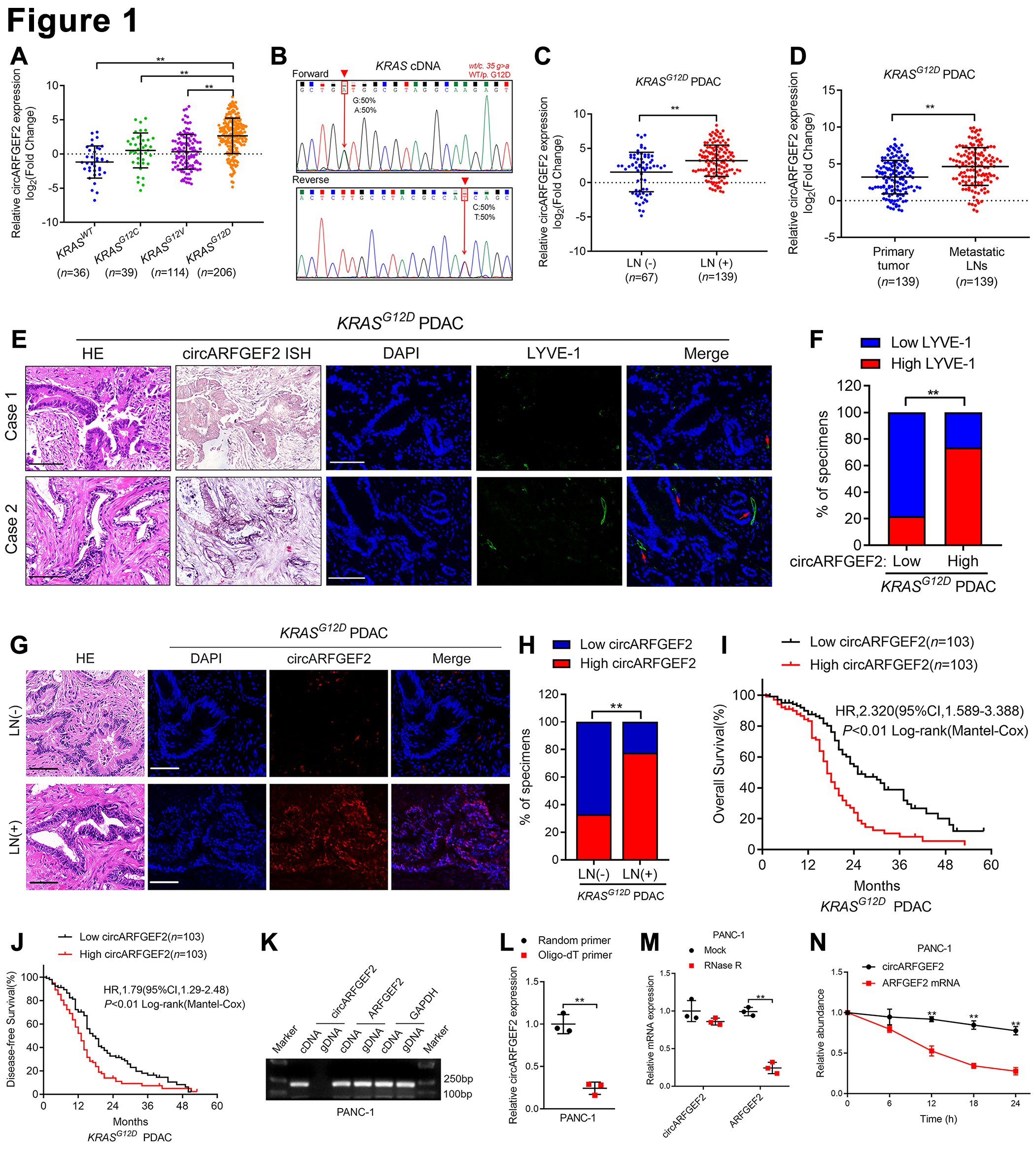
图1:circARFGEF2在LN转移的KRASG12D PDAC患者
2.QKI-5与circARFGEF2结合加速在circARFGEF2在LN转移的KRASG12DPDAC中的生物合成
用circRNA构建了6个双色荧光报告子给予IRES介导的GFP翻译,并将线性mRNA用mCherry标记以同时定量ARFGER2前体mRNA的线性和circRNA 剪接(图2A)。在PANC-1细胞中应用KRASG12D抑制剂MRTX1133或KRASG12D siRNA后,由HA-mCherry表达指示的线性ARFGEF2增加,并且由FLAG-GFP表达指示的circARFGEF2形成以及GFP-mCherry比率显著减少。而在Mia PaCa-2(KRASG12C)和BxPC-3(KRASWT)细胞中应用MRTX1133后未观察到明显变化(图2B-D)。已经证明了QKI在circRNA生物发生中的关键作用。因此,在3对KRASG12D PDAC组织和NAT中进行二代测序以评估QKI是否调节KRASG 12D PDAC中的circARFGEF2生物发生,并确定QKI在KRASG12D PDAC组织中上调(GSE 234927)(图2E)。双色荧光报告基因测定显示,下调QKI表达的显著降低了GFP-mCherry比率(图 2F和G),表明QKI是circARFGEF2生物发生所需的。双色荧光报告测定和蛋白质印迹测定,并揭示降低QKI-5表达显著降低FLAG-GFP表达,同时增加HA-mCherry表达(图2H)。前体mRNA选择性剪接通常由剪接体催化,剪接体的组装与相关的蛋白辅因子相伴逐步发生。免疫共沉淀(Co-IP)测定,随后质谱(MS)和蛋白质印迹鉴定出QKI-5与U2辅助因11(U2AF35)相互作用,直接触发剪接体组装以刺激剪接的U2AF亚基(图2 I和J)。此外,降低U2AF35表达显著阻碍QKI-5诱导的circARFGEF2生物发生(图2K和L)。上述结果表明QKI-5募集U2AF35来调节ARFGEF2前体mRNA剪接,并促进circARFGEF2生物合成。为了证实ARFGEF2前mRNA上的精确QKI-5结合位点,我们用内含子3和6的截短序列进行了下拉测定,其揭示了QKI-5特别富集内含子31000-1200 nt和内含子67600-7800 nt(图2 M和N)。内含子31128-1180 nt和内含子 67672-7740 nt的突变损害QKI-5和ARFGEF前mRNA结合,表明QKI-5 直接结合这两个ARFGEF2前mRNA区域(图2 O和P)。此外,我们评估了QKI-5和ARFGEF2前mRNA之间的相互作用是否影响PDAC中的circARFGE 2产生。CRISPR/Cas9介导的ARFGEF2前mRNA中内含子31128-1180 nt和内含子67672-7740 nt的敲除显著降低了QKI-5介导的circARFGEF2过表达(图2Q)。总之,我们的结果证明QKI-5募集U2AF35并结合内含子31128-1180 nt和67672-7740 nt的转录水平,以促进circARFGEF 2剪接(图2R)。
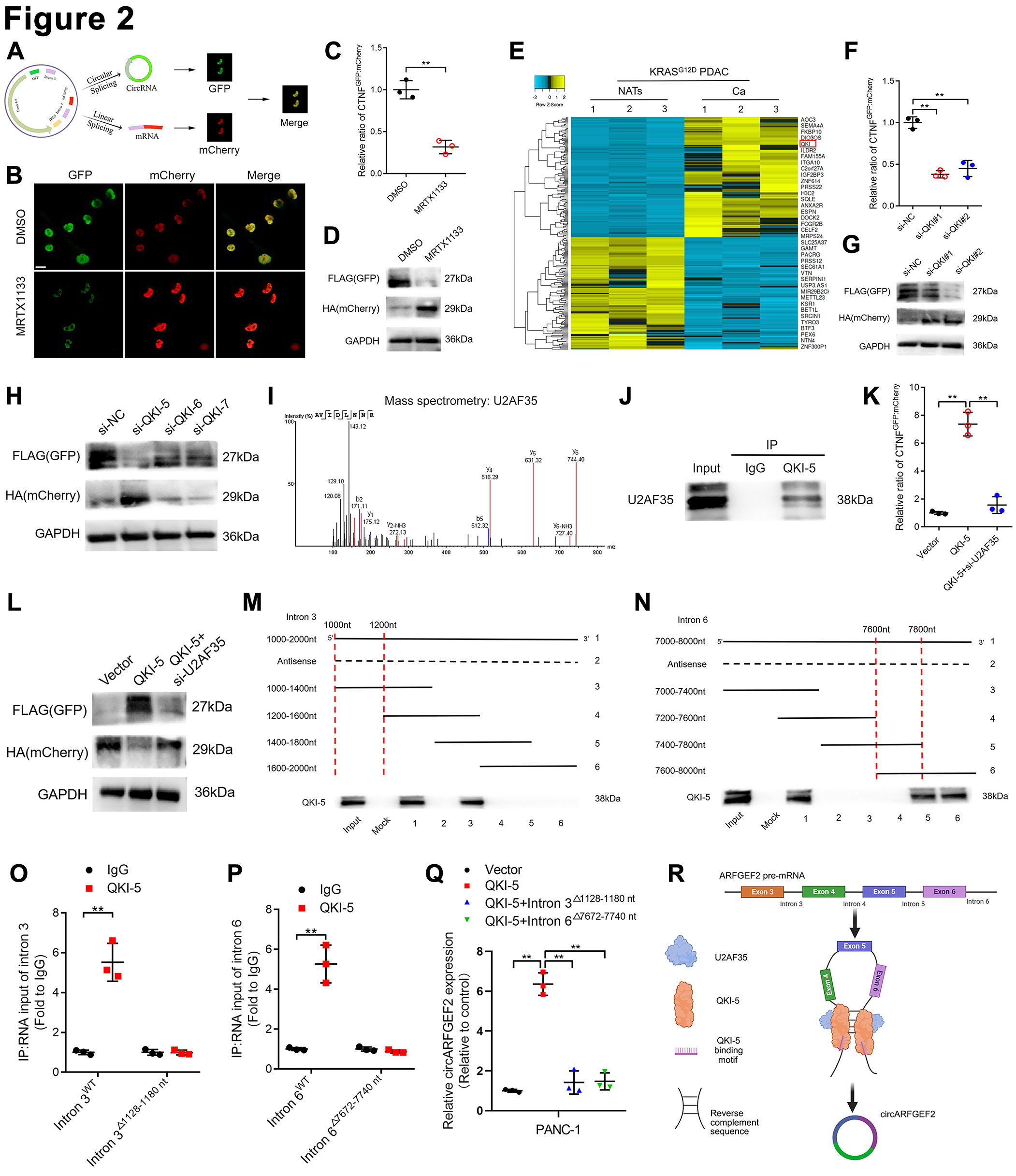
图2:QKI亚群结合至circARFGEF2剪接外显子的侧翼内含子,并加速KRASG12D PDAC中的circARFGEF2生物合成
3.增加circARFGEF2生物合成促进KRASG12D PDACLN转移
circARFGEF2在KRASG12D PDAC细胞中下调抑制HLEC管形成和迀移能力,而circARFGEF2过表达促进KRASG12D PDAC细胞诱导的HLEC管形成和迀移(图3A和B)。进一步评估QKI-5是否调节KRASG12D PDAC中的circARFGEF 2诱导的管形成和迀移,并且证明QKI-5过表达增强HLEC管形成和迀移能力,而下调circARFGEF2表达抑制QKI-5诱导的HLEC的淋巴管生成(图3C)。QKI-5过表达显著促进了KRASG12D PDAC细胞的LN转移,而下调circARFGEF2的明显逆转了这种作用(图3D)。原发性肿瘤的免疫组织化学(IHC)分析表明,降低circARFGEF2表达逆转了由QKI-5上调诱导的MLD的增加(图3E)。使用正电子发射断层扫描-计算机断层扫描18(PET-CT)扫描来评估裸鼠的原位致瘤性,发现QKI-5促进KRASG12D PDAC细胞的原位致瘤性,而当circARFGEF2下调时,这种作用受到阻碍(图3F)。IHC结果显示,QKI-5可显著促进癌细胞向胰周淋巴结转移,增加胰腺移植瘤模型中转移淋巴结的数量,同时降低circARFGEF 2的表达可以逆转这种效应(图3G)。综上所述,上述结果表明QKI-5介导的circARFGEF2促进体外KRASG12D PDAC淋巴管生成以及体内KRASG12D PDAC LN转移。
图3:QKI-5介导的circARFGEF2促进体外KRASG12D PDAC淋巴管生成以及体内KRASG12D PDAC LN转移
4.circARFGEF2海绵化KRASG12D PDAC中的miR-1205
研究circARFGEF2诱导KRASG12D PDAC LN转移的机制。首先确定了circARFGEF2主要位于KRASG12D PDAC细胞的细胞质中(图4A和4 B)。
通过数据库预测和验证发现这些miRNA中,miR-1205最特异地在KRASG12D PDAC细胞系中过表达,而不是具有其他KRAS亚型的PDAC细胞系中过表达。RNA下拉测定揭示,与Oligo探针相比,在KRASG12D PDAC细胞而不是KRASWT PDAC细胞中,miR-1205被circARFGEF 2探针显著富集(图4C)。circARFGEF 2和miR-1205 序列的分析揭示了反向互补序列的存在(图4D)。双荧光素酶报告基因测定揭示miR-1205显著降低circARFGEF2组的荧光素酶活性,而反向互补序列的突变削弱了这种作用(图4 E),表明circARFGEF 2通过特异性序列海绵化miR-1205。此外,FISH测定证明circARFGEF2和miR-1205共定位在KRASG 12D PDAC细胞的细胞质中(图4F),表明 circARFGEF2和miR-1205之间的相互作用。体外实验表明,过表达circARFGEF2的触发HLEC管形成和迀移,而过表达miR-1205的明显逆转了这种作用(图4G)。综上所述,结果表明circARFGEF2在KRASG12D PDAC细胞中充当miR-1205海绵。
KEGG通路分析揭示JAK-STAT途径是与circARFGEF2相关的最显著富集的通路(图4H)。JAK代表用于激活JAK-STAT途径的核心组分,并且由JAK 1、JAK 2、JAK 3和TYK 2组成。随后,检测了JAK亚型的表达谱,发现JAK 2与KRASG12D PDAC细胞中circARFGEF 2的表达正相关(图4I)。此外,miR-1205与KRASG12D PDAC细胞中的JAK2表达负相关(图4J和K)。双荧光素酶报告基因测定表明,miR-1205明显降低JAK2 3′UTR荧光素酶构建体中的荧光素酶活性,而不是miR-1205结合位点中的突变序列(图4L)。miR-1205过表达明显抑制circARFGEF2诱导的JAK2表达,这表明 circARFGEF2充当miR-1205海绵以增加JAK2表达(图4 M和N)。WB显示circARFGEF2过表达促进JAK2表达和STAT 3磷酸化(图4O),而circARFGEF2下调降低JAK2表达并抑制STAT 3磷酸化(图4P)。
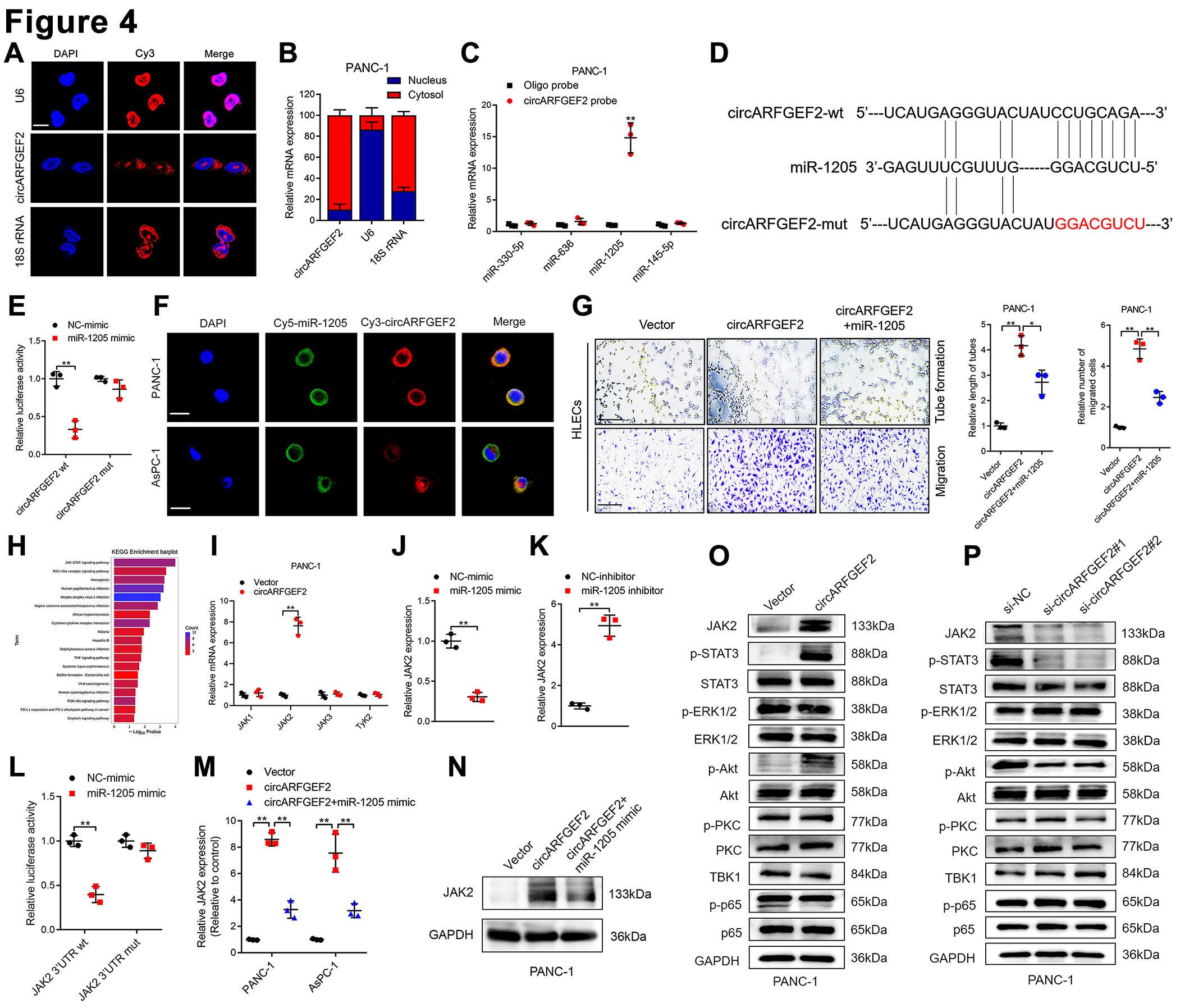
图4:circARFGEF2海绵化KRASG12D PDAC中的miR-1205并激活KRASG12D PDAC中的JAK2-STAT3信号通路
5.JAK2-STAT3通路阻断抑制circARFGEF 2诱导的KPC小鼠LN转移
circARFGEF2过表达显著促进HLEC管形成和迀移能力,而JAK2-STAT3通路抑制剂WP1066显著逆转该作用(图5A和B)。此外,体内实验证明,与对照裸小鼠相比,circARFGEF2过表达裸小鼠具有更大的膝弯淋巴结转移瘤,并且WP1066显著阻碍circARFGEF2诱导的LN转移(图5C和D)。IHC分析显示,circARFGEF2过表达促进膝弯LN的转移,增加足垫肿瘤中的MLD,而抑制JAK 2-STAT3通路逆转了这些作用(图5E和F)。这些结果表明,circARFGEF2 通过JAK2-STAT3通路促进KRASG12D PDAC中的淋巴管生成和LN转移。为了更好地理解circARFGEF2在体内KRASG12D PDAC LN转移中的作用,使用工程化的转基因KrasG12D/+ Trp 53 R172 H/+Pdx-1-Cre(KPC)小鼠模型。结果表明circARFGEF2过表达显著增加了原发性PDAC肿瘤体积,并且抑制JAK2-STAT3信号通路则逆转了这种作用(图6A和B)。此外, circARFGEF2过表达显著增加了KPC小鼠中转移性腹部LN的数量和原发性PDAC肿瘤中的MLD,而阻断 JAK 2-STAT 3信号传导途径阻碍了这些作用(图6C和D)。这些结果表明,阻断JAK2-STAT3通路对CircARFGEF2诱导的KRASG12D PDAC的淋巴管生成和LN转移表现出抑制作用。
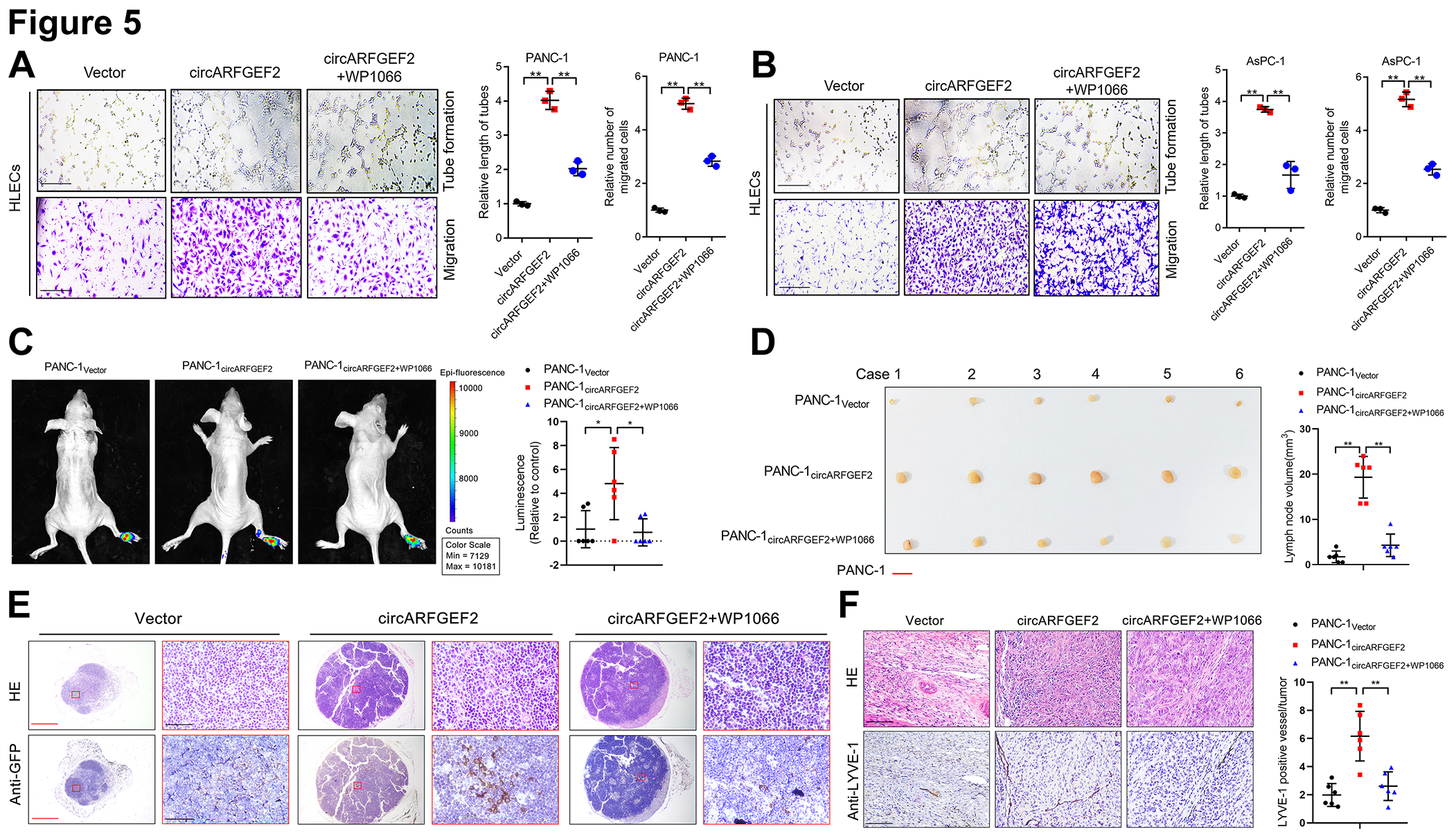

图5:JAK2-STAT3通路阻断抑制circARFGEF 2诱导的KPC小鼠LN转移
6.KRASG12D PDAC患者中QKI-5-circARFGEF 2-JAK 2轴的临床相关性
评估 QKI-5介导的circARFGEF2-miR-1205-JAK2轴在患有KRASG12D PDAC的患者中的临床意义。结果表明,与NAT相比,miR-1205在KRASG 12D PDAC组织中下调,并且circARFGEF2、QKI-5、JAK2在KRASG12D PDAC组织中上调(图6 E和F)。此外,miR-1205与LN转移负相关,而circARFGEF 2、QKI-5和JAK2在LN转移性KRASG12D PDAC组织中显著上调(图6 G和H)。IHC分析显示,QKI-5和JAK2与KRASG12D PDAC组织中的circARFGEF2表达正相关(图6 I-K)。相关性分析揭示JAK2与miR-1205表达负相关,而与QKI-5表达正相关,并且在circARFGEF2和miR-1205表达之间观察到负相关(图6L和M)。总之,这些研究结果表明,来源于QKI-5依赖性剪接的circARFGEF2海绵化miR-1205并激活JAK2-STAT3信号传导通路以诱导KRASG12D PDAC LN转移。

图6:KRASG12D PDAC患者中QKI-5-circARFGEF 2-JAK 2轴的临床相关性
结论
总之,本文提出了KRASG12D突变驱动的 circARFGEF2生物合成的新机制,其经由QKI-5依赖性剪接介导miR-1205-JAK2-STAT3轴以触发PDAC LN转移。抑制circARFGEF2表达或JAK2-STAT3通路显著阻碍了KPC模型中的肿瘤生长。这些发现使得能够对PDAC LN转移中的调节机制有新的理解,表明circARFGEF2是KRASG12D PDAC中的潜在治疗靶标。
实验方法
临床样本收集,RNA测序和数据分析,免疫组化,膝弯淋巴结转移模型,体外移植瘤模型, KrasG12D/+Trp53R172H/+Pdx-1-Cre (KPC)小鼠注射AVV载体,质粒和siRNA转染,CRISPR/Cas9介导的基因敲除,荧光原位杂交实验,琼脂糖凝胶电泳,RNase R消化和Actinomycin D处理实验,RNA下拉实验,Transwell,管形成实验,5-EDU实验,双荧光素酶实验,WB,RT-qPCR,亚细胞分离试验。
参考文献
Kong, Y., Luo, Y., Zheng, S., Yang, J., Zhang, D., Zhao, Y., Zheng, H., An, M., Lin, Y., Ai, L., Diao, X., Lin, Q., Chen, C., & Chen, R. (2023). Mutant KRAS mediates circARFGEF2 biogenesis to promote lymphatic metastasis of pancreatic ductal adenocarcinoma. Cancer research, CAN-22-3997. Advance online publication. https://doi.org/10.1158/0008-5472.CAN-22-3997






