METTL16促进糖酵解代谢重编程和结直肠癌进展
糖酵解是癌症的关键标志,维持恶性肿瘤的发生和发展。m6A修饰在糖酵解中的作用在很大程度上是未知的。本研究探讨了m6A甲基转移酶METTL16在糖酵解代谢中的生物学功能,揭示了结直肠癌(CRC)进展的新机制。研究发现,SOGA1是METTL16的直接下游靶点,参与METTL16介导的糖酵解和CRC进展。METTL16通过结合IGF2BP1显著增强SOGA1的表达和mRNA的稳定性。随后,SOGA1促进AMPK复合体泛素化,抑制其表达和磷酸化,从而上调PDK4。此外,YY1可以通过直接结合METTL16的启动子,通过转录抑制其在CRC细胞中的表达。临床资料显示,METTL16表达与SOGA1、PDK4呈正相关,与结直肠癌患者预后不良有关。我们的研究结果表明METTL16/SOGA1/PDK4轴可能是CRC的有希望的治疗靶点。本文于2023年6月发表于“Journal of Experimental & Clinical Cancer Research”(IF=11.3)上。
技术路线

结果
1)METTL16过表达与结直肠癌患者预后不良相关
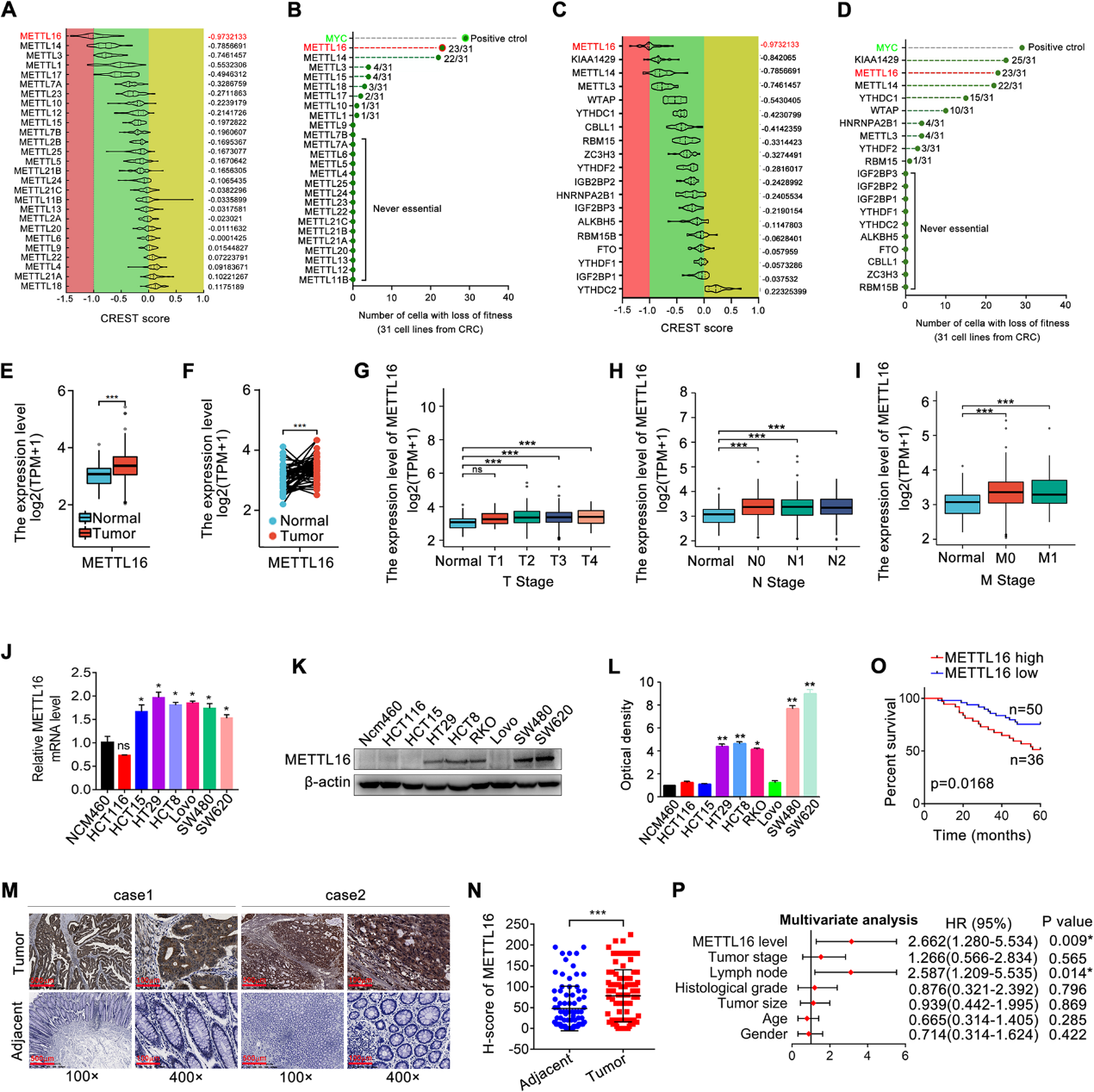
通过对数据集的分析,我们发现在METTL家族成员中,METTL16是CRC细胞存活最重要的基因(图1A, B)。重要的是,在m6A的主要调控因子中,METTL16也在CRC的存活中显示出重要作用(图1C, D),说明其在CRC中的功能意义。TCGA和GEO数据库显示,与正常组织相比,METTL16在结直肠癌组织中显著上调(图1E、F)。此外,TGGA数据显示与METTL16表达和CRC的临床病理变量相关。如图1G-I所示,METTL16表达升高与肿瘤大小、淋巴结转移、远处转移及临床分期分级显著相关。METTL16 mRNA在结直肠癌细胞系中的表达也高于正常结肠上皮细胞(图1J)。同样,METTL16蛋白在结直肠癌细胞系中的表达也普遍高于正常结肠上皮细胞(图1K、L)。免疫组化(IHC)对结直肠癌样本和癌旁组织的染色结果进一步证实了METTL16在结直肠癌组织中的表达增强(图1M和N)。METTL16蛋白表达的增加与结直肠癌患者的低生存率相关(图1O)。此外,多变量Cox回归分析显示,METTL16蛋白表达可能是结直肠癌患者生存的独立预测因子(图1P)。总的来说,METTL16在CRC中上调,可能在CRC进展中发挥重要作用。
2)METTL16促进CRC进展
为了研究METTL16在结直肠癌进展中的作用,我们分别使用两种shRNA (shM161、shM16-2)和pHBLV-METTL16载体(OEM16)在结直肠癌细胞中敲低和过表达METTL16的表达。敲低METTL16可降低CRC细胞的增殖和集落形成,而过表达METTL16则具有相反的作用(图2A-D)。同样,METTL16敲低抑制了CRC细胞的迁移和侵袭能力,而METTL16过表达促进了CRC细胞的转移(图2E、F)。在METTL16敲低和过表达的CRC异种移植物中进一步评估了METTL116的功能,结果表明METTL116促进肿瘤生长,而抑制METTL16则抑制肿瘤生长,这可以通过肿瘤的大小、体积和重量反映出来(图2G-L)。此外,METTL16敲低降低了Ki67的表达,而METTL16过表达则促进了Ki67在体内的表达(图2M, N)。综上所述,这些结果表明METTL16在促进CRC进展中发挥了重要作用。

3)SOGA1是METTL16的直接靶点
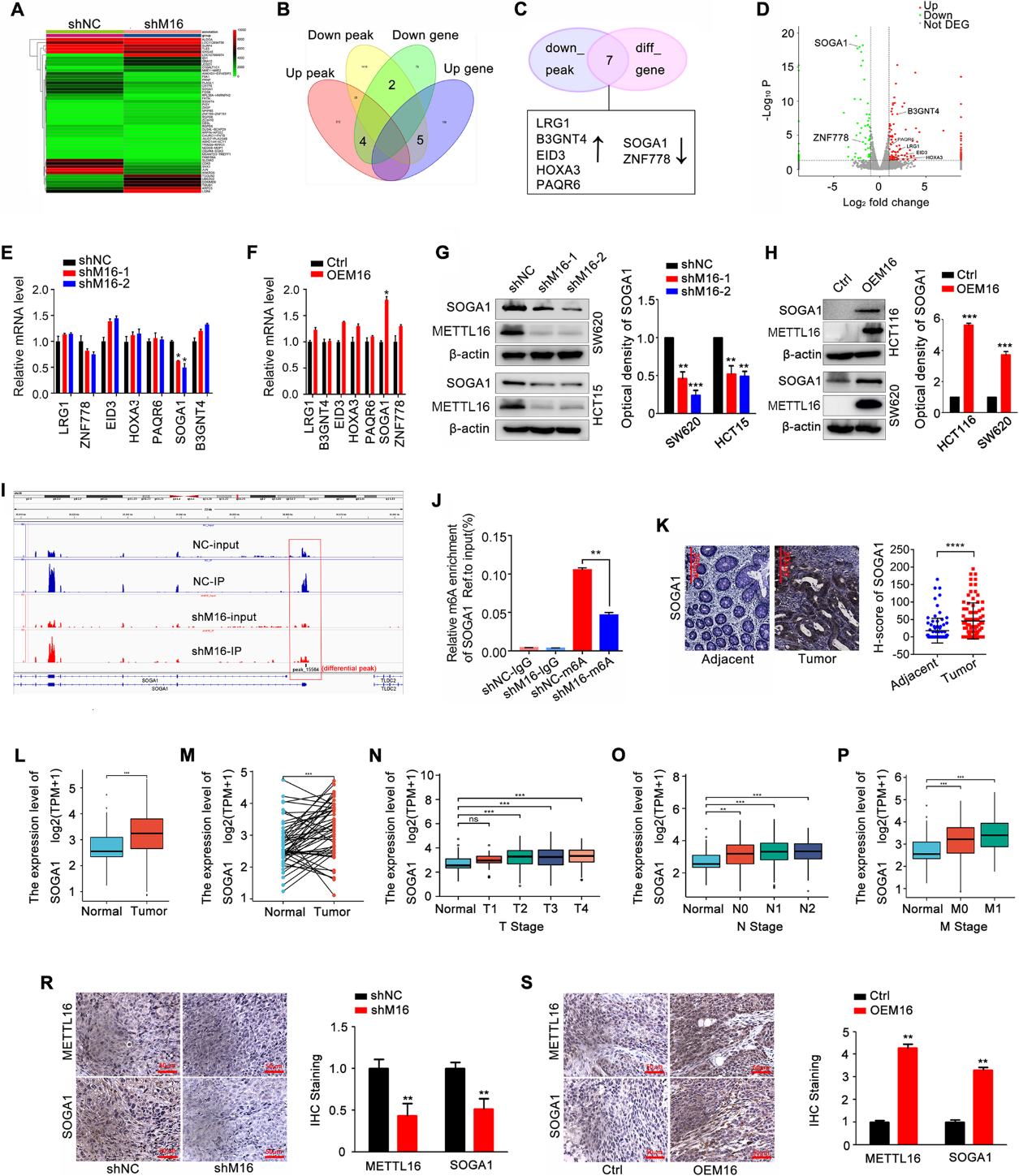
为了探究METTL16诱导CRC增殖的分子机制,我们对METTL16稳定敲除的CRC细胞和对照细胞进行了MeRIP测序和RNA测序。图3A显示了前50个差异基因,9个变化基因和峰重叠(图3B)。在低峰中,有7个基因表达改变,包括LRG1, B3GNT4, EID3, HOXA3, PAQR6, SOGA1和ZNF778(图3C, D)。通过验证,在结直肠癌细胞中,METTL16的敲低降低了SOGA1 mRNA的表达,而METTL16的过表达上调了SOGA1 mRNA的表达(图3E, F)。同样,METTL16正调控SOGA1蛋白的表达(图3G, H)。重要的是,在MeRIP-seq数据中,我们检测到SOGA1 mRNA的一个m6A峰,该峰在METTL16敲除后减弱(图3I)。MeRIP-qPCR结果显示,当METTL16被敲除时,m6A修饰的SOGA1 mRNA显著减少(图3J)。作为致癌基因,SOGA1蛋白和mRNA在结直肠癌组织中的表达与正常组织相比显著升高(图3K-M)。SOGA1表达升高与肿瘤大小、淋巴结转移、远处转移及临床分期分级显著相关(图3N-P)。此外,METTL16在体内正调控SOGA1蛋白表达(图3R, S)。综上所述,这些结果表明SOGA1是METTL16的直接靶点。
4)IGF2BP1是SOGA1的m6A阅读器
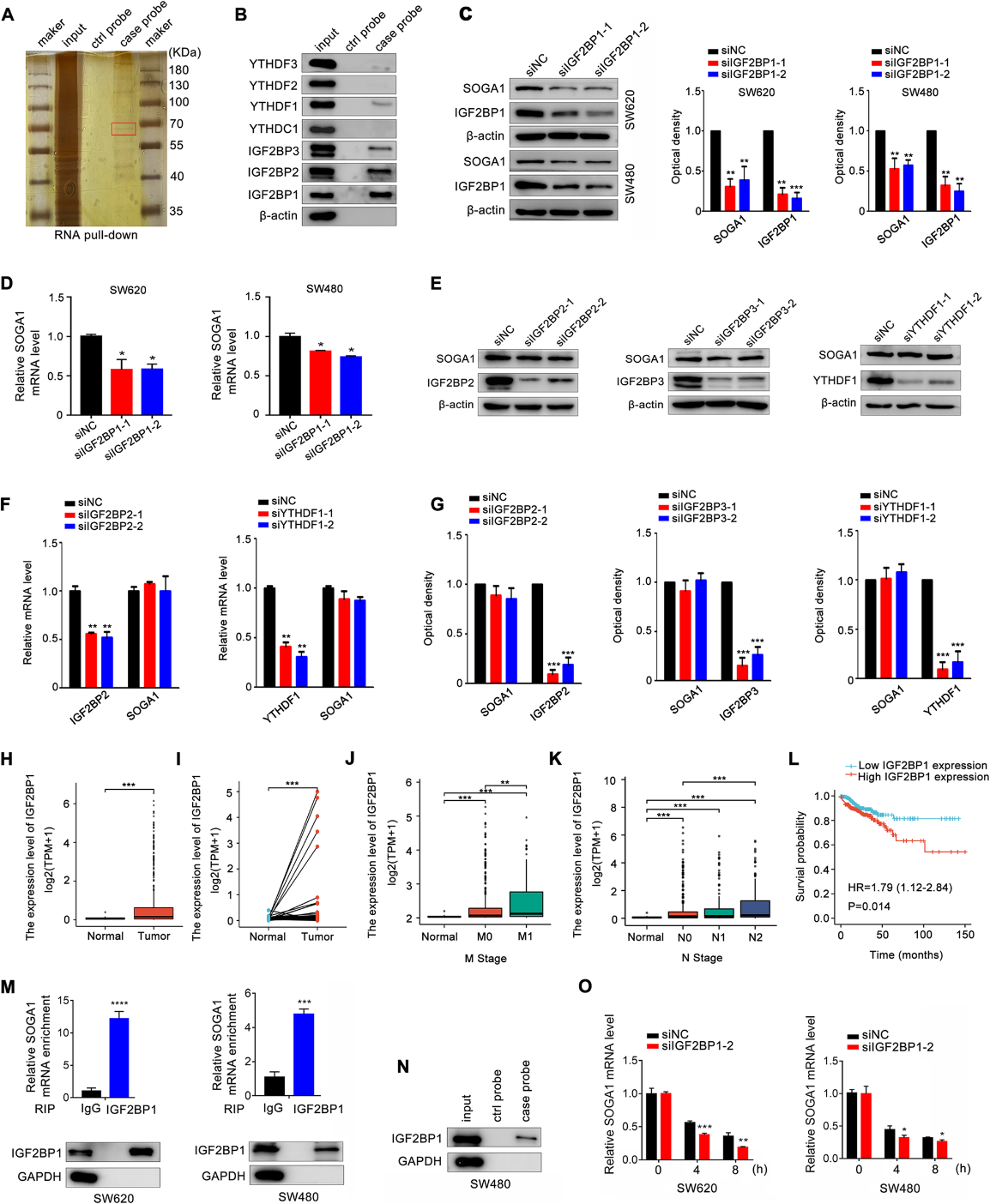
我们进一步研究了m6A修饰SOGA1 mRNA的机制。为了鉴定识别和结合SOGA1甲基化的m6A阅读器,我们进行了RNA下拉实验,从SW620细胞中捕获SOGA1相互作用的阅读器。m6A阅读器YTHDF1和IGF2BP1/2/3与SOGA1 mRNA结合(图4A, B)。有趣的是,敲低IGF2BP1可显著下调结直肠癌细胞中SOGA1 mRNA和蛋白水平(图4C, D)。然而,敲低YTHDF1和IGF2BP2/3对SOGA1蛋白表达无明显影响(图4E-G)。TCGA数据分析显示,与正常组织相比,IGF2BP1在结直肠癌组织中表达上调(图4H、I), IGF2BP1表达升高与肿瘤大小、淋巴结转移、远处转移和临床分期分级显著相关(图4J、K)。IGF2BP1表达升高与CRC患者生存不良相关(图4L)。RNA下拉实验揭示了IGF2BP1蛋白与SOGA1 mRNA之间的密切相互作用(图4M)。同样,RIP实验的结果进一步证实了IGF2BP1直接与SOGA1 mRNA结合(图4N)。IGF2BP1敲低降低了SOGA1 mRNA的稳定性,提高了其在CRC细胞中的降解率(图4O)。综上所述,这些结果表明甲基化的SOGA1 mRNA被IGF2BP1直接识别,从而抑制转录物降解并以依赖m6A的方式促进SOGA1的表达。
5)METTL16/SOGA1通过调节PDK4的表达促进糖酵解
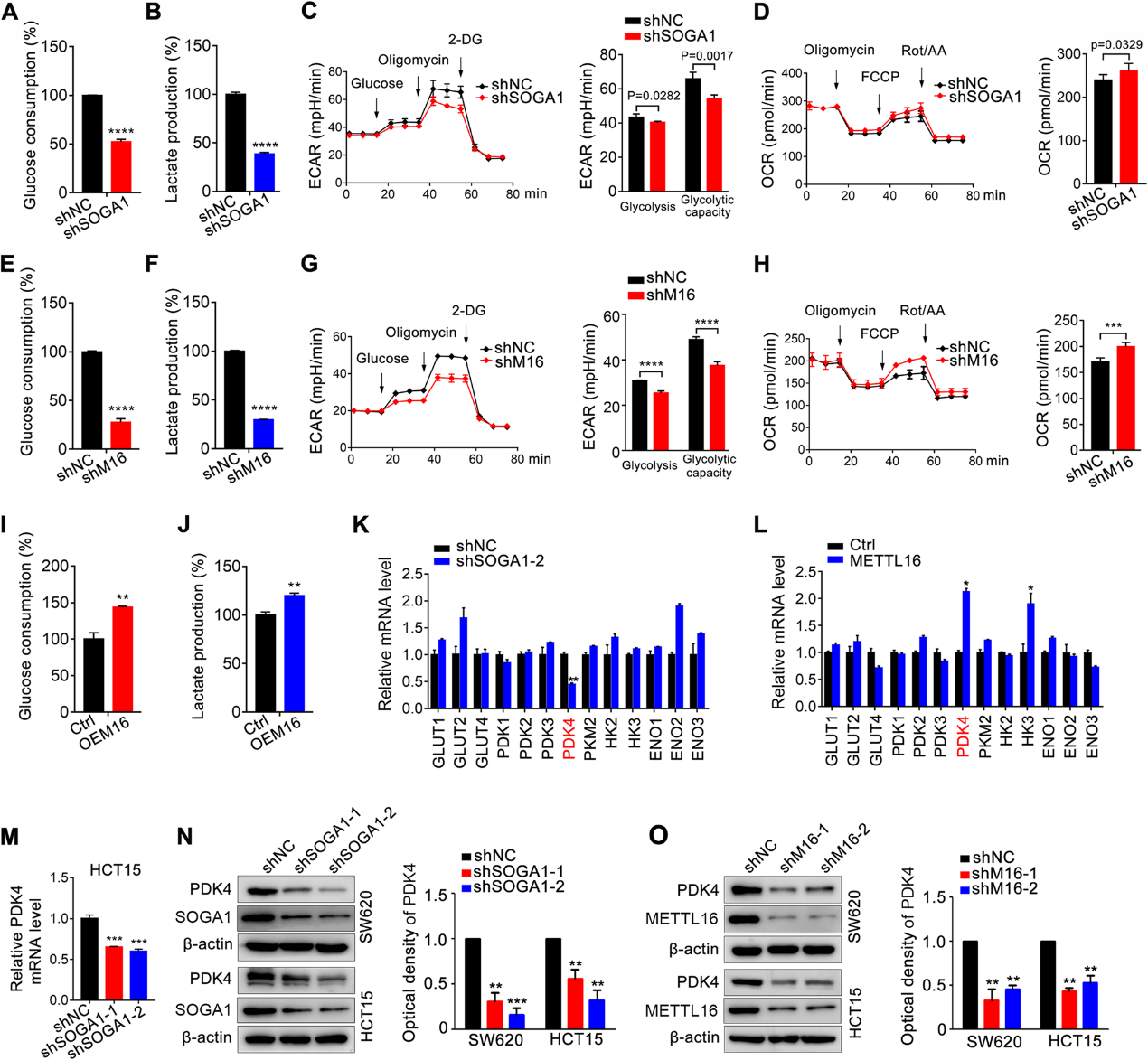
我们研究了METTL16/ SOGA1轴在糖酵解中促进CRC进展的作用。SW620细胞中SOGA1的下调显著降低了葡萄糖摄取和乳酸生成(图5A, B)。此外,SOGA1缺失的CRC细胞显示ECAR降低,OCR增加,反映了线粒体氧化呼吸(图5C, D)。与此一致,METTL16缺失的CRC细胞显示葡萄糖摄取(图5E)、乳酸生成(图5F)、ECAR(图5G)降低,OCR增加(图5H)。与此相反,SW620细胞中METTL16的过表达促进了葡萄糖摄取和乳酸生成(图51,J)。为了进一步确定METTL16/SOGA1介导糖酵解的机制,我们测量了SOGA1敲低CRC细胞中一系列葡萄糖代谢相关基因的mRNA表达(图5K)。我们还研究了这些分子是否受METTL16的控制。因此,我们检测了这些基因在过表达的METTL16 crc细胞中的mRNA表达(图5L)。有趣的是,只有PDK4的表达水平因SOGA1的下调而显著降低,而因METTL16的过表达则持续升高。通过进一步验证,我们发现SOGA1和METTL16的敲低降低了CRC细胞中PDK4 mRNA和蛋白的表达(图5M-O)。总的来说,我们的数据显示METTL16/SOGA1轴通过调节CRC细胞中PDK4的表达来促进糖酵解。
6)SOGA1通过抑制AMPK信号传导促进PDK4的表达
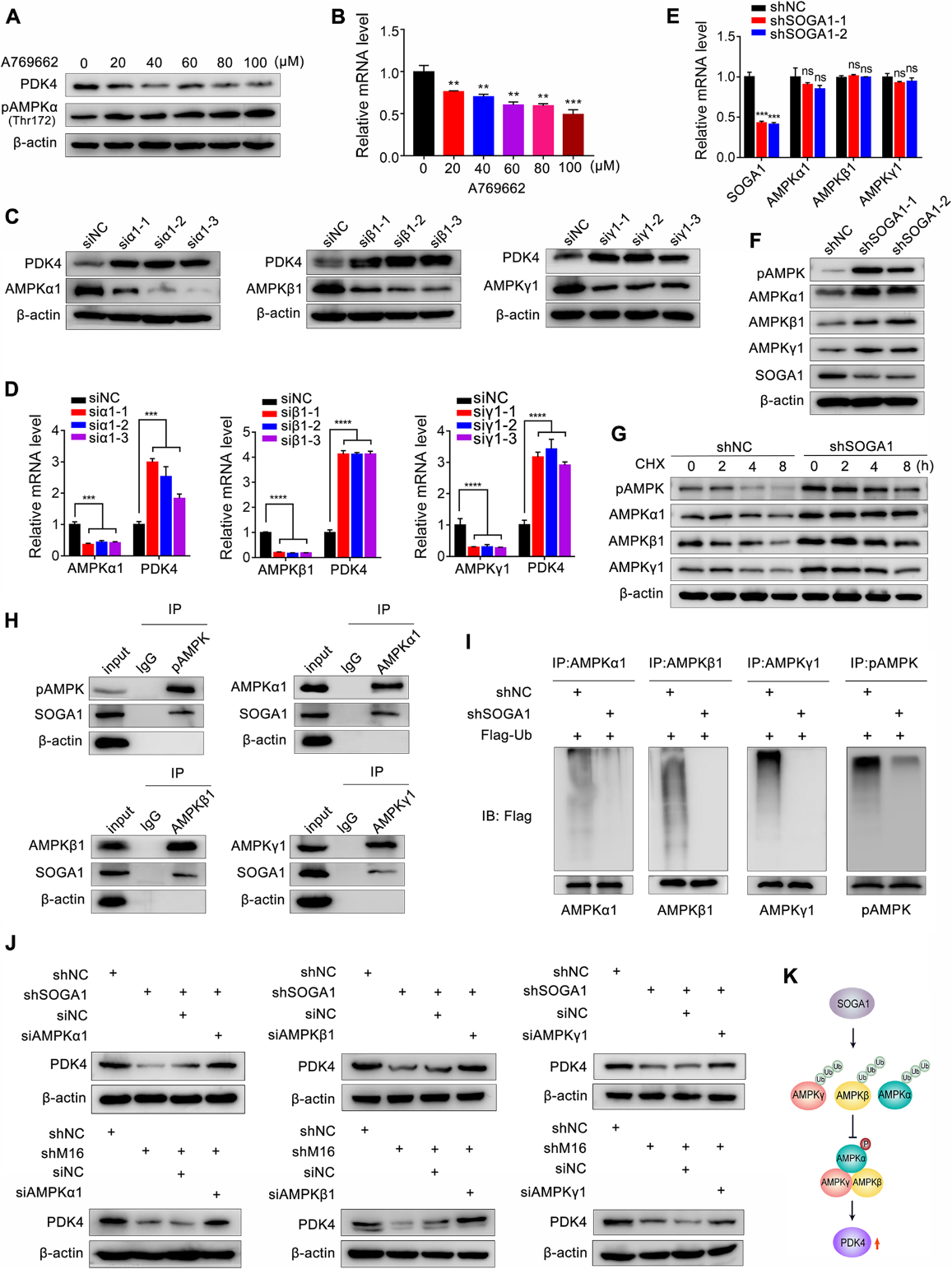
我们进一步探讨了SOGA1调控PDK4表达的潜在机制。有报道称AMPK信号是PDK4上游的关键信号。为了验证AMPK在PDK4表达中的作用,我们使用AMPK激活剂A769662刺激CRC细胞。结果表明,A769662诱导AMPK (Thr172)磷酸化,激活AMPK信号,显著降低PDK4蛋白和mRNA的表达(图6A、B)。我们发现,AMPKα1、β1和γ1亚基的敲低增加了PDK4 mRNA和蛋白的表达(图6C、D),表明AMPK位于PDK4的上游,负向调节CRC细胞中PDK4的表达。接下来,我们发现敲低SOGA1显著促进AMPK磷酸化和AMPKα1、β1和γ1蛋白表达(图6F),但对AMPKα1、β1和γ1 mRNA表达无明显影响(图6E)。蛋白稳定性分析显示,SOGA1敲低可降低pAMPK、AMPKα1、β1和γ1的衰变,增强其蛋白稳定性(图6G)。Co-IP实验结果显示,SOGA1可以结合pAMPK、AMPKα1、β1、γ1(图6H),促进AMPKα1、β1、γ1和pAMPK泛素化(图6I)。此外,抑制AMPKα1、β1和γ1部分逆转SOGA1或METTL16的缺失下调PDK4的表达(图6J)。这些结果表明,SOGA1结合AMPKα1、β1和γ1,诱导其泛素化,抑制其表达和磷酸化,从而促进PDK4的表达(图6K)。
7)YY1通过直接结合METTL16启动子下调其表达
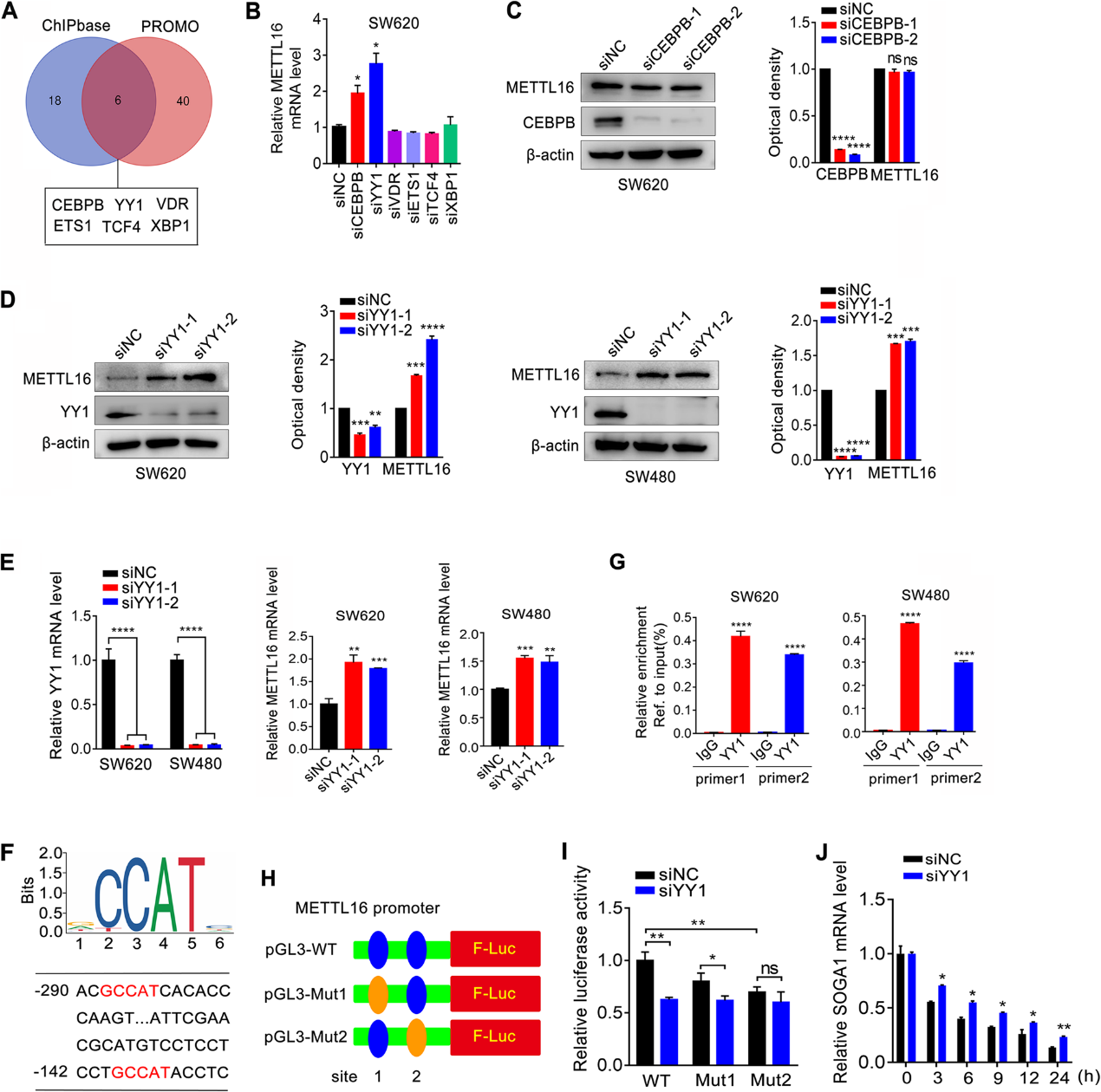
为了探索METTL16在CRC中高表达的潜在机制,我们通过分析ChIPBase和PROMO中的ENCODE染色质免疫沉淀测序(ChIP-seq)数据,评估了负责调节METTL16的潜在转录因子(TFs)。如图7A所示,CEBPB、YY1、VDR、ETS1、TCF4、XBP1 6个TF重叠在ChIPBase预测的26个TF和PROMO预测的46个TF中。接下来,分别下调这6个TF,发现CEBPB和YY1的敲低增加了METTL16 mRNA的表达(图7B)。然而,CEBPB的缺失对METTL16蛋白的表达没有明显影响(图7C)。YY1的敲低明显上调了CRC细胞中METTL16蛋白和mRNA的表达(图7D, E)。在对METTL16基因启动子的分析中,我们找到了YY1在其上的结合位点,并设计了ChIP引物(图7F)。ChIP实验表明,YY1可以直接结合CRC细胞中的METTL16启动子(图7G),表明YY1是METTL16的上游TF。接下来,我们对METTL16启动子报告基因的两个YY1潜在结合位点进行突变,生成pGL-M16-Mut1或pGL-M16-Mut2(图7H)。结果表明,si-YY1可以显著降低pGLM16-WT和pGL-M16-Mut1的荧光素酶水平,而si-YY1对pGL-M16-Mut2的抑制作用减弱(图7I)。此外,YY1敲低增加了CRC细胞中SOGA1 mRNA的稳定性(图7J)。综上所述,这些数据表明YY1是METTL16的上游转录因子,并通过直接结合METTL16的启动子来调节METTL16的表达。
8)METTL16/SOGA1轴与结直肠癌患者预后不良有临床相关性
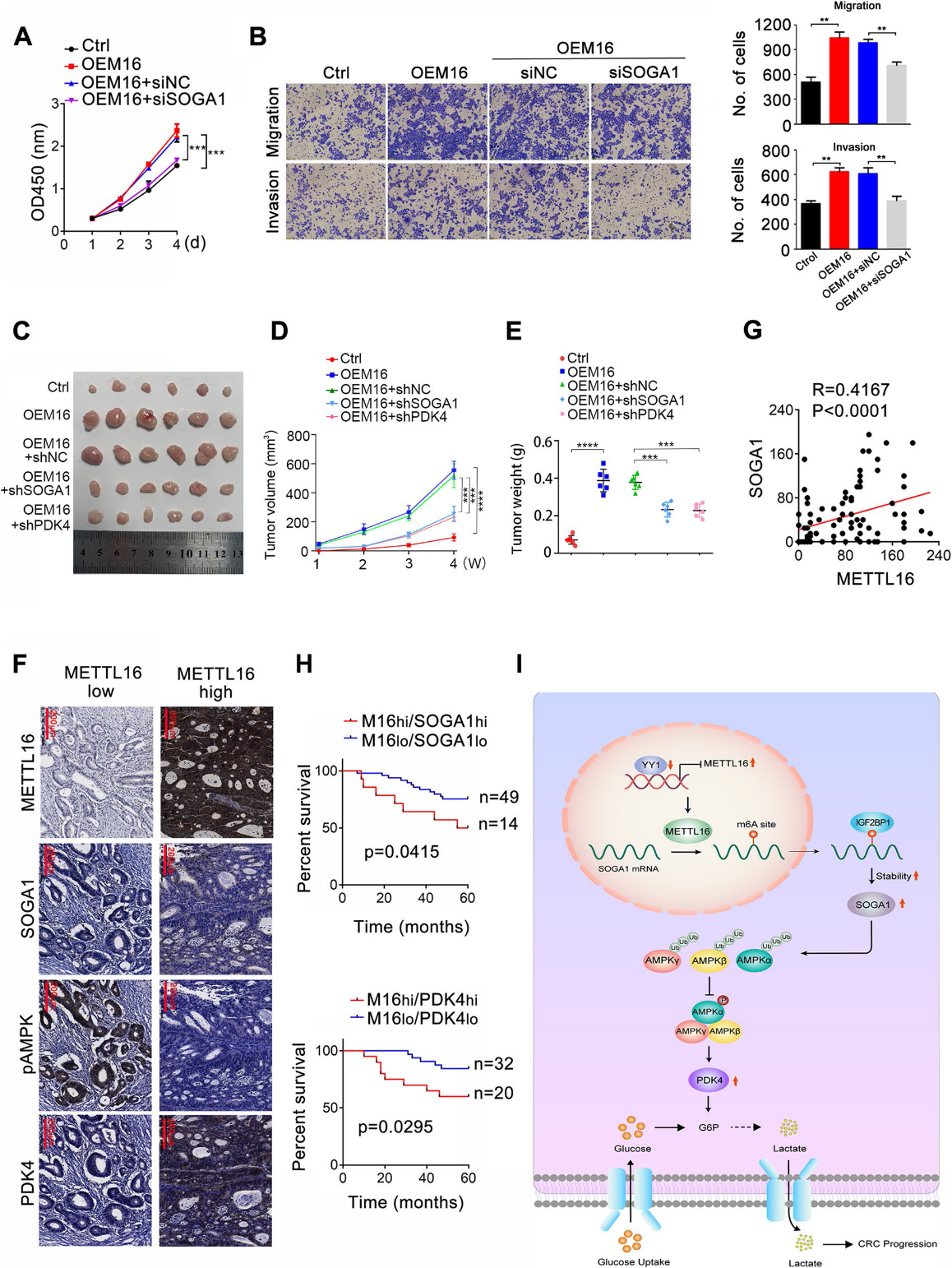
为了研究SOGA1在METTL16介导的CRC增殖中的作用,我们在METTL16过表达的CRC细胞中使用siRNA下调SOGA1的表达并检测细胞增殖。结果表明,SOGA1的敲低削弱了METTL16促进的CRC细胞的增殖(图8A)。SOGA1敲低部分抑制了METTL16促进的CRC细胞转移(图8B)。在体内,SOGA1和PDK4敲低都减弱了METTL116的过表达提高的肿瘤生长,这反映在肿瘤大小(图8C)、体积(图8D)和重量(图8E)上。此外,METTL16和SOGA1在结直肠癌组织中的表达呈正相关(图8F、G)。此外,在结直肠癌组织中,METTL16的表达与PDK4呈正相关(图8F)。重要的是,Kaplan-Meier分析显示,METTL16与SOGA1共表达或METTL16与PDK4高表达与CRC患者预后不良呈正相关(图8H)。上述结果表明,SOGA1在METTL16介导的CRC细胞增殖中起重要作用,METTL16/SOGA1轴与CRC患者预后不良具有临床相关性。
结论
我们的研究结果表明METTL16在结直肠癌进展中具有肿瘤促进作用。METTL16在结直肠癌组织中表达上调,与结直肠癌患者预后不良相关。机制上,METTL16/SOGA1/ PDK4信号轴通过诱导糖酵解促进结直肠癌的进展。这一发现为探索结直肠癌新的诊断生物标志物和治疗靶点提供了新的见解。
实验方法
Western blotting,qRT‑PCR,代谢试验,ECAR和OCR,RNA稳定性和蛋白质稳定性测定,Co‑IP,IHC,transwell,MeRIP测序,RIP,RNA pull‑down,ChIP,动物实验。
参考文献
Wei W, Zhang ZY, Shi B, Cai Y, Zhang HS, Sun CL, Fei YF, Zhong W, Zhang S, Wang C, He B, Jiang GM, Wang H. METTL16 promotes glycolytic metabolism reprogramming and colorectal cancer progression. J Exp Clin Cancer Res. 2023 Jun 20;42(1):151. doi: 10.1186/s13046-023-02732-y.






