肝细胞癌经动脉化疗栓塞后,TREM2+巨噬细胞抑制CD8+T细胞浸润
肝细胞癌(HCC)经肝动脉化疗栓塞术(TACE)后的免疫格局仍有待阐明。本研究旨在描述TACE后的免疫景观和HCC进展的潜在机制。收集5例未经治疗的HCC患者和5例接受TACE治疗的患者的肿瘤样本,并进行单细胞RNA测序。另有22个配对样本使用免疫荧光染色和流式细胞术进行验证。为阐明潜在的机制,体外共培养实验和两种类型的TREM2-KO / WT小鼠模型,即HCC细胞原位注射模型和自发性HCC模型。TACE术后微环境中CD8+T细胞数量减少,肿瘤相关巨噬细胞(TAMs)数量增加。TACE治疗降低了CD8_C4簇,该CD8_C4簇高度富集肿瘤特异性CD8+T细胞。TREM2在TACE术后TAMs中高表达,且与不良预后相关。TREM2+TAMs比TREM2-TAMs分泌更少的CXCL9,但分泌更多的半乳凝素-1。半乳凝素-1促进血管内皮细胞PD-L1过表达,阻碍CD8+T细胞募集。TREM2的缺失也增加了CD8+T细胞的浸润,这在两种体内HCC模型中都抑制了肿瘤的生长。更重要的是,TREM2缺失增强了抗PD-L1阻断的治疗效果。本研究表明TREM2+TAMs在抑制CD8+T细胞中发挥重要作用。TREM2缺失通过增强CD8+T细胞的抗肿瘤活性,增加了抗PD-L1阻断的治疗效果。这些发现解释了TACE术后复发和进展的原因,为TACE术后HCC免疫治疗提供了新的靶点。本研究于2023年7月发表于《Journal of Hepatology》上,IF:25.7。
技术路线
主要研究结果
1、免疫细胞群的全局scRNA-seq分析
研究展示了发现队列中5个未经治疗的原发性HCC和5个TACE后HCC样本的scRNA-seq(图1A)。作者在验证队列中用TACE前后的22个配对样本验证了这一发现(图1B)。图1C显示队列的计算机断层扫描图像。
共鉴定出27个不同的簇,包括CD8、CD4、自然杀伤细胞(NK)、B、血浆和髓系细胞(图1D)。与PT组(图1E和F)相比,TT组髓系细胞数量增加,NK和CD8+T细胞数量减少。所有细胞簇在患者间共享,表明不存在患者特异性批次效应或患者异质性(图1G-H)。这些发现得到了来自验证队列的免疫荧光(图1I-J)和流式细胞术(图1-L)的证实。
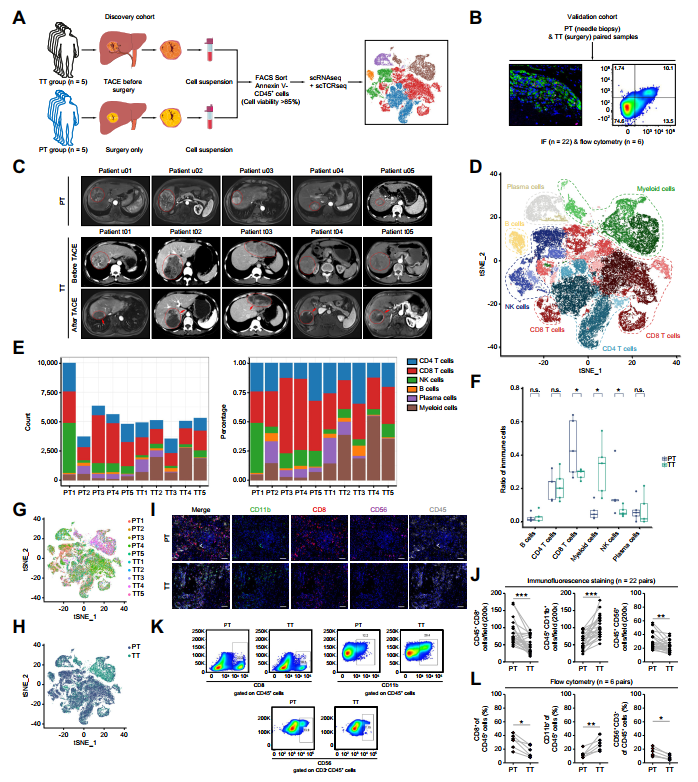
图1 TACE治疗减少CD8+T细胞的数量,但增加髓系细胞的数量
2、在TACE治疗后,高度富集肿瘤特异性CD8+T细胞的CD8_C4亚群的频率降低
将CD8+T细胞重新聚类为15个群体(图2A)。差异表达基因(DEG)分析和细胞评分评估显示,TT组CD8+T细胞的细胞毒性和耗竭降低,而氧化应激增加(图2B、C)。令人惊讶的是,TT样本中CD8_C4细胞的频率显著低于PT样本(图2D)。基于细胞毒性基因数量的增加和耗竭标志物的适度表达,轨迹分析发现CD8_C4细胞代表了介于效应性CD8+和终端耗竭性CD8+T细胞之间的过渡状态(图2E)。研究使用流式细胞术分析了验证队列中的6个配对HCC样本,在TT样本中检测到PD-1intCD8+T细胞的频率降低(图2F、G)。粒酶-B主要表达于PD-1int CD8+T细胞亚群,与作者之前的研究结果一致。此外,TT组PD-1int CD8+T细胞中粒酶-B的表达量远低于PT组(图2H、I)。跨验证队列的免疫荧光实验也验证了TT组中粒酶-B+PD-1+CD8+T细胞数量减少(图2J、K)。此外,基于TCGA数据库的生存分析显示,CD8_C4基因标签组合与HCC患者较好的预后结局相关(图2L)。作者使用转移轨迹研究来探讨CD8+T细胞在耗竭前阶段的能量代谢途径。研究发现,TT样本的CD8+T细胞在拟时间阶段4的脂蛋白代谢评分高于PT样本(图2M),而谷氨酸、糖酵解和三羧酸循环评分低于PT样本(图2M)。这些结果表明TACE治疗在数量和功能上降低了CD8_C4簇。
作者的TCR测序分析证实这些发现。除CD8_C13(IELs)外,所有细胞均表达TCR(图3A)。在许多类群中,扩张的克隆型数量在TT样品中具有较低的趋势(图3B)。Hyper-expanded CD8+克隆(红色)仅在PT样本中观察到,large-expanded CD8+克隆(橙色)数量在TT样本中显著较低(图3C、D)。此外,对所有CD8+细胞簇的TCR克隆型进行系统检测,发现CD8_C1至CD8_C4细胞簇具有较多的TCR克隆型,表明这四组细胞具有同源性。与PT组相比,TT组共用的CD8_C1 ~ CD8_C4克隆型显著减少(图3E),表明TACE治疗后CD8+T细胞克隆扩增受阻。
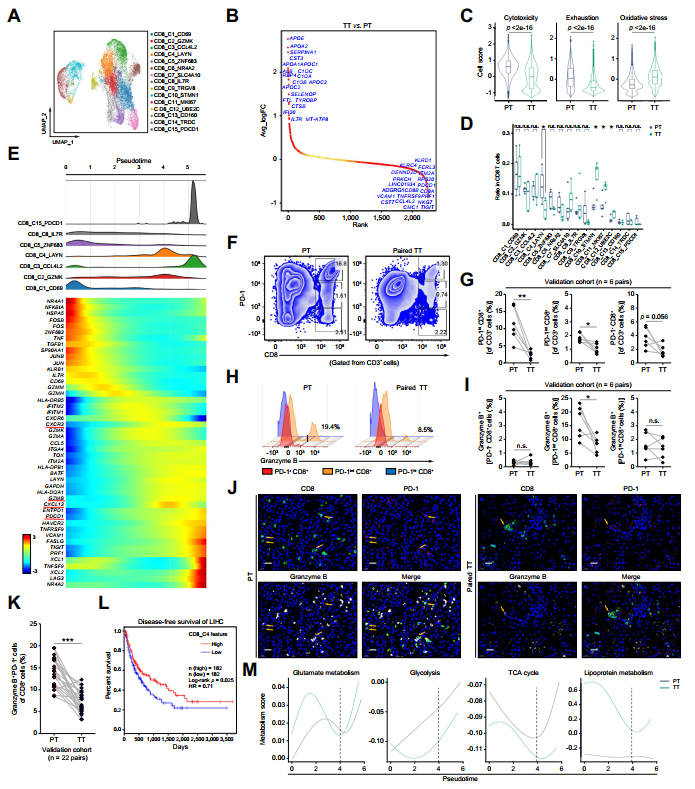
图2 TACE治疗后CD8_C4细胞数量减少
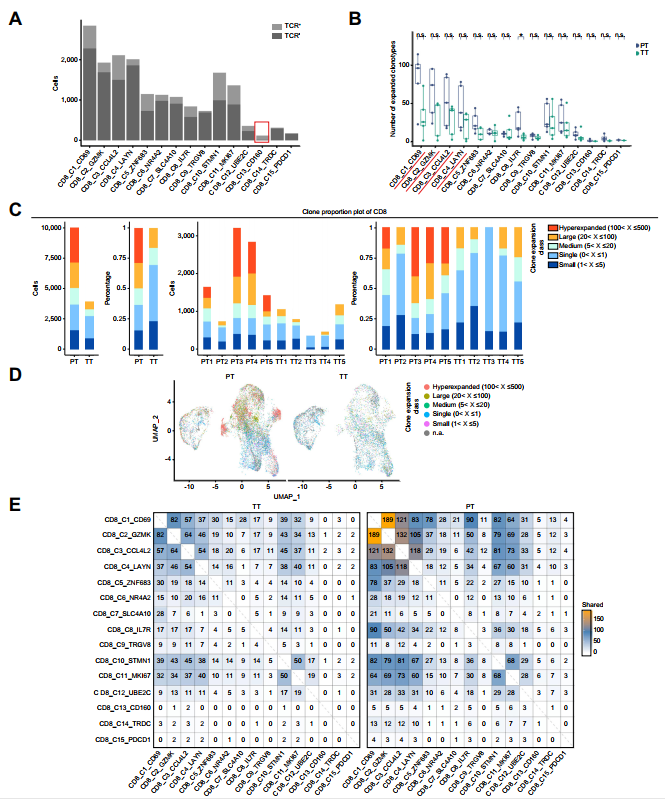
图3 TACE后CD8+ T细胞的TCR克隆扩增减少
3、肝癌患者TACE治疗后TREM2+TAMs数量增加
由于髓系细胞在调节T细胞浸润和功能方面发挥关键作用,作者检测了髓系细胞的scRNA-seq数据。它们被重新聚类成15个群体,包括巨噬细胞、单核细胞、常规树突状细胞和浆细胞样树突状细胞(图4A、B)。
大多数巨噬细胞/单核细胞的频率在TACE治疗后增加(图4C)。DEG分析表明,TT组TAMs中TREM2表达上调,CD5L表达下调(图4D)。作者通过流式细胞术从验证队列中验证了这一观察(图4E、F)。作者的scRNA-seq数据还揭示了TACE治疗后特定亚簇中TREM2的上调和CD5L的下调(图4G)。有趣的是,来自TCGA数据库的HCC队列分析证实,CD45和CD68正常化的TREM2高表达是不良临床预后的显著指标。相反,在相同的正常化水平下,CD5L的高表达与更好的临床结果相关(图4H)。此外,免疫荧光也证实了验证队列中TT组中TREM2+CD68+TAMs的积累增加和CD5L+CD68+TAMs的浸润减少(图4I、J)。
接下来,作者对TAMs /单核细胞进行RNA速度分析,以探索跨TAMs的促肿瘤信号通路的变化,35个C1QC+TAMs和SPP1+TAMs具有末端进化状态,(图5A)。GO通路分析表明C1QC+TAMs在功能上与急性炎症和补体激活通路相关。相反,SPP1+TAMs表达参与血管生成、成纤维细胞增殖和中性粒细胞活化的特定基因(图5B)。与PT组相比,TT组补体激活、吞噬和血管生成相关基因的表达水平显著升高,但IFN诱导基因的表达水平显著降低(图5C)。特别是与血管生成相关的基因在SPP1+TAMs中富集(图5D)。总的来说,这些数据表明TAMs在TACE治疗后表现出肿瘤诱导的血管生成表型。
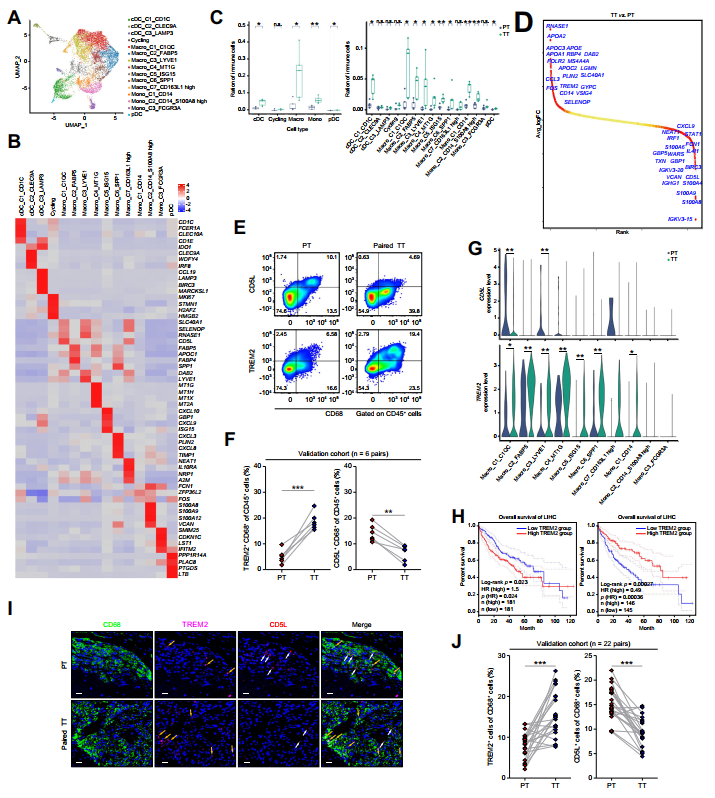
图4 TACE治疗后TREM2+TAM数量增加
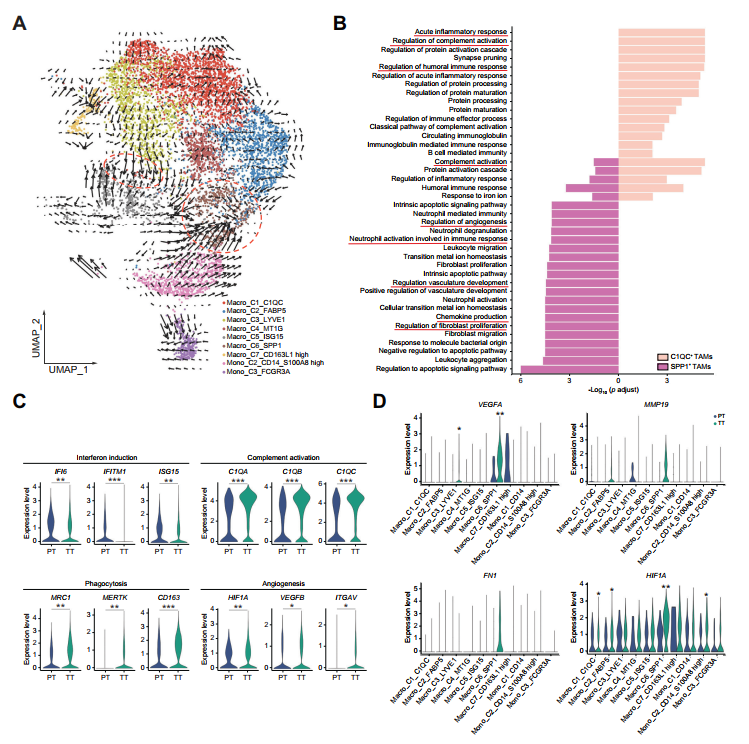
图5 TT样品中的TAM显示出增强的血管生成表型
4、TREM2+TAMs通过低分泌CXCL9和增强GAL-1的产生来抑制CD8+T细胞的浸润
作者使用受/配体分析来研究CD8+T细胞与TAM表型之间的关系。TACE治疗后,趋化因子和检查点DEG分析显示CXCL9和PDCD1表达水平显著降低(图6A)。趋化因子受/配体分析进一步揭示了CXCL9 / CXCR3轴在CD8+T细胞浸润中发挥着比CXCL10/CXCR3轴更重要的调控作用(图6B)。有趣的是,在TT样本中,CXCL9的表达显著降低,而CXCL10和CXCR3的表达没有显著变化(图6C、D)。此外,尽管CD8+T细胞中PDCD1的表达在许多TT样本子簇中降低,但CD274配体在巨/单细胞中几乎没有变化(图6E-G)。这些结果表明,TACE治疗后CD8+T细胞的浸润受到CXCL9 / CXCR3轴下调的阻碍,而不是PD-1 / PD-L1轴的下调。为进一步探索CXCL9下调的分子机制,作者研究了TREM2+vs . TREM2-巨噬细胞。火山图表明,与CXCL9下调相反,LGALS1(GAL-1)在TREM2+TAMs中上调(图6H),这会阻碍CD8+T细胞的功能。36-38此外,作者利用TCGA数据库分析了TREM2与CXCL9 / LGALS1之间的遗传相互作用,发现在HCC TAMs中TREM2与CXCL9呈负相关,而与LGALS1呈正相关(图6I)。
为进一步研究TREM2+TAMs中CXCL9和GAL-1的分泌情况,作者采用流式细胞术对验证组中的6个配对样本进行检测。虽然CXCL9主要在TREM2-TAMs中表达,但GAL-1在TREM2+TAMs中的表达明显高于TREM2-TAMs;PT和TT样品之间无显著性差异(图7A、B)。与此一致,ELISA实验发现TREM2+TAMs比TREM2-TAMs释放更少的CXCL9和更多的GAL-1(图7C)。重要的是,基于TCGA数据库,LGALS1的高表达和LGALS1hiTREM2hi被CD68正常化的基因标签都是不良临床预后的可靠指标(图7D)。通过跨内皮迁移实验,作者观察到与TREM2+TAMs共培养时迁移的CD8+T细胞数量比与TREM2-TAMs共培养时减少。抗CXCL9抗体的加入阻断了CD8+T细胞的迁移,而抗GAL-1抗体增强了CD8+T细胞的迁移(图7E、F)。此外,与TREM2-TAMs相比,TREM2+TAMs对CD8+T细胞的细胞毒活性的抑制作用更强(图7G),这与之前的研究结果一致。18此外,作者发现TREM2+TAMs释放的GAL-1诱导了VE细胞PD-L1的过表达(图7H)。来自验证队列的免疫荧光和流式细胞术检测巩固了TT样本中PDL1+CD31+VE细胞数量的增加,但TT样本中非血管区域的PD-L1+CD31-肿瘤细胞减少(图7I-K),表明PD-L1+VE细胞作为抑制CD8+T细胞迁移的障碍。总体而言,TACE治疗后,TREM2+TAMs低水平的CXCL9分泌和高水平的GAL-1分泌共同抑制了CD8+T细胞的浸润和抗肿瘤活性。
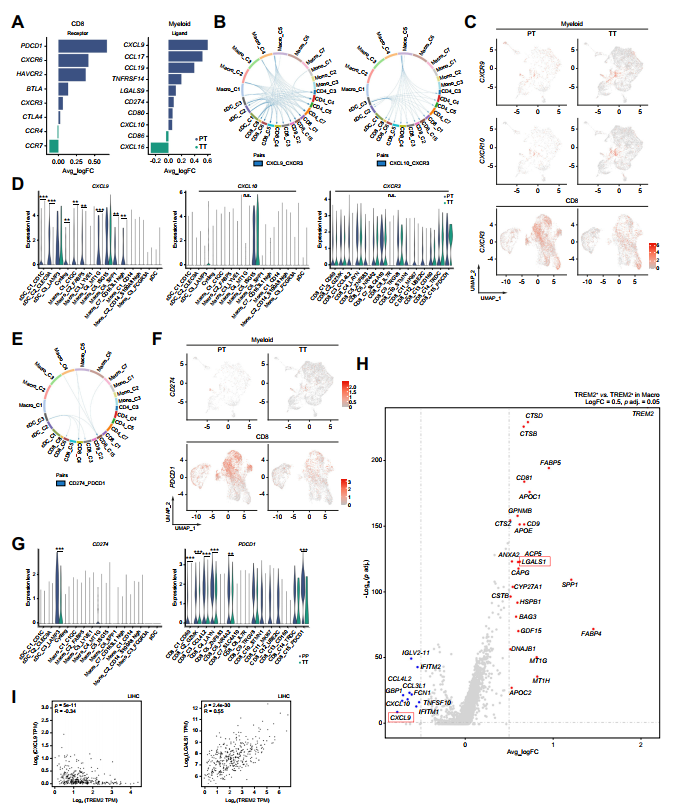
图6 TREM2+TAMs中CXCL9表达降低,LGALS1表达升高
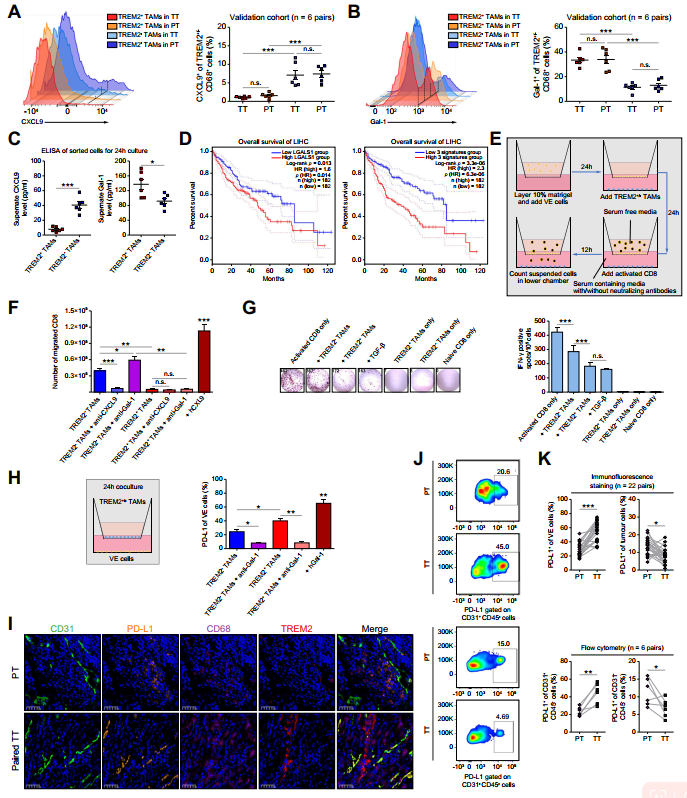
图7 TREM2+TAMs通过低分泌CXCL9和增加GAL-1的产生,阻碍CD8+T细胞的浸润
5、TREM2缺失减弱HCC肿瘤生长并提高抗PD-L1治疗的疗效
体内实验确定TREM2+TAMs是否促进HCC肿瘤生长。构建两种模型,即原位注射Hepa1-6细胞和基于NASH的自发性HCC。在两种肝癌模型中,TREM2-WT小鼠的肿瘤生长呈进行性,而TREM2-KO小鼠的肿瘤生长明显减弱(图8A、B)。然后,作者检测了两种HCC模型中免疫细胞的浸润情况。作者的数据显示,虽然CXCL9+TAMs的频率增加,但TREM2-KO小鼠中GAL-1+TAMs减少。此外,在TREM2-KO小鼠中,NK细胞和CD8+T细胞的频率显著升高,并伴随CD8+T细胞中PD-1和IFN-c的上调。提示TREM2缺失增加NK / CD8+T细胞的浸润,促进CD8+T细胞的活化和细胞毒性。结果与先前的研究一致。此外,PD-L1在CD31+VE细胞中表达下调,而在肿瘤细胞中表达上调(图8C、D),两种模型的免疫荧光实验均验证了这一发现(图8E、F)。这一证据揭示了TREM2缺失抑制HCC肿瘤生长的潜在机制。因此,TREM2缺失可能增强肿瘤细胞对抗PD-L1检查点阻断的反应性。因此,作者采用上述两种注射抗小鼠PD-L1抗体的HCC模型进行验证。该方案在TREM2-KO小鼠中显示出最强的治疗效果(图8G、H)。无论抗PDL1抗体处理与否,TREM2-KO小鼠CD8+T细胞均增加。TREM2-KO小鼠和抗PD-L1抗体注射组的IFN-c+CD8+T细胞也显著增加(图8I、J),具有较强的抗肿瘤活性。
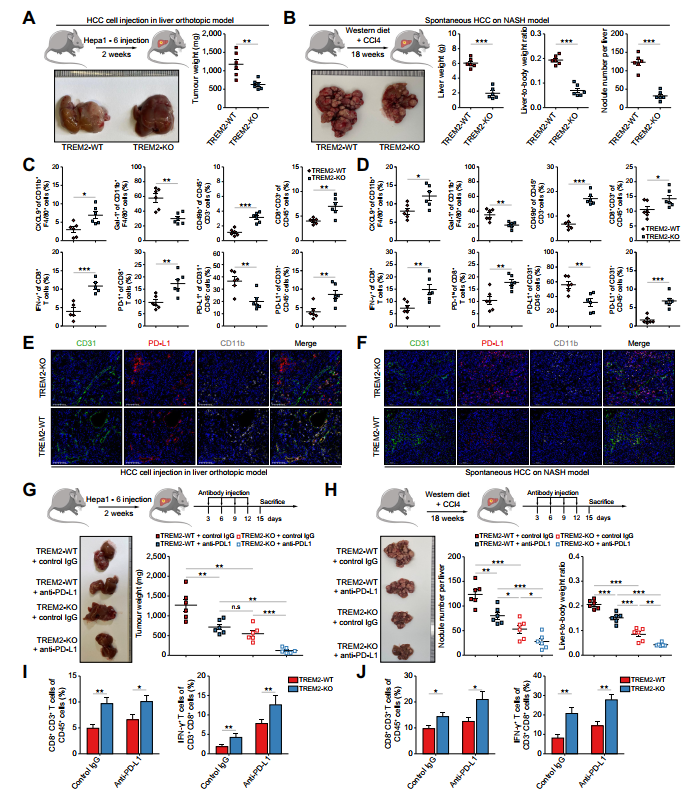
图8 在两种HCC模型中,TREM2缺乏可减缓肿瘤生长并增强抗PD-l1治疗的疗效
结论
总之,本研究数据显示了TACE后HCC独特的免疫景观。作者为TREM2+TAMs引起TACE术后复发和免疫抑制的机制提供了充分的证据,并提出了令人信服的免疫治疗靶点。
实验方法
scRNA-seq单细胞悬液制备,scRNA-seq,血管内皮细胞与巨噬细胞共培养实验,TREM2-KO小鼠,CD8+T细胞跨内皮迁移试验,CD8+T细胞功能抑制实验,流式细胞术,多重免疫荧光染色,ELISAs
参考文献
Tan J, Fan W, Liu T, Zhu B, Liu Y, Wang S, Wu J, Liu J, Zou F, Wei J, Liu L, Zhang X, Zhuang J, Wang Y, Lin H, Huang X, Chen S, Kuang M, Li J. TREM2+macrophages suppress CD8+T-cell infiltration after transarterial chemoembolisation in hepatocellular carcinoma. J Hepatol. 2023 Jul;79(1):126-140. doi: 10.1016/j.jhep.2023.02.032. Epub 2023 Mar 6. PMID: 36889359.






