靶向m7G-SLUG/SNAIL轴——在射频消融不足后阻断肝细胞癌转移

射频热消融是治疗肝细胞癌(HCC)的理想根治方法。然而,不充分的射频消融(IRFA)可能会导致肝癌的高复发率。在哺乳动物和酵母中,tRNA上的N7 -甲基鸟苷(m7G)是一种进化上保守的修饰,可调节热应激反应和肿瘤进展,但它在IRFA后HCC复发中的功能仍不清楚。本研究中,作者发现METTL1 介导的 m7G tRNA修饰在体外和体内亚致死热应激下促进HCC转移。机制上,METTL1介导的m7G tRNA修饰以依赖于密码子频率的方式选择性调控上皮-间充质转化(EMT)过程中关键基因SLUG/SNAIL的翻译。该研究于2023年6月发表在《Molecular Therapy》,IF:12.4。
技术路线

主要研究结果
1. HCC中亚致死热应激促进METTL1表达和m7 G修饰
建立IRFA或HCC患者异种移植(PDX)小鼠模型,以高精度模拟临床HCC 消融。使用红外成像仪监测肿瘤过渡区(TZ)在41℃-50℃范围内遭受亚致死性热应激时的温度(图1A)。结果发现,IRFA 显著上调了TZ中m7G tRNA 修饰水平以及METTL1和WDR4的表达(图1B-1D)。METTL1 和 WDR4 在非肿瘤组织中的水平较低,但在RFA治疗后复发的HCC组织中的水平显著升高(图1E和1F)。亚致死性热处理可显著上调HCC患者衍生的类器官组织中METTL1 和WDR4的表达(图1G和1H)。在亚致死热应激HCC细胞模型中验证亚致死热处理会增加HCC细胞中m7G tRNA的修饰及METTL1/WDR4 的水平(图1I和1J)。这些数据表明,IRFA诱导的m7G tRNA 修饰上调可能与HCC在RFA 期间的耐热性有关。

图1. 暴露于亚致死热应激下的HCC中m7G tRNA修饰和METTL1/WDR4水平升高
2. 敲降METTL1抑制亚致死热应激下HCC细胞的恶性行为
鉴于亚致死热应激会增加m7G tRNA的修饰和METTL1/WDR4的表达,作者推测METTL1 可能在亚致死热应激下发挥重要的致癌功能。northwestern blot(图2A)证明METTL1 基因敲低降低tRNA的m7G修饰。亚致死热应激显著抑制HCC细胞的生长(图2B)、克隆形成能力(图2C、2D)和细胞周期进展(图2E),而 METTL1 的缺失进一步抑制亚致死热处理下HCC细胞的生长和克隆形成。另一方面,亚致死热应激会诱导HCC细胞凋亡,当 METTL1 被沉默时,这一趋势更加明显(图2F)。此外,亚致死热处理显著促进三种HCC细胞的迁移和侵袭能力,但METTL1沉默会显著削弱这一趋势(图2G-2J)。这些数据表明,METTL1 在亚致死热应激下对HCC的恶性特征起着重要作用。
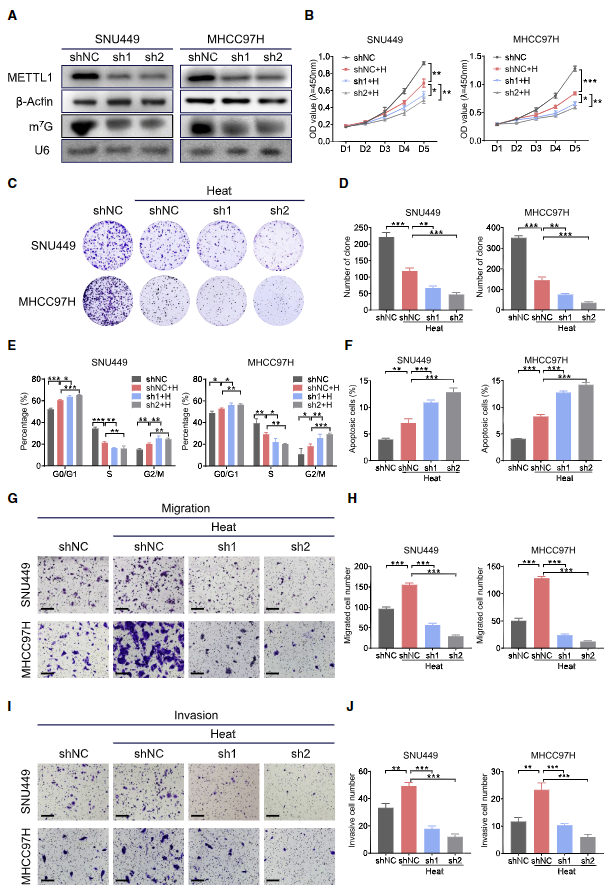
图2. 敲低METTL1抑制亚致死热应激下HCC细胞的恶性行为
3. 过表达METTL1以m7G tRNA 修饰依赖的方式促进HCC细胞在亚致死热应激后的恶性能力
在HCC细胞中过表达野生型(oeWT)及其无催化活性突变体(oeMUT)METTL1。与oeNC 相比,在含有oeWT METTL1 而非oeMUT METTL1的HCC 细胞中观察到tRNA 中m7G修饰水平增加(图3A)。在正常培养条件下,oeWT METTL1 显著促进HCC细胞生长(图3B)、克隆形成(图3C、3D)、迁移(图3E、3F)和侵袭(图3G、3H)。然而,过表达无催化活性突变体METTL1 对HCC的进展影响甚微(图3B-3H)。同样,在亚致死热处理条件下,过表达 WT METTL1 而非突变体METTL1显著促进HCC细胞的恶性发展(图3B-3H)。这些数据表明,在亚致死性热应激下,METTL1以m7G tRNA甲基转移酶活性依赖的方式对HCC细胞恶性化至关重要。
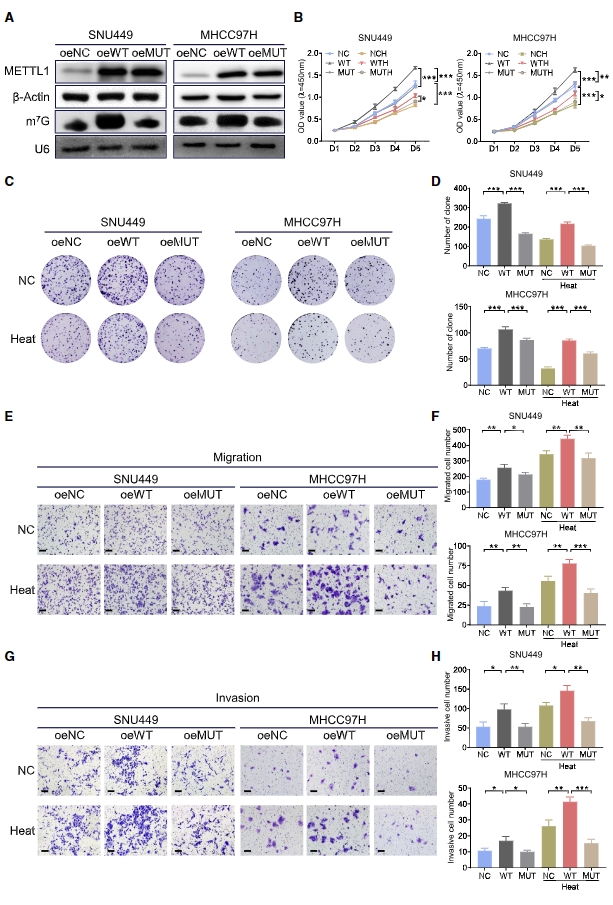
图3. 过表达METTL1以m7G tRNA 修饰依赖的方式促进HCC细胞在亚致死热应激后的恶性能力
4. 亚致死热应激通过METTL1-m7G 介导的翻译控制机制提高HCC细胞的恶性潜能
TRAC-seq结果显示,亚致死热处理后,HCC细胞中的tRNA m7G修饰显著上调(图4A、4B)。此外,大多数经m7G修饰的tRNA的表达水平在亚致死热处理后也有所提高,尤其是ThrTGT和LysCTT tRNA(图4C)。翻译预测进一步发现,亚致死热应激后,关键EMT 基因SLUG和SNAIL的翻译效率显著增加,而敲除METTL1会减少热处理HCC细胞中这两个基因的mRNA翻译(图4D 和4E)。消耗METTL1会显著降低SLUG 和SNAIL 的蛋白水平和mRNA 翻译效率,这表明METTL1 促进热处理HCC细胞中SLUG和SNAIL mRNA的翻译(图4F、4G)。此外,tRNA LysCTT在热处理后显著增加(图4C)。这些数据表明,m7G tRNA,特别是tRNA LysCTT,以依赖于密码子频率的方式调节SLUG 和SNAIL的翻译。因此,作者进行LysCTT挽救实验,发现在缺失METTL1 的细胞中过表达LysCTT可在热致死性应激后挽救SLUG 和SNAIL 的蛋白水平(图4H),从而加强METTL1介导的tRNA m7G修饰与SLUG和SNAIL mRNA 翻译之间的功能联系。
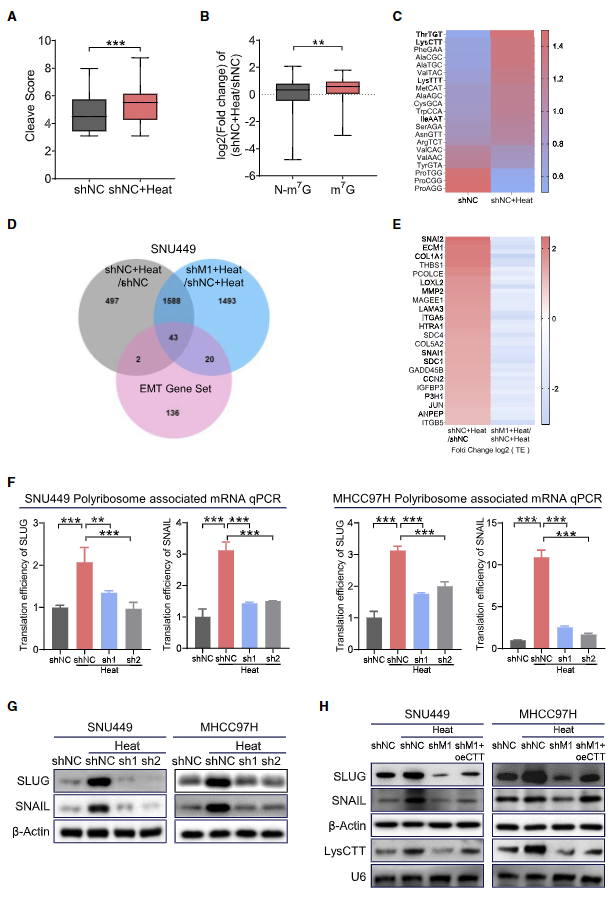
图4. 亚致死热应激以m7G tRNA密码子频率依赖的方式提高SLUG/SNAIL的翻译效率
5. SLUG/SNAIL异位表达挽救亚致死性热应激下METTL1 敲低的 HCC 细胞的恶性能力
在METTL1稳定敲除的HCC细胞中过表达SLUG/SNAIL进行挽救试验(图5A)。数据显示,在亚致死性热应激下,过表达SLUG或SNAIL能显著促进METTL1敲除HCC细胞的生长和菌落形成(图5B-5D)。此外,在过表达SLUG/SNAIL后,METTL1敲除的HCC细胞的迁移和侵袭能力得到恢复(图5E-5H)。因此,SLUG/SNAIL是METTL1的重要下游靶标,在亚致死性热应激下提高HCC细胞的恶性潜能。

图5. SLUG/SNAIL异位表达挽救亚致死性热应激下METTL1敲低的HCC细胞的恶性能力
6. METTL1 加速体内热处理后HCC的转移
利用体内HCC转移模型进一步研究METTL1在IRFA后HCC复发中的致癌功能。在脾内注射模型中,将经过热处理的METTL1敲除的MHCC97H细胞和对照细胞注入NCG小鼠脾脏,以评估肝转移情况(图6A)。数据显示,经热处理的对照组细胞形成了更多的肝转移瘤(7/7),而 METTL1 敲除组则显著减少HCC肿瘤(分别为3/7和2/7)(图 6B-6F)。此外,肿瘤组织中METTL1、WDR4、Ki-67、SLUG和SNAIL 的表达水平以及m7G tRNA的修饰水平在热处理对照组中均有所上升,而在METTL1敲除组中则有所下降(图6G-6M)。进一步用敲除METTL1的MHCC97H细胞建立尾静脉注射模型(图7A),以评估 METTL1在热处理后调控肺转移的功能。结果发现,正如预期的那样,热处理后对照细胞组出现更多的肺转移(图7B、7D和7E)。肺重量与体重的比值也显示亚致死性热应激诱导的肺转移负担更高(图7C)。重要的是,消耗METTL1显著抑制HCC 细胞的肺转移和增殖活性,这一点从尾静脉注射模型中肿瘤负荷的减少和Ki-67水平的降低可以看出(图7F-7I)。因此,这些数据揭示METTL1 在热处理后对体内转移的促进具有重要作用。

图6. METTL1缺失在体内显著抑制亚致死性热应激下HCC细胞的肝内转移
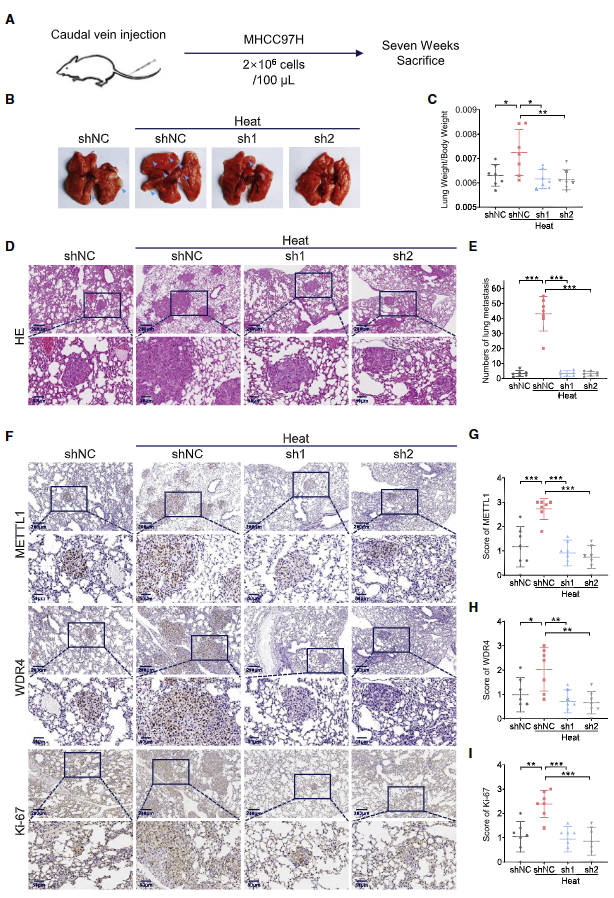
图7. METTL1缺失在体内显著抑制亚致死性热应激下HCC细胞的肺转移
7. METTL1在体内促进IRFA后的HCC转移
在原位异种移植HCC模型中进行IRFA。8周后对小鼠进行解剖以评估不同器官(包括肝脏和肺脏)的转移情况(图8A)。对所有组织进行HE染色定量后,发现shNC + IRFA 组(7/7)肝内转移较多(图8B、8C、8E 和8F)。值得注意的是,在shNC + IRFA 组发现了肝外转移,包括肺、腹壁、脾、肾、膈、肠和肠系膜(图8D、8G、8H)。正如预期的那样,METTL1基因敲除显著抑制IRFA 诱导的肝转移和其他器官转移,尤其是肺转移的趋势。这些数据证明METTL1在IRFA后促进HCC转移的关键生理功能。
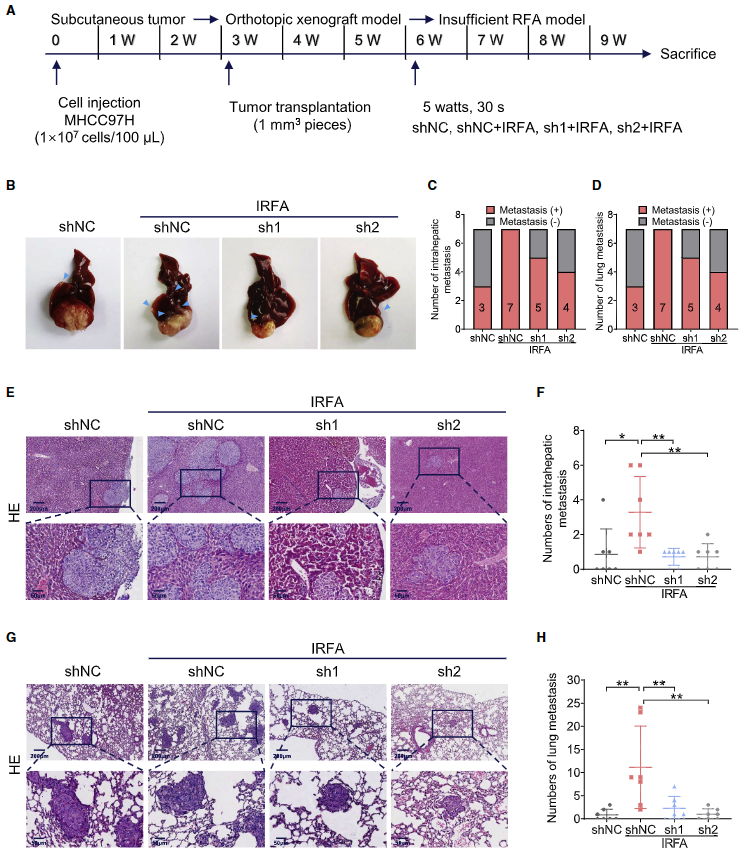
图8. METTL1在体内促进IRFA后的HCC转移
结论
综上所述,本研究提供了证据,证明在亚致死热应激下,METTL1通过促进SLUG/SNAIL mRNA翻译,以m7G tRNA修饰依赖的方式促进HCC转移,为防止射频热消融治疗后HCC转移提供了分子基础。
实验方法
细胞培养,动物实验,细胞活力和克隆形成检测,细胞周期和细胞凋亡检测,迁移和侵袭实验,RNA提取和RT-qPCR,northern blot,northwestern blot,western blot,HE染色,免疫组化分析,多聚核糖体结合mRNA测序, m7G tRNA还原和断裂测序(TRAC-seq),质粒构建和慢病毒转导,体外亚致死热处理模型构建,体内射频消融不充分(IRFA)实验,IRFA动物模型构建,转移动物模型构建
参考文献
Zhu S, Wu Y, Zhang X, Peng S, Xiao H, Chen S, Xu L, Su T, Kuang M. Targeting N7-methylguanosine tRNA modification blocks hepatocellular carcinoma metastasis after insufficient radiofrequency ablation. Mol Ther. 2023 Jun 7;31(6):1596-1614. doi: 10.1016/j.ymthe.2022.08.004. Epub 2022 Aug 13. PMID: 35965412; PMCID: PMC10278047.






