心肌梗死后,乳酸诱导Snail1乳酸化促进内皮-间充质转化

高乳酸水平与心脏病患者的预后和死亡率呈正相关。内皮-间质转化(EndoMT)在心脏纤维化中起着重要作用。本研究中,作者报告了乳酸的新功能,即在心肌梗死(MI)后,通过促进EndoMT增加心脏纤维化并加剧心功能不全。机制上,乳酸能上调缺氧/ MI后Snail1的核转位和乳酸化。抑制Snail1可改善MI后乳酸诱导的心脏功能障碍,抑制乳酸刺激的EndoMT、Snail1的乳酸化和TGF-β/Smad2信号的激活。该研究于2023年2月发表在《Science Advances》,IF:13.6。
技术路线





主要研究结果
1. 减少乳酸改善MI后的心功能和心脏纤维化
腹腔注射糖酵解抑制剂2-脱氧-D-葡萄糖(2-DG)降低乳酸水平。2-DG 抑制MI引起的血清和心脏乳酸水平(图1A、B)。值得注意的是,2-DG MI 小鼠的射血分数(EF%)和缩短分数(FS%)水平高于对照组MI小鼠(图1C、D)。2-DG MI小鼠的左心室舒张末期容积(LVEDV)和左心室收缩末期容积(LVESV)值低于对照MI小鼠(图E、F)这表明抑制乳酸生成改善MI后的心脏功能。此外,Masson三色染色显示给予2-DG减少MI后的心脏纤维化(图 1G)。这些数据表明乳酸的产生促进MI诱发的纤维化和心功能不全。
2. 增加乳酸生成加剧MI后的心功能不全和心脏纤维化
在诱导MI3小时后给小鼠补充乳酸,在MI1周和4周后用超声心动图评估心脏功能。图1H显示,腹腔注射乳酸(0.5 g/kg体重7天后,血清乳酸浓度恢复到正常水平。与假手术组相比,MI 显著降EF% 和FS% 的值(图1I 、J)与 MI 组相比,注射乳酸进一步降低EF%(7 天时降低14.0%,28 天时降低19.5%)和FS%(7 天时降低15.8%,28 天时降低21.6%)的值(图1I、J)。同样,乳酸处理也增加MI后LVEDV和LVESV的水平(图1K、L)这些数据共同表明,乳酸水平升高加重MI后的心脏功能障碍。Masson三色染色表明乳酸给药显著诱导MI小鼠的心脏纤维化(图1M)。

图1. 乳酸水平升高导致MI后心脏功能障碍恶化和心脏纤维化增加
3. 抑制乳酸生成减轻MI后的心脏EndoMT
与假手术组相比,MI诱导内皮标志物CD31和VE-cadherin(VE-钙粘蛋白)表达(图 2A)以及间充质标志物成纤维细胞特异性蛋白1(FSP1)、α-平滑肌肌动蛋白(α-SMA)和Collagen1a1 表达(图 2A)明显增加。施用2-DG抑制乳酸产生提高 CD31和VE-cadherin的表达,同时消除MI诱导的 Collagen1a1、α-SMA和FSP1 的减少(图2A)。同样,用2-DG 处理上调内皮标志物Cdh5和Kdr的mRNA水平(图2B)。相反,2-DG下调间质标志物Atca2、Col1a1、Fn1和S100a4的mRNA 表达(图2B)。总之,这些数据表明抑制乳酸减弱MI后的EndoMT进程。在添加或不添加2-DG的内皮细胞特异性绿色荧光蛋白(GFP)标记小鼠(TIE2GFP)中诱导MI,并用抗GF(绿色)和抗FSP1(红色)抗体对心脏组织进行免疫荧光染色。如图2C所示,与假手术组相比,MI 诱导GFP与FSP1的共定位。与此相反,2-DG抑制乳酸产生减轻MI诱导的GFP与FSP1的共定位,表明2-DG减少MI刺激的心肌EndoMT。此外,在MI或假手术后7天,从获得的心脏中分离出内皮细胞,流式细胞术检测分化成肌成纤维细胞的内皮细胞百分比。如图2D所示,从假手术组小鼠体内分离的内皮细胞显示,抗 CD31 和抗 CD114(内皮细胞标记物)抗体染色的GFP细胞最多,几乎检测不到Gp38(心脏成纤维细胞标记物)染色(图2E)。然而,MI明显增加GFP标记的内皮细胞中Gp38阳性染色细胞的数量和百分比。相反,用2-DG处理可抑制MI 诱导的Gp38阳性内皮细胞。
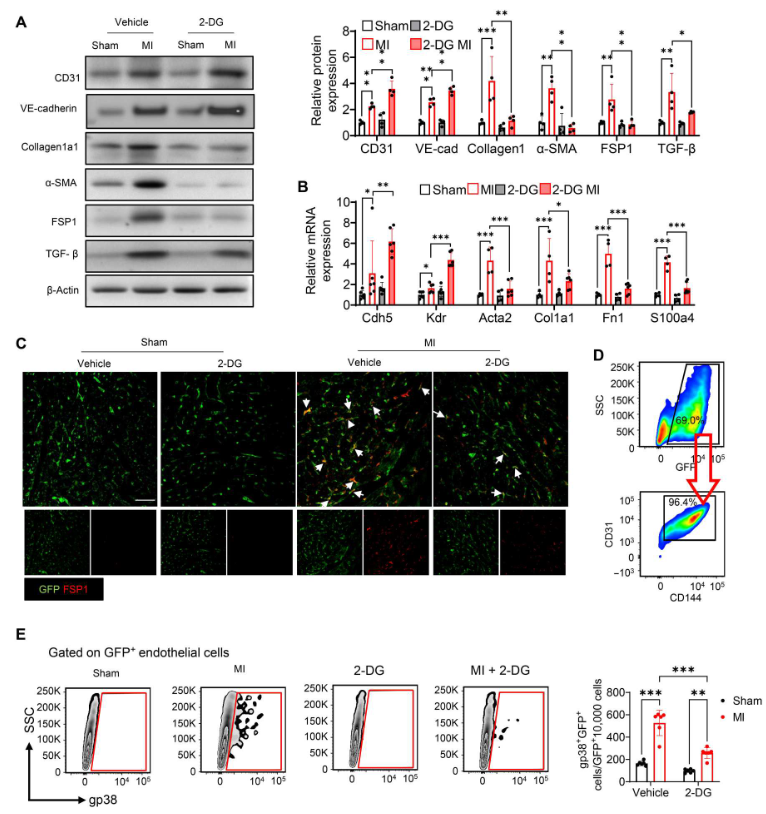
图2. 2-DG减弱MI诱导的EndoMT
4. 高水平乳酸促进MI后心肌中的EndoMT
WB显示,对MI小鼠补充乳酸降低内皮细胞标记物(CD31和VE-cadherin)的水平,促进间充质标记物(FSP1、α-SMA和Collagen1a1)的表达(图3A)qRT-PCR显示,乳酸水平升高导致MI后Cdh5和Kdr mRNA水平降低(图3B、C),并诱导Col1a1、Fn1和S100a4 mRNA水平升高(图3D- F),表明乳酸诱导MI 后的EndoMT。用抗 GFP(绿色)和抗 FSP1(红色)抗体进行免疫荧光染色显示,与假手术组小鼠相比,MI 诱导GFP和FSP1的共定位(图3G),这表明乳酸盐处理后有更多的内皮细胞分化成成纤维细胞。同样,流式细胞术显示,MI 后乳酸盐处理进一步上调GFP+gp38+ 细胞的数量(图3H),表明乳酸盐促进MI后的EndoMT。

图3. 补充乳酸盐促进MI后的EndoMT
5. 缺氧后,乳酸盐刺激内皮细胞迁移、降低VE-cadherin的表达,并促EndoMT
进行伤口愈合试验和EdU掺入试验,图4A显示,与常氧对照组相比,缺氧加速内皮细胞的迁移。此外,10 mM(而非5 mM)的乳酸显著促进缺氧诱导的伤口愈合(图4A),表明乳酸盐能诱导缺氧挑战下的内皮细胞迁移。同样,EdU掺入试验再次证明乳酸盐能促进缺氧刺激的内皮细胞增殖(图4B)。VE-cadherin的免疫荧光染色显示,缺氧72小时后,VE-cadherin的完整性受到破坏(图4D)。缺氧后,用10 mM乳酸盐处理进一步破坏内皮细胞表面的VE-cadherin完整性(图4D)。此外,WB和 qRT-PCR 分析显示,与缺氧组相比,乳酸处理显著降低VE-cadherin的水平(图4C、5C),表明乳酸改变缺氧挑战下内皮细胞的表型。用乳酸处理内皮细胞,检测缺氧后EndoMT的标记物。如图5A所示,缺氧72小时后,内皮细胞的形态从典型形状变为拉长的纺锤形外观。与缺氧对照组相比,乳酸处理导致细胞形态发生更大变化。此外,拉长细胞的FSP1染色呈阳性,CD31 染色呈阴性(图5B)。图5C显示,缺氧挑战后,乳酸减少VE-cadherin的表达并诱导α-SMA的释放。进行基于Matrigel的内皮细胞血管生成试验,发现乳酸的施用抑制缺氧诱导的血管生成(图5D)。此外,利用胶原凝胶收缩试验,证实乳酸处理的内皮细胞在缺氧刺激后表现出类似间充质的功能,这表现在胶原凝胶体积减小和收缩力增强(图5E)。总之,这些数据表明缺氧后乳酸诱导EndoMT。
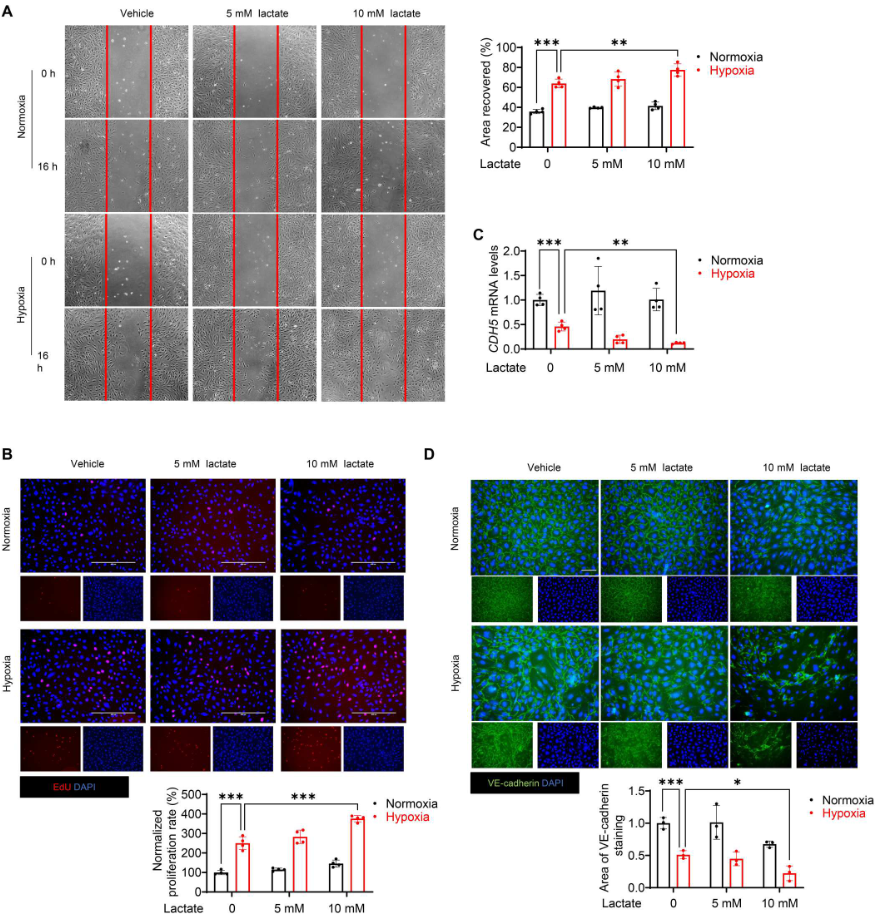
图4. 缺氧后,乳酸诱导内皮细胞迁移并减少VE-cadherin的表达
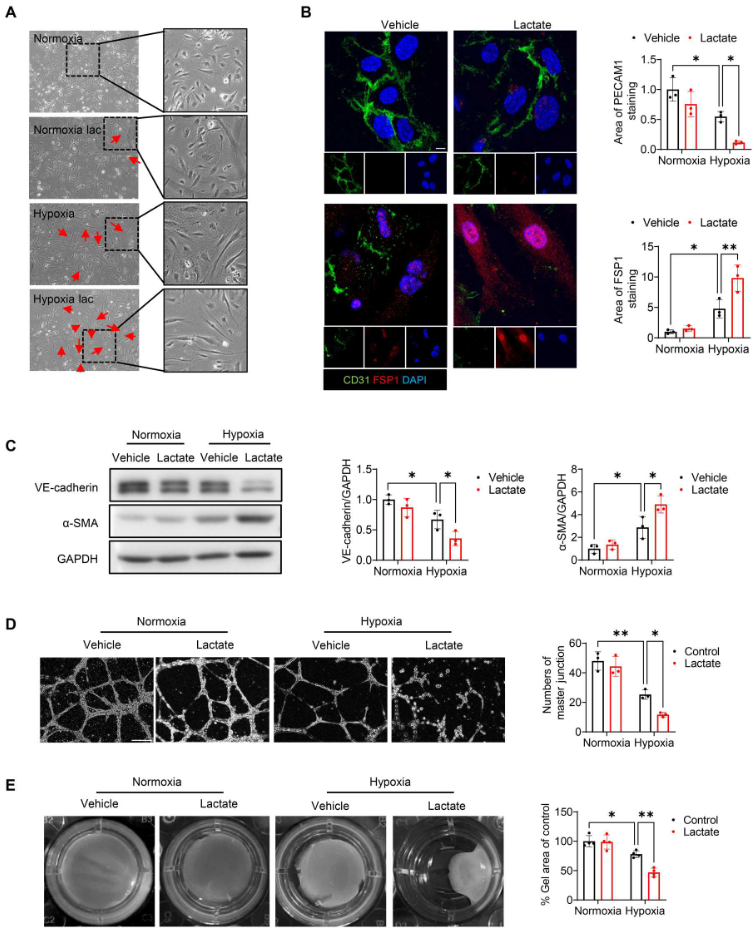
图5. 缺氧后,乳酸促进内皮细胞中EndoMT
6. 缺氧后乳酸激活TGF-β/Smad2信号传导
qRT-PCR显示,在体内乳酸显著加速MI后心肌中Tgfb1和Smad2 mRNA的表达(图6A、B)。然而,乳酸盐并没有改变Smad3的mRNA水平(图6C)。此外,2-DG抑制乳酸的产生降低MI诱导的Tgfb1和Smad2 mRNA表达(图6D、E)。体外研究也表明,乳酸促进缺氧挑战下的人脐带内皮细胞(HUVECs)和HCMECs中TGFB1和SMAD2 mRNA 的表达(图6F、G)。与基因表达水平一致,乳酸处理上调缺氧挑战后Smad2的磷酸化和TGF-β的表达,但不影响 Smad3的磷酸化(图6H)。这些数据综合表明,乳酸诱导的TGF-β/Smad2激活有助于缺氧后的EndoMT。
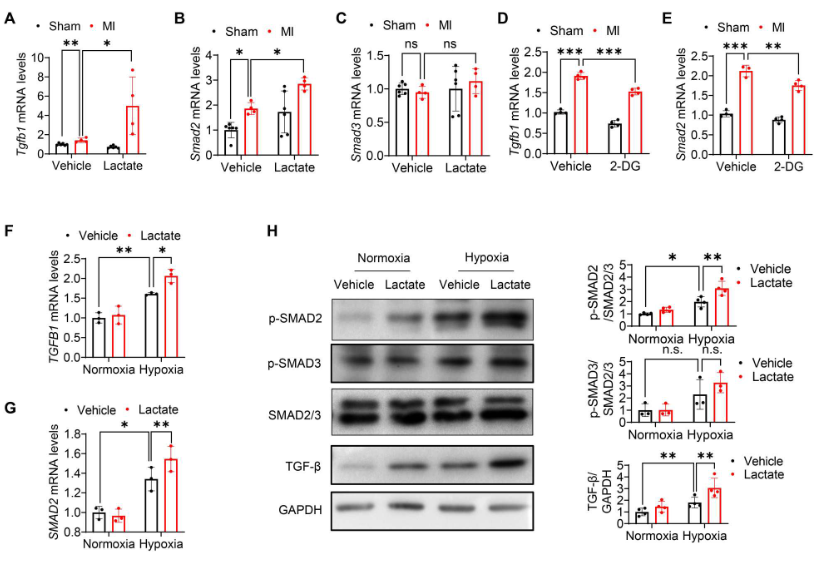
图6. MI/缺氧后,乳酸刺激TGF-β/Smad2信号传导
7. 抑制细胞内乳酸减轻缺氧诱导的EndoMT
CHC[单羧酸盐转运体(MCT)抑制剂α-氰基-4-羟基肉桂酸盐]降低乳酸处理诱导的细胞内乳酸水平(图7A),表明细胞外乳酸是通过MCT 转运到内皮细胞的。此外,服用CHC改善缺氧后乳酸促进的内皮细胞迁移(图7B)。免疫荧光染色显示,CHC阻乳酸处理导致的VE-cadherin表达减少(图7C),而血管形成试验表明,CHC促进缺氧后的血管生成(图7D)。此外,CHC还缓解乳酸诱导的内皮标志物PECAM1、CDH5和KDR mRNA水平的降低(图7E-G)以及间充质标志物ACTA2、FN1和COL1A1 mRNA水平的升高(图7H-J)。用CHC处理抑制乳酸诱导的TGFB1和SMAD2 mRNA的表达(图7K、L)。
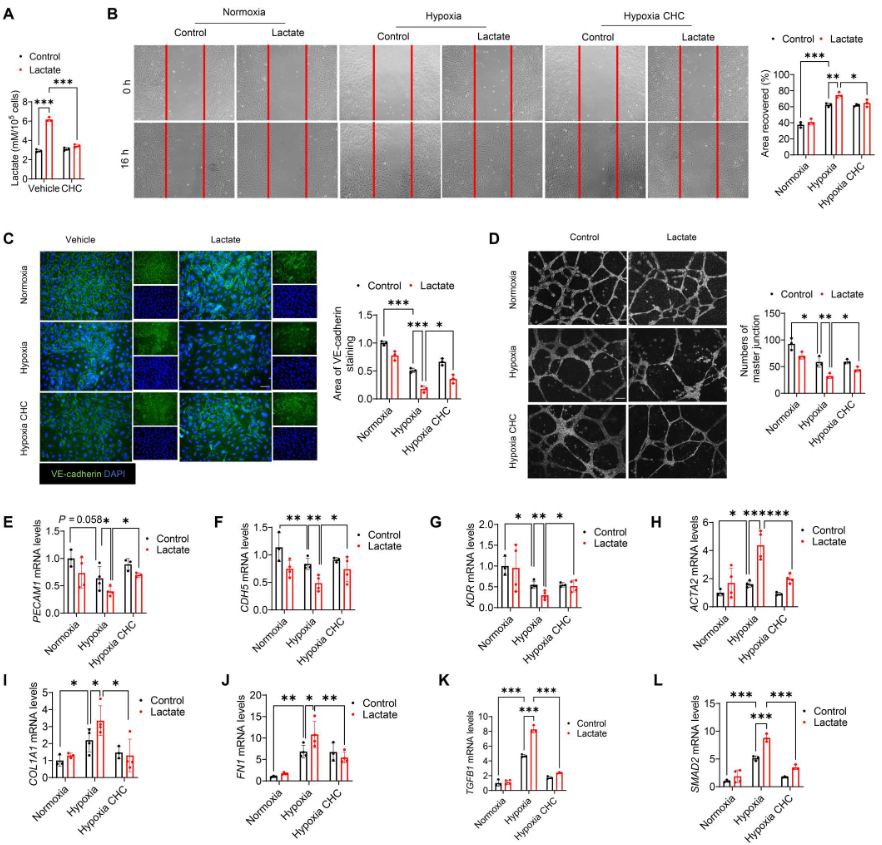
图7. 抑制细胞内乳酸减弱缺氧诱导的EndoMT
8. 缺氧后乳酸促进Snail1的核转位
如图8A所示,单独缺氧不会改变Snail1的胞浆表达。然而,与常氧状态相比,缺氧后Snail1的核表达明显加快。乳酸处理进一步上调Snail1的核转位。免疫荧光染色显示,缺氧后Snail1核表达的阳性率更高,而乳酸进一步诱导Snail1核表达(图8B),表明Snail1的核转位在乳酸促进的EndoMT中发挥重要作用。用抗Snail1抗体进行染色质免疫沉淀(ChIP)实验,图8C显示,在缺氧挑战的细胞中,Snail1与TGFB1 基因一起被大量招募。然而在乳酸处理的缺氧挑战细胞中,TGFB1基因和Snail1蛋白之间的相互作用明显大于缺氧细胞(图8C)。这些数据表明,乳酸促进Snail1蛋白和TGFB1基因的相互作用,从而有助于TGF-β/Smad2介导的EndoMT。
9. 缺氧后乳酸诱导Snail1乳酸化
使用抗Snail1抗体进行免疫沉淀,然后使用抗泛乙酰赖氨酸(Kac)或抗泛乳酸赖氨酸(Kla)抗体进行免疫印迹,结果显示缺氧诱导Snail1的乙酰化和乳酸化。给予乳酸进一步上调Snail1的乙酰化和乳酸化(图8D)。Snail1和CBP/p300之间存在相互作用,缺氧后乳酸处理促进它们之间的相互作用(图8D)。然而,给予CHC抑制细胞内乳酸可减轻乳酸促进的Snail1和CBP/p300之间的相互作用,以及Snail1的乙酰化和乳酸化(图8E)。反过来,与缺氧组相比,乳酸处理也显著增加抗CBP抗体、抗p300抗体、抗pan-Kla抗体和抗pan-Kac抗体免疫沉淀中Snail1的表达(图8F)。相比之下,给予CHC可减少Snail1与CBP/p300 之间的相互作用以及Snail1的乳酸化和乙酰化(图8F)。
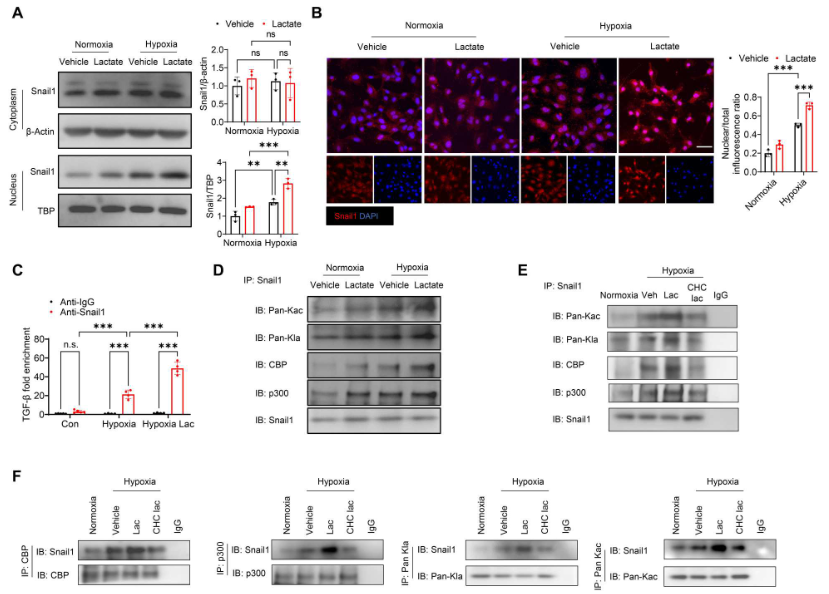
图8. 缺氧后,乳酸促进Snail1的核转位和乳酸化
10. 沉默Snail1减弱缺氧后的EndoMT和TGF-β/Smad2激活
通过转染特异性siRNA沉默Snail1逆转缺氧后乳酸诱导的CD31和VE-cadherin下调(图9A)。相反,抑制Snail1阻止乳酸促进的间充质标志物α-SMA 和FSP1的表达(图9A)、SMAD2磷酸化和TGF-β激活(图9H)。qRT-PCR观察到在乳酸处理下,敲除Snail1提高PECAM1、KDR和CDH5的mRNA水平(图9B-D),降低ACTA2、COL1A1和S100A4的mRNA水平(图9E-G)。此外,沉默Snail1降低乳酸诱导的SMAD2和TGFB1 mRNA水平(图9I、J)。
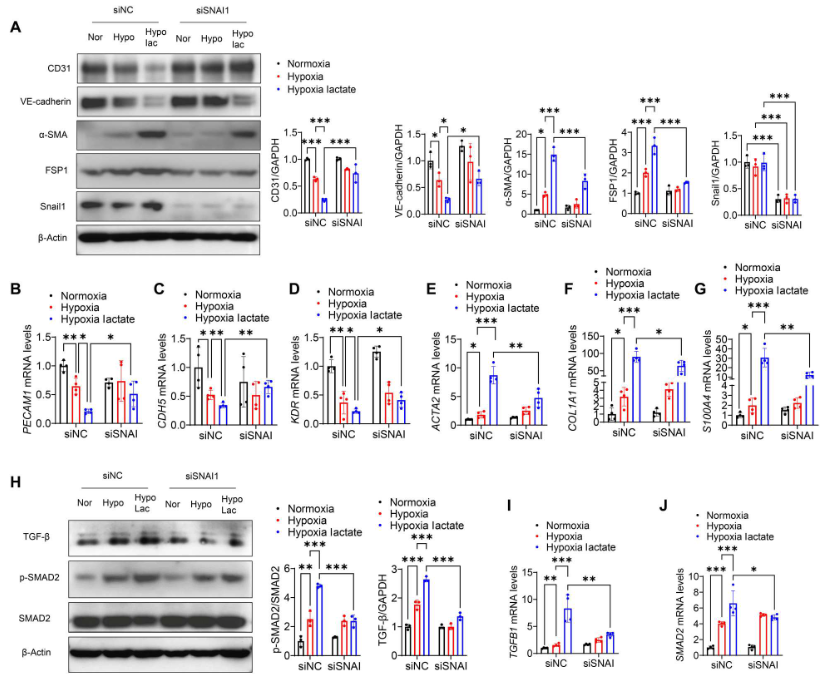
图9. 沉默Snail1减轻缺氧后的EndoMT和TGF-β/Smad2的激活
11. 沉默Snail1改善MI后的心脏功能并减弱EndoMT
如图10(A和B)所示,与假手术组相比,MI显著促进Snail1的乳酸化和乙酰化,以及Snail1与CBP/p300之间的相互作用。乳酸给药进一步诱导它们之间的相互作用(图10A)。用2-DG处理减轻MI诱导的Snail1与CBP或p300之间的相互作用,并减少Snail1乙酰化和乳酸化(图10B)。转染特异性Snail1 siRNA,WB和免疫荧光染色证实,施用siSnai1显著降低Snail1在心脏中的表达(图10C、D)。然而,沉默Snail1逆转乳酸降低的EF%和FS%水平(图10E、F),并防止MI后乳酸诱导的LVEDV和LVESV水平升高(图10G、H),表明Snail1的缺失改善乳酸诱导的心脏功能障碍。此外,与MI后乳酸处理相比,沉默Snail1提高Cdh5和Kdr mRNA的表达(图10I、J),降低Acta2、Fn1和S100a4 mRNA的表达(图10K-M),表明Snail1有助于MI后乳酸诱导的EndoMT。这些数据表明,Snail1通过激活TGF-β/Smad2信号在乳酸促进的EndoMT中发挥重要作用(图10N)。
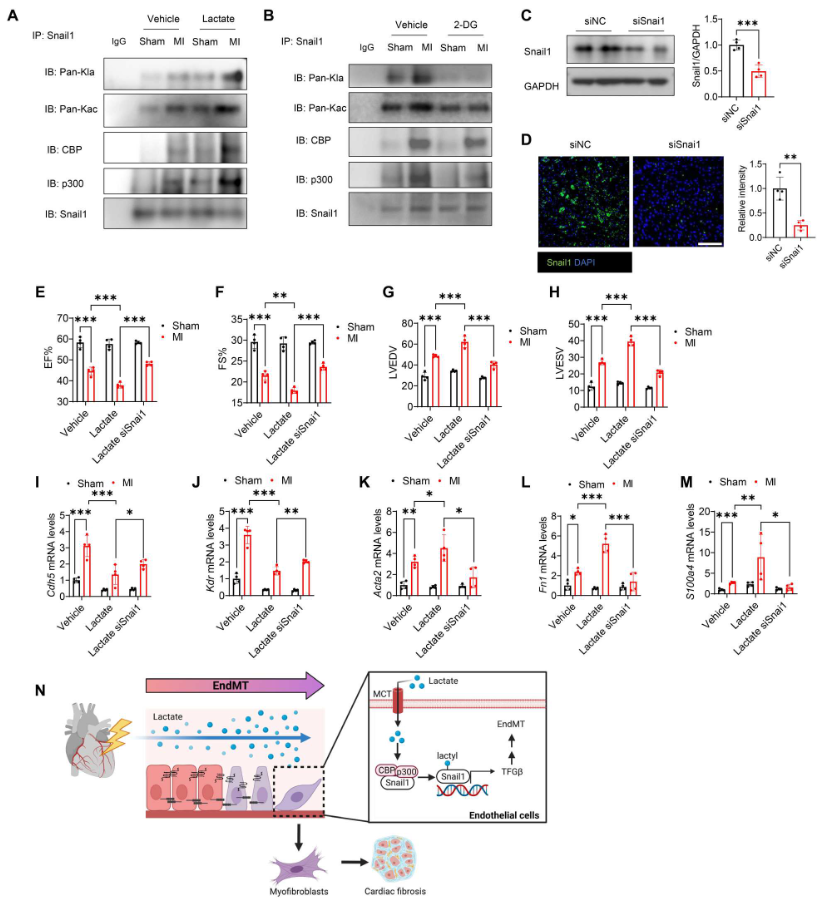
图10. 沉默Snail1减轻MI后Snail1的乳酸化和EndoMT
结论
综上所述,本研究发现乳酸发挥一种以前未知的功能,即在MI及缺氧后,乳酸通过激活TGF-β/ Smad2通路诱导EndoMT增加心脏纤维化并加剧心功能不全。这些发现加深了我们对乳酸在MI后EndoMT中作用的理解,并将成为开发创新疗法以改善MI后心脏重塑和功能的基础。
实验方法
siRNA体内转染,Masson三色染色,2,3,5-三苯基氯化四氮唑染色,2,3,5-三苯基氯细胞凋亡检测,乳酸测定,流式细胞术,小鼠心脏内皮细胞的分离,细胞培养,增殖测定,血管生成试验,胶原凝胶收缩实验,免疫荧光,WB,qRT-PCR,免疫沉淀,ChIP-qPCR
参考文献
Fan M, Yang K, Wang X, Chen L, Gill PS, Ha T, Liu L, Lewis NH, Williams DL, Li C. Lactate promotes endothelial-to-mesenchymal transition via Snail1 lactylation after myocardial infarction. Sci Adv. 2023 Feb 3; 9 (5): eadc9465. doi: 10.1126/ sciadv. adc9465. Epub 2023 Feb 3. PMID: 36735787; PMCID: PMC9897666.






