“中性粒细胞胞外陷阱”+“心肌细胞”助力房颤研究
心房颤动(房颤)是一种常见的心律失常,与心血管疾病的发病率和死亡率有关。中性粒细胞胞外诱捕网(NETs)是中性粒细胞释放的具有胞浆蛋白的DNA片段,参与多种心血管疾病。为了阐明NETs在AF中的作用,作者研究了NETs对AF进展的影响以及NETs在AF中的分泌情况。结果表明:NETs诱导了心肌细胞的自噬凋亡,NETs还通过促进线粒体去极化和ROS产生导致线粒体损伤。持续的快速起搏导致心肌细胞结构丧失,并提供强有力的刺激诱导中性粒细胞分泌NETs。同时,AF中增加的AngⅡ通过上调AKT磷酸化促进NETs形成,但由于未诱导自噬,AngⅡ不能直接启动NETosis。在体内实验中,脱氧核糖核酸酶I被用来抑制NETs的形成,AF相关的纤维化也得到了预期的改善。相应地,诱发AF的持续时间减少。作者的研究阐明了NETs在AF中的形成机制,并证明了NETs通过诱导线粒体损伤和自噬性细胞死亡对心肌细胞的致死作用,这全面描述了NETs和心肌细胞分泌的刺激组成的正反馈维持AF和AF相关纤维化的进展。本研究于2023年7月发表于杂志《Signal Transduction and Targeted Therapy》上,IF:39.3。
技术路线
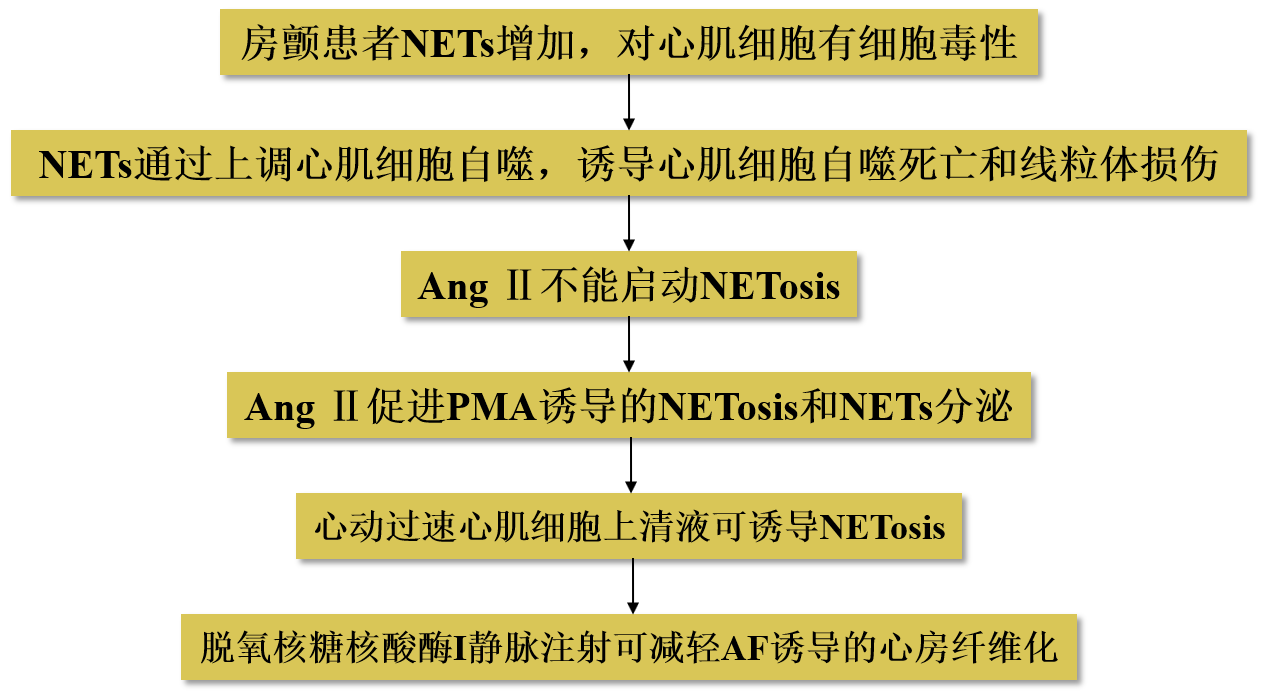
主要研究内容
1、NETs与房颤有关
为探讨NETs与AF的可能关系,作者首先收集了AF或窦性心律(SR)患者的外周血。采用抗髓过氧化物酶(MPO)捕获抗体和抗dsDNA检测抗体的复合酶联免疫吸附试验(ELISA)测定NETs的相对浓度。如预期的那样,AF患者外周血NETs水平显著高于SR患者(图1a)。同时比较左心耳组织匀浆中NETs浓度,也观察到类似的趋势(图1b)。在AF患者冠状静脉窦口处采集冠状动脉血液,并与外周血中NETs浓度进行比较。有趣的是,血液通过冠状动脉循环后NETs水平降低(图1a)。因此,作者推测NETs可能在冠状动脉血管中充血,这与心肌梗死(MI)的情况类似。为验证这一假设,在左心耳切面进行了免疫荧光染色,以识别和定位NETs,表明AF患者左心耳和冠状动脉血管中NETs的形成(图1c)。然而,与MI后NETs主要集中在冠状动脉血管不同,AF中的NETs也分布于冠状动脉血管外(图1d)。
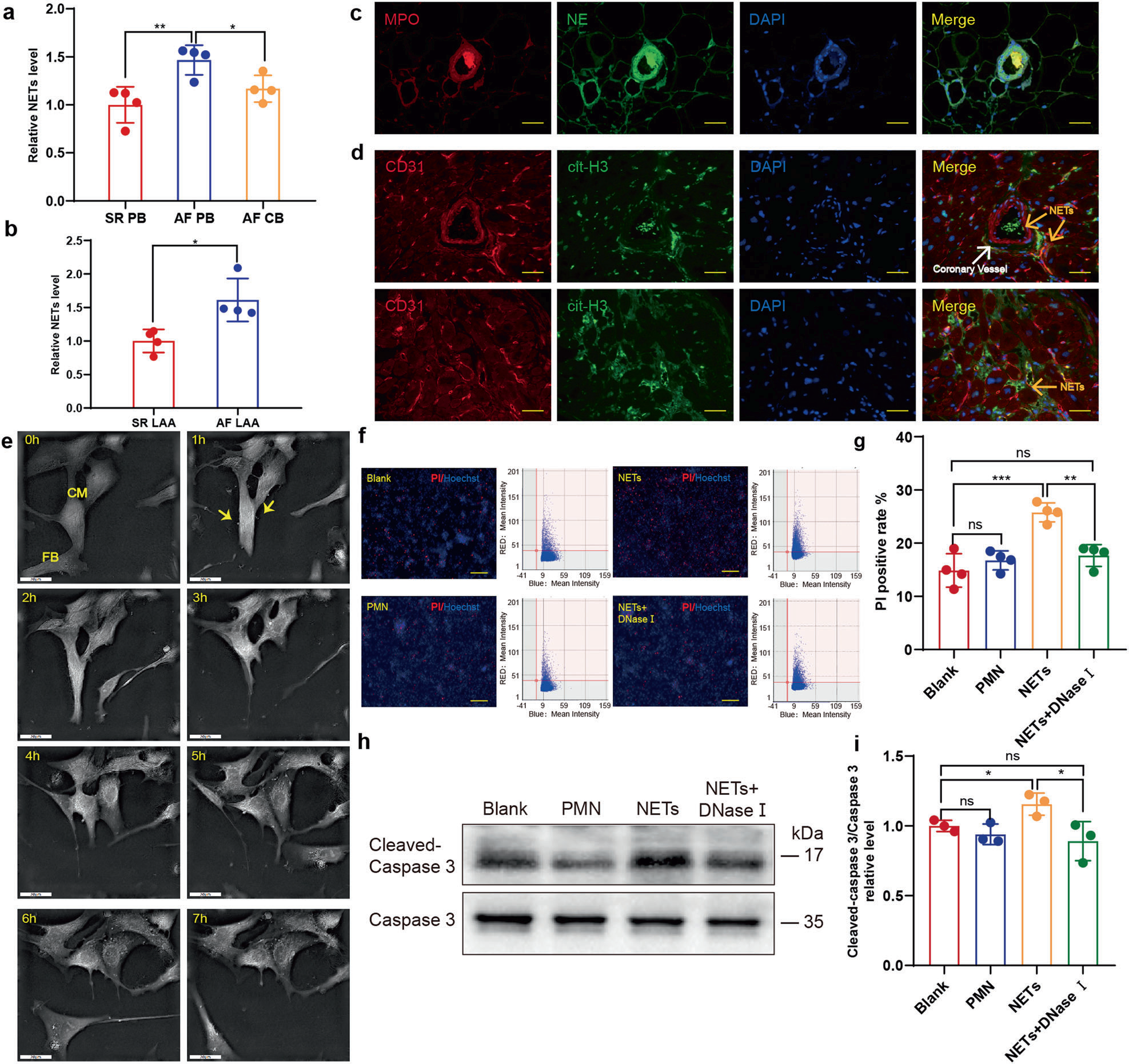
图1 房颤患者NETs增加,对心肌细胞有细胞毒性
2、NETs通过促进自噬导致心肌细胞凋亡
作者之前报道,NETs单独激活Smad和MAPK信号通路,进一步诱导成纤维细胞向肌成纤维细胞分化。考虑到心脏重塑所必需的心肌细胞的丢失以及NETs含有丰富的细胞毒性蛋白酶,作者进一步研究了NETs对心肌细胞是否具有毒性。在Nanolive 3D-全息显微镜下,作者连续监测了与NETs孵育的心肌细胞,在心肌细胞中观察到萎缩和核周颗粒增加(图1e)。由于一些原代心肌细胞可能无法粘附在板上并发生凋亡,因此细胞残留经常被发现粘附在正常的细胞上。而在流式细胞术中,附着的残留物可能导致贴壁细胞的误判。为更精确地识别死亡的心肌细胞,通过Celigo全视野分析代替碘化丙啶(PI)和Hoechst染色的联合染色。正如预期的那样,在NETs孵育的孔中PI阳性率升高(图1f,g),WB检测发现cleaved caspase3 / caspase 3的类似趋势,进一步得到支持(图1h,i)。这些结果表明NETs对心肌细胞的细胞毒性作用。
NETs孵育后,心肌细胞核周颗粒明显增多。由于在自噬过程中增加的溶酶体也会迁移到核周区域,作者进一步研究了自噬是否可能参与了NETs诱导的细胞死亡。19免疫荧光染色显示,与NETs孵育后,自噬水平上调(图2a)。相应地,p62和Beclin-1的蛋白水平也增加了(图2b , c)。为了进一步研究NETs是否诱导心肌细胞自噬性死亡,使用3甲基腺嘌呤(3-MA)阻断自噬。如预期的那样,3-MA部分削弱了增加的cleaved caspase3(图2d , e)。通过PI染色和Celigo分析(图2f , g)也验证了3-MA对NETs诱导的心肌细胞凋亡的保护作用。

图2 NETs通过上调心肌细胞自噬,诱导心肌细胞自噬死亡和线粒体损伤
3、NETs通过促进线粒体去极化和活性氧的产生而导致线粒体损伤
由于线粒体是心肌细胞收缩所必需的能量供应,而功能失调的线粒体产生过量的活性氧(ROS)可以促进死亡,因此分析了NETs对心肌细胞线粒体的影响。心肌细胞中肿胀的线粒体与NETs孵育后显著增加(图2h)。为进一步阐明NETs对线粒体的损伤作用,分别使用JC-1和MitoSOX比较线粒体膜电位和线粒体ROS(mtROS)的产生。正如预期的那样,NETs导致线粒体膜电位去极化(图2i,j)。心肌细胞经NETs孵育后,线粒体ROS生成也增加(图2k,l)。
4、仅Ang II不能直接启动NETosis
炎症可以促进AF的进展,反过来,AF又可以促进炎症。然而,与MI相比,AF相关的炎症反应较弱,其中丰富的促炎细胞因子和氧化剂诱导NETosis。除了炎症相关的刺激外,其他分子也普遍存在诱导NETosis的能力。Akt是NOX依赖的NETosis所必需的,在NETosis过程中,Akt的磷酸化水平上调。既往研究表明,AF中AngⅡ升高可诱导心脏重构,而Akt的磷酸化可被AngⅡ1型(AT1)/受体信号通路激活而上调。与之前的报道类似,作者发现在AF患者的外周血中Ang II升高(图3a)。Chrysanthopoulou等报道0.1 nM AngⅡ以ROS /自噬依赖的方式显著诱导NETosis。然而,作者的结果表明AngⅡ诱导细胞凋亡而不是NETosis。作者首先通过SYTOX Green染色和Celigo全视野分析比较了中性粒细胞与Ang II共孵育后NETs的分泌情况,发现中性粒细胞与Ang II共孵育后细胞游离DNA(cell-free DNA,cfDNA)增加(图3b,c)。然而,在相应的Celigo IF图片中,缺乏典型的NETs结构(图3b)。
考虑到死亡细胞的细胞核也可以被SYTOX Green染色,作者进一步测定了cleaved caspase 3的蛋白水平,发现Ang II诱导的中性粒细胞凋亡呈剂量依赖性(图3d,e)。此外,作者发现AngⅡ也不上调中性粒细胞的自噬(图3f-h)。
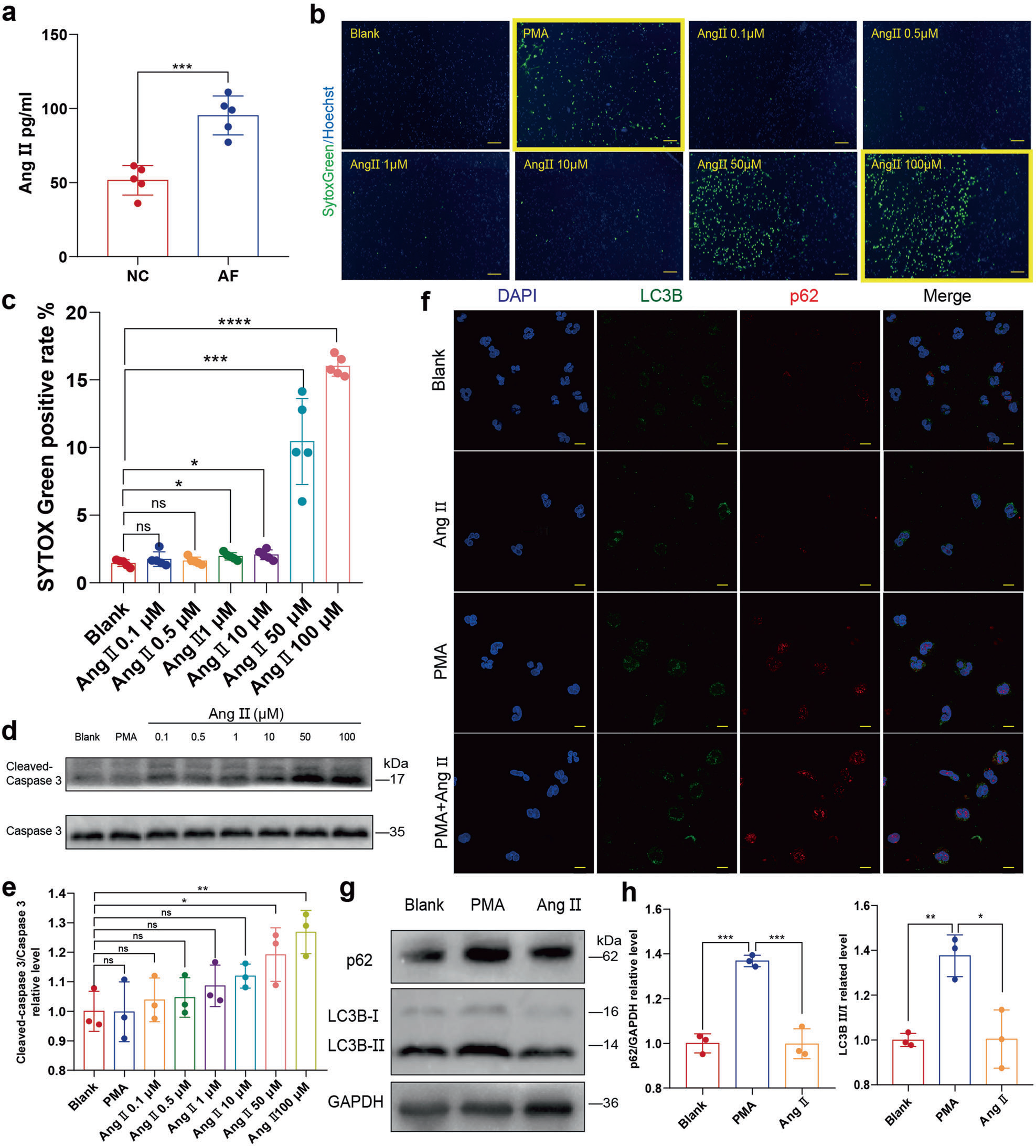
图3 AngⅡ不能启动NETosis
5、Ang II促进PMA诱导NETosis
醋酸豆蔻酸盐二萜醇(PMA),一种常见的佛波酯,强烈诱导中性粒细胞的活化。由于AngⅡ不能直接启动NETosis,作者接下来研究了AngⅡ对PMA诱导的NETosis的影响。与Ang II立即诱导中性粒细胞凋亡不同,在PMA和Ang II(浓度小于10 μM)孵育的大鼠中性粒细胞中没有观察到cleaved caspase 3的增加(图4a、b)。当PMA和AngⅡ共同孵育时,Akt的磷酸化进一步上调,但与单独AngⅡ孵育相比,磷酸化Akt的增加并不显著。在自噬方面,作者发现当中性粒细胞与10 nM PMA和10 μM Ang II共孵育时,LC3BII/I比值上调,然而,较高的Ang II浓度(100 μM)似乎可以逆转PMA和Ang II单独孵育的促自噬作用,并以剂量依赖的方式降低LC3BII/I比值。此外,共孵育导致中性粒细胞中更高的ROS产生(图4c)。似乎当PMA等强刺激超过其抗自噬作用时,AngⅡ可能发挥促NETosis作用。因此,作者推测AngⅡ可能通过间接协同刺激如PMA来促进NETosis,而不是直接启动这种特殊的细胞死亡。
分离供者外周血中性粒细胞,分别与PMA或PMA +AngⅡ孵育。由于10 μM的AngⅡ没有诱导明显的细胞凋亡,因此在后续的实验中大多采用这一浓度。PMA与AngⅡ共孵育显著增加SYTOX Green阳性率,比AngⅡ或PMA单独作用产生的SYTOX Green阳性率增加更显著(图4d,e)。通过IF染色进一步研究NETs分泌情况。用PMA刺激中性粒细胞30 min后,细胞核的去浓缩过程正在进行,这在有或没有Ang II存在的中性粒细胞中都没有观察到。同样,当血管紧张素浓度达到100 μM时,NETs结构也消失,大量分叶状细胞核(仍为浓缩状)被染色。此外,单独加入PMA和单独加入10 μM Ang II的SYTOX Green计数的平均值远低于共孵育的SYTOX Green计数,说明Ang II具有促进因子的作用(图4f,g)。在组蛋白3瓜氨酸化中也观察到类似的趋势(图4h,I)。总体而言,AngⅡ可以促进NETosis,而不是直接启动NETosis。

图4 Ang Ⅱ促进PMA诱导的NETosis和NETs分泌
6、速搏新生大鼠心肌细胞上清液可诱导NETosis,其表现为线粒体DNA增加和高流动性组盒1分泌增多
由于单独升高的AngⅡ并不能诱导NETosis的发生,因此AF中必须存在其他可能的刺激源才能诱导NETosis的发生。Mallavia等报道NETs形成可由线粒体DNA(mitochondrial DNA,mtDNA)触发,Wiersma等证明心肌细胞在快速起搏后发生线粒体功能障碍。因此,作者推测快节奏的心肌细胞可能通过释放mtDNA来诱导NETosis。为证明这一假设,作者在乳鼠心肌细胞上进行了如前所述的快速起搏(6 Hz,40 V,10 ms脉冲)作为实验性AF或正常起搏作为阴性对照(1HZ,40 V,10 ms脉冲),并收集上清。在显微镜下连续监测起搏过程,作者发现在电刺激1 h后观察到结构损伤,心肌细胞没有从持续的快速起搏中存活(图5a)。作者首先比较了两组细胞的cfDNA和mtDNA水平,发现在快速起搏3 h后,细胞上清中的cfDNA和mtDNA水平均升高(图5b,c)。此外,作为cfDNA一部分的mtDNA比cfDNA增加的幅度更大。除了升高的mtDNA外,作者发现高迁移率族蛋白B1(high mobility group box 1,HMGB1)从细胞核转位到细胞质也可以被快节奏诱导,这可能是诱发NETosis的潜在能力(图5d)。
接下来,将分离的大鼠中性粒细胞与佛波酯(PMA)、正常起搏心肌细胞上清液、快节奏心肌细胞上清液、快节奏心肌细胞上清液+ AngⅡ共孵育。大鼠中性粒细胞易分泌云雾状而非尖刺状的NETs,且交联较弱,形成较大的网状结构,难以通过IF显微镜进行识别和定量。因此,本研究采用Celigo全视野分析法,通过SYTOX Green染色胞外DNA来分析NETs分泌情况。如预期的那样,与快节奏的心肌细胞上清液孵育后,SYTOX Green计数增加,并且在额外给予Ang II的情况下,SYTOX Green计数增加更显著,这与PMA相似(图5e,f)。值得注意的是,正常节律的心肌细胞上清降低了NETosis,这表明正常心肌细胞可能分泌某种细胞因子来保护中性粒细胞免受NETosis。

图5 心动过速心肌细胞上清液可诱导NETosis
7、静脉注射DNase I可下调NETs形成,改善房颤相关纤维化,缩短房颤持续时间
NETs是以dsDNA为骨架的网状结构,可被脱氧核糖核酸酶I降解,因此作者研究脱氧核糖核酸酶I是否具有保护作用,是否可以减少AF相关的纤维化和AF持续时间。通过静脉注射氯化钙和乙酰胆碱的混合溶液诱导大鼠AF,并记录心电图(ECG)以确保诱导成功。每隔一天注射一次,连续注射两周,同时额外注射脱氧核糖核酸酶I溶液或相同体积的生理盐水。Western blot检测大鼠左心房(LA)中的瓜氨酸化组蛋白3(cit-H3),比较大鼠NETs的形成(图6a、b)。Masson三色染色显示诱导的AF导致LA中胶原沉积增加,而额外给予脱氧核糖核酸酶I可以缓解这种情况(图6c,d)。在胶原蛋白I(Col I)、磷酸化Smad2(p-smad2)和磷酸化p38(pp38)的蛋白水平也观察到类似的趋势(图6e,f)。此外,脱氧核糖核酸酶I有效地改善了诱发AF的成功率和持续时间(图6g)。
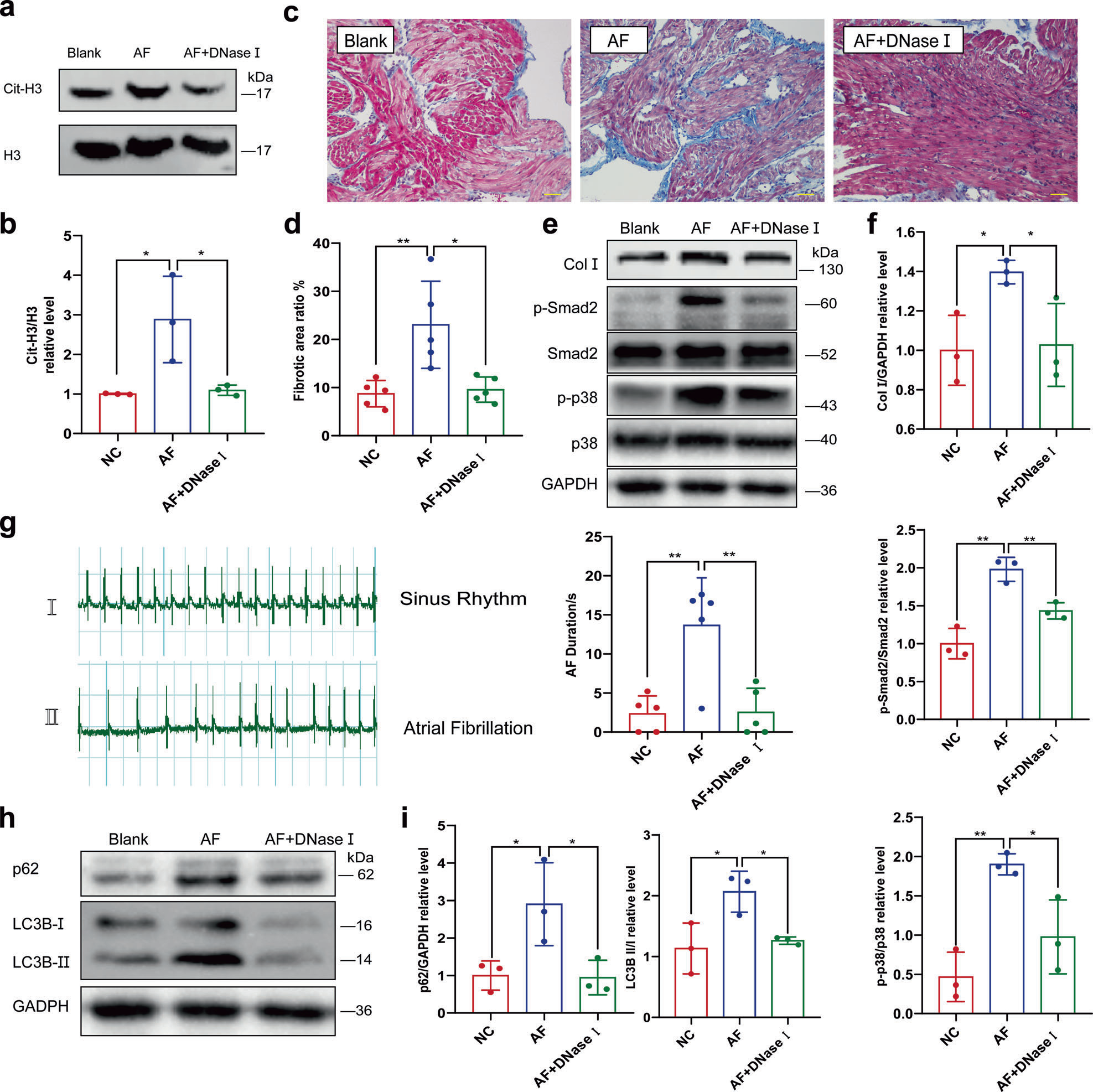
图6 脱氧核糖核酸酶I静脉注射可减轻AF诱导的心房纤维化
实验方法
Specific-pathogen-free(SPF)Sprague-Dawley(SD)大鼠,心肌细胞的分离与培养,大鼠骨髓中性粒细胞的分离,大鼠NETs获取,人中性粒细胞的分离、培养和处理,活细胞三维全息显微镜,Celigo血细胞计数,透射电镜,线粒体膜电位测定,Western-blot,乙酰-CaCl2致AF大鼠模型
参考文献
He L, Liu R, Yue H, Zhang X, Pan X, Sun Y, Shi J, Zhu G, Qin C, Guo Y. Interaction between neutrophil extracellular traps and cardiomyocytes contributes to atrial fibrillation progression. Signal Transduct Target Ther. 2023 Jul 26;8(1):279. doi: 10.1038/s41392-023-01497-2. PMID: 37491321; PMCID: PMC10368710.






