LncRNA通过调控Hippo-YAP信号重编程铁代谢

铁代谢失调与癌症的发展密切相关。长链非编码RNA(lncRNA)通过整合信号通路参与各种代谢过程。在本研究中,作者揭示LncRIM能有效将Hippo通路与铁代谢联系起来。LncRIM与 NF2结合抑制NF2-LATS1相互作用,从而激活YAP并通过DMT1和TFR1增加胞内铁水平。另外,LncRIM-NF2轴介导依赖于Hippo通路的细胞铁代谢。临床上,LncRIM高表达与患者低生存率相关,表明其作为生物标志物和治疗靶点的潜在用途。该研究于2023年4月发表在《Nature Communications》,IF:16.6。
技术路线











主要研究结果
1. LncRIM调节铁代谢和乳腺癌进展
本研究结果表明,细胞铁水平降低导致YAP失活(图1a)。为证实这一结果,使用Calcein-AM评估用空载体、YAP、活性YAP突变体(YAP-5SA)或无活性YAP突变体(YAPS94A)稳定转染MCF-7细胞中的细胞铁水平。结果表明,YAP和YAP-5SA过表达显著增加铁水平,而YAP-S94A没有发挥这种作用(图1b,c)。此外,如图1d,e所示,YAP激活与癌症铁水平呈正相关,表明Hippo通路在细胞铁代谢中的潜在作用。
作者根据相关数据库确定了YAP1依赖性转录可能需要的40个lncRNA。然后用铁螯合剂去铁胺(DFO)处理MCF-7细胞以降低细胞内铁水平,或用柠檬酸铁铵(FAC)增加胞内铁含量(图1f)。如图1g所示,FAC处理促进几种lncRNA表达,而DFO处理显著降低几种lncRNA水平,这表明响应FAC和DFO刺激的lncRNA可能参与癌细胞铁代谢稳态。作者发现,敲低LncRIM(一种与铁代谢相关的lncRNA)可显著降低细胞铁水平(图1h)。鉴于LncRIM与肿瘤抑制Hippo信号通路相关性,作者接下来研究LncRIM和癌症发展之间的功能关系。结果与对照组相比,LncRIM在肿瘤组织中高度表达(图1i)。此外,在独立队列中,LncRIM高表达与癌症患者低生存率相关(图1j)。这些数据表明LncRIM在癌症发展中起重要作用。
作者检测LncRIM是否协调细胞铁代谢以诱导乳腺癌进展。构建LncRIM过表达或敲低的MCF-7和MDA-MB-468细胞系。如图1k、l所示,敲低LncRIM可显著降低细胞铁水平,而过表达LncRIM则可增加细胞铁水平。如图1m所示,FAC刺激部分逆转LncRIM沉默的MCF-7和MDA-MB-468细胞中减弱的细胞增殖和细胞周期停滞。LncRIM过表达部分降低DFO对细胞增殖的抑制作用(图1n)。这些数据表明,铁稳态对LncRIM调节细胞增殖和存活很重要。
细胞铁代谢受与铁吸收、储存和排泄相关基因调节(图1o)。通过RT-qPCR评估LncRIM敲低或过表达后这些基因的表达变化,结果显示,LncRIM敲低细胞系中,TFR1和DMT1表达显著降低,而LncRIM过表达增加这些基因的表达(图1p)。此外,LncRIM主要定位于细胞质(图1q)。这些数据揭示了新发现的胞质lncRNA—LncRIM,它在细胞铁代谢和乳腺癌发展中起关键作用。

图1:LncRIM调控铁代谢与乳腺癌进展
2. LncRIM与NF2互作使LATS1激酶失活
作者使用MCF-7细胞裂解物进行RNA pull-down,检测Hippo通路中可能参与LncRIM相关铁代谢过程的潜在蛋白。他们发现有义LncRIM与NF2结合,NF2是Hippo-YAP信号通路上游重要的膜-细胞骨架支架(图2a)。此外,用重组NF2进行RNA-蛋白质结合测定验证了LncRIM和NF2之间直接的相互作用(图2b,c)。用表达SFB-NF2的MCF-7细胞进行RNA免疫沉淀(RIP),结果显示LncRIM与NF2直接互作(图2d)。这些数据表明LncRIM可能通过NF2相关机制调节细胞铁代谢。
如RNA荧光原位杂交(FISH)所示(图2e,f),LncRIM和NF2共定位于细胞膜。作为肿瘤抑制因子,NF2与激酶LATS1互作并将其募集到质膜,导致LATS1磷酸化和胞质内YAP滞留。接下来,作者评估LncRIM对NF2和LATS1互作以及LATS1向质膜募集的影响。如图2g、h所示,LncRIM过表达显著减少NF2和LATS1之间的互作,而LncRIM敲低显著增加NF2-LATS1的相互作用。免疫荧光(IF)和亚细胞分级证实LncRIM降低NF2诱导的LATS1膜易位(图2i-k)。此外,作者构建了两个NF2缺失突变体并进行蛋白纯化(图2l)。co-IP结果显示,C-末端结构域(CTD)-缺失的NF2突变体与野生型NF2同样有效结合LncRIM,而FERM结构域缺失的NF2突变株与LncRIM没有发生结合(图2m)。通过构建具有三个不同截短环的LncRIM突变体(S1突变体由1-580碱基组成,S2突变体由581-893碱基组成,S3突变体由894-1113碱基组成),发现LncRIM S1截短对LncRIM-NF2相互作用至关重要(图2n)。此外,S1结构域环恢复显著抑制LncRIM沉默的细胞中LATS1和NF2之间的结合,显示与全长LncRIM作用相似结果(图2o)。
然后作者评估LncRIM-NF2轴在细胞铁代谢中的功能。他们发现全长LncRIM或S1截短环过表达充分恢复LncRIM沉默细胞中的细胞铁水平(图2p)。此外,在LncRIM缺失细胞中敲低NF2部分恢复YAP激活、DMT1和TFR1表达以及细胞铁水平(图2q,r)。这些数据阐明了一种新机制,通过该机制,LncRIM与NF2直接结合来抑制NF2-LATS1相互作用并调节细胞铁代谢(图2s)。
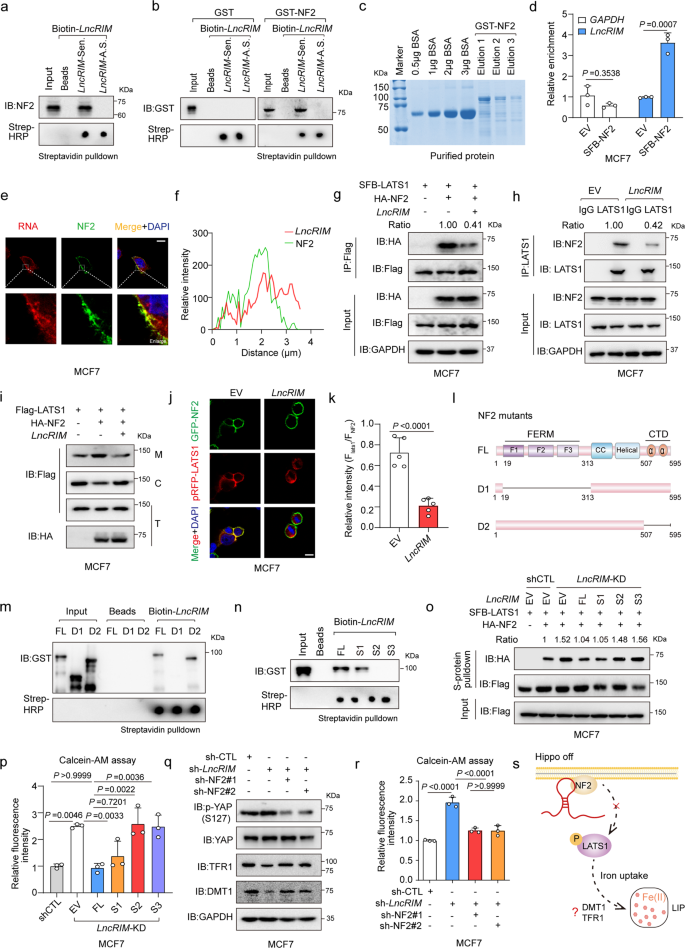
图2:LncRIM与NF2互作抑制LATS1激酶
3. LncRIM依赖Hippo-YAP通路调节铁代谢
接下来,作者研究LncRIM-NF2轴介导的细胞铁代谢与Hippo-YAP通路之间的联系。作者发现当LncRIM过表达,LATS1在Ser909和Thr1079以及YAP在Ser127磷酸化降低,DMT1和TFR1表达增加;相反,LncRIM敲低则观察到相反的结果(图3a,b)。与对照细胞结果相反,YAP沉默的MCF-7细胞中LncRIM过表达没有促进DMT1和TFR1表达或是增加铁水平(图3c-f)。而YAP的再表达显著恢复DMT1和TFR1以及YAP靶基因的表达,且表达水平与LncRIM过表达诱导结果相似,细胞铁水平同样得到恢复(图3g,h)。这些发现表明Hippo通路在LncRIM-NF2轴介导的细胞铁代谢调节中发挥重要作用。
先前有研究报道,TFR1是YAP的下游靶标。为确定YAP是否直接调节DMT1转录,使用GEO数据库(GSE107013)分析DMT1启动子,并鉴定一个YAP/TEAD4结合位点(图3i)。荧光素酶报告基因和染色质免疫沉淀(ChIP-PCR)结果显示YAP直接与DMT1启动子结合(图3j)。此外,DMT1启动子中YAP/TEAD结合位点(CATTCT)的缺失显著减弱YAP-5SA诱导的DMT1启动子萤光素酶活性(图3k)。这些结果表明DMT1是YAP的直接转录靶点。
DMT1 mRNA编码四种不同的亚型。在所有亚型中,DMT1亚型1(含铁应答元件(IRE)的变异体)在MCF-7和MDA-MB-468细胞中高度表达。先前研究报道,细胞铁稳态在很大程度上由铁调节蛋白(IRP)/ IRE系统控制。IRP2已被证明可调节乳腺癌中的铁稳态。因此,作者在先前报道的IRP2系统基础上比较细胞铁代谢中LncRIM-NF2轴的激活。如图3l,m所示,敲低IRP2显著降低DMT1和TFR1表达,然而,LncRIM和YAP过表达仍然部分挽救DMT1和TFR1表达以及IRP2敲低后的细胞铁水平。上述数据共同表明,LncRIM-NF2轴在细胞铁代谢中发挥重要作用,其方式可能与经典的IRP/IRE系统不同。
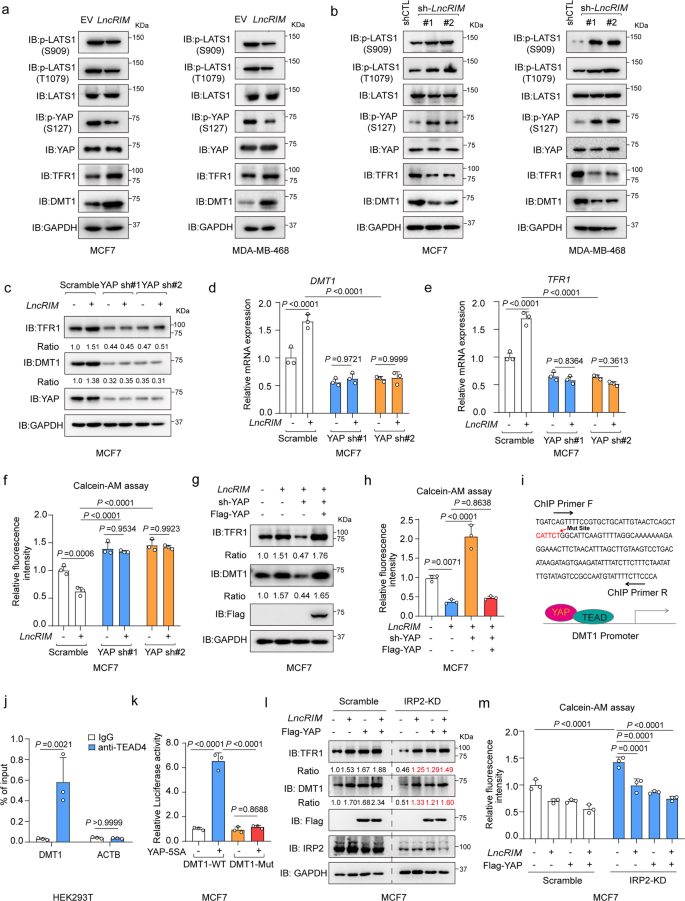
图3:LncRIM以Hippo-YAP通路依赖方式调控铁代谢
4. 铁触发的LncRIM-NF2反馈回路过度激活YAP
在本研究中,LncRIM被证明对铁刺激有反应,并调节Hippo信号通路(图1g和3a,b)。为进一步探索细胞铁水平对Hippo通路的潜在影响,作者用FAC或DFO刺激MCF-7细胞和MDA-MB-468细胞一定时间。FAC刺激后,YAP和LATS1磷酸化显著降低,而DFO刺激增加LATS1和YAP磷酸化水平(图4a)。如图4b所示,较低浓度的FAC显著降低YAP和LATS1磷酸化,而较高浓度的铁则恢复这些蛋白的磷酸化水平。作者还发现FAC或DFO刺激后,LncRIM表达与YAP激活变化一致(图4c,d)。荧光素酶报告基因和ChIP-PCR检测结果显示(4e,f),YAP/TEAD显著提高LncRIM启动子萤光素酶活性,并直接与LncRIM启动子结合。提示LncRIM Hippo在细胞铁代谢中潜在的反馈回路。
此外,作者发现FAC处理显著增强LncRIM和NF2的相互作用,并减少NF2与LATS1结合(图4g,h),这表明铁触发的LncRIM在铁诱导Hippo-YAP信号通路激活的调节中起关键作用。考虑LncRIM-NF2轴对铁激活的反馈回路,作者用FAC处理对照、LncRIM敲低和LncRIM过表达的MCF-7和MDA-MB-468乳腺癌细胞。结果显示,FAC处理部分恢复LncRIM沉默诱导的YAP和LATS1磷酸化,进一步增强LncRIM过表达时YAP的激活(图4i,j)。此外,IF结果显示,敲低LncRIM导致YAP在细胞质中发生隔离,而FAC刺激在很大程度上改善YAP向细胞核的迁移(图4k,l)。总之,这些数据证实铁触发的LncRIM-NF2反馈回路过度激活YAP以促进细胞增殖。
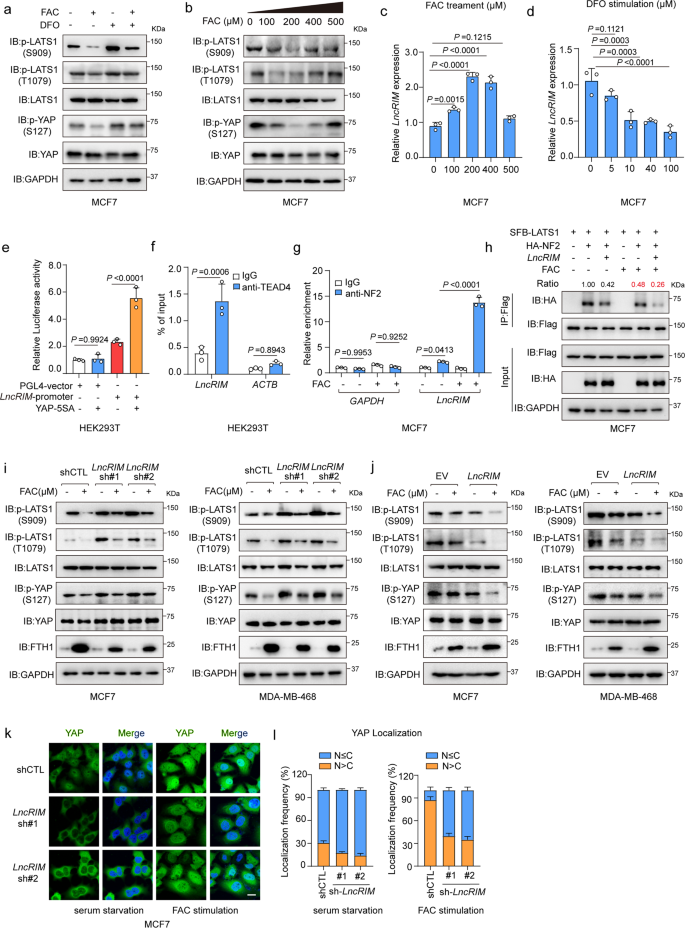
图4:铁触发的LncRIM-NF2反馈回路过度激活YAP
5. LncRIM-YAP轴介导的铁代谢促进肿瘤进展
接下来,作者研究LncRIM-YAP铁代谢轴在体内肿瘤发生中的作用。LncRIM敲低抑制了异种移植物肿瘤的大小和重量(图5a-c),并显著降低细胞增殖,如Ki67和YAP表达降低(图5d)。此外,敲低LncRIM损害血管生成,如CD31(一种内皮细胞标记物)染色强度降低,以及降低细胞铁含量,如增强的DAB铁染色(图5d,e)。此外,免疫印迹和免疫组织化学(IHC)染色结果显示,在LncRIM沉默的肿瘤中,DMT1和TFR1表达均降低,LATS1和YAP磷酸化水平升高,YAP下游靶标表达降低(图5f,g)。这些结果表明LncRIM介导的肿瘤进展与细胞铁代谢呈正相关。
为进一步验证LncRIM介导的细胞铁代谢与肿瘤生长之间的相关性,作者构建LncRIM过表达和LncRIM过表达的DMT1和TFR1双敲低细胞系,随后将每个细胞系直接注射裸鼠。如图5h–k所示,敲低DMT1和TFR1导致LncRIM介导的异种移植肿瘤生长显著降低,且这种降低伴随着细胞铁水平以及Ki67和YAP表达降低(图5j,k)。这些结果在一定程度上证明LncRIM-NF2轴通过上调细胞铁代谢促进细胞增殖和乳腺癌生长。
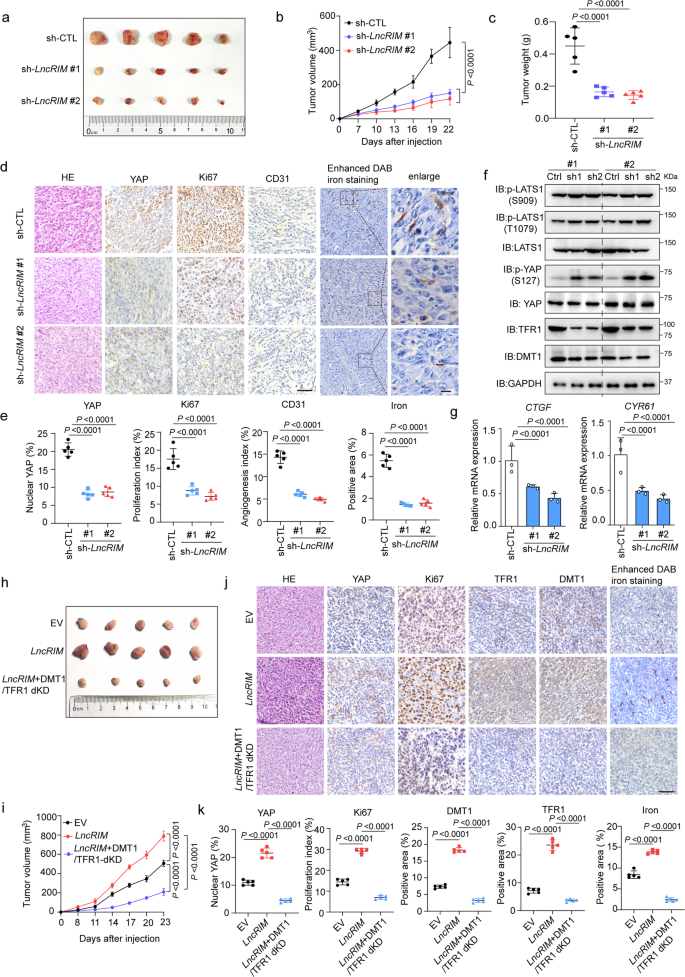
图5:LncRIM-YAP轴介导的铁代谢促进肿瘤进展
6. LncRIM高表达与癌症患者临床结果不良相关
LncRIM与YAP密切相关,可促进铁代谢重编程和肿瘤生长,因此也可能在病理上参与了乳腺癌发展。为验证这一假设,作者使用RT-qPCR检测LncRIM在癌组织队列中的表达,将这些数据分为LncRIM-低组和LncRIR-高组,并通过IHC进一步检测其与增殖、血管生成和铁代谢的相关性。如图6a,b所示,LncRIM高表达与Ki67和CD31呈正相关,它们分别是增殖和血管生成的标志物。在癌症中,LncRIM高表达与YAP、DMT1和TFR1表达以及细胞铁水平增加呈正相关(图6a)。用Perl蓝对铁和免疫细胞标记物CD45进行双重染色,结果显示LncRIM介导的铁水平变化主要位于乳腺癌细胞(图6a)。
此外,在乳腺癌患者样本中,LncRIM表达与YAP靶基因(包括CTGF、CYR61、DMT1和TFR1)呈正相关(图6c,d)。DMT1和TFR1在乳腺癌组织中的表达显著高于对照组(图6e,f),且独立队列中DMT1和TFR1高表达与乳腺癌患者低生存率相关(图6g,h)。这些数据表明LncRIM-NF2-DMT1/TFR1轴可能成为癌症临床治疗靶点(图6i)。
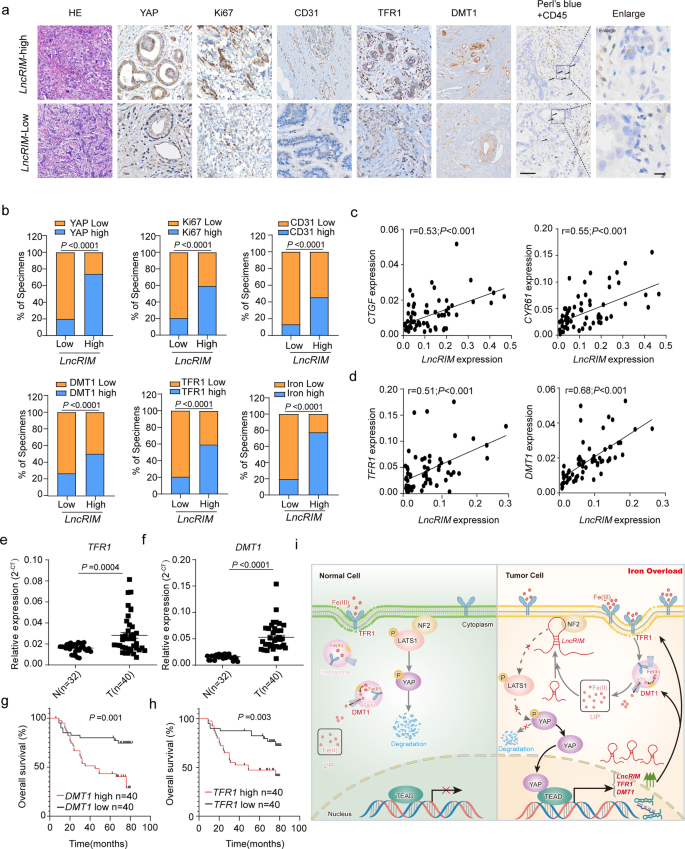
图6:LncRIM高表达与乳腺癌患者临床结果不良相关
结论
本研究揭示了一种新的铁代谢相关机制,其中LncRIM直接结合NF2触发YAP激活,然后促进DMT1和TFR1表达,最终提高细胞铁水平并促进癌细胞增殖。此外,作者证明LncRIM-Hippo轴以独立于IRP2的方式发挥作用,并引起与IRP2类似的生物学效应,包括增加DMT1和TFR1表达以及细胞铁水平。作者还验证了铁触发的LncRIM-NF2反馈回路,该回路反过来过度激活YAP。
实验方法
RNA pull-down,RT-qPCR,敲低细胞系和过表达细胞系构建,RIP,免疫荧光,ChIP-PCR,WB,IHC,免疫荧光染色,重组蛋白表达及纯化,荧光素酶报告基因系统构建
参考文献
He XY, Fan X, Qu L, Wang X, Jiang L, Sang LJ, Shi CY, Lin S, Yang JC, Yang ZZ, Lei K, Li JH, Ju HQ, Yan Q, Liu J, Wang F, Shao J, Xiong Y, Wang W, Lin A. LncRNA modulates Hippo-YAP signaling to reprogram iron metabolism. Nat Commun. 2023 Apr 20;14(1):2253. doi: 10.1038/s41467-023-37871-5. PMID: 37080959; PMCID: PMC10119135.






