单细胞测序揭示特应性皮炎中的多细胞形态和互作
栏目:最新研究动态
发布时间:2023-12-13
本研究发现IL19+IGFL1+KCs可能参与了皮肤屏障的破坏、Th2和Th17炎症反应的连接和放大以及皮肤瘙痒的介导......
特应性皮炎(AD)是一种慢性、复发性炎症性皮肤病,以剧烈瘙痒和湿疹为特征。据报道,不同种族群体的特应性皮炎在临床、分子和遗传方面存在差异。本研究旨在对中国人群中的AD进行深入的转录组分析。ScRNA-seq共分析了 87,853个细胞,其中AD 中的角质细胞(KCs)表现出高表达的角质细胞活化和促炎症基因。KCs表现出一种新的IL19 + IGFL1 +亚群,在AD病变中有所增加。炎性细胞因子IFNG、IL13、IL26和IL22在AD病变中高表达。在体外,IL19直接下调HaCaT细胞中的KRT10和LOR,并激活HaCaT细胞产生TSLP。因此,IL19+IGFL1+KCs可能参与了皮肤屏障的破坏、Th2和Th17炎症反应的连接和放大以及皮肤瘙痒的介导。此外,在AD慢性病灶中会出现以2型炎症反应为主的多种免疫轴的进行性激活。本文于2023年6月发表在《Journal of the European Academy of Dermatology and Venereology》IF:9.2期刊上。
技术路线

主要实验结果
1、AD和健康(HC)皮肤活检样本的scRNA-seq检测皮肤细胞类型
本文scRNA-seq的程序流程如图1a所示。使用降维分析展示了scRNA-seq检测到的9种细胞cluster和10种细胞类型(图1b)。顶端上调基因(根据平均log2(FC)和FDR)证实了细胞类型对特定簇的分配(图1c)。经典marker基因也证实了细胞类型的注释(图1d)。比较了AD组和HC组的细胞组成,发现在AD慢性病变中,基础KC的比例显著降低,而增殖KC的比例显著升高,符合AD的表皮过度增生和异常分化的本质,与此同时,AD慢性病变中黑素细胞的比例大幅下降(图1e,f)。
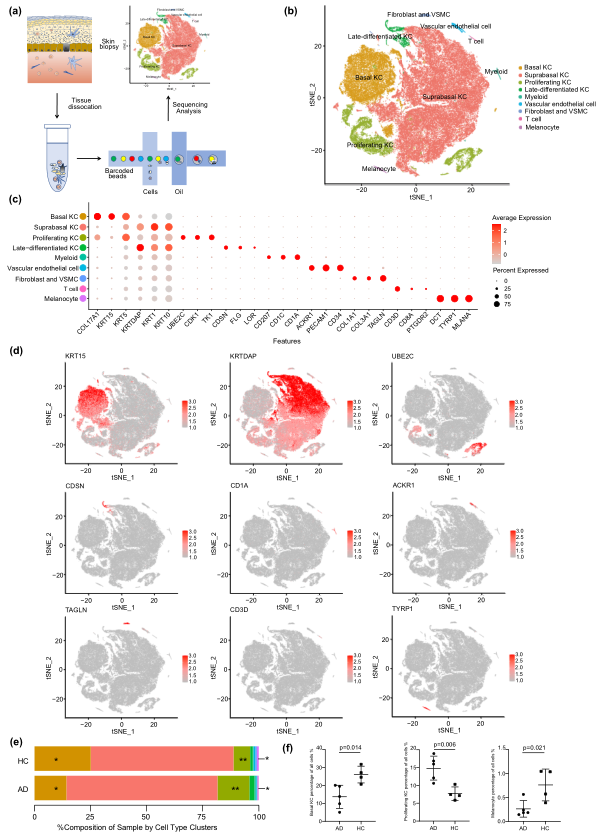
图1在AD和健康对照皮肤活检中的细胞类型
2、AD和HC中的角质细胞的分化
在两组中,所有四种KC簇都存在(图2a),并表现出相似的结构和增殖标记的表达。比较scRNA-seq数据中AD和HC组的差异表达基因(DEGs),发现低表达干细胞和基础角质形成细胞基因(KRT15, COL17A1),但高表达干扰素响应基因(IFI27, IFITM1)和基因SERPINB13,这些基因参与AD基础KC的角质形成细胞增殖和分化(图2b)。AD 基底上层KC的炎症转录本进一步明显上调,包括alarmins(S100A7、S100A8 和 S100A9)和Th 诱导基因SERPINB4;调节有丝分裂后细胞向分化的TXNIP6AD病变中的表达下降(图2c)。在增殖的 KC 中,AD患者的角朊细胞活化标志物KRT6A、KRT6B、KRT6C和KRT16以及趋化因子CCL2均显著上调(图2d)。在AD的晚期分化KC中,大量下调的基因包括编码屏障分子(FLG、LOR)和紧密连接复合体(CLDN1、OCLN)的基因。另一方面,参与局部炎症反应的IL36信号系统基因IL36RN、IL36G在AD晚分化KC中上调(图2e)。KCs DEGs的GO富集分析表明,主要的生物学过程包括先天免疫反应、激活信号转导、髓细胞分化、上皮细胞增殖、抗原加工和递呈、淋巴细胞分化(图2f)。
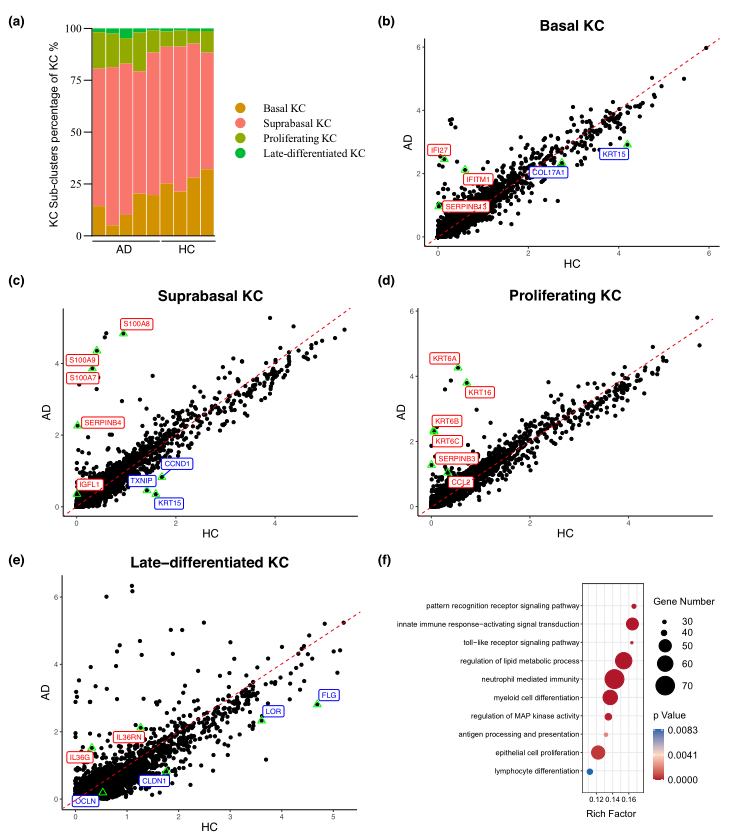
图2 AD与健康对照的角质细胞分化
所有单细胞的基因表达谱数据使作者得以解构KCs的时空分布。在HC中,作者发现了从干细胞基因(KRT15、COL17A1)富集的基底型KC到表达CDSN、FLG和LOR的晚分化型KC的双重推断分化轨迹(图3a,b),这与之前的报道一致。为了深入了解基因表达沿轨迹的动态变化,分析了基因的表达变化,观察到六大类转录基因簇的特征模式。Cluster 2的基因(如连接蛋白基因LAD1、皮肤屏障功能基因TMEM79和缝隙连接基因GJA1)表达上调并维持在高表达水平直至最后阶段,主要参与调控 "皮肤屏障的建立、胆固醇代谢过程、脱绒毛组织 "等生物学过程(图3c,d)。值得注意的是,在AD病变中,发现了KCs的多种分化轨迹(图3e,f)。尽管发现cluster 4中的炎症和过度增殖基因(SPRR1、SPRR2、S100A7 和 S100A8)也表现出了持续的高表达模式,在GO术语"中性粒细胞介导的免疫,粒细胞趋化的正向调节,肥大细胞趋化"中也有表达(图3g,h)。
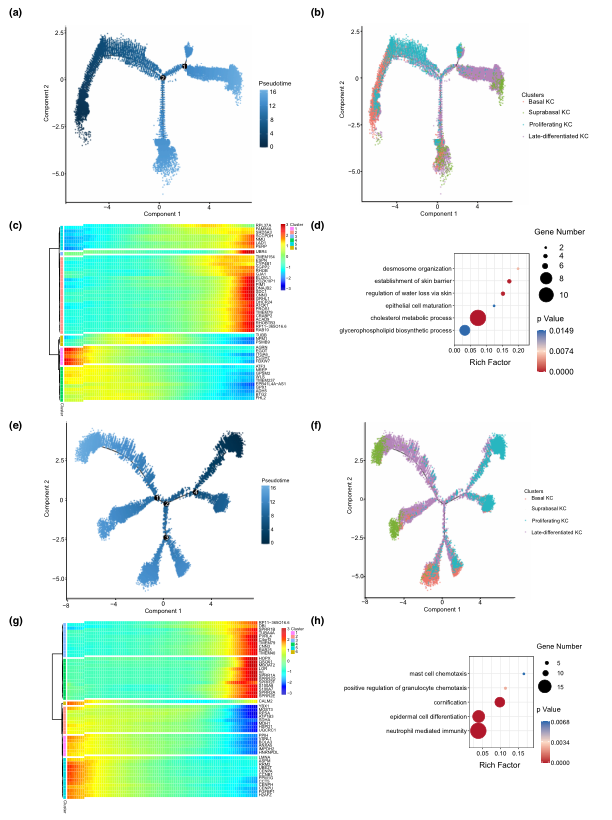
图3 角质细胞分化轨迹
3、AD病变中新型炎症分化的IL19+IGFL1+KC亚群
作者聚焦于基底层KC,聚类后使用t-SNE 进行可视化降维描绘了14个细胞簇(图4a),其中基底层KC cluster 5主要包含病变的AD细胞(图4b),其IL19和IGFL1高表达(图4c,d),这在之前的健康KC研究中没有报道过。同时,IL19+IGFL1+KC主要存在于AD病灶中(图4e)。为验证并确定这些IL19+IGFL1+KC的解剖位置,对代表性标记物进行了多重免疫组化。IL19和IGFL1双重染色细胞在棘层中最为显著(图4f),在AD病变中明显多于HC(图4g)。接下来,探讨了IL19在体外的表达和功能。将HaCaT细胞与Der p(100 μg/mL)共培养24小时。通过RT-qPCR,发现Der p可诱导HaCaT细胞产生IL19(图4h)。与PBS相比,在IL19(40 ng/mL)处理的HaCaT细胞中检测到了更高的TSLP mRNA水平(图4i);然而,KRT10和LOR mRNA水平则出现了下调(图4j,k)。对IL19+IGFL1+KC的DEGs分析显示,Th17轴相关基因(S100A12、DEFB4A和PI3)、高增殖基因(KRT6A、KRT16、NTRK1和EPGN)和S100基因(S100A7、S100A8)高度表达。此外,分析表明,与HCs相比,AD病变中组胺受体(HRH1、HRH2)、allikin释放酶KLK7和整合素相关基因CD47的基因表达大幅上调,而KRT15、CLDN1则下调(图4l)。IL19+IGFL1+KC的DEGs的GO分析显示主要涉及调控凋亡和表皮生长因子受体信号通路,角质形成细胞增殖,髓样细胞和淋巴细胞分化(图4m)。
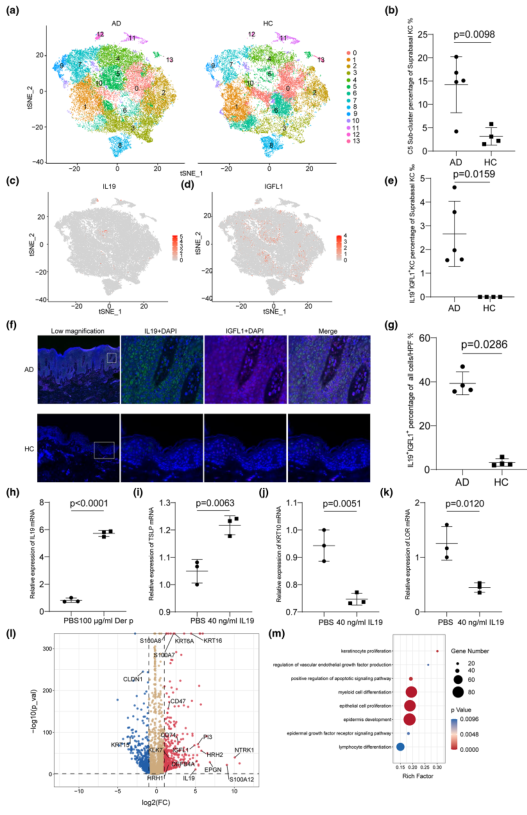
图4 AD病变中新型炎症分化的IL19 + IGFL1 + KC亚群
4、免疫细胞激活促进免疫微环境重塑
在AD慢性病变中,2型和22型细胞因子IL13、IL22的表达进一步升高,1型和17型细胞因子IFNG、IL26的表达进一步升高。在病变T细胞中,KC分泌分子IL25、IL19和IGFL1的受体分子IL17RB、IL20RB和IGFLR1表达较高(图5a)。GO富集分析显示,T细胞分化增殖、Th1型免疫应答和Th17型免疫应答在病变T细胞中富集(图5b)。因此,scRNA-seq数据证实了记忆/效应1型、2型、17型和22型T细胞在AD慢性病变中的活跃扩增。
在AD病变中,髓系细胞对T细胞的招募和极化起着至关重要的作用。根据先前的研究,AD特异性DCs包括CD1A、FCER1A和MRC1阳性的炎性树突状表皮细胞(IDEC)亚群和一个少量但重要的表达LAMP3(成熟DCs的标记)的细胞亚群,后者以CCL19受体CCR7的强表达而与之区分(图5c)。同样,AD标志性趋化因子CCL17、CCL2222以及TSLP受体成分IL7R也出现了上调(图5d)。GO富集分析表明,DEGs在抗原处理和表达、T细胞分化、活化和迁移方面有显著富集(图5e)。总之,免疫细胞显示出多个炎症基因的失调,并促进了AD病变中免疫微环境的重塑。
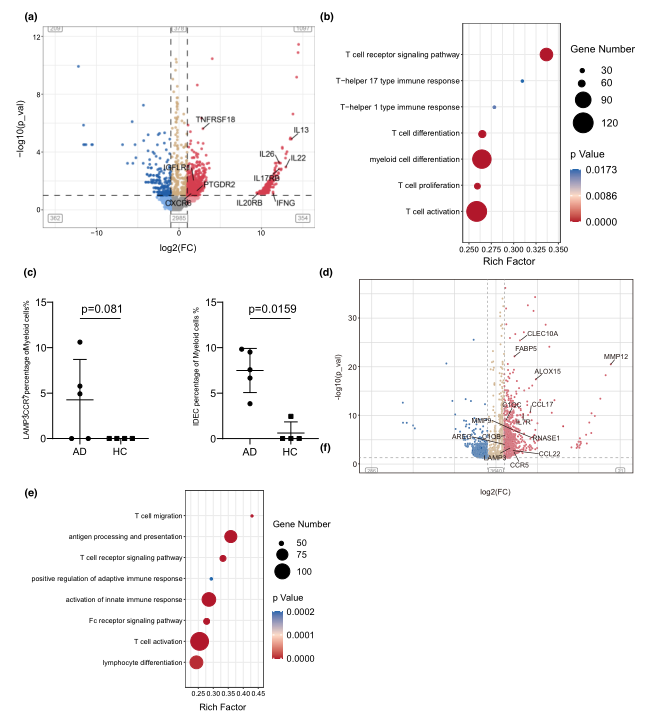
图5 AD病变中的免疫细胞激活
5、细胞类型簇中潜在配体-受体相互作用分析
scRNA-seq数据提供了一个独特的机会用来研究由配体-受体相互作用介导的潜在细胞-细胞通讯。在所有细胞的网络图中观察到,KC细胞、T细胞和类髓鞘细胞之间的相互作用最为丰富,这表明KCs和免疫细胞之间的相互作用信号在AD中的重要性(图6a, b)。接下来确定了配体-受体对。AD病变中,IFNG IFNG、IL13、IL26、IL22与各自受体之间的相互作用在T细胞和KC之间的相互作用明显增强。值得注意的是,血管内皮生长因子信号,如VEGFA-KDR、VEGFA-FLT1和NRP2-VEGFA在KCs、骨髓细胞和血管内皮细胞之间发生了改变。配体-受体相互作用分析还预测髓系细胞上的CXCL8和CCL17与血管内皮细胞上的ACKR1有显著的富集相互作用,而ACKR1能介导免疫细胞的迁移,这与之前的研究结果相当一致。AD中髓系细胞与T细胞之间的配体-受体相互作用增强,如CD28-CD86和CTLA4-CD80(图6c,d)。

图6 细胞类型簇中潜在配体-受体相互作用分析
实验方法
采集临床样本,细胞培养和刺激,单细胞样本悬浮液制备,单细胞测序(scRNA-seq)和生信分析,多色免疫组化,RT- qPCR,
参考文献
Zhou J, Liang G, Liu L, Feng S, Zheng Z, Wu Y, Chen X, Li X, Wang L, Wang L, Song Z. Single-cell RNA-seq reveals abnormal differentiation of keratinocytes and increased inflammatory differentiated keratinocytes in atopic dermatitis. J Eur Acad Dermatol Venereol. 2023 Jun 16. doi: 10.1111/jdv.19256.






