TNFAIP2通过KEAP1/NRF2信号传导赋予头颈部鳞状细胞癌顺铂耐药
耐药限制了顺铂类化疗在头颈部鳞状细胞癌(HNSCC)中的治疗效果,其潜在机制尚不完全清楚。本研究的目的是探讨HNSCC顺铂耐药的原因。在本研究中,TNFAIP2的高表达与HNSCC的不良预后、顺铂耐药和低活性氧(ROS)水平相关。具体来说,它通过抑制ROS介导的c-JUN N-末端激酶(JNK)磷酸化,保护癌细胞免受顺铂诱导的凋亡。机制上,TNFAIP2中包含的DLG基序通过直接结合KEAP1的Kelch结构域与NRF2竞争,从而阻止NRF2进行泛素蛋白酶体介导的降解。这导致NRF2的积累并产生顺铂耐药性。在HNSCC标本中证实了TNFAIP2蛋白水平与NRF2及其下游靶基因之间的正相关。我们的研究结果揭示了TNFAIP2/KEAP1/NRF2/ JNK轴在HNSCC中的抗氧化和顺铂耐药调节作用,提示TNFAIP2可能是改善顺铂治疗效果的潜在靶点,特别是对于顺铂耐药患者。本文于2023年8月发表于“Journal of Experimental & Clinical Cancer Research”(IF=11.3)上。
技术路线

结果
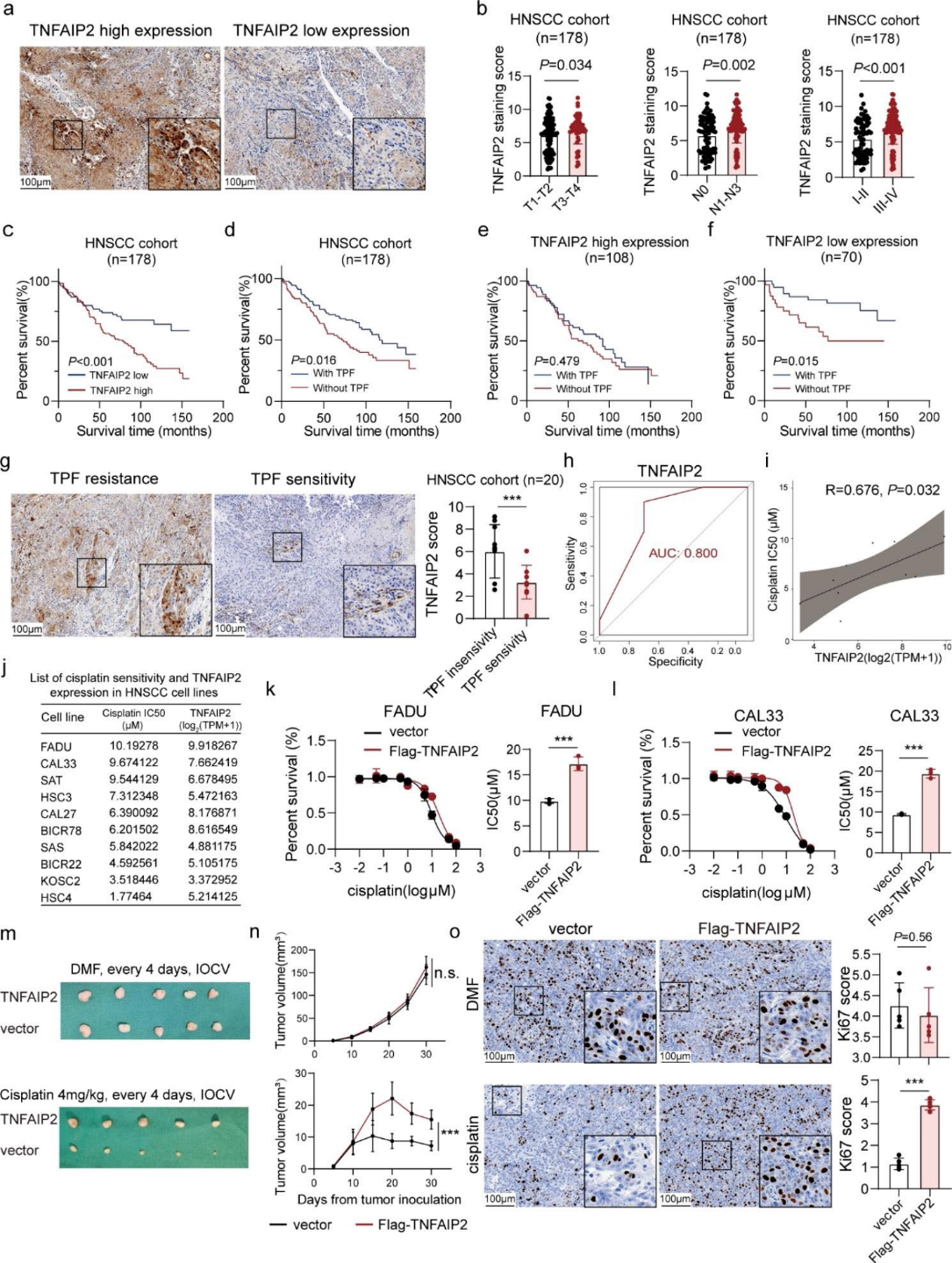
1)TNFAIP2高表达的HNSCC患者易出现顺铂治疗失败
我们对178例HNSCC患者进行了免疫组化染色。我们发现TNFAIP2在晚期患者中表达上调,提示其肿瘤促进作用(图1a和b)。TNFAIP2高表达表明总生存率较差(图1c)。我们观察到TPF化疗在TNFAIP2低表达组中取得了更好的治疗效果(图1 -f)。在另一个HNSCC患者单独接受TPF治疗的队列(n = 20)中,TNFAIP2在TPF治疗耐药患者中显著上调(图1g)。表达水平有效地区分了TPF治疗的合适候选者(图1h)。我们进一步研究了10个HNSCC细胞系中TNFAIP2 mRNA水平与紫杉醇、顺铂和5-氟尿嘧啶半IC50之间的相关性。结果显示,顺铂IC50与TNFAIP2表达呈正相关(图1i、j)。此外,IC50结果证实,TNFAIP2过表达增加了顺铂耐药性,而其敲低则降低了顺铂耐药性(图1k、l)。随后,我们通过将FADU皮下接种到BALB/c裸鼠中,并给予指示治疗(图1m),建立了异种移植肿瘤模型。结果显示,TNFAIP2过表达对肿瘤重量和体积均无影响,但明显降低了顺铂的治疗效果(图1n)。Ki67染色在体内证实了这种作用(图1o)。综上所述,上述结果揭示了TNFAIP2在顺铂治疗HNSCC中的不良作用。
2)TNFAIP2通过抑制ROS/JNK信号保护HNSCC细胞免受顺铂诱导的凋亡
根据以往的报道,恶性肿瘤通过多种机制逃避顺铂诱导的细胞凋亡。我们发现当TNFAIP2过表达时,ROS水平降低(图2a和b)。此外,GSH/GSSG比值以及SOD活性也增加,表明氧化应激减轻(图2c)。ROS清除剂NAC恢复了TNFAIP2敲低诱导的顺铂耐药(图2d-g)。大量证据表明,过量的ROS通过持续激活JNK通路诱导细胞凋亡。我们假设TNFAIP2以ROS/JNK途径抑制的方式保护癌细胞免受顺铂细胞毒性(图2h)。结果,JNK抑制剂(SP600125)逆转了TNFAIP2敲低诱导的细胞凋亡率和顺铂敏感性的增加(图2i和j)。Western blot分析显示,当TNFAIP2过表达时,顺铂诱导的JNK磷酸化和顺铂诱导的caspase 9和caspase 3的激活持续被抑制(图2k)。NAC逆转TNFAIP2敲低诱导的信号增强(图21),表明TNFAIP2通过抑制ROS/JNK途径保护HNSCC细胞免受顺铂诱导的凋亡。

3)TNFAIP2通过抑制NRF2的泛素化和降解来稳定NRF2蛋白
基于TCGA和GEO (GSE39366)数据的进一步富集分析显示,NRF2信号在TNFAIP2高表达的组织中显著上调(图3a)。我们认为TNFAIP2的抗氧化作用是由NRF2介导的。正如预期的那样,当NRF2被敲除时,TNFAIP2过表达不影响ROS水平(图3b和c),而促进顺铂耐药的能力也消失了(图3d和e)。此外,一组NRF2靶基因,包括HO1、NQO1、GCLC、CAT和SOD2,在mRNA和蛋白水平上与TNFAIP2一起发生改变(图3f和g)。这些结果表明TNFAIP2的抗氧化和顺铂耐药功能是由NRF2介导的。然后,我们发现TNFAIP2影响的是NRF2的蛋白水平而不是mRNA水平(图3 h和i),表明这种调控作用发生在转录后阶段。经环己亚胺(CHX)处理后,TNFAIP2敲低组NRF2降解更快(图3j),表明TNFAIP2抑制NRF2蛋白降解,但不促进其合成。随后,我们发现当TNFAIP2被敲低时,蛋白酶体抑制剂MG132或类泛素化修饰抑制剂MLN4924可阻断NRF2的降解(图3k)。此外,免疫共沉淀(Co-IP)实验显示,当TNFAIP2被敲除时,泛素结合的NRF2增加,这可以通过TNFAIP2过表达来恢复(图31)。总之,TNFAIP2通过促进NRF2蛋白稳定表现出抗氧化和顺铂耐药功能。

4)TNFAIP2与KEAP1相互作用以稳定NRF2
为了确定TNFAIP2稳定NRF2的机制,我们使用Co-IP/MS进行了高通量筛选。结果显示TNFAIP2和KEAP1之间存在广泛的结合关系(图4a), Co-IP验证了这一点(图4b)。我们推测KEAP1可能介导TNFAIP2的氧化应激抑制和顺铂耐药促进作用。为了验证这一点,我们敲低了KEAP1,发现TNFAIP2过表达不会导致ROS减少(图4c)、IC50升高(图4d和e)、NRF2蛋白积累(图4f)。Co-IP实验显示,当TNFAIP2被敲除时,KEAP1结合了更多的NRF2(图4g)。相反,当TNFAIP2以浓度梯度过表达时,KEAP1沉淀的NRF2量逐渐减少(图4h)。

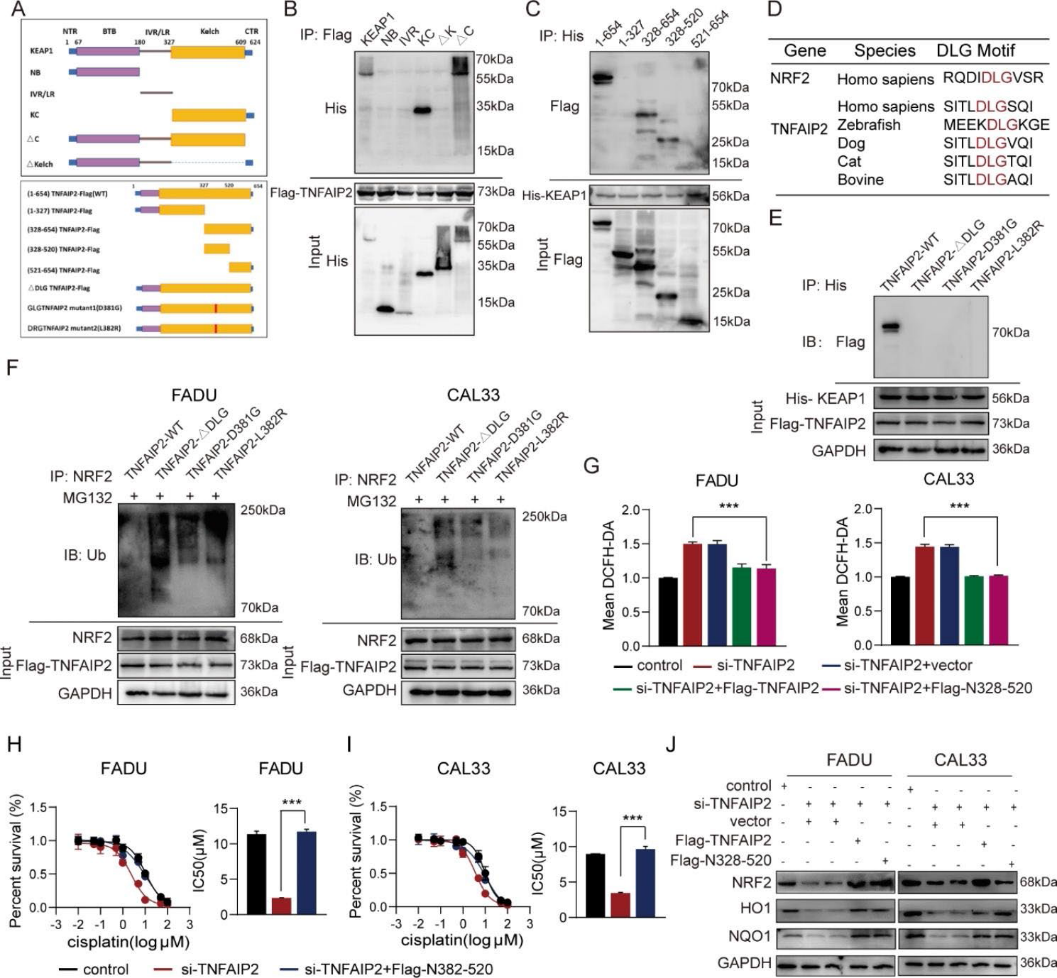
5)DLG基序和kelch结构域介导TNFAIP2与KEAP1的相互作用
我们构建了一系列的截短质粒来探索TNFAIP2和KEAP1之间特异的相互作用位点(图5a)。首先,将flag标记的TNFAIP2全长和his标记的KEAP1片段质粒共转染到293T细胞中。co-IP分析显示,只有含有Kelch结构域的片段才能与TNFAIP2相互作用(图5b)。同样,TNFAIP2的全长(N1-654)和其他两个片段(N328-654和N328-520)也被KEAP1沉淀,这意味着TNFAIP2通过N328-520片段与KEAP1相互作用(图5c)。有趣的是,我们发现DLG基序恰好位于TNFAIP2的N328-520片段中,该片段在不同物种中高度保守(图5d)。此外,我们构建了一个DLG缺失(ΔDLG)和两个突变体flag标记的质粒(图5a)。正如预期的那样,三者都不能与KEAP1相互作用(图5e)。与野生型TNFAIP2组相比,三个质粒转染组的NRF2泛素化水平均未降低(图5f)。此外,我们还进行了一系列的拯救实验来验证DLG基序的作用。我们发现过表达的N328-520片段逆转了由TNFAIP2干扰引起的ROS水平升高、顺铂敏感性升高和NRF2丰度降低(图5g-j)。这些结果表明,DLG基序和Kelch结构域介导了TNFAIP2与KEAP1的相互作用和顺铂耐药的发展。
6)靶向Tnfaip2可促进体内顺铂治疗效果
为了探索抑制TNFAIP2对顺铂治疗的促进作用,我们建立了4NQO诱导的HNSCC小鼠模型(图6a)。在Tnfaip2敲低组中,肿瘤病变面积减少,但当Tnfaip2过表达时,这种效果不显著。此外,si-Tnfaip2与顺铂联合使用的肿瘤抑制和细胞凋亡诱导效果最为显著(图6b-d)。同时,肿瘤侵袭性明显受到抑制(图6e)。GSH/GSSG比值和SOD活性持续下降,表明敲低Tnfaip2会加重肿瘤内氧化应激(图6f)。免疫组化染色表明当Tnfaip2被抑制时,NRF2及其靶基因在蛋白水平上有效减少(图6g和h)。以上结果证实了Tnfaip2特异性siRNA可以通过抑制HNSCC中的NRF2信号改善顺铂治疗效果。

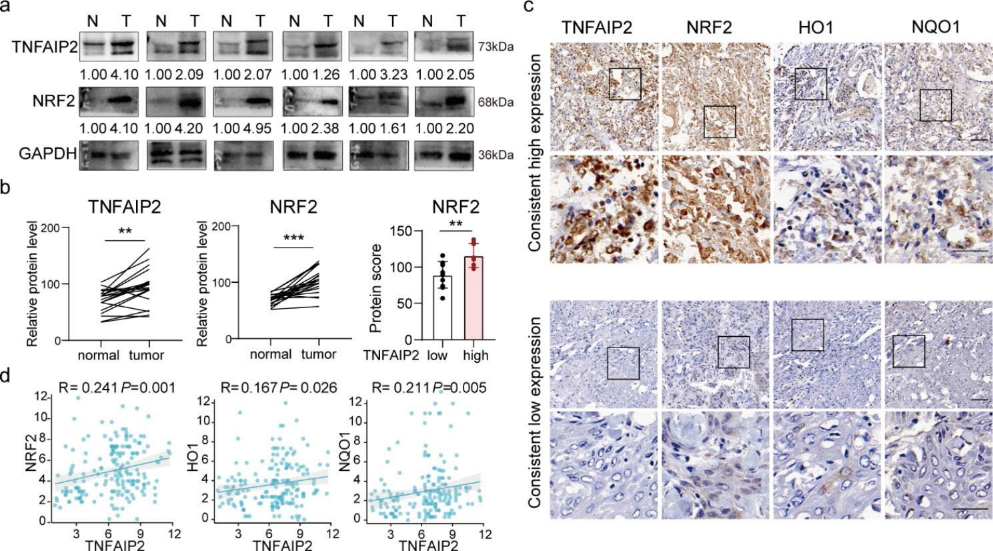
7)HNSCC患者TNFAIP2表达与NRF2表达呈正相关
为了验证TNFAIP2和NRF2在HNSCC中的表达水平及其相关性,我们首先使用western blotting检测了20对HNSCC组织中TNFAIP2和NRF2的表达。与邻近正常组织相比,TNFAIP2和NRF2在HNSCC组织中的表达更高(图7a)。在TNFAIP2低表达的组织中,NRF2也下调(图7 b)。免疫组化染色显示TNFAIP2与NRF2、HO1和NQO1呈正相关(图7c和d),这表明TNFAIP2可能在HNSCC中作为NRF2信号启动子。
结论
TNFAIP2可以通过与KEAP1的竞争性相互作用来稳定NRF2,从而抑制顺铂诱导的氧化应激和细胞凋亡,最终导致顺铂耐药。TNFAIP2可能是改善HNSCC化疗治疗效果的潜在治疗靶点。
实验方法
WB,Co-IP/MS,RT‒qPCR,CCK-8,克隆形成实验,流式,ROS和抗氧化能力检测,免疫组化,TUNEL染色,双荧光素酶报告基因实验。
参考文献
Xu T, Yang Y, Chen Z, Wang J, Wang X, Zheng Y, Wang C, Wang Y, Zhu Z, Ding X, Zhou J, Li G, Zhang H, Zhang W, Wu Y, Song X. TNFAIP2 confers cisplatin resistance in head and neck squamous cell carcinoma via KEAP1/NRF2 signaling. J Exp Clin Cancer Res. 2023 Aug 1;42(1):190. doi: 10.1186/s13046-023-02775-1.






