m5C甲基化lncRNA NR_033928促进谷氨酰胺代谢重编程从而促进胃癌增殖

5-甲基胞嘧啶(m5C)异常甲基化已被证实与胃癌发生、发展及预后密切相关。失调的长链非编码RNAs (lncRNAs)参与癌症的多种生物学过程。然而,迄今为止,m5C甲基化的lncRNAs在胃癌(GC)中的研究很少。本研究中,作者发现RNA胞嘧啶- C(5)-甲基转移酶(NSUN2) 在胃癌中上调,并且NSUN2的高表达与不良预后相关。lncRNA NR_033928发生NSUN2甲基化且在胃癌中表达上调。机制上,NR_033928作为IGF2BP3/HUR复合物的支架,提高谷氨酰胺酶(GLS)mRNA的稳定性,从而增加其表达。谷氨酰胺代谢物α-KG的积累促进NR_033928启动子5-羟甲基胞嘧啶(hm5C)去甲基化,从而上调NR_033928的表达,形成正反馈环路。该研究于2023年8月发表在《Cell Death & Disease》,IF:9.0。
技术路线

主要研究结果
1. m5C调节因子上调NSUN2与胃癌患者不良预后相关
从癌症基因组图谱(TCGA)数据库中检测m5C在胃腺癌(STAD)项目中的表达。结果表明,与正常组织相比,m5C的writers(NOP2,NSUN2,NSUN3,NSUN4,NSUN5和NSUN6)和readers(ALYREF和YBX1)在胃癌样本中上调。核心m5C甲基转移酶NSUN2在GC中表达最高(图1A)。Pearson相关分析表明,NSUN2的表达与大多数其他m5C调节因子的表达呈正相关(图1B)。分析NSUN2在24对配对的胃癌和癌旁正常组织微阵列中的表达。结果显示NSUN2在GC中显著升高(图1C)。在48对胃癌和匹配的正常胃组织中进行的qPCR分析验证NSUN2在胃癌中的表达显著较高(图1D)。Western blot分析显示NSUN2蛋白在胃癌组织中表达明显升高(图1E)。Kaplan-Meier Plotter结果显示,NSUN2表达与胃癌患者的不良总生存期呈正相关(图1F)。总之,这些结果表明NSUN2在胃癌中表达上调,并且与胃癌患者的不良诊断相关。
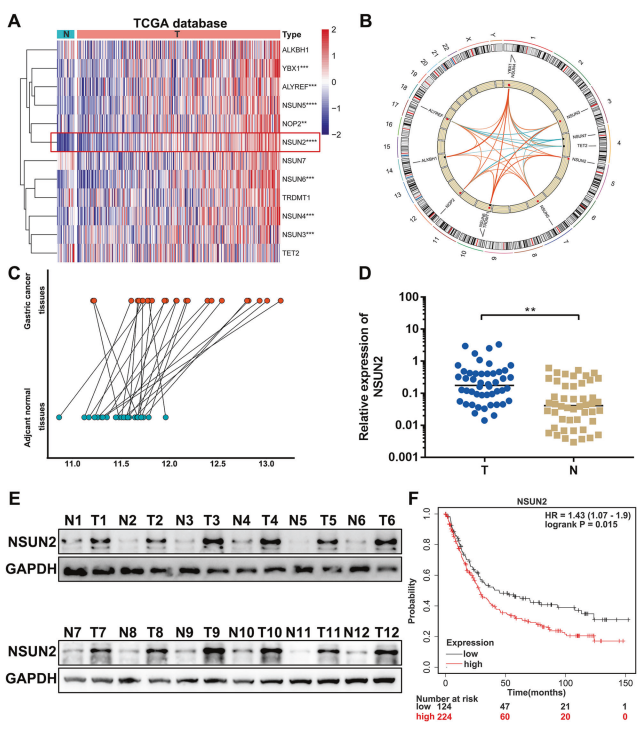
图1. 在胃癌中NSUN2表达上调并与不良预后相关
2. NR_033928在GC中上调,且被鉴定为发生NSUN2甲基化的lncRNA
为绘制GC中lncRNA的m5C表观遗传修饰图,作者对3对胃癌组织及其癌旁正常组织进行基于m5C抗体的RNA甲基化测序和二代测序。结果显示,有254个表达失调和11107个不同程度甲基化的lncRNAs (图2A,B)。进一步分析发现有10个上调且高甲基化的lncRNAs,1个上调且低甲基化的lncRNA,3个下调且高甲基化的lncRNAs,1个表达下调且低甲基化的lncRNA(图2C)。在胃癌细胞中转染NSUN2 siRNA,qPCR检测NSUN2修饰的lncRNAs。结果显示,在NSUN2沉默的细胞中,NR_033928的表达下调最明显(图2D)。qRT-PCR证实NR_033928在48例GC患者的GC组织中表达高于配对的正常组织(图2E)。RNA荧光原位杂交(FISH)分析表明,与邻近正常黏膜组织相比,GC组织具有显著的NR_033928丰度(图2G)。通过分析患者的临床病理特征,发现NR_033928的表达水平与胃癌肿瘤大小和TNM分期呈正相关(表1)。检测 NR_033928 在 GC 细胞系中的表达,结果显示与正常人胃细胞系GES-1相比,NR_033928在所有检测的胃癌细胞系(HGC-27, MKN28, MKN45, AGS和SNU1)中的表达均较高(图2F)。根据上调的表达水平,选择MKN45和AGS进行进一步研究。FISH显示NR_033928主要定位于AGS和MKN45的细胞质中(图2H)。CPC2和CPAT预测NR_033928的编码概率极低(图2I)。综上所述,NR_033928被确定为胃癌中潜在的NSUN2修饰的致癌lncRNA。

图2. NR_033928的鉴定与表征
3. NR_033928在体内和体外均有致癌作用
在GC细胞中进行功能增益和功能丧失试验。将NR_033928 siRNA 和过表达载体分别转染到MKN45和AGS细胞中。菌落形成实验表明,敲除NR_033928 会减少MKN45细胞中的菌落数量,而过表达NR_033928则会促进AGS细胞中的菌落形成(图3A,B)。同样,EDU试验表明,减少NR_033928的表达会削弱MKN45细胞的增殖能力,而增加NR_033928的表达则会增强AGS细胞的增殖能力(图3C,D)。此外,流式细胞术检测显示,与对照组相比,转染NR_033928 siRNA的MKN45细胞中凋亡细胞比例增加(图3E)。而转染NR_033928过表达载体的AGS细胞凋亡细胞数量减少(图3F)。将转染有NR_033928 shRNA和过表达载体的GC细胞皮下注射到5周大的Balb/c小鼠体内。异种移植肿瘤模型显示,注射MKN45-sh-NR_033928小鼠的肿瘤重量和体积明显小于对照组(图 3G)。稳定转染过表达NR_033928慢病毒的AGS细胞促进异种移植瘤的生长(图 3H)。总之,NR_033928在体外和体内都促进GC的增殖,抑制细胞凋亡。
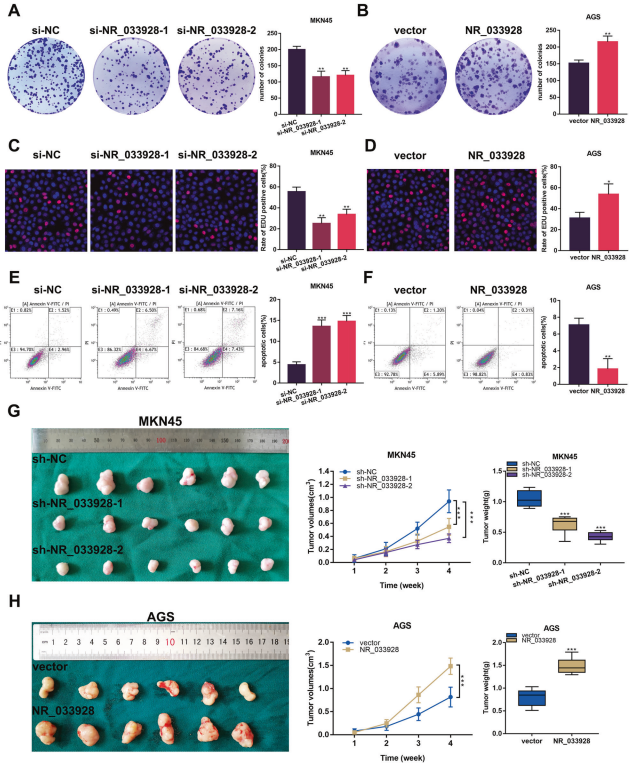
图3. NR_033928促进细胞增殖,抑制细胞凋亡。
4. NSUN2通过维持NR_033928在GC中的稳定性而上调其表达
m5C RIP分析显示,在GC细胞中同步转染NSUN2 siRNA或过表达载体后,NR_033928的m5C修饰水平降低或升高(图4A-D)。Sanger测序验证特定的m5C甲基化位点C154(图4E)。在敲低NSUN2后,这种甲基化被完全消除,碱基C被转化为碱基T。通过Dactinomycin实验评估NSUN2是否通过调节NR_033928的RNA稳定性来调节其表达。结果显示,在转染NSUN2 siRNA或过表达载体的细胞中,NR_033928的半衰期缩短或延长(图4F-I)。综上所述,结果表明NSUN2催化NR_033928的m5C修饰,并通过增强RNA稳定性来上调其表达。
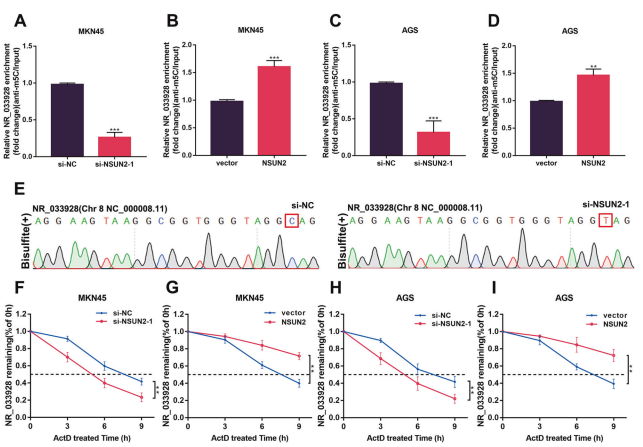
图4. NSUN2介导NR_033928 m5C甲基化并调控其表达。
5. NR_033928通过GLS介导的谷氨酰胺代谢调控胃癌的增殖和凋亡
在NR_033928缺陷和野生型细胞中进行RNA-seq(图5A)。通过KEGG分析发现NR_033928的表达与谷氨酰胺代谢通路呈正相关,而谷氨酰胺代谢通路与癌症进展密切相关(图5B)。EDU实验表明NR_033928过表达细胞在正常培养基和谷氨酰胺剥夺培养基中增殖能力增强或减弱(图5C)。细胞凋亡实验显示,正常培养基中NR_033928过表达的细胞凋亡比例降低,而在去除谷氨酰胺的培养基中,凋亡细胞的比例恢复(图5E)。在所有差异表达基因中,GLS是参与谷氨酰胺分解的关键基因。在GC细胞中,过表达NR_033928上调谷氨酸和α-KG的含量,而共转染sh-GLS则下调它们的含量(图5D, F)。EDU实验显示,在AGS细胞中,过表达NR_033928增加EDU阳性细胞的比例,在NR_033928过表达载体和sh-GLS共转染后,EDU阳性细胞的比例下降(图5G)。细胞凋亡实验显示,在AGS细胞中过表达NR_033928降低凋亡细胞的比例,而在AGS细胞中共转染NR_033928过表达载体和sh-GLS挽救凋亡细胞的比例(图5H)。在AGS细胞中应用GLS抑制剂Telaglenastat(CB-839)。EDU分析显示CB-839降低AGS细胞中转染NR_033928过表达载体的细胞的增殖活性(图5I)。凋亡分析表明,CB-839促进AGS细胞中转染NR_033928过表达载体的细胞的凋亡(图5J)。这些结果表明,NR_033928通过GLS介导的谷氨酰胺代谢在胃癌中发挥作用。

图5. NR_033928通过GLS介导的谷氨酰胺代谢促进GC进展
6. NR_033928与IGF2BP3/HUR复合物相互作用并促进其形成
在胃癌细胞中分别进行3次RNA pull-down和质谱分析。在所有的候选蛋白中,IGF2BP3和HUR存在于质谱结果和预测的GLS结合蛋白结果中 (图6A-C)。使用IGF2BP3和HUR抗体进行RNA免疫沉淀分析。结果显示,与IgG组相比,IGF2BP3或HUR抗体组中NR_033928的表达显著较高(图6D)。RNA pull-down分析证实,生物素标记的NR_033928可以沉淀出重组IGF2BP3和HUR(图6E)。提出假设NR_033928作为IGF2BP3/ HUR复合物的支架来促进GLS mRNA在胃癌中的稳定性。免疫共沉淀实验表明,IGF2BP3和HUR在GC中相互作用(图6F, G)。siRNA沉默NR_033928,减少IGF2BP3或HUR抗体沉淀的HUR或IGF2BP3的蛋白量(图6H, I)。为进一步阐明NR_033928如何招募IGF2BP3和HUR,设计NR_033928缺失突变体。RNA pull-down分析显示,含有1387-1926nt的NR_033928 #1片段与IGF2BP3相互作用,含有1387-1926nt、50-1014nt、1 - 1374nt的#1、#4、#5片段与HUR相互作用(图6J)。此外,根据IGF2BP3和HUR的内在蛋白结构域构建一系列flag标记的截短体。RIP实验表明,IGF2BP3结构域(198-344aa)和HUR结构域(1-99aa)与NR_033928特异性相互作用(图6K, L)。总之,NR_033928与IGF2BP3/HUR复合体相互作用并促进其形成。
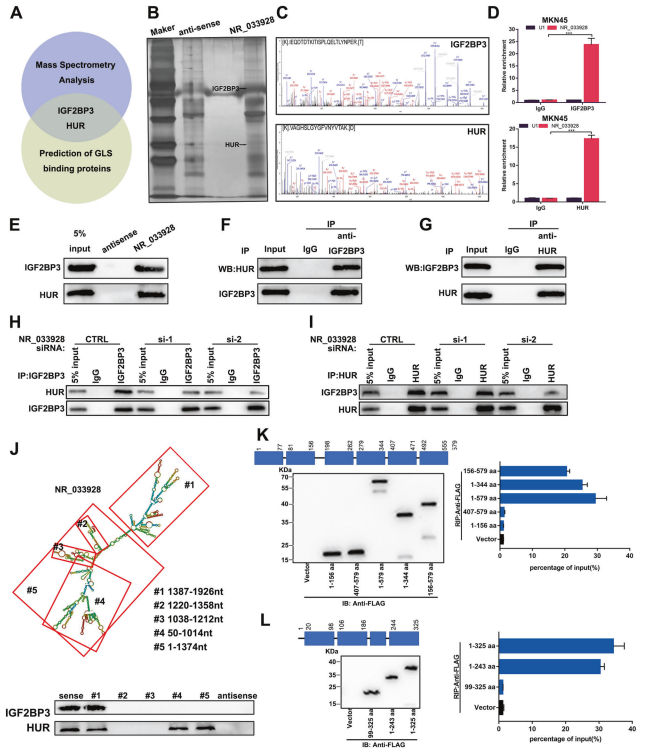
图6. NR_033928直接结合IGF2BP3/HUR复合物
7. NR_033928促进IGF2BP3/HUR复合物与GLS mRNA的相互作用
RIP实验表明HUR和IGF2BP3与GLS结合(图7A,E)。Western blot分析证实,构建IGF2BP3和HUR的过表达质粒和siRNA,并在GC细胞中转染(图7B,F)。Dactinomycin实验表明,过表达IGF2BP3使GLS的半衰期延长,共转染HUR siRNA使GLS的半衰期缩短(图7C)。在使用HUR过表达载体和IGF2BP3 siRNA进行的Dactinomycin检测中,也检测到类似的结果(图7G)。这些结果表明,IGF2BP3和HUR协同增强GLS的稳定性。RIP实验显示,沉默NR_033928或过表达NR_033928降低或增加IGF2BP3和HUR结合的GLS的数量(图7D,H)。Dactinomycin实验显示,si-IGF2BP3或si-HUR缩短GLS的半衰期,与NR_033928过表达载体共转染延长GLS的半衰期(图7I,K)。qRT-PCR分析表明,抑制IGF2BP3表达降低通过过表达NR_033928增加的GLS表达(图7J)。同样,抑制HUR表达降低GLS的表达,而过表达NR_033928增加GLS的表达(图7L)。因此,NR_033928通过作为IGF2BP3/HUR复合物和GLS的支架调节GLS的稳定性,从而调节GLS的表达。

图7. NR_033928在IGF2BP3/HUR和GLS之间起支架作用
8. α-KG促进NR_033928启动子去甲基化从而增加NR_033928的表达
NR_033928在谷氨酰胺缺失培养基中表达显著降低(图8A)。沉默GLS降低NR_033928的表达(图8B)。qRT-PCR分析表明,添加外源性合成的α-KG (DM-α-KG)而不是谷氨酰胺的其他代谢物增加NR_033928的表达(图8C)。α-KG异常积累作为DNA去甲基化酶(TETs)和组蛋白去甲基化酶(JMJDs)的辅因子在基因组表观遗传调控中发挥重要作用(图8D)。通过GSK-J4抑制组蛋白去甲基化酶(JMJDs)并没有改变NR_033928的表达(图8E)。Tet家族(Tet1 Tet2和Tet3)的联合沉默显著降低NR_033928的表达(图8F)。hMeDIP实验表明,添加外源性DM-αKG增加NR_033928启动子hm5C的水平,在谷氨酰胺去除培养基培养的细胞中转染sh-Tet1-3降低hm5C的水平(图8G,H)。总之,α-KG以TETs依赖的DNA去甲基化方式促进NR_033928的表达。
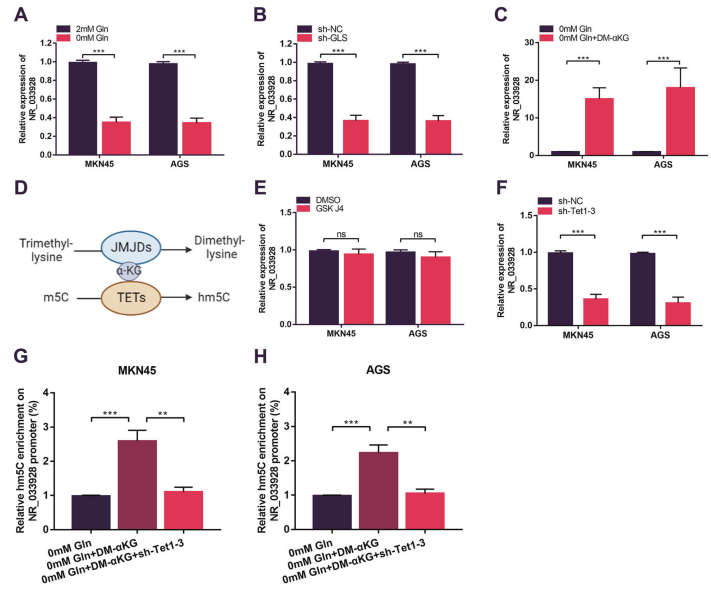
图8. α-KG通过促进NR_03928启动子去甲基化上调NR_033928的表达
9. NR_033928在GC中的临床意义
对随访数据的Kaplan-Meier分析表明,NR_033928的表达与患者的总生存期呈负相关(图9A)。此外,在线Kaplan-Meier模型结果显示,GLS高表达的患者总生存期低于GLS低表达的患者(图9B)。在异种移植瘤模型中,第4周处死所有小鼠,并将肿瘤用于免疫组织化学分析(图9C)。GLS免疫组织化学染色显示,敲低NR_033928后,GLS的表达明显降低。此外,对增殖标志物Ki67和凋亡标志物c-caspase3的分析表明,沉默NR_033928降低Ki-67的表达,增强c-caspase3的表达。因此,NR_033928可作为胃癌的潜在预后标志物,沉默NR_033928可抑制胃癌细胞增殖并促进其凋亡。

图9. NR_033928作为胃癌的预后和治疗性生物标志物
结论
综上所述,本研究发现一种NSUN2甲基化的lncRNA,NR_033928,在GC细胞和组织中高表达。NR_033928通过GLS 介导的谷氨酰胺代谢促进GC的进展,可能是一个潜在的预后和治疗靶点。
实验方法
细胞培养,m5C MeRIP测序和MeRIP- PCR,lncRNA表达谱和mRNA二代测序,寡核苷酸、慢病毒和质粒转染,RNA提取和PCR,FISH,WB,RNA半衰期检测,菌落形成实验,EDU染色,细胞凋亡检测,谷氨酸和α-酮戊二酸检测,羟甲基化DNA免疫沉淀,裸鼠实验,免疫组化,RIP,Co-IP,RNA pull-down和质谱分析,sanger测序
参考文献
Fang L, Huang H, Lv J, Chen Z, Lu C, Jiang T, Xu P, Li Y, Wang S, Li B, Li Z, Wang W, Xu Z. m5C-methylated lncRNA NR_033928 promotes gastric cancer proliferation by stabilizing GLS mRNA to promote glutamine metabolism reprogramming. Cell Death Dis. 2023 Aug 15;14(8):520. doi: 10.1038/s41419-023-06049-8. PMID: 37582794; PMCID: PMC10427642.






