SEC63激活ACLY可通过代谢重编程促进内质网应激下的肝细胞癌转移

内质网(ER)在蛋白质折叠、修饰和运输中发挥重要作用。内质网稳态对缺氧、营养和致癌激活等环境刺激高度敏感。这些刺激降低了内质网的效率,导致错误折叠或未折叠的蛋白在内质网腔内堆积,这一事件称为内质网应激。通常,错误折叠的蛋白无法离开内质网,并可能通过蛋白激酶RNA样内质网激酶(PERK)、肌醇需要酶1(IRE1α)和转录激活因子6(ATF6)三个分支最终启动被定义为未折叠蛋白反应(UPR)的信号级联。UPR的启动将通过减慢蛋白翻译或增加ER的折叠能力来减轻ER的负担,以支持细胞存活。肿瘤细胞的快速增殖需要蛋白质合成的急性增加,从而不可避免地引起UPR。癌细胞可以劫持内质网应激通路支持其恶性活动。UPR信号失调常伴随着肿瘤细胞生长、侵袭能力和耐药性的上调。然而,肿瘤细胞劫持内质网应激的潜在机制尚未完全阐明。众所周知,代谢重塑是肿瘤细胞适应生物合成途径以及对微环境刺激提供特定适应性特征的标志。乙酰辅酶A是中枢代谢中间产物之一。然而,在内质网应激下,癌细胞是否通过调控乙酰辅酶A代谢重编程来维持恶性状态仍不确定。该研究发表在《Journal of Experimental & Clinical Cancer Research》,IF:11.3。
技术路线
主要研究结果
1. ACLY高表达与HCC患者不良预后相关
为了探索乙酰辅酶A代谢重编程对HCC细胞内质网应激的影响,作者分析了来自三个HCC队列(包括TCGA-LIHC,ICGC-LIRI-JP和GSE101728)的HCC组织和癌旁组织中的乙酰辅酶A代谢相关基因(ARGs)的表达模式。将每个数据集的差异表达ARG合并在维恩图中,并确定重叠基因(图1A)。接下来,作者使用毒胡萝卜素(TG)和衣霉素(TM)作为内质网应激的诱导剂来模拟不利的微环境刺激,并在肿瘤细胞中评估上调基因的表达水平。如图1B所示,内质网应激后只有ACLY上调。这些数据表明,ACLY可能在调节内质网应激下的肝癌细胞稳态中发挥重要作用。为了分析ACLY在HCC中的临床相关性,作者检测了139例HCC样本中ACLY的表达,并将患者分为两组(ACLY低表达组和ACLY高表达组)。与非肿瘤组织相比,ACLY在肿瘤组织中增加,在B/C期上调(图1C)。生存分析显示,与ACLY低表达组相比,ACLY高表达预示着更短的总生存(OS)和无病生存(DFS)时间(图1D)。同样,来自TCGA队列或ICGC-LIRI-JP队列的数据分析也显示,ACLY过表达与HCC患者的不良预后相关(图1E)。
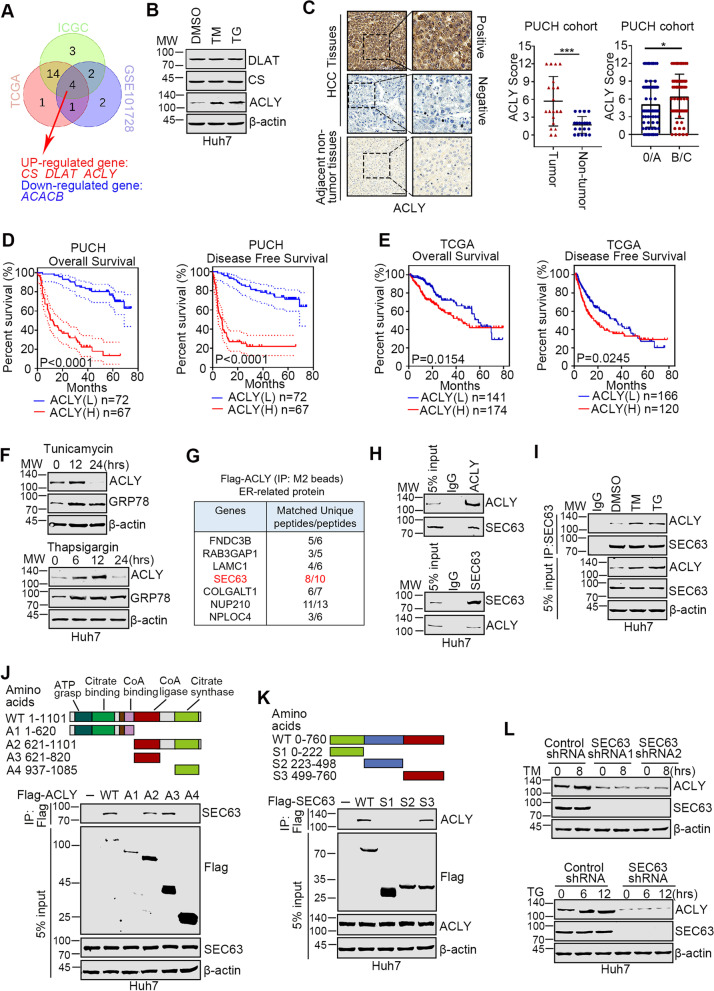
图1 在HCC细胞中,ACLY被SEC63上调以响应内质网应激
2. ACLY在内质网应激时被SEC63上调
进一步分析毒胡萝卜素和衣霉素处理后肝癌细胞中ACLY的表达水平。如图1F所示,内质网应激标志物的GRP78显著升高,提示内质网应激诱导成功。TM或TG短期干预后,ACLY表达上调,与GRP78相似。然而,当诱导药物处理细胞较长时间(24h)时,ACLY降低,表明严重的内质网应激不能上调ACLY。由于过度的内质网应激诱导细胞死亡是众所周知的,作者接下来确定了ACLY在原始内质网应激下被激活的潜在机制。通过免疫共沉淀(Co-IP)和质谱分析,发现与内质网应激相关的潜在ACLY结合蛋白。定位分析发现7个蛋白为ER相关蛋白(图1G)。在这些蛋白中,SEC63因为其调节内质网应激的作用而特别受关注。Co-IP实验显示SEC63确实与ACLY有相互作用(图1H),并且这种相互作用被内质网应激增强(图1I)。ACLY的SEC63结合区域被缩小到CoA连接酶结构域(图1J)。此外,SEC63的c端是与ACLY相互作用所必需的(图1K)。最后,在SEC63缺失的细胞中,内质网应激不能诱导ACLY(图1L),这表明在内质网应激下,ACLY的激活需要SEC63。总之,这些结果表明,ACLY在内质网应激中被SEC63上调。
3. 内质网应激时,SEC63在T537被磷酸化
SEC63在内质网应激时如何被激活尚不清楚。作者观察到SEC63的核定位以及SEC63的一部分在内质网应激下从细胞质转位到细胞核(图2A-D)。之前的研究报道SEC63是ER常驻蛋白。为了进一步证实作者的结果,作者用COMPARTMENTS预测了SEC63的亚细胞定位。预测提示SEC63除了定位于ER外,还定位于细胞质和细胞核。JPred4识别了核定位信号(NLS),表明残基510-546区域可能是SEC63核定位所必需的(图2E)。作者构建了SEC63缺失突变体(delN),该突变体缺乏NLS。事实上,免疫荧光和蛋白印迹分析表明,在正常条件下或内质网应激下,delN没有核定位(图2F-G)。综上所述,这些结果表明内质网应激诱导SEC63从细胞质转位到细胞核。
研究SEC63在内质网应激下的激活机制具有重要的意义。由于SEC63与IRE1α结合,作者推测IRE1α通过其激酶活性磷酸化SEC63。在TM或TG处理的细胞中检测到SEC63的丝氨酸/苏氨酸磷酸化(图2H),表明SEC63在内质网应激后被磷酸化。磷酸化位点由PhosphoSitePlus预测为Thr537(图2I)。然后,作者通过用丙氨酸取代Thr537来消除磷酸化,从而创建了SEC63突变体,并发现野生型(WT)SEC63的免疫沉淀中可检测到磷酸化,但在SEC63- t537a的免疫沉淀中不能检测到磷酸化(图2J)。为了进一步研究Thr537磷酸化对SEC63功能的影响,作者制备了t537磷酸化特异性抗体(T537-p)来识别t537磷酸化。因此,使用T537-p抗体,作者也观察到SEC63在T537的磷酸化在内质网应激时增加(图2K)。此外,内质网应激后,Flag-SEC63而不是Flag-SEC63 T537A被磷酸化(图2L)。此外,KIRA6对IRE1α的抑制显著降低了ACLY的表达水平和SEC63在Thr537的磷酸化(图2M)。这些数据表明,内质网应激时SEC63的Thr537位点被磷酸化。
值得注意的是,Thr537位于SEC63的NLS。因此,磷酸化是否影响SEC63从细胞质转位到细胞核尚不清楚。此外,T537A突变降低了SEC63和ACLY的相互作用,而T537E突变增加了相互作用(图2N)。因此,这些结果表明,在内质网应激后,Thr537位点的磷酸化促进了SEC63的核定位,并增强了SEC63与ACLY的相互作用。
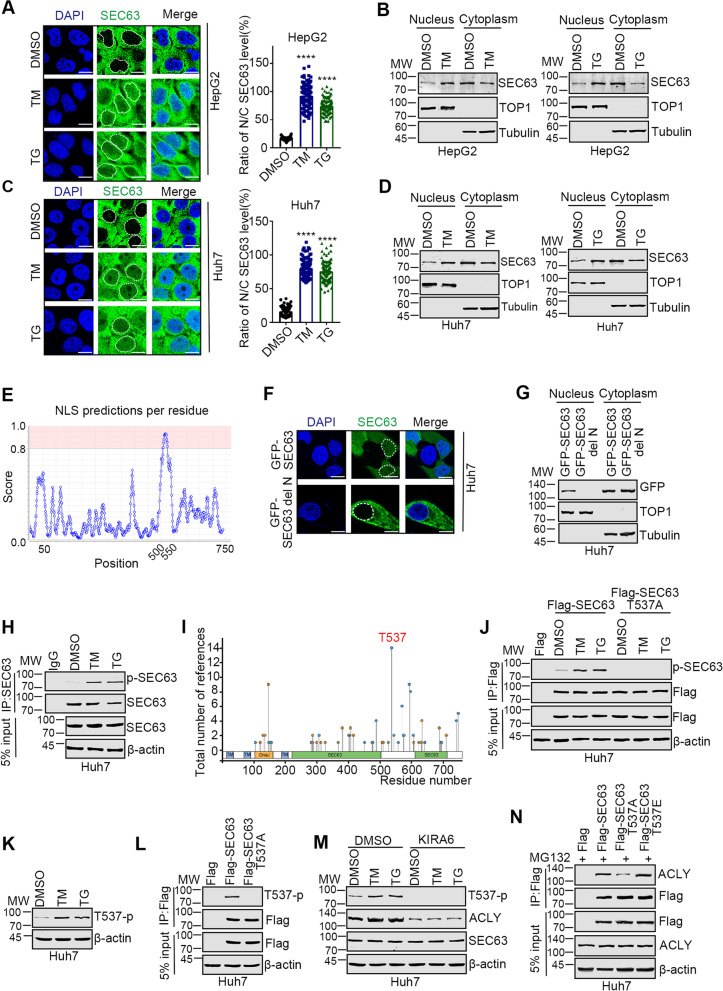
图2 内质网应激后,SEC63在Thr537位点被磷酸化。
4. SEC63通过拮抗KLHL25提高ACLY的稳定性
由于内质网应激下ACLY的激活需要SEC63的参与,因此作者研究了SEC63对ACLY的调控机制。如图3A所示,敲除SEC63降低了肝癌细胞中ACLY的蛋白水平。同样,SEC63和SEC63 S3突变体的过表达上调了ACLY的表达水平,但SEC63 S1和S2突变体没有这一作用(图3B)。与SEC63野生型相比,SEC63 T537A突变体对ACLY表达水平的影响较弱,而SEC63 T537E突变体对ACLY表达水平的影响较强(图3C),说明SEC63的磷酸化增强了其对ACLY的功能。此外,下调SEC63对ACLY的mRNA水平没有影响,ACLY的mRNA水平在响应内质网应激时没有改变(图3D),表明SEC63本身可能调节ACLY的稳定性。为了证实这一假设,作者使用了CHX(一种核糖体阻滞药物)来阻断蛋白翻译,并分析了ACLY的稳定性。如图3E所示,在SEC63缺失的细胞中,ACLY的稳定性受到损害。过表达SEC63提高了ACLY的稳定性,而SEC63 T537A突变体减弱了这一作用(图3F)。
泛素-蛋白酶体系统(UPS)对控制ACLY稳定性至关重要。因此,作者使用蛋白酶体抑制剂MG132来确定SEC63介导的ACLY稳定是否依赖于UPS。加入MG132后,SEC63减少的ACLY被逆转,表明SEC63通过蛋白酶体依赖途径调节ACLY水平(图3G)。在内质网应激下,肝癌细胞中ACLY的泛素化水平降低,而敲低SEC63后,这种作用几乎不可见(图3H)。此外,当SEC63被敲除时,ACLY的泛素化上调(图3I)。同样,过表达SEC63抑制ACLY的泛素化,而SEC63的T537A突变减弱了这一作用(图3J)。这些结果表明,SEC63通过抑制ACLY的泛素化来增加ACLY的稳定性。接下来,作者揭示了SEC63影响ACLY泛素化的机制。CUL3通过其接头蛋白KLHL25与ACLY相互作用,从而泛素化并降解ACLY。有趣的是,SEC63与片段A3(氨基酸621~820)结合(图1J),而片段A3也与KLHL25相互作用,这表明SEC63可能与KLHL25竞争与ACLY的结合。事实上,Flag-SEC63抑制了KLHL25和ACLY之间的相互作用,并且这一作用被SEC63的磷酸化增强(图3K)。此外,作者在对照组细胞中观察到内质网应激后KLHL25和ACLY之间的相互作用减少,而不是在去除SEC63的细胞中(图3L)。在SEC63缺失的细胞中,内质网应激未能诱导ACLY稳定(图1L)。综上所述,这些发现表明SEC63通过对抗KLHL25和ACLY之间的相互作用来提高ACLY的稳定性。
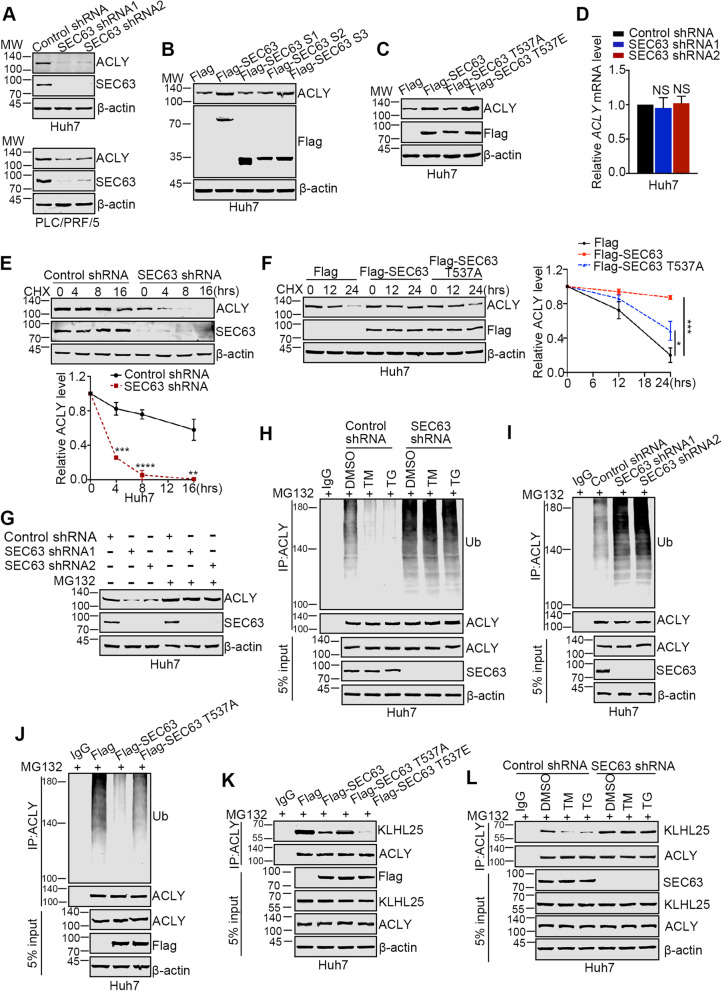
图3 SEC63增加了ACLY的稳定性
5. SEC63高表达与HCC患者不良预后相关
考虑到SEC63被内质网应激激活并上调ACLY,作者接下来分析了SEC63与HCC的临床相关性。作者首先在139例HCC标本中检测到SEC63的表达(图4A)。SEC63在HCC组织中表达上调,在临床B/C期升高(图4B)。SEC63在HCC患者中的高表达与较短的OS和DFS时间相关(图4C-D)。TCGA-LIHC队列的数据分析也一致表明,与SEC63低表达的患者相比,SEC63高表达预测的临床结局较差(图4E-F)。鉴于SEC63在晚期(B/C)HCC中高于早期(0/A)HCC,作者探索了SEC63或ACLY表达与HCC转移的关系,发现与非转移的HCC组织相比,SEC63和ACLY在转移的HCC组织中表达增加(图4G)。综上所述,这些结果表明,SEC63和ACLY表达水平升高与HCC转移相关,可作为HCC不良预后的潜在指标。
此外,与SEC63低表达组相比,ACLY在SEC63过表达的HCC组织中表达上调(图4H)。通过免疫印迹法进一步检测12例配对的人HCC癌组织和配对的非癌组织中SEC63和ACLY的表达(图4I),SEC63和ACLY在HCC组织中的表达显著相关。重要的是,单因素和多因素Cox回归分析显示,除Edmondson分级、转移和肿瘤大小外,SEC63的表达也被确定为HCC患者预后的独立预后指标(图4J-K)。最后,生存分析显示,SEC63和ACLY表达共上调的患者OS最短(图4L)。与SEC63和/或ACLY低表达的患者相比,SEC63和ACLY表达的共上调也预测了最差的DFS(图4M)。这些结果表明,SEC63和ACLY的共同上调在HCC进展中起重要作用。
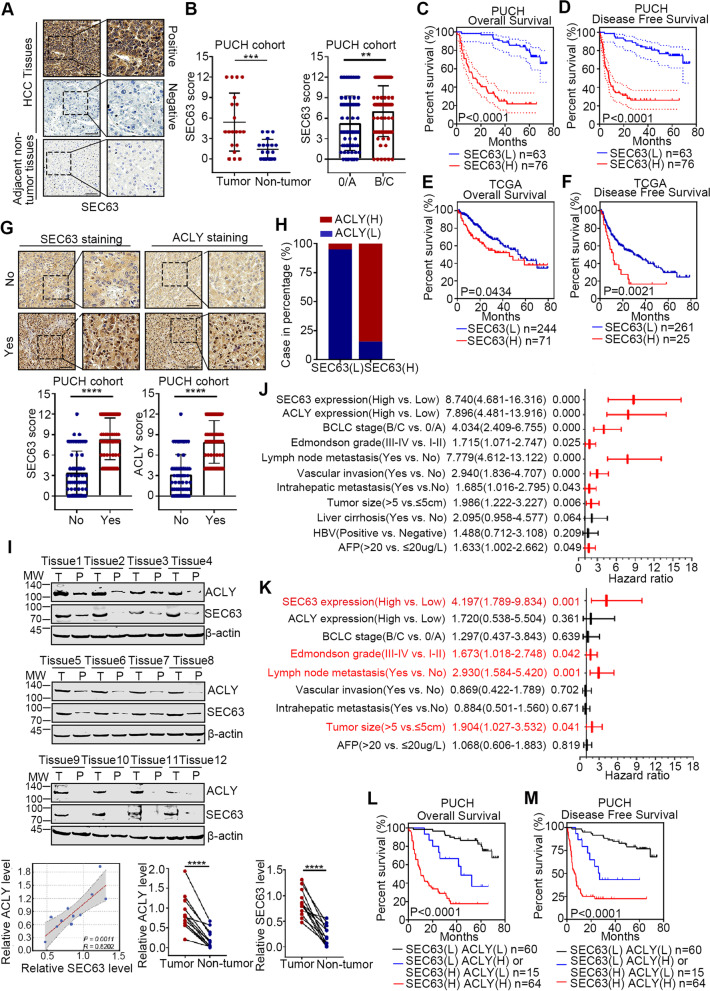
图4 SEC63与HCC患者的预后有关
6. SEC63依赖于ACLY促进肝癌细胞转移
值得注意的是,SEC63的高表达与肝癌转移相关。因此,作者确定了SEC63在肝癌细胞转移中的功能作用。在HCC细胞中,内源性SEC63被稳定敲低,异位SEC63被稳定过表达。过表达SEC63导致HepG2和Huh7细胞的迁移和侵袭显著增加(图5A)。这些现象在ACLY敲除的细胞中未观察到。同样,敲低SEC63降低了肝癌细胞的迁移和侵袭能力(图5B)。划痕实验进一步证实,在ACLY表达的细胞中,过表达SEC63促进肝癌细胞的迁移(图5C)。同样,SEC63敲低降低了肝癌细胞的迁移能力(图5D)。为了验证这些结果,作者进一步通过静脉注射细胞到裸鼠体内来研究SEC63敲低或过表达对肝癌移植瘤体内转移的影响。如图5E所示,SEC63的缺失减少了肺转移瘤的形成。同样,SEC63的表达增加促进了肺转移的形成(图5F)。此外,ACLY敲低或ACLY抑制剂(ECT1002)主要抑制SEC63介导的转移(图5F)。综上所述,作者的结果表明SEC63通过调节ACLY来增强HCC的转移,并且靶向SEC63显示出抑制HCC进展的潜力。
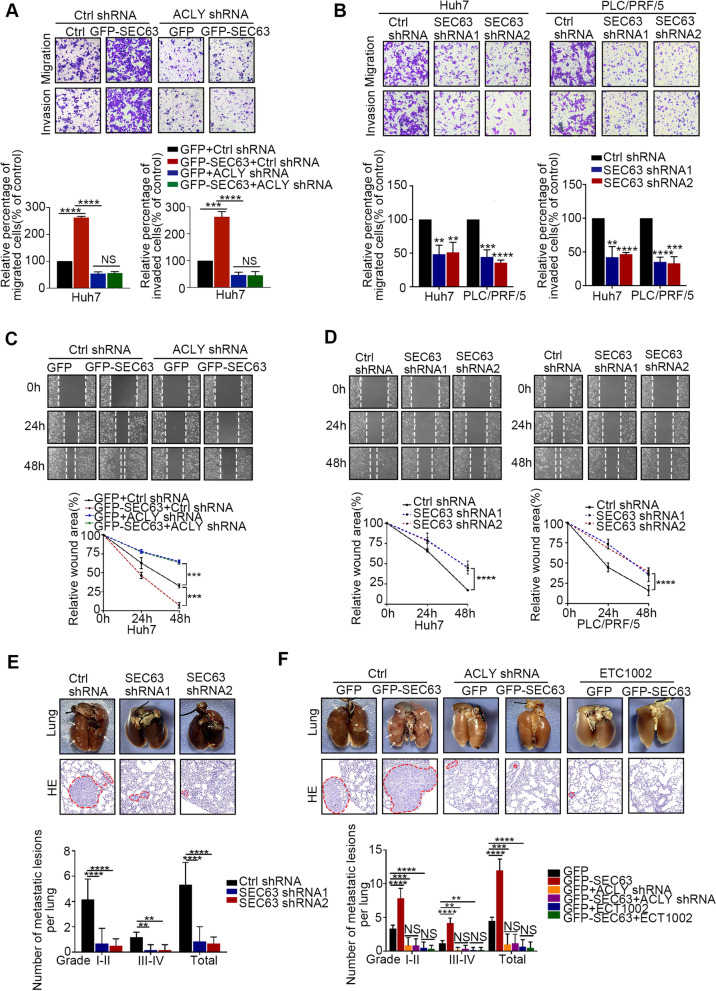
图5 SEC63依赖于ACLY促进肝癌细胞转移
7. SEC63通过上调Snail1表达诱导肝癌细胞发生上皮-间充质转化(EMT)
为了阐明SEC63促进肝癌转移的机制,作者使用纯化的SEC63敲除细胞和对照细胞的RNA进行了RNA测序。共有433个基因被鉴定为差异表达(图6A)。STRING蛋白互作分析显示,前15个hub基因主要参与细胞迁移和侵袭(图6B)。在这些基因中,Snail1(由SNAI1编码)是EMT的重要转录因子,EMT是公认的肿瘤细胞转移的生物学过程。因此,作者研究了SEC63对肝癌细胞中Snail1及其下游靶点表达的影响。在过表达SEC63的HCC细胞中,Snail1和Vimentin(两种间质标志物)的mRNA水平显著升高,而E-cadherin(上皮标志物)的mRNA水平降低(图6C)。蛋白质印迹法也显示了类似的作用(图6D)。此外,敲除SEC63降低了Snail1和Vimentin的表达,而增加了E-cadherin的表达(图6E)。蛋白质印迹法也显示,SEC63敲除导致Snail1表达下降(图6F)。在异种移植组织中,SEC63水平与Snail1显著相关(图6G)。SEC63通过调控Snail1的表达促进肝癌细胞EMT。
为了分析SEC63是否通过下调Snail1的表达诱导肝癌细胞转移,作者在SEC63敲除的细胞中重新引入Snail1。如图6H所示,重新引入Snail1表达显著逆转了SEC63敲除后降低的EMT表型,恢复到与对照细胞相似的水平。此外,在Snail1抑制的细胞中,SEC63的过表达对肝癌细胞的迁移和侵袭没有影响(图6I)。SEC63上调Snail1的表达是否需要ACLY是一个值得关注的问题。作者发现,ACLY缺失显著减弱了SEC63对Snail1表达水平和组蛋白H3乙酰化水平的影响(图6J)。另一方面,内质网应激下Snail1的水平也增加(图6K)。总之,SEC63通过稳定ACLY上调Snail1的表达来增强HCC的转移,这一作用在内质网应激下增强。
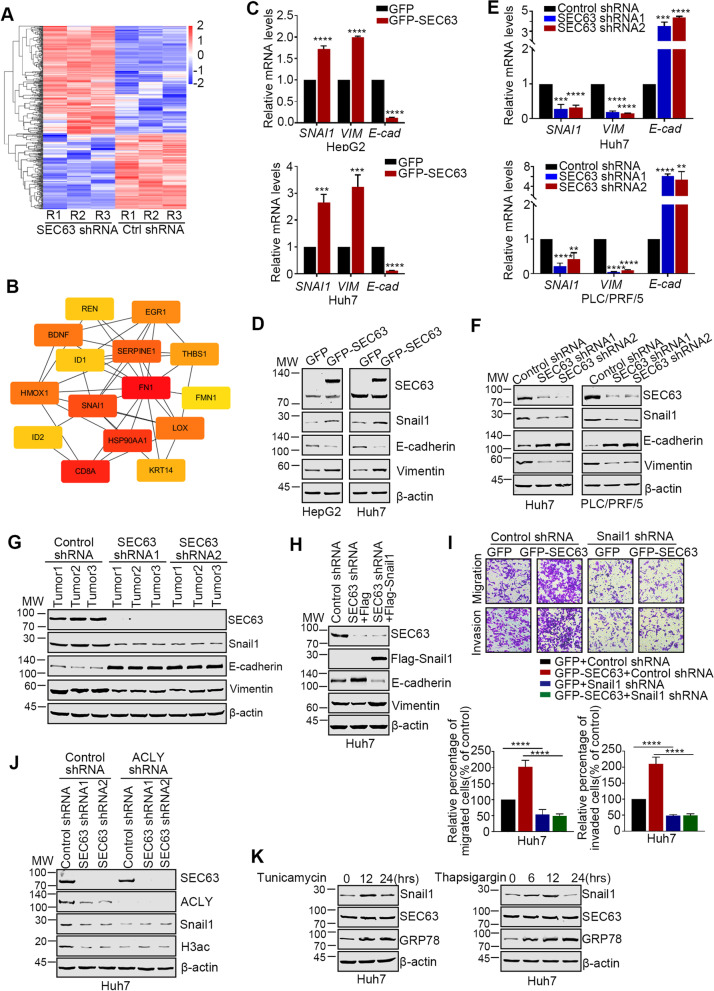
图6 SEC63在肝癌细胞中调控Snail1的表达
8. SEC63促进ACLY相关的代谢重编程
ACLY是催化柠檬酸盐转化为草乙酸盐和乙酰辅酶A的关键酶,而乙酰辅酶A是生物合成脂类(包括游离脂肪酸、胆固醇和磷脂)的基石。当内质网应激时,IREα通路增加脂质生物合成以支持内质网膜。此外,ACLY介导的乙酰辅酶A生成调节对肿瘤代谢重编程也至关重要。因此,研究SEC63是否调控ACLY相关的代谢重编程具有重要意义。SEC63过表达增加了细胞乙酰辅酶A水平和脂质水平(图7A-B)。SEC63 T537A突变减弱了这种作用。此外,在没有ACLY的情况下,SEC63对HCC细胞的乙酰辅酶A和脂质水平影响很小。此外,在对照组细胞中,内质网应激后乙酰辅酶A水平增加,但在ACLY抑制的细胞中没有(图7C)。因此,这些发现表明,SEC63增强ACLY介导的乙酰辅酶A生成,从而增加脂质生成,以支持内质网应激时的内质网膜。
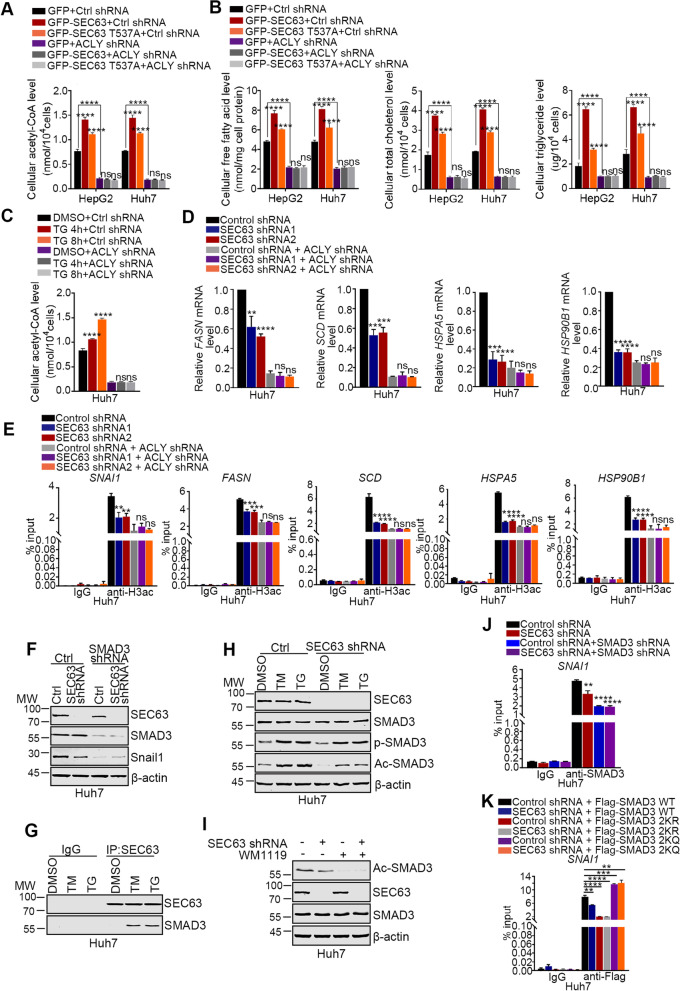
图7 SEC63调节ACLY相关的代谢和表观遗传重编程
9. SEC63改变表观遗传重编程,从而增强UPR
细胞乙酰辅酶A水平在组蛋白乙酰化的维持中起重要作用。为了进一步阐明SEC63介导的ACLY稳定的作用,作者分析了SEC63缺失后的组蛋白乙酰化水平。SEC63敲除后,组蛋白H3乙酰化水平显著下降。此外,在ACLY敲除的细胞中,SEC63敲除后未发现这一效应(图6J)。因此,这些结果表明,SEC63上调ACLY通过增加细胞乙酰辅酶A水平促进H3乙酰化。
ACLY相关组蛋白乙酰化参与调控下游基因的转录。内质网应激后,IRE1α被激活,诱导具有活性的转录因子XBP1s的表达。XBP1s上调UPR靶基因的表达,如ER伴侣蛋白和脂质代谢。ACLY是否参与调控UPR靶基因尚不清楚。为了解决这一问题,作者分析了SEC63和ACLY对UPR靶基因的影响。如图7D所示,在内质网应激条件下,SEC63的缺失显著降低了靶基因的表达。敲低ACLY后,这种作用消失了。同时,SEC63敲低后,这些基因启动子区域的H3乙酰化水平降低,而当ACLY被沉默时,这种作用被消除(图7E)。综上所述,这些发现揭示了SEC63特异性地上调ACLY提供了足够的乙酰辅酶A,从而改变表观遗传特征,支持UPR。
有趣的是,作者观察到,与对照细胞相比,SEC63敲除细胞中SNAI1启动子区H3乙酰化水平降低(图7E),这与SEC63敲除细胞中Snail1的表达降低一致(图6E)。这些结果表明SEC63表观遗传调控Snail1的表达。为了阐明潜在的机制,作者鉴定了SEC63相互作用蛋白对内质网应激的影响。通路分析发现SEC63相互作用蛋白主要富集在代谢通路、ER蛋白加工、黏附相关蛋白等。此外,作者还发现SMAD3可以促进Snail1转录。在SMAD3敲除的细胞中,SEC63不能调节Snail1的表达(图7F),表明SEC63以SMAD3依赖的方式上调Snail1。SMAD3 K20和K117位点的乙酰化对于增强SMAD3介导的转录活性至关重要。作者假设SEC63通过稳定ACLY提供乙酰辅酶A来增加SMAD3的乙酰化。为了验证这种可能性,作者证实了SEC63和SMAD3之间的结合,并且这种相互作用在内质网应激时增强(图7G)。此外,内质网应激时SMAD3的乙酰化显著增加,而敲低SEC63则降低了SMAD3的乙酰化(图7H),表明SEC63对内质网应激下SMAD3乙酰化的重要性。既往研究表明,IRE1α/STAT3信号通路增加内质网应激后SMAD3的磷酸化,这对于SMAD3的核转位必不可少。SEC63对SMAD3的磷酸化影响较小,提示SEC63主要在细胞核内调控SMAD3。由于赖氨酸乙酰转移酶6A(KAT6A)是SMAD3的关键乙酰转移酶,作者测试了用KAT6A抑制剂(WM1119)处理细胞时,SEC63或ACLY敲低对SMAD3乙酰化的作用。结果表明,在KAT6A被抑制后,SEC63或ACLY的敲低对SMAD3乙酰化水平没有影响(图7I)。因此,SEC63通过与SMAD3结合并稳定ACLY提供乙酰辅酶A来增加SMAD3的乙酰化。此外,敲低SEC63降低了SMAD3与SNAI1启动子的相互作用(图7J)。构建乙酰化缺陷的SMAD3 2KR突变体和乙酰化模拟的SMAD3 2KQ突变体后,作者观察到2KR突变体降低了SMAD3与SNAI1启动子的结合,而2KQ增加了SMAD3与SNAI1启动子的结合。重要的是,SEC63只影响野生型SMAD3与SNAI1启动子的结合(图7K),表明SEC63相关的SMAD3乙酰化调节SMAD3介导的SNAI1转录。综上所述,这些数据表明,在内质网应激下,与SEC63相关的SMAD3乙酰化表观遗传促进Snail1的表达,从而促进HCC在细胞核内的转移。
结论
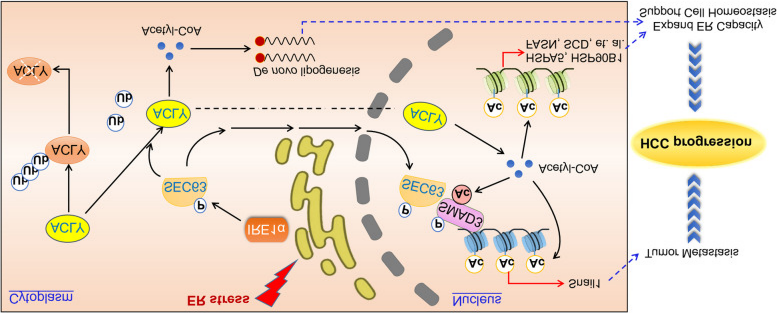
该研究报道了IRE1α-SEC63-ACLY信号通路在调节肝癌代谢和转移中的重要作用。内质网应激后,SEC63在T537被IRE1α通路磷酸化。磷酸化的SEC63随后上调ACLY的稳定性,产生更多的乙酰辅酶A。乙酰辅酶A的升高用于脂肪生成,组蛋白乙酰化用于UPR靶基因的转录。同时,SEC63通过增加SMAD3乙酰化诱导Snail1表达,促进癌细胞转移。这些发现强调了一种癌症选择性适应,即HCC细胞部署与内质网应激相关的反应来维持细胞存活并启动细胞转移。
机制图
实验方法
蛋白质印迹,免疫共沉淀(Co-IP),跨孔迁移和侵袭测定,伤口愈合测定,免疫组织化学(IHC),免疫荧光(IF),实时荧光定量PCR(RT-qPCR),染色质免疫沉淀(ChIP),GST pull-down,RNA测序,动物实验
参考文献
Hu C, Xin Z, Sun X, Hu Y, Zhang C, Yan R, et al. Activation of ACLY by SEC63 deploys metabolic reprogramming to facilitate hepatocellular carcinoma metastasis upon endoplasmic reticulum stress. J Exp Clin Cancer Res. 2023 May 1; 42(1):108. doi: 10.1186/s13046-023-02656-7.






