DRP1驱动的线粒体可塑性诱导代谢重编程可减少乳腺癌脑转移
扩散的肿瘤细胞具有灵活的新陈代谢,可以利用远端器官中的营养物质,但其促进新陈代谢适应性的确切机制仍不清楚。在本研究中,作者揭示了潜伏脑转移细胞(Lat)中的线粒体点状片段能够通过脂肪酸氧化(FAO)维持细胞生物能和氧化还原平衡,消耗富集的动态相关蛋白1(DRP1)并限制Lat细胞线粒体的可塑性,会导致脂滴堆积增加、FAO受损和转移减弱。同样,在临床前模型中,使用小分子脑渗透抑制剂对DRP1进行药理抑制,可减轻转移负荷。与上述结论一致的是,与患者匹配的原发肿瘤相比,在转移的脑转移瘤中观察到磷酸-DRP1表达增加。该研究结果揭示了线粒体可塑性在支持瘤细胞存活方面的关键作用,并强调了靶向细胞可塑性程序与肿瘤特异性改变相结合以预防转移性复发的治疗潜力,于2023年5月发表在《nature cancer》,IF:22.7。
技术路线
主要研究结果
1.潜伏细胞吸收反应性星形胶质细胞分泌的FAs
癌症转移到中枢神经系统是致命的。乳腺癌患者的脑转移发生率因疾病亚型而异,晚期乳腺癌患者中约有25-50%出现脑转移。为了解扩散的肿瘤细胞是如何作为亚临床疾病持续存在并引发远期转移的,作者在小鼠体内进行了表型选择,并从HCC1954和SKBR3 HER2+乳腺癌细胞中分离出了潜伏的脑转移(Lat)细胞。脂质组图谱也显示Lat细胞中的中性脂肪酸含量较高(图1a),这表明Lat细胞具有更好的吸收外源脂质的能力。
在心内注射 5 周后对小鼠大脑进行免疫荧光(IF)染色发现,大脑中的Lat细胞被反应性星形胶质细胞包围(图1b)。作者将星形胶质细胞与BODIPY-C12培养过夜,然后用温培养基洗涤三次,并与GFP+癌细胞一起培养。对这些共培养物进行活细胞延时成像,以评估荧光标记的FA从星形胶质细胞转移到癌细胞的情况。与Pa细胞相比,在HCC1954和SKBR3 Lat细胞中观察到的 BODIPY-C12+脂滴(LDs)数量明显增加(图1 c-e)。

图1潜伏细胞吸收反应性星形胶质细胞分泌的 FAs(a-e)
2.潜伏细胞中丰富的线粒体碎片点状结构
为了观察和量化Lat和Pa细胞中的LDs,作者进行了透射电子显微镜观察。与之前的观察结果相一致,两种细胞系模型的Lat细胞与Pa细胞相比,LDs数量显著增加(图1f)。值得注意的是,与具有大管状线粒体的亲代细胞相比,Lat细胞中的线粒体碎片更小(图 1f、g )。TOMM20染色证实Lat细胞中的中间线粒体和点状线粒体数量增加(图 1h、i)。
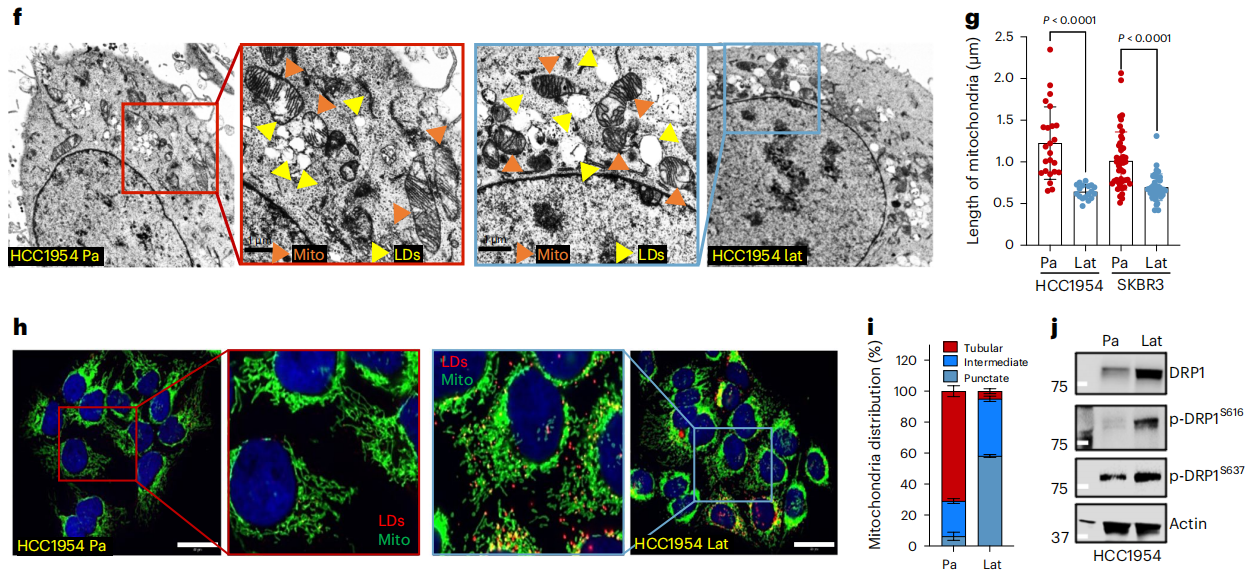
图1 潜伏细胞吸收反应性星形胶质细胞分泌的 FAs(f-j)
3. 凋亡细胞氧化内化的 FAs 并维持氧化还原平衡内化的 FAs
内化的脂肪酸可能被导入线粒体氧化或直接储存在低密度脂蛋白中。线粒体中增加的FAs β-氧化作用可产生乙酰-CoA,乙酰-CoA 进入三羧酸(TCA)循环,促进细胞在应激或营养耗竭条件下的存活。事实上,与Pa相比,14C 标记的棕榈酸酯处理诱导Lat细胞产生更多的14CO2(图 2a),表明 FAO 增加。
为了进一步评估脂肪酸的利用模式及其对所观察到的代谢物池差异的贡献,作者进行了 13C16 棕榈酸酯同位素追踪分析(图 2b)。此外,与Pa细胞相比,柠檬酸盐、谷氨酸盐和苹果酸盐的 M+2 同位素在HCC1954和SKBR3 Lat细胞中明显富集(图 2c-e )。此外,在Lat细胞中,棕榈酸酯衍生的碳富集于谷胱甘肽的 GSH(还原型谷胱甘肽)和GSSG(氧化型谷胱甘肽)形式中(图 2f、g )。稳态谷胱甘肽定量显示,细胞ROS减少的Lat细胞中GSH/GSSG比率升高(图 2h)。如前所述,与亲代细胞相比,Lat细胞能更好地将过量的FA储存为LD 并存活下来(图2 i, j)。因此,潜伏细胞氧化内化的FAs,然后通过TCA循环进行氧化,维持细胞氧化还原平衡,这对转移启动细胞至关重要。
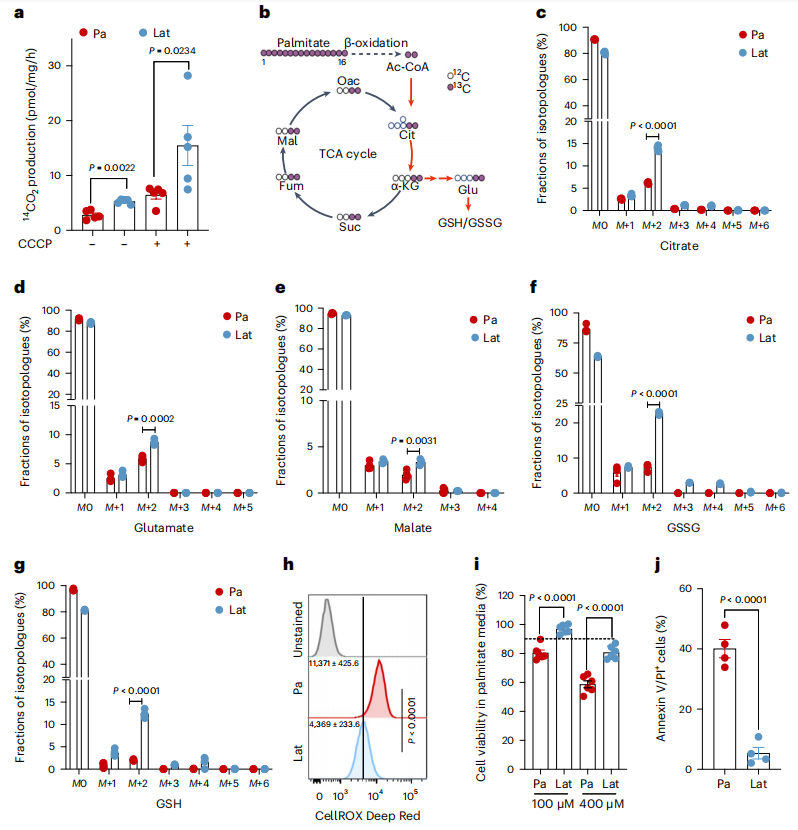
图2 Lat细胞氧化内化的FAs并维持氧化还原平衡
4. DRP1驱动的线粒体动力学可实现FAO和氧化还原平衡
如前所述,HCC1954和SKBR3潜伏细胞的线粒体裂解蛋白DRP1和活化的磷酸化形式p-DRP1S616水平升高(图 1j )。此外,点状线粒体与FAO的增加有关。因此,作者检验了线粒体动力学的改变是否促进了Lat细胞中FAO的增加和代谢重编程。透射电子显微镜(TEM)和IF分析表明,与对照组相比,Lat细胞中 DRP1的缺失会导致线粒体长度增加、线粒体呈管状以及点状线粒体数量减少(图 3a-c )。
接下来,作者猜想线粒体动力学的改变是否会影响潜伏细胞对FA的吸收和氧化。在对照组和去除了DRP1的Lat细胞中的13C16棕榈酸酯示踪表明,棕榈酸酯的摄取没有明显差异。然而,DRP1缺失导致柠檬酸、谷氨酸和苹果酸的M+2 同位素富集分数减小(图3 d)。此外,DRP1 的缺失大大降低了谷胱甘肽 GSH 和 GSSG 的水平(图3 d)。与这些观察结果一致的是,去除了DRP1的Lat细胞的稳态谷胱甘肽显著下降,细胞ROS增加(图3e)。此外,由于棕榈酸酯处理后细胞死亡增加和肿瘤球形成减少,DRP1 缺失导致细胞活力下降(图 3f)。这些结果表明,DRP1驱动的线粒体动力学使Lat细胞中的FAO和氧化还原平衡得以实现。
DRP1驱动的线粒体可塑性促进了FAO并有助于Lat细胞的存活,FA图谱显示 CPT1A消耗后FA含量增加(图3 g)。消耗CPT1A后,线粒体动力学发生了明显的变化,点状线粒体显著减少,线粒体长度或管状线粒体增加(图 3h、i)。13C16棕榈酸酯示踪显示,对照和CPT1A缺失细胞的棕榈酸酯摄取量没有实质性差异。然而,Lat细胞中肉碱共轭脂肪酸的合成以及柠檬酸盐、谷氨酸盐和苹果酸盐的 M+2同素异形体的标记在CPT1A缺失后明显减少(图3 j)。去除了 CPT1 的HCC1954和SKBR3 Lat 细胞的谷胱甘肽(GSH和GSSG)水平急剧下降(图 3j)。进一步表征DRP1耗竭,在CPT1耗竭的Lat细胞中观察到形成癌细胞球的能力降低、细胞ROS水平升高,以及服用棕榈酸酯后细胞死亡增加(图3k,l)。

图3 DRP1驱动的线粒体动力学可实现 FAO 和氧化还原平衡
5. DRP1驱动的线粒体可塑性促进转移潜伏期
为了评估DRP1消耗对转移潜伏期的影响,作者向小鼠心内注射了Ctrl和DRP1敲除的Lat细胞。注射一周后,给小鼠补充dox饮食以消耗DRP1。注射五周后,收集小鼠大脑并进行免疫组化(IHC)分析,以评估存活的潜伏细胞数量。与对照组相比,携带去除了DRP1的HCC1954 Lat 细胞的小鼠的GFP+转移病灶数量显著减少(图 4a)。以前的研究曾报道过自然杀伤(NK)细胞能限制Lat细胞的增殖并加强转移潜伏。在携带Lat细胞的无胸腺小鼠体内传播后,用抗asialo-GM1多克隆抗体消耗NK细胞会导致转移爆发增加。注射了去除了 DRP1的Lat细胞的小鼠在NK细胞耗竭后没有观察到明显的转移(图4 b,c),表明残余疾病已被消除。
由于CPT1A缺失与DRP1缺失表型相同,作者通过向小鼠心内注射Ctrl或 CPT1A贫化的HCC1954和SKBR3 Lat细胞,评估了CPT1A贫化对转移潜伏期的影响。注射一周后,通过给小鼠喂食dox诱导CPT1耗竭。与 DRP1 损伤类似,CPT1A损伤也导致小鼠大脑中GFP+转移的数量显著减少(图4 d )。
接下来,作者进行了DRP1挽救实验,以证明DRP1对Lat细胞的存活至关重要。在这些研究中,他们生成了诱导性HA标记的DNM1L全长构建体,并将其转导表达在DRP1缺失的Lat细胞中,诱导DRP1表达导致线粒体形态发生逆转,并增强了去势 DRP1 细胞的肿瘤球形成能力(图4 e-g)。不出所料,DRP1挽救后,在大脑中观察到存活的Lat细胞数量增加(图4 h)。总之,作者的数据证明了依赖于DRP1的线粒体可塑性促进了FAO并促进了小鼠潜伏转移细胞的存活。

图4 DRP1驱动的线粒体可塑性促进转移潜伏期
6. 人脑转移瘤中磷酸-DRP1升高
在HER2+乳腺癌患者中,DRP1的高表达与无远处转移生存率低相关。作者对7 名HER2+乳腺癌患者的匹配 PT和转移灶进行IHC分析发现,与相应的匹配PT 相比,p-DRP1S616在脑转移灶中的高表达(图5 a,b)。M-BM细胞主要转移到大脑,偶尔也会转移到脊柱/骨骼。全身、脊柱和脑部光子通量分析表明,DRP1耗竭后,脑部和脊柱/骨骼转移负荷显著减少,这是由于细胞凋亡增加所致(图 5c-e)。此外,在去除了DRP1的M-BM细胞中异位表达DRP1能够挽救小鼠的线粒体动力学、肿瘤球形成能力和转移发生率(图6 a-c )。
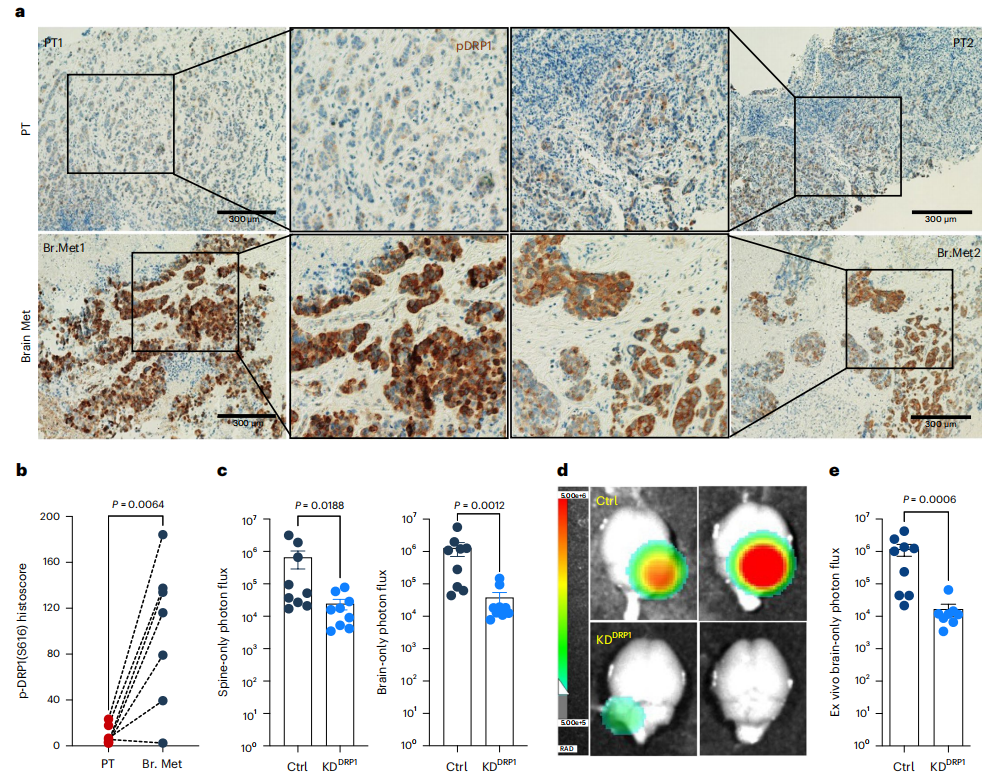
图5 Phospho-DRP1 在人脑转移瘤中升高

图6 DRP1 的基因耗竭或药物抑制可减轻脑转移
7. 药物抑制DRP1可减轻脑转移
据报道,线粒体分裂抑制剂1(Mdivi-1)可抑制依赖于DRP1的线粒体分裂,并在多种脑缺血和神经变性模型中减轻神经细胞凋亡。因此,作者评估了Mdivi-1 对脑转移的影响。为了进行这项分析,作者将HCC1954 Lat和M-BM细胞注射到无胸腺小鼠的心内。注射一周后,每天口服Mdivi-1,持续4周。在治疗过程中未观察到小鼠体重有明显差异。IHC和生物发光成像分析表明,抑制DRP1可显著减少携带M-BM细胞的小鼠中存活的潜伏细胞数量,并降低脑转移发生率(图6 d-f)。因此,限制DRP1的功能,进而阻碍线粒体的可塑性,可减轻潜伏和转移的脑转移细胞的存活率。
总之,该项研究强调了线粒体可塑性在促进潜伏转移细胞中FAs氧化过程中的重要作用。在临床前乳腺癌转移模型中消耗或药理学抑制DRP1会破坏线粒体动力学、细胞生物能和氧化还原平衡,导致脑转移减弱(图7)。这些研究结果表明,以线粒体可塑性为靶点是一种很有前景的预防转移复发的治疗方法。

图7 DRP1驱动的线粒体可塑性和代谢重编程在HER2+乳腺癌脑转移中的作用示意图
结论
线粒体动力学异常与神经退行性疾病、衰老和癌症有关。神经元线粒体裂变增加会导致线粒体功能障碍,而限制线粒体裂变会改善突触功能,减少临床前模型中认知能力的下降。此外,抑制线粒体裂变还能保护心肌缺血和急性肾缺血。另一方面,扩散的Lat乳腺癌细胞和胶质瘤诱发细胞显示线粒体形态破碎,抑制DRP1 会导致肿瘤细胞死亡增加。因此,以DRP1和线粒体分裂为靶点可能对有扩散和定植脑部倾向的癌症具有更广泛的治疗适用性。用DRP1抑制剂 能限制残留疾病的发生,并能延缓临床前模型的转移复发。同样,高活性小分子DRP1 GTPase 抑制剂(Drpitor1、Drpitor1a)也能有效限制脑转移。最后,这些发现可能在其他有脑转移倾向的癌症类型中具有更广泛的治疗应用。
实验方法
动物实验,小鼠皮质星形胶质细胞的分离和培养,转移试验,脉冲追逐试验,透射电镜,线粒体成像, FA 分析,细胞活力测定,ROS,V/PI 染色比色法检测,FAO 检测,体外 13C16 棕榈酸追踪,Western 印迹,石蜡脑组织切片,质谱分析,基因敲除和挽救
参考文献
Parida PK, Marquez-Palencia M, Ghosh S, Khandelwal N, Kim K, Nair V, Liu XZ, Vu HS, Zacharias LG, Gonzalez-Ericsson PI, Sanders ME, Mobley BC, McDonald JG, Lemoff A, Peng Y, Lewis C, Vale G, Halberg N, Arteaga CL, Hanker AB, DeBerardinis RJ, Malladi S. Limiting mitochondrial plasticity by targeting DRP1 induces metabolic reprogramming and reduces breast cancer brain metastases. Nat Cancer. 2023 Jun;4(6):893-907. doi: 10.1038/s43018-023-00563-6. Epub 2023 May 29. PMID: 37248394.






