m6A调节的肿瘤糖酵解“集合”--癌症治疗的“新星”
栏目:最新研究动态
发布时间:2023-12-22
研究者认为m6A修饰糖酵解在肿瘤治疗中具有重要意义和潜力......
糖酵解重编程是癌症最重要的特征之一,在癌症的发展中起着不可或缺的作用。在癌细胞中,葡萄糖代谢的变化满足了自身增殖、血管生成和淋巴管生成、转移的需要,也影响了肿瘤的免疫逃逸、预后评价和治疗效果。RNA的n6-甲基腺苷(m6A)修饰在真核细胞中广泛存在。动态和可逆的m6A修饰广泛参与肿瘤干细胞更新和分化、肿瘤治疗抵抗、肿瘤微环境、肿瘤免疫逃逸和肿瘤代谢的调控。近年来,越来越多的证据表明m6A修饰可以通过多种方式影响肿瘤的糖酵解过程,从而调节肿瘤的生物学行为。本文综述了糖酵解在肿瘤发生发展中的作用,并详细阐述了m6A修饰通过调节糖酵解对不同肿瘤的深远影响。研究者认为m6A修饰糖酵解在肿瘤治疗中具有重要意义和潜力。本文于2023年8月发表在《Molecular Cancer》IF: 37.3期刊上
m6A修饰
m6A修饰是真核细胞mRNA和lncRNA中最常见的化学修饰。它几乎参与了RNA的加工、核输出、翻译和降解等整个RNA代谢过程。RNA的m6A修饰是动态和可逆的。这种复杂的反应离不开“编写者”、“擦除者”和“阅读者”的互动。具体地说,m6A的“编写者”和“擦除者”负责调节相关RNA的甲基化水平。这样,各种m6A“阅读者”就可以识别并结合m6A修饰的RNA来调节基因表达(图1;表1)。
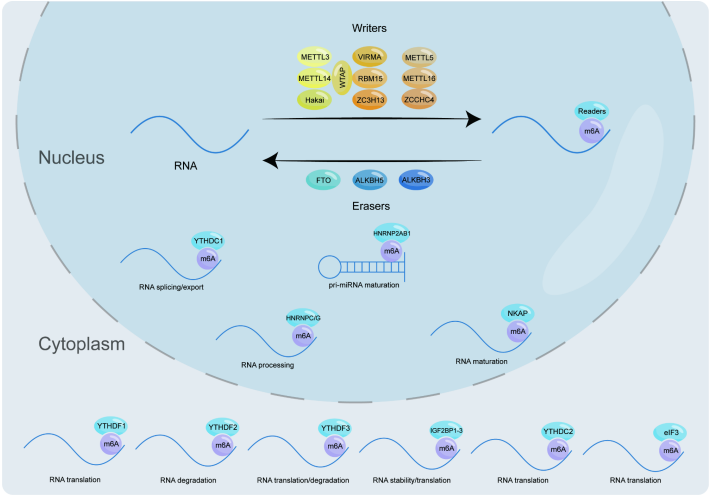
图1 m6A修饰的调控
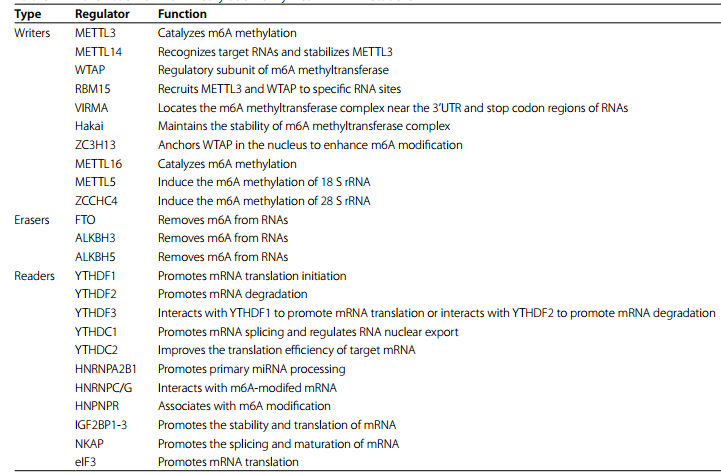
表1 m6A甲基化酶在RNA代谢中的功能

m6A“编写者”- 甲基化转移酶
作为m6A“编写者”,甲基转移酶复合物由多个成分组成,这些成分相互支持,共同调节核酸的甲基化。众所周知,METTL3和METTL14是来自同一家族的S-腺苷甲硫氨酸(SAM)依赖性甲基转移酶。它们形成的异二聚体在m6A的调节中起着至关重要的作用,同时也与体外DNA损伤的修复有关。这里,主要讨论METTL3和METTL14作为m6A“编写者”的作用。Wang等人证明,METTL3在分子水平上折叠形成带正电沟槽,并含有大量的SAM,而在METTL14中没有发现SAM。这说明METTL3是催化甲基化修饰的核心力量,但对METTL3的赖氨酸残基进行类泛素修饰后,其催化能力受到抑制。此外, METTL3的功能也与Cys-Cys-Cys-His(CCCH)型锌结合基序的结构基础密不可分。作为METTL3-METTL14二聚体复合物的另一个组分,METTL14可以通过其末端RGG重复序列与RNA结合,也可以在分子水平上与METTL3形成广泛的连接,从而提高METTL3的生物活性。METTL14还能在METTL3的保护下避免U-box-蛋白 1介导的泛素化降解。肾母细胞瘤1相关蛋白(WTAP)是催化m6A修饰的核心复合物的组分之一。它作为METTL3- METTL14复合体的调控亚基存在,其表达也受METTL3的调控。RNA结合基序蛋白15(RBM15)主要与METTL3和WTAP结合。它还通过促进RNA解旋酶DBP5与mRNA的结合来提高mRNA的成核效率。VIRMA在招募由METTL3、METTL14和WTAP组成的催化核心复合体方面发挥作用。它主要在RNA的3’非编码区和终止密码子附近发挥催化功能。Hakai是一种环指E3泛素连接酶,在维持m6A甲基转移酶复合体的稳定性方面发挥着不可替代的作用。ZC3H13就像一颗铆钉,连接着RBM15、WTAP和Virma,也与WTAP、Virma和Hakai的核定位有关。
除了上述,还有一些甲基转移酶是不容忽视的。例如,METTL16是近年来逐渐被发现的一种甲基转移酶,它通过其N-末端结构域和C-末端VCRs来调节MAT2A mRNA和U6 snRNA的表达,维持细胞内SAM的动态平衡,并与DNA损伤后的修复有关。此外,METTL5和ZCCHC4还负责细胞中18 S rRNA和28 S rRNA的甲基化。其作用的具体机制有待进一步研究。
M6A“擦除者”-去甲基化酶
脂肪量和肥胖相关蛋白(FTO)、ALKB同源物5(ALKBH5)和ALKB同源物3(ALKBH3)都是双加氧酶ALKB蛋白家族的成员。它们依靠α-酮戊二酸和铁(II)来降低RNA的m6A修饰水平。在微观结构水平上,ALKBH3、ALKBH5和FTO都具有浅间隙,因此它们更喜欢与mRNA等单链核酸结合。此外,FTO的去甲基化活性受RNA序列和三级结构的影响,并且它还具有SFPQ(一种RNA结合蛋白)作为其伴侣蛋白。SFPQ可以与RNA上的CUGUG序列结合并募集FTO来促进近端去甲基化。
M6A“阅读者”-甲基化阅读蛋白
与“编写者”和“擦除者”不同,m6A“阅读者”不直接改变甲基化水平,而是识别并结合RNA的甲基化位点。在这个过程中,各种“阅读者”与各种m6A位点结合,影响RNA的命运。
含有YT521-B同源(YTH)结构域的蛋白质YTHDF1-3是m6A修饰的常见“阅读者”。一般认为YTHDF1可以诱导mRNA翻译;YTHDF2加速mRNA的降解;YTHDF3具有以上两个功能。但最近,一个新的YTHDF蛋白模型显示,YTHDF1/2/3作用于相同的mRNAs子集,导致其降解,但不促进翻译。该模型还表明,它们之间存在一定的功能补偿。另一类具有YTH结构域的m6A“阅读者”是YTH Domain Containing 1(YTHDC1)和YTHDC2,前者与RNA剪接和核输出有关,后者与RNA翻译有关。异质核核糖核蛋白(HNRNP)家族是另一个m6A“阅读者”。其中,核内不均一核糖核蛋白A2/B1(HNRNPA2B1)可与含有RGm6AC序列的miRNA结合,募集microRNA微处理器复合物蛋白DGCR8剪接miRNA的前体,促进成熟miRNA的形成。HNRNPC和HNRNPG均与m6A开关的特殊机制有关。所谓m6A开关,是指m6A修饰的RNA结构发生变化,影响RNA结合蛋白与相应位点的结合,从而调控细胞内相关生命活动的过程。最近研究表明,HNPNPR也是HNRNPs蛋白家族的一员,与m6A修饰有很强的相关性,参与肿瘤糖酵解。此外,胰岛素样生长因子2 mRNA结合蛋白(igf2bp)主要参与调控mRNA的稳定性和翻译。NF-κB激活蛋白(NKAP)促进mRNA的剪接和成熟。真核生物翻译起始因子3(Eukaryotic translation initiation factor 3, eIF3)也被认为是m6A的“读者”,在真核生物翻译起始过程中起核心作用。由此可见,m6A“读者”所起的作用是非常复杂多样的,包括但不限于RNA剪接、成熟、稳定、翻译、定位等调控。在这方面,还有许多未知的“读者”等待被发现。
糖酵解过程
糖酵解是将一分子葡萄糖分解成两分子丙酮酸,然后产生两分子ATP的过程。在这个过程中,胞外葡萄糖在葡萄糖转运蛋白(GLUT)的帮助下转移到细胞液中。葡萄糖在己糖激酶(HK)、葡萄糖-6-磷酸异构酶(GPI)、磷酸果糖激酶-1(PFK)和醛缩酶(ALD)的作用下分解为相互转化的甘油醛- 3-磷酸和二羟丙酮磷酸。到目前为止,含有六个碳原子的葡萄糖已经分解成两个三碳单元。然后,在甘油醛-3-磷酸脱氢酶(GAPDH)、磷酸甘油酸激酶(PGK)、磷酸甘油酸变化酶(PGAM)、烯醇化酶(ENO)和丙酮酸激酶(PK)的催化下,最终转化为两分子丙酮酸。
当细胞为需氧且有线粒体时,丙酮酸通常进入线粒体进行三羧酸循环,产生大量ATP,为细胞提供能量;然而,如果细胞缺氧或缺乏线粒体,丙酮酸就会被还原成乳酸。在这些过程中,代谢中间体也可以进入其他生化反应过程,使细胞内的各种反应得以协调有序。然而,生物化学家Otto Warburg发现了一个特殊的现象:在癌细胞中,即使它们有正常的线粒体和充足的氧气,它们也很少发生氧化磷酸化(OXPHOS)。相反,癌细胞主要依靠糖酵解提供能量。这一特性表现为癌细胞能够耐受低氧环境,同时也增加了肿瘤细胞微环境中的乳酸水平,刺激肿瘤生长发育。
糖酵解与肿瘤
对于大多数正常细胞来说,它们更喜欢氧化磷酸化为自己提供能量。然而,在肿瘤细胞中,糖酵解具有独特的地位。这是因为与OXPHOS相比,虽然糖酵解产生的ATP少,但速度更快。因此,糖酵解同时可以产生更多的ATP,为肿瘤细胞的生命活动提供能量。此外,糖酵解过程中产生的各种中间产物对于细胞内脂质、核酸等生物大分子的合成至关重要,有助于肿瘤细胞的增殖。乳酸是糖酵解的产物之一,能有效抑制多种免疫细胞的功能,有助于肿瘤细胞的免疫逃逸。近年来,越来越多的研究证实,肿瘤糖酵解在肿瘤增殖、血管生成和淋巴管生成、转移、免疫逃逸等肿瘤进展过程中起着不可或缺的作用,并与肿瘤预后评价和治疗有一定的相关性(图2;表2)。

图2 糖酵解与肿瘤的关系
表2 糖酵解在肿瘤发生发展中的作用
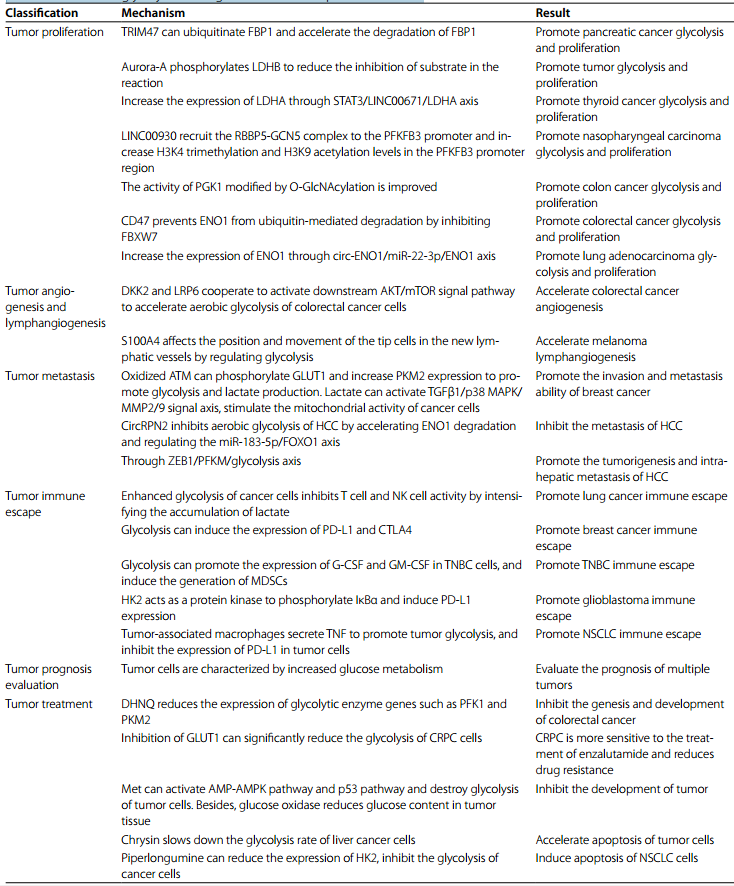

糖酵解与肿瘤增殖
细胞的生命活动离不开能量。如果没有糖酵解提供能量,即使是顽强的肿瘤细胞也无法存活。在胰腺癌中,TRIM47可以泛素化果糖-1,6-二磷酸酶(FBP1),并加速FBP1的降解,从而促进胰腺癌细胞的糖酵解和增殖。
LDH是催化丙酮酸还原为乳酸正向反应的关键酶,LDHB是LDH的一个亚基。丝氨酸/苏氨酸激酶Aurora-A可以直接结合乳酸脱氢酶B(LDHB)并使其丝氨酸162位点磷酸化。磷酸化的LDHB降低了底物在还原反应中的抑制作用,显著加速丙酮酸向乳酸的转化,促进糖酵解和肿瘤细胞的增殖。除LDHB外,LDHA作为LDH的组成部分,在肿瘤增殖中也起着重要作用。在甲状腺癌中,lncRNA LINC00671与LDHA水平呈负相关。在缺氧条件下,转录因子STAT3被激活,抑制LINC00671的表达。这增加了肿瘤细胞中的LDHA含量,促进糖酵解和甲状腺癌的增殖。
果糖-2,6-二磷酸酶3(PFKFB3)是糖酵解的调节酶。在LINC00930的作用下,更多的RBBP5-GCN5复合物与PFKFB3启动子结合。因此,PFKFB3启动子区域的H3K4三甲基化和H3K9乙酰化增加,导致PFKFB3的表达显著增加。过表达的PFKFB3可以催化乳酸的产生,调节细胞周期相关蛋白的表达,促进鼻咽癌细胞糖酵解和增殖。
作为糖酵解过程中的关键酶,PGK1催化1,3-二磷酸甘油酸转化为3-磷酸甘油酸,并产生一个ATP分子。在结直肠癌中,PGK1中的O-连接N-乙酰氨基葡萄糖(O-GlcNAc)修饰苏氨酸255位的糖基化位点。经O-GlcN酰化修饰的PGK1活性大大提高,并能在线粒体外膜转位酶TOM20的帮助下进入线粒体。进入线粒体的PKG1可以抑制癌细胞中的OXPHOS,但可以提高糖酵解活性和乳酸的产生。因此,结肠癌细胞通过提高PGK1 O-GlcN酰化水平促进肿瘤增殖酰化水平促进肿瘤增殖。
ENO1能催化2-磷酸甘油酸生成磷酸烯醇式丙酮酸。研究表明,CD47的过度表达与结直肠癌的预后不良有关。从机制上讲,CD47通过抑制FBXW7来阻止ENO1泛素介导的降解。这可以增强肿瘤细胞的糖酵解,激活ERK信号通路,最终加速肿瘤细胞的增殖。在肺腺癌中,CIRC-ENO1通过与miR-22-3p相互作用上调ENO1基因的表达,导致肿瘤细胞的ATP水平、葡萄糖摄取和乳酸生成增加,从而促进肿瘤的增殖。
糖酵解与肿瘤血管生成和淋巴管生成
肿瘤血管生成和淋巴管生成是一个复杂的过程。这一过程的异常是肿瘤转移的重要特征之一。Dickkopf相关蛋白2(DKK2)可与脂蛋白受体相关蛋白6(LRP6)协同作用,激活下游的AKT/mTOR信号通路,促进结直肠癌细胞的有氧糖酵解。此时,糖酵解产生的大量乳酸在肿瘤微环境中积聚,进一步刺激内皮细胞生长,加速肿瘤血管生成和结直肠癌的转移。
肿瘤淋巴管生成和前哨淋巴结转移是肿瘤进展的关键。Li等通过对黑色素瘤淋巴结转移小鼠模型的研究发现,S100A4在小鼠体内的表达可以增强淋巴管内皮细胞(LECs)的运动能力,促进黑色素瘤淋巴管生成和淋巴结转移。在低氧条件下,LECs中S100A4的表达上调,激活AMPK依赖的糖酵解,并通过影响肿瘤淋巴管尖端细胞在新淋巴管中的位置和运动来调节肿瘤淋巴管的出芽。
糖酵解与肿瘤转移
在肿瘤微环境中,癌相关成纤维细胞(cancer-associated fibroblasts, CAF)是大量能够分泌多种癌细胞调节因子的基质细胞。CAF分泌的调节因子能促进肿瘤的发生发展。CAF还具有很强的糖酵解能力,在细胞外释放大量乳酸。之后,这部分乳酸会被癌细胞吸收,在癌细胞浆中转化为丙酮酸,然后通过线粒体的OXPHOS为癌细胞的增殖提供持续的能量。这个过程被称为“reverse Warburg effect”。肿瘤相关成纤维细胞中的共济失调-毛细血管扩张突变蛋白激酶(ATM)在低氧条件下可被诱导氧化。氧化ATM可使GLUT1磷酸化,增加PKM2的表达,促进糖酵解。在这个过程中,大量积累的乳酸可以激活转化生长因子β1/p38MAPK/MMP2/9信号轴,刺激癌细胞的线粒体活性,提高乳腺癌细胞的侵袭和转移能力。
Li等人的动物模型显示,CircRPN2抑制肝细胞癌的糖酵解和转移。具体地说,CircRPN2通过加速ENO1的降解和调节miR-183-5p/FOXO1轴来抑制肝癌的有氧糖酵解,最终抑制肝癌的转移。此外,周和他的同事分析了来自TCGA数据库的数据,发现ZEB1-PFKM-糖酵解轴与肝癌的肿瘤发生和肝内转移显著相关。此外,在原位肝细胞癌移植瘤的随访实验中也得到了相同的结果。
糖酵解与肿瘤免疫逃逸
肿瘤的免疫逃逸是指癌细胞逃避免疫系统的监视和攻击,从而在体内存活和增殖的现象。大量证据表明,肿瘤糖酵解与多种癌细胞的免疫逃逸密切相关。研究发现,Notch1信号与TAZ形成的正反馈环具有促进糖酵解基因表达,加速癌细胞乳酸合成的作用。胞外液中积累的乳酸可抑制T、NK细胞活性,诱导肺癌免疫逃逸。在乳腺癌中,糖酵解活性升高可上调IL-17信号通路,募集巨噬细胞等免疫细胞,但降低了肿瘤杀伤细胞的聚集。高糖酵解还可诱导PD-L1、CTLA-4等免疫检查点的表达,使乳腺癌逃脱免疫系统的监视。此外,肿瘤糖酵解还可促进三阴性乳腺癌(TNBC)细胞中粒细胞集落刺激因子(G-CSF)和粒细胞巨噬细胞集落刺激因子(GM-CSF)的表达,诱导肿瘤髓系抑制细胞(MDSCs)的产生,影响肿瘤免疫逃逸和肿瘤生长。
在胶质母细胞瘤中,高水平的有氧糖酵解将HK2从线粒体转移到细胞质。然后,HK2作为一种蛋白激酶,磷酸化IκBα,诱导PD-L1表达,导致肿瘤免疫逃逸。此外,研究发现,肿瘤相关巨噬细胞(TAM)通过减少肿瘤免疫微环境中的氧含量,分泌肿瘤坏死因子促进肿瘤糖酵解,抑制肿瘤细胞中PD-L1的表达,参与非小细胞肺癌的糖酵解和免疫逃逸。
糖酵解与肿瘤预后评估
18F-FDG PET/CT显像是一种无创性评估各种恶性肿瘤的分期、复发或治疗反应的工具。这项检查最常用的显像剂是18F-FDG,它是一种葡萄糖类似物。被注射到人体后,它可以像葡萄糖一样进入细胞,被磷酸化形成FDG-6-磷酸。然而,它不能进一步代谢,只能在细胞内积累。肿瘤细胞的特征是糖代谢增加,表现为葡萄糖摄取和代谢率增加。因此,PET/CT的成像原理是利用18F-FDG在各种恶性肿瘤中的高代谢、高摄取和蓄积来发现原发灶和转移灶。
目前,结合肿瘤体积和肿瘤代谢活性的18F-FDG PET/CT参数,如代谢肿瘤体积和总病变糖酵解,是预测多种癌症的预后成像生物标志物,如口咽鳞状细胞癌、上皮性卵巢癌、肾细胞癌和结直肠癌。
糖酵解与肿瘤治疗
肿瘤细胞为了适应恶劣的肿瘤微环境,通过调节有氧糖酵解为其各种生命活动提供能量支持。因此,破坏肿瘤细胞糖酵解被认为是一种潜在的肿瘤治疗策略。目前,已开发出几种靶向糖酵解的抑制剂,但仍需进一步研究,使其发挥更全面的肿瘤抑制作用。
DHNQ是一种新的磷脂酰肌醇3-激酶(PI3K)信号通路抑制剂。DHNQ通过减少PFK1、PKM2等糖酵解酶基因的表达,阻断癌细胞的糖酵解,从而抑制结直肠癌的增殖、迁移和血管生成。在去势抵抗前列腺癌(CRPC)细胞中,雄激素受体直接与GLUT1基因启动子结合,促进GLUT1转录,以满足CRPC对葡萄糖的大量需求。抑制GLUT1可以显著降低CRPC细胞的糖酵解和增殖率,使CRPC对苯扎鲁胺(药名)的治疗更加敏感,并降低耐药性。
二甲双胍是一种选择性抑制HK2活性的药物。它通过激活AMP-AMPK通路和P53通路,破坏肿瘤细胞的糖酵解。葡萄糖氧化酶通过消耗积聚的葡萄糖来降低肿瘤组织中葡萄糖的含量,从而提高饥饿治疗的效果。两种药物联合用药的抑瘤效果优于单独用药。
除了上述抑制剂外,还有一些天然化合物可以调节肿瘤的糖酵解和增殖。徐等人发现,生物活性黄酮白杨素通过减少HK2的表达,减缓肝癌细胞的糖酵解速度,加速肝癌细胞的凋亡。胡椒碱是另一种具有抗肿瘤作用的天然化合物。在非小细胞肺癌中,胡椒碱可以降低HK2的表达,抑制癌细胞的糖酵解,促进癌细胞的凋亡,达到抗肿瘤的作用。
m6A调节肿瘤糖酵解
越来越多的证据表明,m6A修饰通过多种途径调节肿瘤糖酵解,对肿瘤的增殖、转移和治疗具有重要意义(图3;表3)。
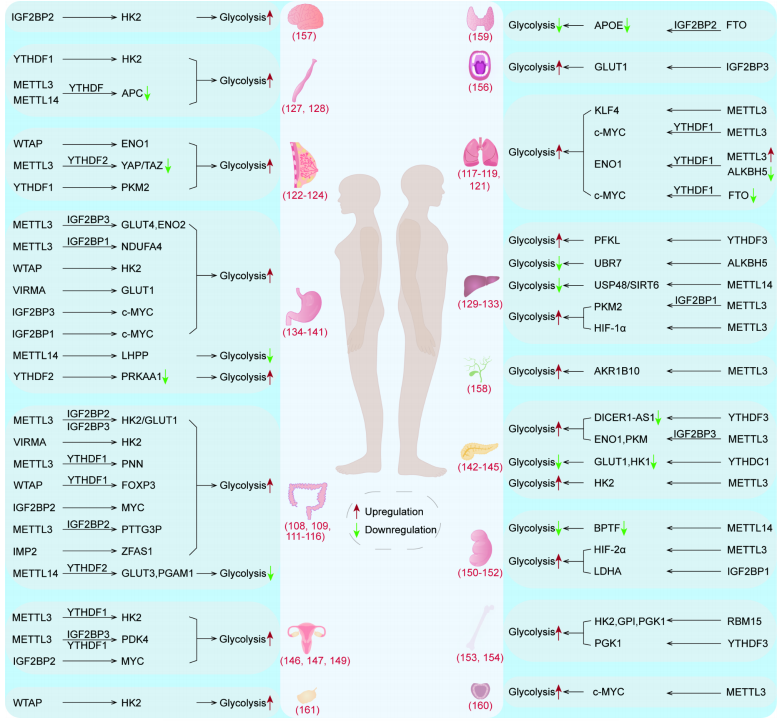
图3 m6A调节肿瘤糖酵解
表3 肿瘤糖酵解中的m6A甲基化


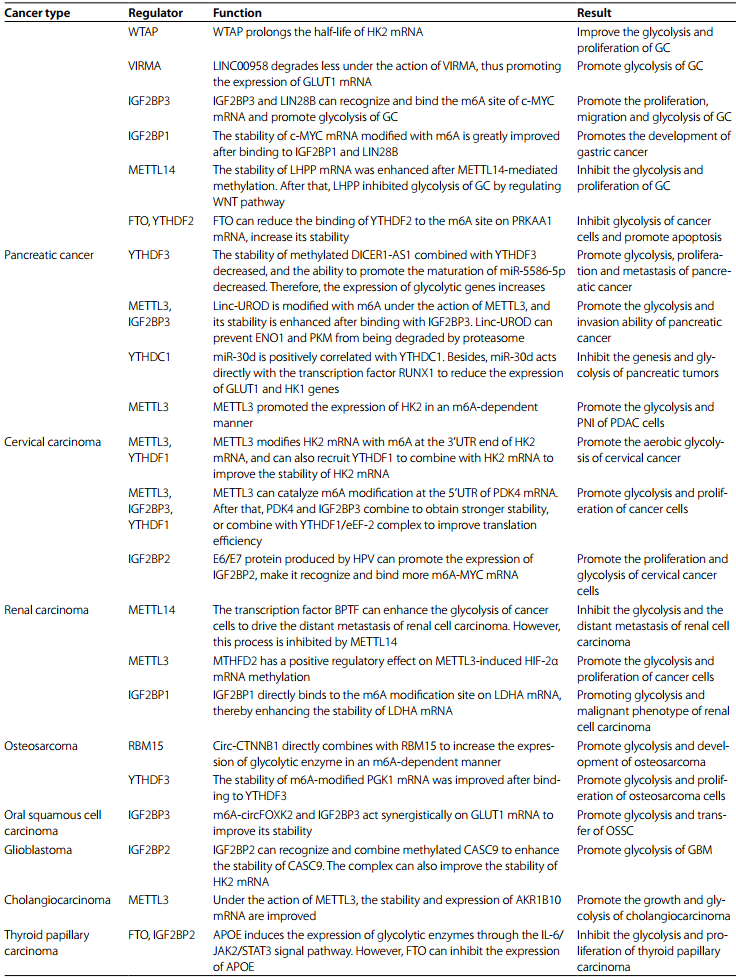

结直肠癌
结直肠癌(CRC)是全球第二大癌症死亡原因。在结直肠癌细胞中,METTL3直接作用于HK2和GLUT1基因,M6A修饰的HK2和GLUT1基因的稳定性增强。在随后的过程中,IGF2BP2与HK2的5’/3’非编码区结合。IGF2BP2/3与GLUT1的3’非编码区结合。这促进了HK2和GLUT1的表达,促进结直肠癌细胞的糖酵解和增殖。另一种甲基转移酶VIRMA以m6A依赖的方式增加HK2 mRNA的甲基化水平,上调HK2 mRNA的水平并提高其mRNA稳定性,最终可加速癌细胞的有氧糖酵解,提高肿瘤的恶性程度。Liu等人的分析表明,m6A可以修饰GLUT1基因,增强GLUT1基因的稳定性,从而促进结直肠癌的糖酵解和细胞增殖。Pinin(PNN)是一种桥粒相关蛋白,参与了一些肿瘤的发生发展。He等人发现PNN mRNA在METTL3的作用下经历了m6A修饰,并通过与YTHDF1结合来提高稳定性,最终促进了结肠癌的糖酵解和增殖。Zhang等人发现WTAP和YTHDF1以m6A依赖的方式增强FOXP3mRNA的稳定性。FOXP3的高表达可直接促进下游糖酵解过程,也可通过上调SMARCE1的表达促进结肠腺癌的糖酵解和增殖。除了直接调节糖酵解相关酶的mRNA外,M6A修饰还可以作用于一些lncRNAs和miRNAs来调节肿瘤的糖酵解。Wang等人发现IGF2BP2稳定性的长基因间非编码RNA(LINRIS)在结直肠癌细胞中处于高水平,并与患者的预后不良有关。LINRIS可以诱导IGF2BP2的K139泛素化,从而阻止溶酶体对IGF2BP2的降解,使IGF2BP2蛋白的含量保持在一定水平,并通过IGF2BP2/MYC/糖酵解轴促进癌细胞的糖酵解和增殖。郑等人的研究表明,lncRNA PTTG3P的表达与结直肠癌患者的预后密切相关。PTTG3P在METTL3的作用下甲基化,并与IGF2BP2结合以获得更高的稳定性。之后,在转录调控因子YAP1的协同作用下,促进了结直肠癌的糖酵解和增殖。作为m6A的“阅读者”,IMP2通过HH3-4结构域与m6A修饰的LncRNA ZFAS1相互作用,增加了ZFAS1的稳定性。高表达的ZFAS1可以与Obg-like ATPase 1(OLA1)结合,提高其水解三磷酸腺苷和激活糖酵解的能力。通过对表达野生型p53的CRC细胞的研究,侯和他的同事发现,野生型p53作用于METTL14的启动子区域,并诱导METTL14的表达。其次,METTL14在YTHDF2的辅助下,促进了pri-miR-6769b和pri-miR-499a的生物成熟。最终,MiR-6769b-3p/GLUT3轴和miR-499a-3p/PGAM1轴通过降低GLUT3和PGAM1的表达,抑制p53 WT结直肠癌细胞的有氧糖酵解和恶性表型。
肺癌
肺癌是世界上第二常见的癌症。在非小细胞肺癌中,经METTL3介导的m6A修饰后,lncRNA ABHD11-AS1更加稳定,并通过ABHD11-AS1/EZH2/KLF4轴促进非小细胞肺癌的有氧糖酵解。张和他的同事们发现,METTL3还可以增加lncRNA DLGAP1-AS2的甲基化水平,并提高其稳定性。接下来,DLGAP1AS2和YTHDF1共同促进c-MYC mRNA的表达,加速癌细胞的生长,促进糖酵解。
在肺腺癌(LUAD)中,ENO1以M6A依赖的方式促进肿瘤的发展。在肺腺癌(LUAD)中,ENO1以M6A依赖的方式促进肿瘤的发展。肺腺癌组织中METTL3基因表达上调,ALKBH5基因表达下调,M6A水平和ENO1基因甲基化水平升高。YTHDF1,一个m6A“阅读者”,与甲基化的ENO1 mRNA相结合,导致ENO1表达增加,并促进肺腺癌的糖酵解。刘和他的同事通过分析TCGA和GEO数据集发现,NPM1与m6A修饰和糖酵解有关。他们还认为,m6A修饰可能通过增强NPM1的稳定性来促进LUAD中ENO1、HK2、LDHA、LDHB和GLUT1等糖酵解酶的表达,从而增强LUAD的糖酵解能力和发。Yang等发现WnT/β-连环素轴可以作用于FTO的启动子区域,从而抑制FTO的表达。增加c-MYC基因m6A的修饰,募集YTHDF1促进c-MYC基因的翻译,最终加速肺腺癌细胞的糖酵解和增殖。
乳腺癌
到目前为止,乳腺癌已经超过肺癌,成为世界上最常见的癌症。在乳腺癌中,C5aR1阳性的中性粒细胞可以促进乳腺癌细胞的糖酵解。从机制上讲,C5aR1阳性中性粒细胞分泌的白介素1β和肿瘤坏死因子α可作用于下游的ERK1/2-WTAP-ENO1信号轴,增加eNO1mRNA的m6A修饰水平,促进乳腺癌细胞中eNO1的表达和糖酵解。徐和他的同事们发现,m6A还可以通过Hippo途径调节乳腺癌的糖酵解。具体地说,METTL3/LATS1/YTHDF2轴通过抑制河马途径中的YAP/TAZ促进乳腺癌的糖酵解和肿瘤发生。姚等人发现,在低氧条件下,肿瘤细胞中HIF-1α转录增加,miR-16-5p的表达受到抑制,导致miR-16-5p与YTHDF1的结合减少,促进YTHDF1的表达。YTHDF1随后与PKM2 mRNA结合,增加癌细胞中PKM2的表达和糖酵解,加速乳腺癌的发生和转移。此外,生物信息学分析表明,GPI与乳腺癌的m6A修饰密切相关,并可能成为乳腺癌的一个新的预后标志物。
食道癌
目前,食道癌的总死亡率和发病率分别排在第六位和第七位。TCGA ESCA队列分析表明,关键糖酵解酶HK2与食道癌M6A修饰密切相关。功能研究表明,人类白细胞抗原复合体P5(HCP5)可增强YTHDF1与m6A修饰的HK2 mRNA的结合,从而提高HK2mRNA的稳定性,促进ESCC细胞的有氧糖酵解,增加ESCC的恶性表型。
APC是一种常见的抑癌基因。在食道癌中,METTL3和METTL14协同作用于APC mRNA,M6A修饰的APC mRNA与YTHDF结合后降解。因此,APC对Wnt/β-catenin通路的调节作用减弱,细胞周期蛋白D1、c-myc和PKM2的表达增加,从而促进肿瘤的有氧糖酵解和肿瘤的发展。
肝癌
肝癌是世界上第六大常见癌症,但它是导致癌症死亡的第三大原因。在肝细胞癌中,作为m6A“阅读者”的YTHDF3抑制了m6A修饰的PFKL mRNA的降解,促进了PFKL的表达和有氧糖酵解。令人惊讶的是,PFKL正向调节YTHDF3蛋白的表达,形成YTHDF3-PFKL-YTHDF3的正反馈循环,促进肝癌的生长和肺转移。赵等人的研究表明,泛素蛋白连接酶E3组分N-识别素7(UBR7)激活Keap1/Nrf2/Bach1/HK2轴,减少肝癌细胞中HK2的含量,抑制肝癌细胞的糖酵解和增殖。然而,m6A“擦除器”ALKBH5以m6A依赖的方式促进UBR7的表达。Du等发现METTL14/USP48/SIRT6轴也具有抑制肝癌的作用。这是因为肝癌细胞中的泛素特异肽酶48(USP48)可以与组蛋白脱乙酰基酶SIRT6结合,提高SIRT6的稳定性,从而起到削弱肝癌细胞糖酵解的作用。USP48也受METTL14监管。
LNCAROD是一种与肝细胞癌糖酵解和预后不良相关的lncRNA。在METTL3和IGF2BP1的作用下,LNCAROD的表达和稳定性都有所提高。LNCAROD的高表达可促进SRSF3介导的PKM向PKM2的转化,并可作为miR-145-5p的ceRNA,维持胞浆内PKM2的水平。这两条途径协同增加PKM2的水平,诱导肝癌细胞的有氧糖酵解、增殖和侵袭。杨和他的同事在他们对乙肝病毒X相互作用蛋白(HBXIP)的研究中发现,HBXIP的表达可以促进肝癌细胞的糖酵解,提高肿瘤的恶性程度。这是因为HBXIP可以诱导甲基转移酶METTL3的表达。在METTL3过表达的肝癌细胞中,HIF-1α的m6A修饰水平增加,激活下游糖酵解酶,增加肝癌的侵袭能力。
胃癌
胃癌的死亡率和发病率分别位居第四和第五位。在胃癌中,m6A在METTL3的作用下修饰HDGF mRNA,与IGF2BP3结合后,其稳定性和表达增强。细胞核内的HDGF可与GLUT4和ENO2启动子结合,增加细胞内糖酵解酶的含量,促进胃癌的糖酵解、增殖和肝转移METTL3还可以催化NADH脱氢酶-1α亚复合物4(NDUFA4)mRNA 3’UTR的m6A修饰,募集IGF2BP1增加NDUFA4 mRNA的稳定性,促进NDUFA 4表达。NDUFA4作为线粒体电子传递链复合体的组成成分,通过促进GC细胞糖酵解而促进胃癌细胞增殖和肿瘤生长。另一种甲基转移酶WTAP催化HK2 mRNA 3’UTR的m6A修饰,延长HK2 mRNA的半衰期,并促进GC细胞的糖酵解和增殖。
LncRNA和WNT通路在胃癌糖酵解中也起重要作用。比如LINC00958可以促进GC细胞的有氧糖酵解。在机制上,m6A甲基转移酶VIRMA诱导LINC00958甲基化位点的m6A修饰。m6A修饰后的LINC00958降解减少,并与GLUT1 mRNA结合,提高GLUT1 mRNA的稳定性,从而加速GC的有氧糖酵解。徐等发现RNA结合蛋白IGF2BP3和LIN28B可以识别并结合c-MYC mRNA的m6A位点。LncRNA LOC101929709作为一个支架来支撑以上三者的结合。c-MYC的过表达反过来促进LOC101929709和LIN28B的表达,形成一个正反馈环,促进胃癌的增殖、迁移和糖酵解。此外,罗等发现IGF2BP1的过表达与胃癌的不良预后有关。机制上,m6A修饰的c-MYC mRNA与IGF2BP1结合后稳定性大大提高。c-MYC的过度表达通过c-MYC/糖酵解轴促进胃癌的发展。
与上述方式不同,METTL14介导的甲基化后,磷酸赖氨酸磷酸组氨酸无机焦磷酸磷酸酶(LHPP)mRNA的稳定性增强,起到抑制胃癌糖酵解的作用。之后LHPP的乙酰化可以抑制GSK3b的磷酸化进而抑制WNT途径,从而抑制胃癌细胞的糖酵解和增殖。在Zhang等人的另一项研究中,发现FTO去除了催化亚基α1(prkaa 1)mRNA 3’UTR区的m6A修饰,阻止了YTHDF2识别和结合PRKAA1 mRNA。结果,PRKAA1 mRNA的稳定性增加,最终促进胃癌细胞中的糖酵解并抑制凋亡。
m6A调节肿瘤糖酵解的临床意义
上述信息表明,m6A调节的肿瘤糖酵解在肿瘤发生和发展中起重要作用。这也引起了研究者对靶向m6A调控的肿瘤糖酵解是否有利于肿瘤治疗的好奇。因此,在这里,进一步讨论m6A调控的肿瘤糖酵解在癌症发病机制、药物治疗反应和耐药性中的作用机制,以及靶向m6A调控的肿瘤糖酵解的治疗潜力(图4;表4)。
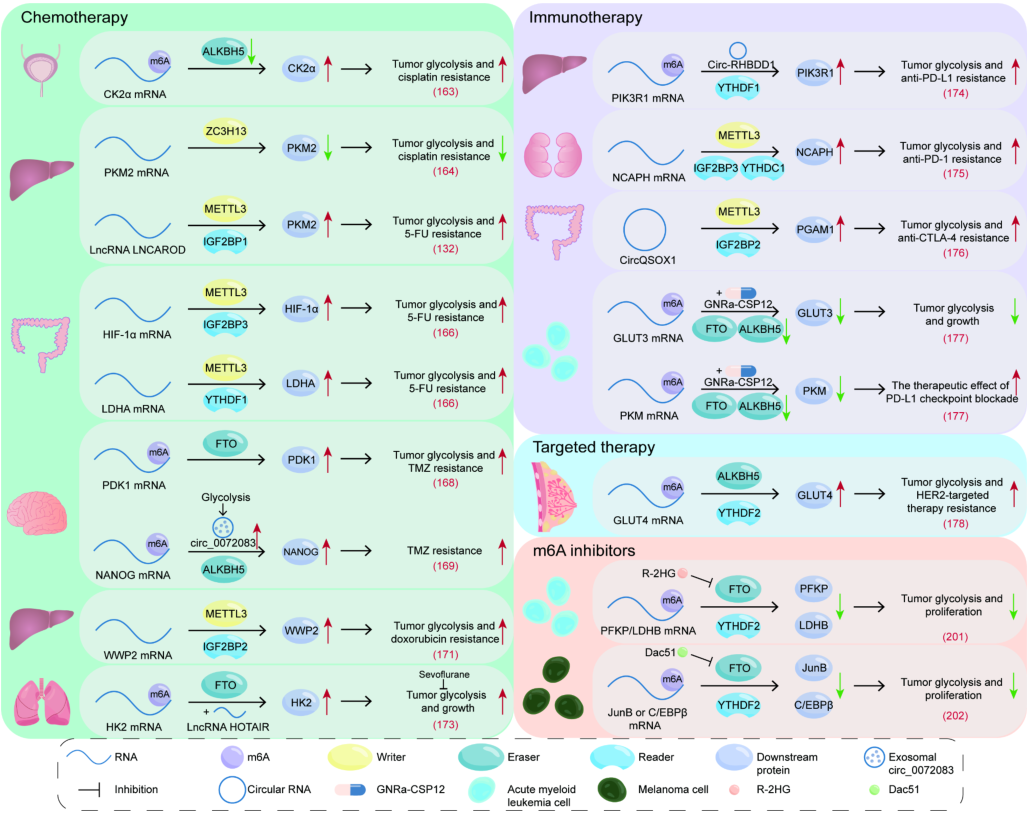
图4 m6a调节肿瘤糖酵解的临床意义。m6A调节通过影响糖酵解影响肿瘤化疗、免疫治疗和靶向治疗的疗效。此外,m6A抑制剂通过抑制糖酵解发挥抗肿瘤作用
表4 m6A通过调节肿瘤糖酵解影响肿瘤治疗
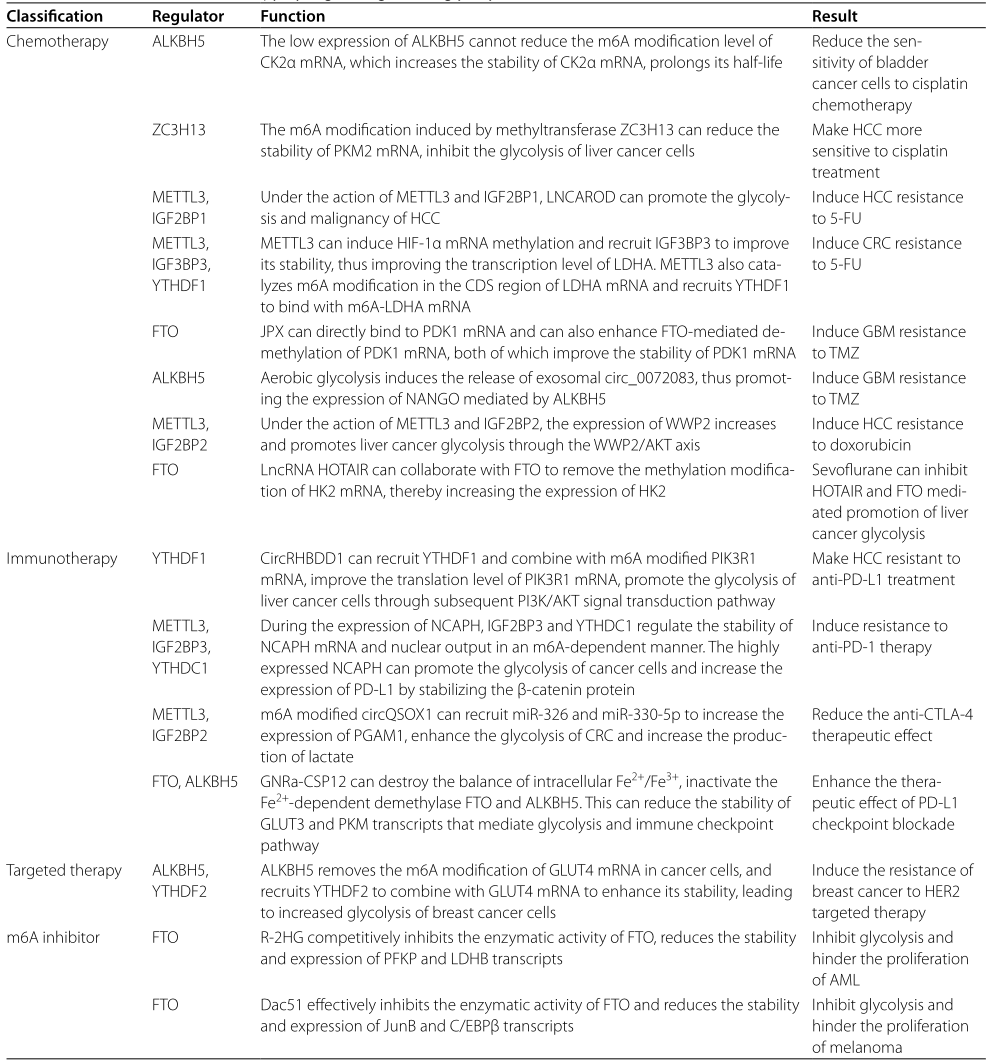

在肿瘤化疗中
癌症的化疗是通过使用某些化学药物破坏或抑制癌细胞的增殖来治疗癌症的方法。一些研究表明,肿瘤糖酵解中的m6A修饰与对化疗的反应有关。顺铂可以抑制癌细胞分裂,诱导癌细胞死亡。因此,它已成为治疗多种实体肿瘤的有效化疗药物。在膀胱癌组织中,ALKBH5的低表达不能降低CK2α mRNA的m6A修饰水平,这增加了CK2α mRNA的稳定性,延长了其半衰期,最终加速了膀胱癌细胞的糖酵解、增殖、迁移和侵袭,降低了膀胱癌细胞对顺铂化疗的敏感性。Wang等在对肝癌的研究中发现,甲基转移酶ZC3H13诱导的m6A修饰可以降低PKM2 mRNA的稳定性,抑制肝癌细胞的糖酵解,降低恶性程度,并使肝癌对顺铂治疗更加敏感。
在肿瘤免疫治疗中
肿瘤免疫治疗是通过重新启动和维持肿瘤免疫循环,恢复机体正常的抗肿瘤免疫反应。目前,m6A修饰的肿瘤糖酵解在肿瘤免疫检查点抑制剂(抗PD-L1/抗PD-1和抗CTLA-4)治疗中的作用已引起人们的关注。
在肝癌中,CircRHBDD1可以募集YTHDF1并与m6A修饰的PIK3R1mRNA结合,提高PIK3R1mRNA的翻译水平,通过随后的PI3K/AKT信号转导途径促进肝癌细胞的糖酵解,使肝癌对抗PD-1治疗产生耐药。因此,糖酵解抑制剂和免疫抑制剂联合治疗肝癌值得关注。Chen等人发现非SMC凝集素I复合体H(NCAPH)与肾透明细胞癌的糖酵解和免疫耐受密切相关。在NCAPH表达过程中,IGF2BP3和YTHDC1以m6A依赖的方式调节NCAPH mRNA的稳定性和核输出。高表达的NCAPH通过稳定β-连环蛋白,促进肿瘤细胞糖酵解,增加PD-L1的表达,诱导抗PD-1治疗耐药。在结直肠癌中,CircQSOX1在METTL3的作用下发生甲基化,与IGF2BP2结合后其稳定性提高。m6A修饰的CircQSOX1可以募集miR-326和miR-330-5p增加PGAM1的表达,增强结直肠癌的糖酵解,增加乳酸的产生,促进结直肠癌的免疫逃逸,降低抗CTLA-4的治疗效果。由此可见,sh-CircQSOX1与抗CTLA-4联合治疗对于避免结直肠癌免疫治疗的耐药性具有重要价值。此外,GNRa-CSP12是一种潜在的治疗白血病的免疫抑制剂。它能破坏细胞内Fe2+/Fe3+的平衡,使依赖Fe2+的脱甲基酶FTO和ALKBH5失活,并增加细胞内m6A的水平。这可以降低分别介导糖酵解和免疫检查点途径的GLUT3和PKM转录物的稳定性,从而抑制AML细胞的增殖并增强PD-L1检查点阻断的治疗效果。
在肿瘤靶向治疗中
除了化疗和免疫治疗外,m6A的修饰还可能通过调节糖酵解来降低HER2靶向治疗乳腺癌的疗效。具体来说,ALKBH5去除癌细胞中GLUT4 mRNA的m6A修饰,并招募YTHDF2与GLUT4 mRNA结合以增强其稳定性,导致乳腺癌细胞糖酵解增加,并对HER2靶向治疗产生耐药性。因此,抑制ALKBH5/GLUT4轴对提高包括曲妥珠单抗和拉帕替尼在内的HER2靶向治疗乳腺癌的疗效具有重要意义。
联合m6A和糖酵解抑制剂治疗肿瘤
如前所述,m6A调控的肿瘤糖酵解在肿瘤的化疗、免疫治疗和靶向治疗中具有不可估量的作用。这也提出了m6A和糖酵解抑制剂联合使用是否有助于更好的抗肿瘤治疗的问题。
为了满足对葡萄糖的需求,绝大多数癌细胞的细胞膜上都有GLUT1的高表达。GLUT1特异性抑制剂,如STF31和WZB117,已被开发用于阻断癌细胞对葡萄糖的摄取,从而抑制肿瘤生长。此外,针对糖酵解过程中关键酶的几种抑制剂已被研究,包括2-脱氧-d -葡萄糖(2-DG)、PFK158、3-BrPA、紫草素和核黄素。这些抑制剂分别作用于HK2、PFKFB3、GAPDH、PKM2和LDH,有效抑制糖酵解和肿瘤增殖。其中,靶向HK2的糖酵解抑制剂2-DG已进入临床试验阶段。
随着高通量筛选技术的进步和对m6A修饰分子机制的不断探索,出现了几种具有抗癌潜力的m6A调节抑制剂。例如,STM2457和Elvitegravir是METTL3的特异性抑制剂,而CWI1-2和JX5选择性抑制IGF2BP2。然而,FTO抑制剂的效果最为显著。Rhein、FB23、FB23-2、MO-I-500、MA2、CS1和CS2均通过抑制FTO的m6A去甲基化酶活性显示出良好的抗肿瘤作用。值得注意的是,这里重点介绍了两种FTO抑制剂,R-2-羟基戊二酸(R-2HG)和Dac51。R-2HG竞争性地抑制FTO的酶活性,导致AML细胞中pFKP和LDHB的m6A修饰增加。随后,YTHDF2识别并结合这些转录本,降低它们的稳定性和表达,最终通过抑制糖酵解途径来阻碍AML的增殖。在黑色素瘤中,Dac51通过抑制FTO增强JunB和C/EBPβ mRNA的m6A修饰水平,这促进了YTHDF2与这两种mRNA的结合,导致JunB和C/EBPβ表达显著降低。JunB和C/EBPβ都是转录因子,能激活参与糖酵解的基因,如pFKP、PGAM1和HK1,从而促进肿瘤细胞的糖酵解,限制CD8+T细胞的激活和效应状态,促进肿瘤的发生和发展。通过靶向这些过程,FTO抑制剂Dac51有效地抑制了黑色素瘤。有趣的是,在FTO-KD细胞中过表达JunB足以抑制CD8+T细胞的激活。用HK2抑制剂2-DG阻断肿瘤糖酵解可显著恢复受损的CD8+T细胞活化。
现有证据有力地表明,m6A可以通过调节肿瘤糖酵解调节各种癌细胞类型对抗癌治疗的敏感性。因此,m6A抑制剂与肿瘤糖酵解抑制剂联合使用有望提高抗肿瘤疗效。人们热切期待这些抑制剂在临床应用上的早期突破,因为它们为未来的癌症治疗带来了希望。
结论与未来展望
肿瘤和糖酵解之间的故事已经被探索了几十年。最典型的例子是Warburg效应的发现,它从葡萄糖代谢的角度揭示了肿瘤细胞与正常细胞之间的差异。随着MeRIP-seq、miCLIP、SELECT-m6A等m6A检测技术的快速发展,对m6A与肿瘤糖酵解关系的研究越来越多。研究者发现m6A修饰通过一系列直接或间接的方式调节肿瘤细胞的糖酵解和增殖。如m6A可以直接修饰HK2、GLUT1、ENO1、PDK4等关键糖酵解酶的mRNA,通过影响这些酶的表达来调节肿瘤糖酵解。m6A还可以通过调控lncRNA和circRNA的下游通路来调节肿瘤糖酵解。例如OSSC中的circFOXK2/IGF2BP3/GLUT1轴和胶质母细胞瘤中的lncRNA CASC9/IGF2BP2/HK2轴。从目前的研究来看,科学家可以预测m6A通过极其复杂的相互作用网络调控肿瘤糖酵解,从而影响肿瘤的发生、发展和治疗。进一步研究m6A与肿瘤糖酵解之间的潜在联系将有助于人类更深入地了解肿瘤代谢,并对未来开发新的肿瘤诊断方法和治疗方案具有重要意义。
虽然靶向m6a修饰的肿瘤糖酵解治疗肿瘤的策略前景广阔,但相关研究仍存在挑战。早在20世纪50年代就在生物体中检测到m6A修饰,但m6A调控肿瘤糖酵解的研究是近年才开始开展的。因此,相关研究尚处于起步阶段,还有许多潜在的机制尚未被发现。从代谢的角度来看,肿瘤细胞的异质性使得肿瘤组织中不同的细胞具有不同的代谢状态,这对靶向糖酵解在癌症治疗中的应用提出了严峻的挑战。目前,临床前研究已经证明了某些糖酵解抑制剂的抗肿瘤特性,如二甲双胍和天然化合物白杨素和胡萝卜素。此外,体外和动物研究表明,抑制结直肠癌细胞中的METTL3可以降低糖酵解水平,恢复对5-FU的治疗敏感性。在耐药乳腺癌细胞中,特定的ALKBH5基因敲除抑制糖酵解并恢复对曲妥珠单抗和拉帕替尼的治疗反应。可以预见,m6A抑制剂和肿瘤糖酵解抑制剂的联合作用将为未来肿瘤的治疗打开一扇新的希望之窗。然而,现有的m6A调节剂和肿瘤糖酵解的特异性药物和小分子抑制剂都处于开发阶段,还没有进入临床试验阶段。为了尽快应用于临床,迫切需要寻找抗肿瘤效果强、生物利用度高、药物副作用小的特异性抑制剂。
综上所述,葡萄糖代谢与肿瘤增殖、血管生成和淋巴管生成、转移、免疫逃逸、预后评价和治疗密切相关。在不同类型的肿瘤中,m6A修饰通过改变关键糖酵解酶mRNA的稳定性,激活或抑制糖酵解相关信号通路,影响肿瘤的生物学行为、治疗反应和预后。因此,进一步探索m6A甲基化调控肿瘤糖酵解的复杂关系和机制,为今后的肿瘤治疗提供了新的思路。开发针对m6A调节因子和肿瘤糖酵解的特异性抑制剂将是未来肿瘤治疗的新方向。
参考文献
Shi-Wei Yu, Hai-Ling Liu, Hong-Fei S, er al. m6A-regulated tumor glycolysis: new advances in epigenetics and metabolism. Molecular Cancer. 2023(22):137 DOI:10.1186/s12943-023-01841-8






