RARRES2调节脂质代谢重编程以介导三阴性乳腺癌脑转移的发展

乳腺癌是全世界女性中最常见的癌症,也是癌症相关死亡的第二大原因。脑转移(BrM)是乳腺癌最致命的形式。三阴性乳腺癌(TNBC)是最具侵袭性的亚型,多达46%的患者发生脑转移。尽管近年来系统治疗取得了进展,但乳腺癌脑转移(BCBrM)的治疗仍具有挑战性。因此,作者迫切需要提高对BCBrM,尤其是TNBC亚型的潜在机制的理解。癌细胞表现出显著的代谢重编程以支持转移能力,其中之一是脂质代谢重编程。最近的证据表明,能转移到大脑的乳腺癌细胞具有独特的脂质代谢特征,干扰这些细胞的脂质代谢可抑制BrM。这些有限的发现阐明了脂质代谢重编程在BrM中的潜在重要性,但其确切的潜在机制还远未完全阐明。维甲酸受体反应蛋白2(RARRES2)是一种重要的调节脂肪生成和脂肪细胞脂质代谢的脂肪因子。已有多项研究报道了RARRES2在癌症发生发展中具有肿瘤抑制作用,但目前对RARRES2在癌细胞脂质代谢中的作用知之甚少,也不清楚RARRES2与脂质代谢以及BCBrM之间的关系。该研究发表在《Military Medical Research》,IF:21.1。
技术路线

主要研究结果
1. BCBrM中RARRES2表达降低
为了研究BrM潜在的脂质代谢重编程特征,作者对三阴性乳腺癌原发肿瘤和BrM样本进行了scRNA-seq分析。本研究中使用的两个BrM数据集来自作者自己的scRNA-seq数据(BrM1)和GSE186344(BrM2)。通过评估特定标记基因的表达水平,共识别出9个不同的细胞簇。通过对原发肿瘤(n=87045个肿瘤细胞,GSE176078)和BrM(n=29173个肿瘤细胞)的肿瘤细胞簇进行比较分析,作者发现BrM肿瘤细胞表现出上调的脂质合成和脂肪酸代谢标签,这与之前的文献一致。为了确定一个可能在BCBrM的启动和发展中起关键作用的潜在脂肪因子,作者利用Gene Expression Omnibus公共数据集进行了数据挖掘分析。具体而言,在人TNBC MDA-MB-231父代细胞和MDA-MB-231 BrM(GSE12237)之间,以及在异种移植到小鼠脂肪垫、皮肤和脑(GSE19184)中的MDA-MB-231-BrM细胞之间,比较了编码脂肪因子或脂质代谢关键酶的823个基因的表达(GSE19184)(图1a)。在两个数据集中,与亲代细胞或注射到脂肪垫的肿瘤细胞相比,BrM中显著下调的基因被确定。值得注意的是,RARRES2是BCBrM中下调最显著的基因(图1a)。为了验证作者的发现,作者使用一个由配对的原发性乳腺肿瘤和BrM组成的独立患者队列进行了额外的分析。在这个队列中检测RARRES2的表达,发现BrM中RARRES2的表达水平显著低于匹配的乳腺原发肿瘤样本(图1b)。此外,作者采用免疫组织化学方法评估了人类肿瘤样本中RARRES2蛋白的表达。结果表明,与原发性乳腺肿瘤相比,BrM样本中的RARRES2表达显著降低(图1c)。此外,基于上述scRNA-seq数据,作者观察到与原发性乳腺癌相比,BrM中RARRES2的表达水平较低(图1d)。
为了进一步研究RARRES2在不同肿瘤部位的表达,作者分析了另一个独立的患者队列,包括不匹配的原发性乳腺肿瘤和脑转移病灶。在该队列中,与原发性乳腺肿瘤相比,RARRES2在BCBrM中的表达显著降低,而且在原发性脑肿瘤(GSE100534)中也显著降低(图1e)。GSE14020分析显示,RARRES2在脑转移乳腺癌中的表达水平明显低于骨转移和肺转移乳腺癌(图1f)。此外,作者使用MetMap数据(GSE148283)检测了RARRES2的表达,发现与肝转移的乳腺癌细胞相比,脑转移的乳腺癌细胞中RARRES2的表达显著下调(图1g)。此外,在分析GSE62598数据集时,作者未观察到与原发性乳腺肿瘤相比,RARRES2在肝、骨或肺转移瘤中的表达降低(图1h)。综上所述,这些发现表明RARRES2的表达在乳腺癌的BrM中特异性降低,凸显了RARRES2下调和BrM之间的潜在关联。
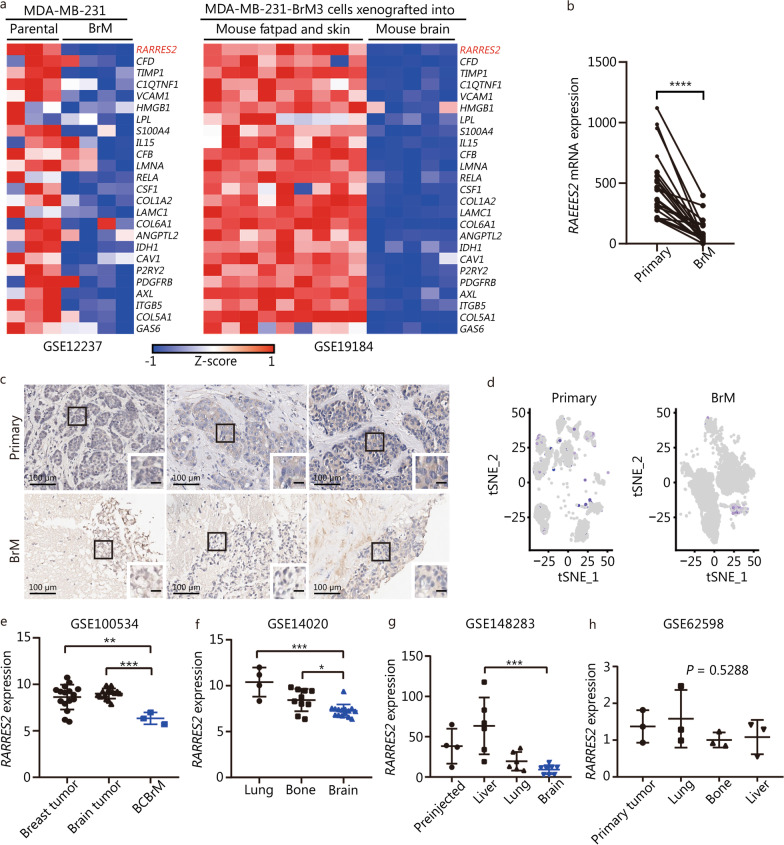
图1 RARRES2在乳腺癌脑转移(BrM)中表达下调
2. RARRES2缺失促进BrM形成
为了探索RARRES2在三阴性乳腺癌BrM中的作用,作者的下一个目标是研究RARRES2的表达是否影响脑转移细胞的侵袭或增殖。对基因型-组织表达数据库进行的初步分析显示,正常脑组织中RARRES2表达水平相对较低。这使作者推测,在转移到大脑的乳腺癌细胞中,RARRES2表达下降可能是对大脑微环境的适应。为了模拟BrM中RARRES2的低表达,作者分别用两种不同的短发夹RNA在MDA-MB-231和4T1细胞中稳定敲低RARRES2(RARRES2-KD)(图2a, d)。随后,作者观察到RARRES2-KD显著促进了两种细胞的增殖和侵袭(图2b, c, e, f)。相反,过表达RARRES2(RARRES2-OE)(图2g, j)显著抑制MDA-MB-231细胞的增殖和侵袭(图2h, i)。
为了在体内追踪肿瘤细胞的行为,作者使用了荧光素酶标记的RARRES2-OE 4T1细胞的BLI。值得注意的是,当将RARRES2-OE注入小鼠颅内时,显示出对4T1细胞生长的显著抑制(图21),尽管在体外没有统计学差异(图2k)。此外,RARRES2-OE还抑制了心脏内注射后4T1细胞的脑转移(图2m, n)。然而,值得注意的是,RARRES2-OE没有表现出对肝转移的显著抑制(图2n)。综上所述,这些发现强烈提示,RARRES2在BCBrM中发挥关键作用,因为高水平的RARRES2会阻碍乳腺癌中BrM的进程。

图2 RARRES2-OE抑制乳腺癌脑转移
3. RARRES2调控脂质代谢重编程和磷脂酰肌醇3-激酶(PI3K)信号通路
为了更深入地了解RARRES2调控BCBrM的分子机制,作者在TCGA-BRCA转录组测序数据中鉴定了RARRES2共表达基因。随后,GO和KEGG富集分析表明,这些基因主要参与脂质代谢通路,包括磷脂酰肌醇磷酸化、甘油三酯稳态、脂氧合酶通路、PI3K-Akt信号通路和mTOR信号通路(图3a, b)。这些发现揭示了这些通路在RARRES2介导的BCBrM调节中的潜在作用。
作者进一步扩展了研究,分别在乳腺癌和BrM癌上皮细胞的单细胞转录组数据中鉴定了RARRES2共表达基因,并探索了受RARRES2调控的生物学过程。值得注意的是,与RARRES2呈正相关的基因主要与肿瘤转移相关过程相关,包括生物黏附、细胞迁移和增殖(图3c)。另一方面,与RARRES2表达呈负相关的基因主要参与物质和酸的代谢(图3d)。这些发现进一步揭示了RARRES2在乳腺癌转移相关生物学过程中的潜在调控作用。
为了进一步研究与RARRES2过表达相关的分子改变,作者在RARRES2过表达的细胞和对照MDA-MB-231细胞中进行了转录组测序。差异表达基因富集于转移性生物学过程,如细胞黏附(图3e, g)。此外,功能富集分析进一步突出了脂质代谢过程,包括磷脂外流。此外,基于京都基因和基因组百科全书数据库的基因集富集分析表明,RARRES2-OE组甘油磷脂代谢和泛酸盐和辅酶A的生物合成上调,而视黄醇代谢和类固醇激素的生物合成下调(图3f)。值得注意的是,对差异表达基因的通路分析也发现了PI3K信号通路(图3g)。这些发现让作者了解了与RARRES2过表达相关的分子变化,特别是转移过程、脂质代谢和PI3K信号通路的变化。
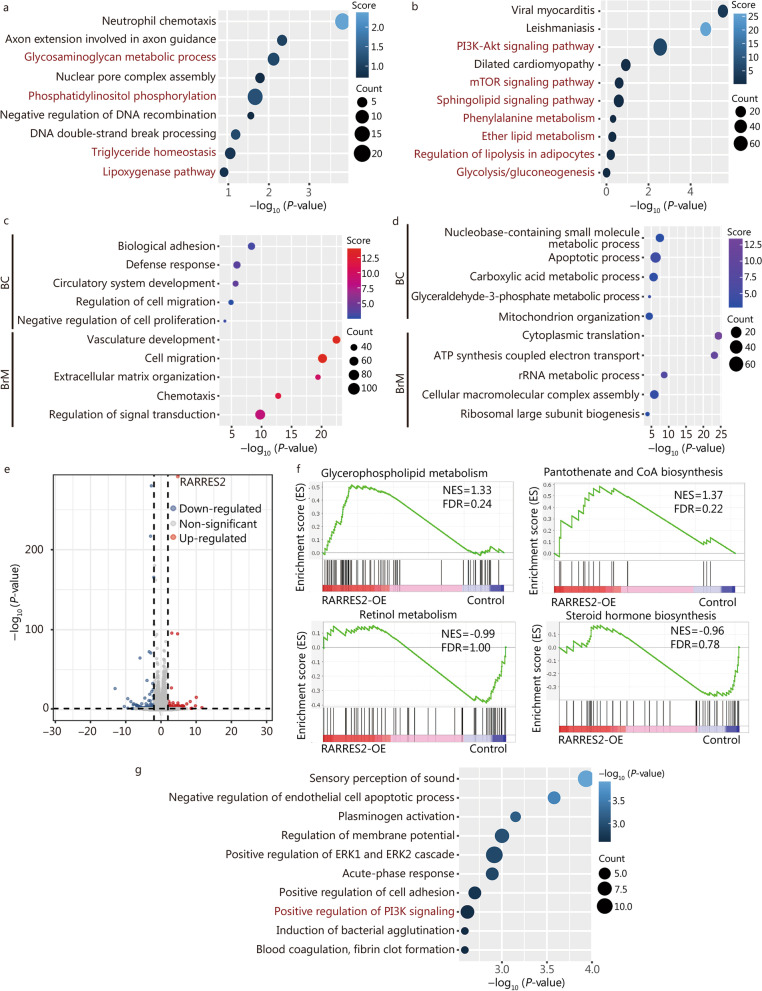
图3 富集分析表明,RARRES2在乳腺癌中调节脂质代谢重编程和PI3K信号通路
4. RARRES2改变MDA-MB-231细胞的脂质代谢
为了研究RARRES2在调节BCBrM中脂质代谢中的作用,作者在RARRES2-KD及其对照MDA-MB-231细胞中进行了非靶向脂质组学分析,并观察到脂质代谢物的显著变化(图4a, b)。具体而言,作者注意到磷脂酰胆碱和phosphatidyl ethanolamine 水平的增加,这两种物质是甘油磷脂家族的关键组成部分(图4c)。相反,TAGs水平降低(图4c)。对差异表达脂质进行的通路分析显示,甘油磷脂代谢、鞘脂代谢和甘油脂代谢显著富集(图4d)。此外,对RARRES2-OE及其对照MDA-MB-231细胞的RNA测序显示,RARRES2调节参与甘油磷脂代谢、脂肪酸合成和胆固醇合成的基因的表达,如FASN、SCD、HMGCR、CPT1A和PTDSS1的表达等(图4e)。此外,RT-qPCR也证实了ACACA和HMGCR在RARRES2敲低后表达上调(图4f)。这些发现强烈表明,RARRES2的表达降低与MDA-MB-231细胞系的脂质代谢失调密切相关,提示RARRES2在BCBrM中调节脂质代谢的潜在作用。
为了研究干扰RARRES2介导的脂质代谢重编程是否影响乳腺癌细胞的恶性表型,作者使用CPT1抑制剂etomoxir对RARRES2表达改变的MDA-MB-231细胞进行了实验。有趣的是,作者观察到在RARRES2敲低的细胞中,与对照细胞相比,CPT1的抑制显著逆转了细胞增殖(图4g)。综上所述,遗传、代谢、转录组学和功能学证据为RARRES2在调节脂质代谢中的作用提供了支持。
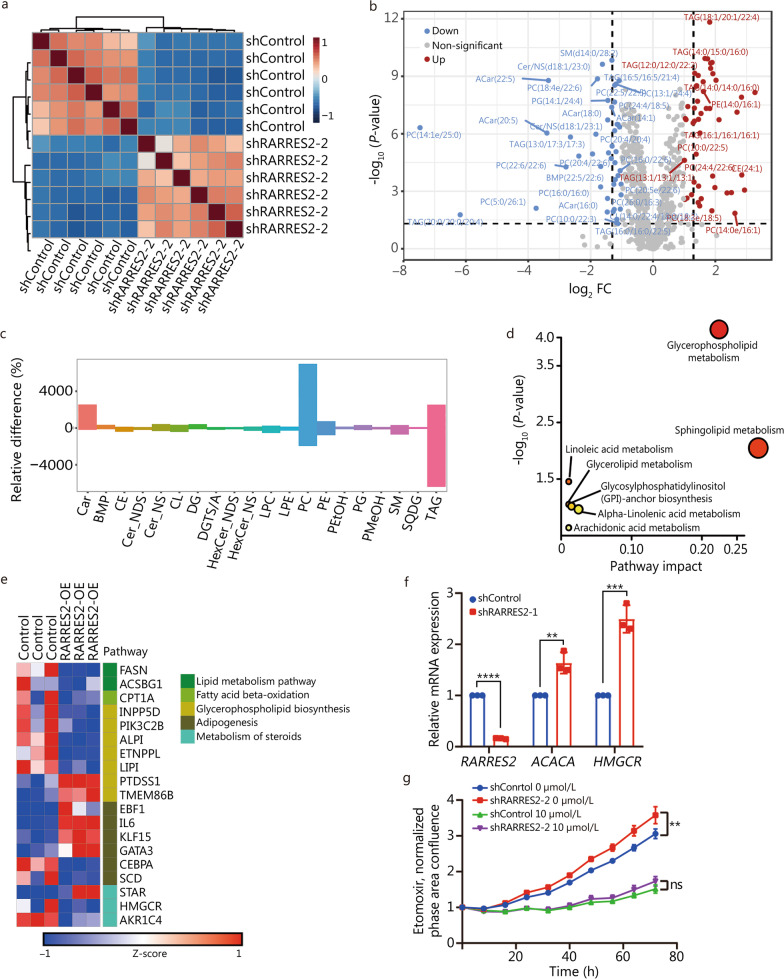
图4 RARRES2调节MDA-MB-231细胞的脂质代谢
5. RARRES2负调控PTEN-mTOR-SREBP1信号通路
脂质代谢重编程受到多种代谢途径的严格调控,参与代谢产物的合成和降解。值得注意的是,PI3K/mTOR轴及其下游的SREBP信号成为脂质代谢的关键调控枢纽。
最近的证据强调了PIK3CA突变作为与BCBrM相关的主要突变的重要性,以及SREBP1在脑中促进乳腺癌细胞增殖的重要作用。根据这些发现和作者的功能富集分析(图3b, g),作者提出RARRES2可能通过mTOR-SREBP1信号通路调节脂质代谢重编程。根据这一假设,在MDA-MB-231细胞中,p-Akt、mTOR、p-mTOR、SREBP1/cleaved SREBP1的蛋白水平与RARRES2-KD或RARRES2-OE呈负相关(图5a),表明RARRES2对mTOR-SREBP1信号通路具有负性调控作用。在这一背景下,另一个关键的参与者是PTEN,这是一种在TNBC中经常缺失的肿瘤抑制因子,并与PI3K通路激活相关。据报道,TNBC中PTEN缺失/突变的比例高达35-40%。此外,在BCBrM的基因组图谱中,PTEN位于基因组改变最多的5个基因内。既往研究报道RARRES2通过PTEN调节PI3K-mTOR轴,作者观察到PTEN的蛋白水平与RARRES2直接相关(图5a)。
为了研究是否可以通过抑制mTOR通路来逆转RARRES2缺陷的促癌作用,作者使用mTOR抑制剂雷帕霉素处理RARRES2-KD及其对照MDA-MB-231细胞。结果表明,雷帕霉素处理显著逆转了RARRES2-KD细胞的增殖和侵袭增加(图5b, c)。此外,蛋白质印迹分析显示,雷帕霉素处理逆转了RARRES2敲低引起的P-mtor和SREBP1表达水平的升高(图5d)。
CMKLR1是RARRES2发挥其生物学功能的主要受体。因此,作者进一步研究了CMKLR1在RARRES2介导的脂质代谢重编程及其下游信号通路中的作用。敲低CMKLR1消除了在RARRES2-OE细胞中观察到的PTEN表达的显著增加和p-Akt表达的降低(图5e)。此外,在RARRES2过表达和对照细胞中,CMKLR1敲低导致FASN在mRNA水平的表达上调(图5f)。这些发现共同表明,RARRES2调节PTEN-mTOR-SREBP1轴,而PTEN-mTOR-SREBP1轴反过来调节TNBC中的脂质代谢和BCBrM。
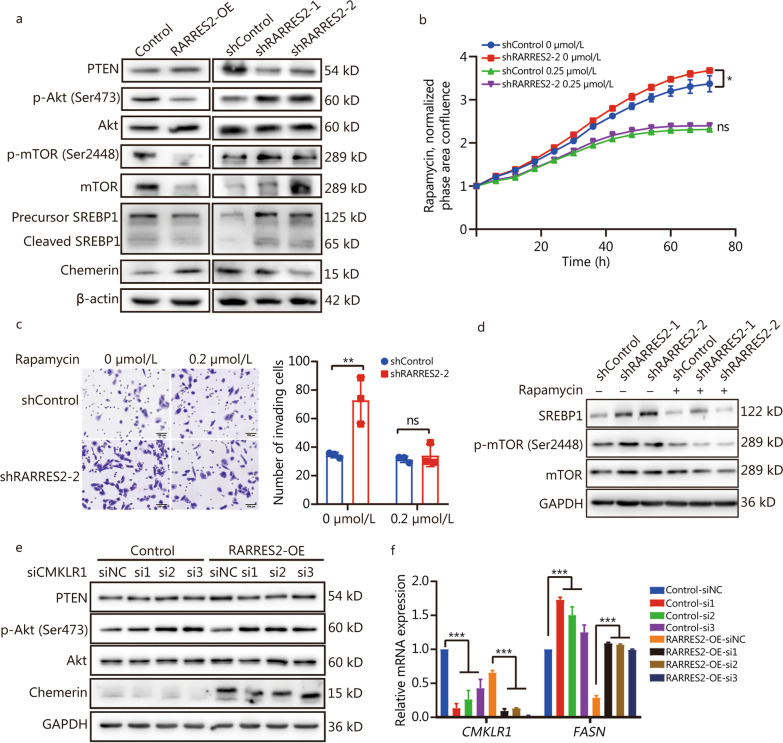
图5 RARRES2负调控PTEN-mTOR-SREBP1轴
结论
该研究聚焦于BrM,即乳腺癌的临床困境,并确定了RARRES2和BCBrM之间的特异性关联。该研究表明,由RARRES2介导的脂质代谢重编程对三阴性乳腺癌的脑转移形成至关重要。该研究结果不仅为目前对脂质代谢和乳腺癌BrM的理解提供了新的见解,而且提示了RARRES2作为这种危及生命的疾病的潜在治疗靶点的干预措施。
实验方法
IHC染色,RNA测序,RT-qPCR,蛋白质印迹,细胞增殖测定,体外侵袭试验
参考文献:
Li YQ, Sun FZ, Li CX, Mo HN, Zhou YT, Lv D, et al. RARRES2 regulates lipid metabolic reprogramming to mediate the development of brain metastasis in triple negative breast cancer. Mil Med Res. 2023 Jul 25;10(1):34. doi: 10.1186/s40779-023-00470-y.






