肿瘤相关巨噬细胞分泌外泌体LINC01232诱导肿瘤免疫逃逸

肿瘤相关巨噬细胞(TAM)浸润促进胶质瘤恶化,但其机制尚不清楚。本研究发现TAMs分泌外泌体LINC01232诱导肿瘤免疫逃逸。机制上,LINC01232直接结合E2F2并促进E2F2进入细胞核,两者协同促进NBR1的转录。NBR1通过泛素结构域与泛素化的MHC-I蛋白结合增加,导致自噬溶酶体中MHC-I的降解增加以及肿瘤细胞表面MHC-I的表达减少,进而导致肿瘤细胞逃避CD8+ CTL的免疫攻击。该研究于2023年4月发表在《Advance Science》,IF:15.1。
技术路线

主要研究结果
1. M2-TAM衍生的外泌体促进胶质瘤免疫逃逸
为模拟TAMs,作者将THP1细胞极化为M2-TAMs。细胞共培养实验表明,与M0-Exos相比,M2-Exos显著抑制T细胞介导的肿瘤细胞杀伤(图1a)。流式细胞术和qRT-PCR结果显示,与M2-Exos培养的胶质瘤细胞共培养后,CD8+ T细胞的增殖能力和IFN-γ、TNF-α、Gzmb的表达均降低(图1b-e)。建立裸鼠颅内原位移植瘤模型:将U-87MG/U-251细胞植入裸鼠脑内。12 d后,将小鼠分为两组,每3 d肿瘤内注射M0/M2-Exos。从健康人外周血中分离出活化的CD8+ T细胞,经尾静脉注射。结果显示,与注射M0-Exos的小鼠相比,注射M2-Exos的小鼠肿瘤体积显著增加。动物移植瘤标本中CD8+的IHC分析表明,与M0-Exos组相比,M2-Exos组CD8+的表达显著降低(图1f,g)。这些数据表明,体外分离的M2-TAMs来源的外泌体显著促进胶质瘤细胞逃避CD8+ CTL细胞介导的抗肿瘤免疫反应。
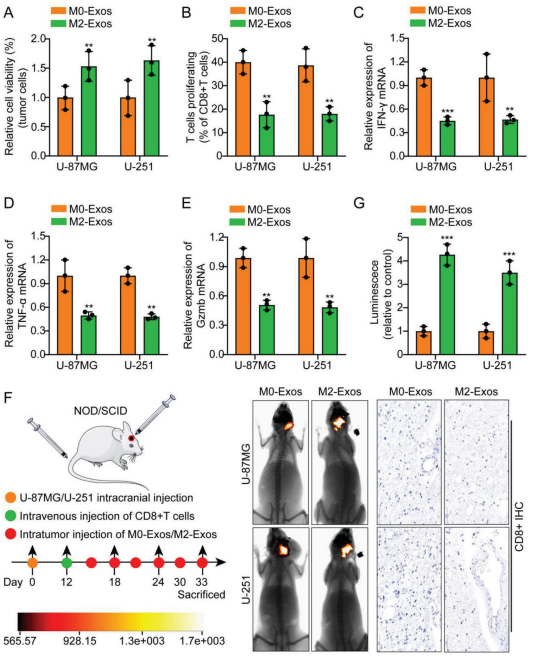
图1. M2-TAM衍生的外泌体促进胶质瘤免疫逃逸
2. M2-TAMs分泌的LINC01232被转移到胶质瘤细胞
使用M0-Exos和M2-Exos组成的lncRNA阵列鉴定TAMs中外泌体相关的lncRNA。层次聚类分析显示LINC01232是最主要的非编码RNAs之一(图2a)。使用透射电子显微镜(TEM)、纳米颗粒跟踪分析(NTA)和蛋白质印迹法(WB)测量外泌体的形态、大小和表面标志物,验证它们存在于TAM培养基中(图2b)。下一步检测细胞外LINC01232。在条件培养基(CM)中,单独用RNase A处理M2-TAMs,LINC01232的水平没有变化。然而,经RNase A和Triton X-100处理后,CM中的LINC01232水平降低(图2c)。此外,外泌体与CM中的的LINC01232水平相似(图2d)。这些结果证明,外泌体是细胞外LINC01232的主要载体。
此外,通过FISH和亚细胞分割研究LINC01232的亚细胞定位,结果显示LINC01232定位于细胞核和细胞质,并且主要定位于胶质瘤细胞的细胞核(图2e,f)。随后,将鬼笔环肽标记的U-87MG细胞与pkh26标记的M2外泌体孵育。IF结果显示,鬼笔环肽脂质染料与PKH26荧光在孵育的U-87MG细胞中共定位,表明外泌体被细胞有效吸收(图2g)。这些结果表明,外泌体可以将M2分泌的LINC01232转运到胶质瘤细胞。
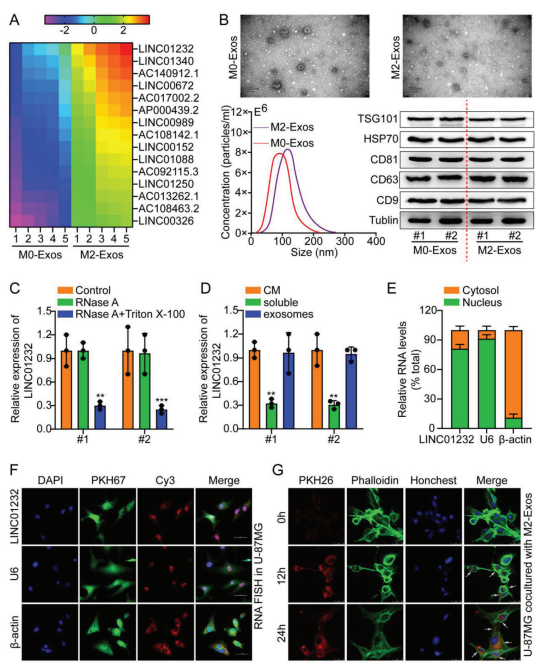
图2. M2-TAMs分泌的LINC01232被转移到胶质瘤细胞
3. M2-TAM衍生的外泌体LINC01232诱导肿瘤免疫逃逸
使用含有不同siRNAs和两个shRNAs的慢病毒载体敲低LINC01232基因。在加入外泌体抑制剂Annexin V或敲低LINC01232后,M2-Exos抑制T细胞介导的肿瘤细胞杀伤能力显著降低(图3a)。流式细胞术和实时定量PCR结果显示,与M2-Exos培养的胶质瘤细胞共培养的CD8+ T细胞增殖能力和IFN-γ、TNF-α、Gzmb的表达均降低。然而,在加入外泌体抑制剂Annexin V或敲低LINC01232后,这一现象被逆转(图3b-e)。
建立裸鼠颅内原位移植瘤模型。12 d后,将小鼠分为4组,每3 d肿瘤内注射M2- Exos、M2- Exos +Annexin V、M2/sh-NC-Exos和M2/sh-1232#1-Exos。从健康人外周血中分离出活化的CD8+ T细胞,经尾静脉注射。结果表明,与单纯注射M2-Exos或M2/sh-NC-Exos相比,M2-Exos +Annexin V或M2/sh-1232#1-Exos显著降低肿瘤体积。动物移植瘤标本中CD8+的IHC显示,与单独注射M2- Exos或M2/sh-NC-Exos的小鼠相比,M2-Exos +Annexin V或M2/sh-1232#1-Exos组的CD8+表达显著增加(图3f,g)。这些实验结果表明,M2-Exos衍生的LINC01232诱导肿瘤免疫逃逸。相反,使用AnnexinV处理或敲低LINC01232的外泌体均不能促进这些过程。
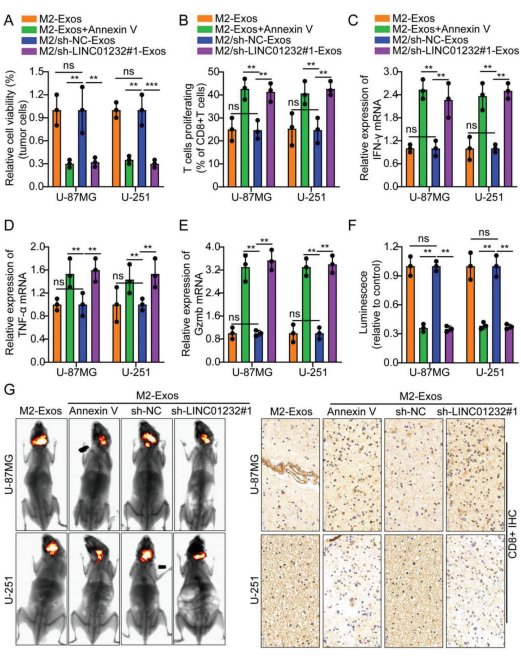
图3. M2-TAM衍生的外泌体LINC01232诱导肿瘤免疫逃逸
4. M2-TAM衍生的LINC01232通过调节自噬-溶酶体途径介导MHC-I的表达
与M0-Exos相比,M2-Exos对胶质瘤细胞中MHC-I的mRNA水平和mRNA稳定性没有显著影响,但却显著降低MHC-I的蛋白水平和蛋白稳定性(图4a,b)。使用M0/M2-Exos处理胶质瘤细胞,然后同时使用蛋白酶体抑制剂MG132和溶酶体抑制剂leupeptin处理。结果表明,只有溶酶体抑制剂消除M2-Exos对MHC-I蛋白的抑制作用(图4c)。正如预期的那样,在CHX追逐试验中,MHC-I在过表达(OE) LINC01232的细胞中具有较短的半衰期。同样,在下调LINC01232的细胞中,MHC-I的半衰期较长(图4d,e)。这些数据表明,M2-Exos衍生的LINC01232通过调节自噬-溶酶体途径介导胶质瘤细胞中MHC-I的表达,从而诱导肿瘤免疫逃逸。
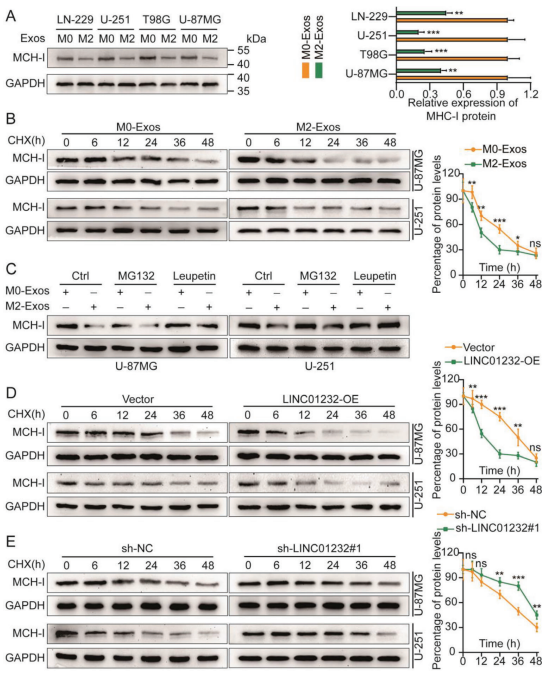
图4. M2-TAM衍生的LINC01232通过调节自噬-溶酶体途径介导MHC-I的表达
5. LINC01232与E2F2结合并加速E2F2的核转位
采用RNA pull-down确定与LINC01232相互作用的蛋白E2F2 (图5a)。RIP检测结果表明,LINC01232在E2F2-免疫沉淀复合物中特异性富集(图5b)。从LINC01232下拉实验中提取的蛋白质表明,E2F2特异性地结合正义链而不是反义链(图5c)。此外,LINC01232可以调节E2F2的整体水平和细胞核内的水平。在U-87MG阴性对照细胞中,E2F2主要定位于细胞质,少量定位于细胞核。在敲低LINC01232细胞的细胞核中几乎检测不到E2F2。相比之下,在过表达LINC01232细胞的细胞核中有相当水平的E2F2(图5d)。与核裂解液相比,U-87MG细胞质裂解液中E2F2蛋白表达最多。沉默LINC01232后,U-87MG细胞中E2F2在细胞核和细胞质中的数量明显减少,然而,异位表达LINC01232后,细胞核相关的E2F2含量增加,与IF结果一致(图5e)。co-IP测试LINC01232是否可以介导E2F2和NBR1的相互结合。正如预期的那样,过表达LINC01232增强这种结合,而敲低则减弱这种结合(图5f)。这些结果表明LINC01232与E2F2结合并促进其转运到细胞核中。
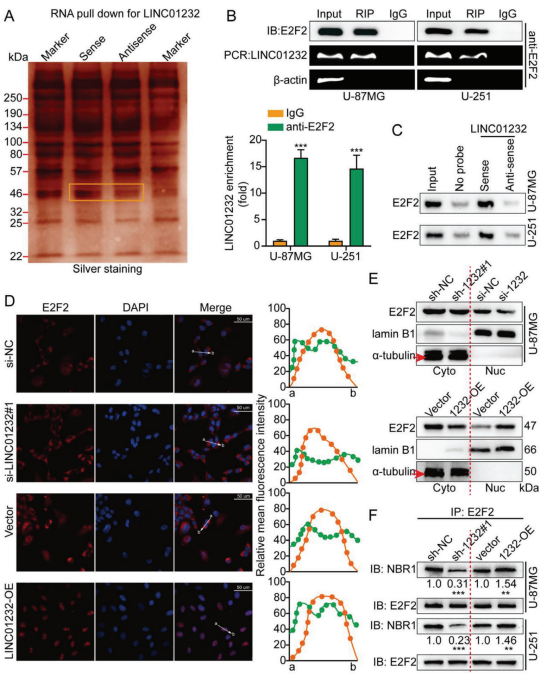
图5. LINC01232与E2F2结合并加速E2F2的核转位
6. LINC01232促进E2F2介导的NBR1转录
使用JASPAR数据库,发现E2F2可能与NBR1启动子区域结合。构建由野生型(WT)或突变型(mut) NBR1启动子组成的荧光素酶载体,转染U-87MG和U-251细胞(图6a)。荧光素酶实验表明,过表达E2F2刺激野生型NBR1启动子的活性,表现为荧光素酶活性的增加,但过表达对mut型NBR1启动子活性无影响。此外,LINC01232增强E2F2诱导的荧光素酶活性的增加(图6b)。ChIP实验结果显示E2F2与NBR1启动子结合,并且这种相互作用被LINC01232增强(图6c)。此外,增强E2F2表达显著上调NBR1 mRNA和蛋白水平,LINC01232进一步促进NBR1 mRNA和蛋白水平(图6d)。这些结果表明,E2F2直接结合到NBR1的启动子区域激活其转录,而LINC01232促进这一过程。
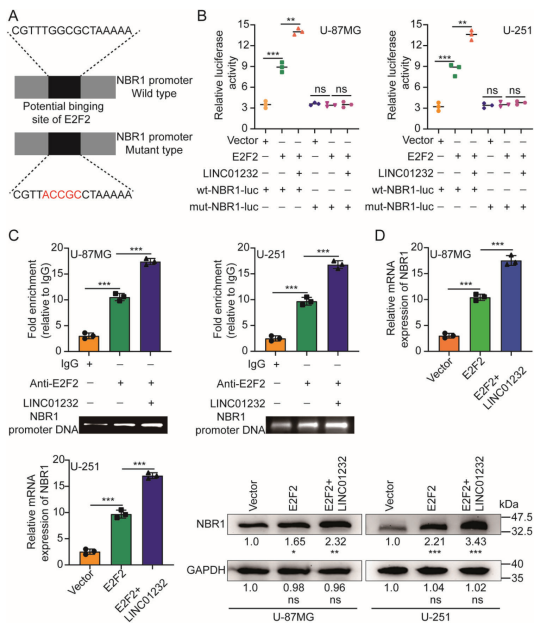
图6. LINC01232促进E2F2介导的NBR1转录
7. LINC01232通过调节NBR1促进神经胶质瘤免疫逃逸
在胶质瘤细胞株U-87MG和U-251中敲低NBR1,同时过表达LINC01232。细胞共培养结果显示,与vector相比,LINC01232-OE/U-87MG/U251细胞显著抑制T细胞介导的肿瘤细胞杀伤。然而,敲低NBR1过表达LINC01232可以逆转这一现象(图7a)。流式细胞术和实时定量PCR结果显示,与LINC01232-OE胶质瘤细胞共培养的CD8+ T细胞增殖能力和IFN-γ、TNF-α、Gzmb的表达均较低;然而,敲低NBR1同时过表达LINC01232可以逆转这一现象(图7b - e)。建立裸鼠颅内原位移植瘤模型:Vector/LINC01232-OE/LINC01232-OE+NBR1-KD U-87MG/U-251细胞原位移植入小鼠脑内。12 d后,从健康人外周血中分离出活化的CD8+ T细胞经尾静脉注射。结果显示,与注射vector的小鼠相比,LINC01232-OE组小鼠肿瘤体积显著增加。动物移植瘤标本中CD8+的免疫组化结果显示,与vector组小鼠相比,LINC01232-OE组小鼠CD8+的表达明显降低。敲低NBR1同时过表达LINC01232可以逆转这一现象(图7f,g)。这些结果进一步说明LINC01232通过调节NBR1促进胶质瘤免疫逃逸。
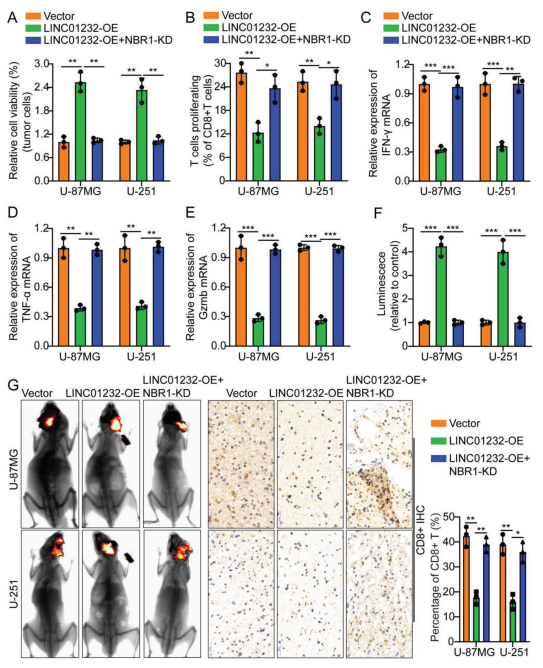
图7. LINC01232通过调节NBR1促进神经胶质瘤免疫逃逸
8. LINC01232/E2F2/NBR1/MHC-I轴与临床进展的相关性
比较正常脑组织(NBT)、低级别胶质瘤组织(LGG)、高级别胶质瘤组织(HGG)中LINC01232/E2F2/NBR1/MHC-I的表达水平。与NBT相比,LINC01232/E2F2/NBR1在肿瘤组织中表达水平较高,尤其是在HGG中。然而,MHC-I的表达呈现相反的趋势(图8a-d)。此外,LINC01232/E2F2/NBR1信号轴成员之间的表达水平成正比。然而,MHC-I的表达与LINC01232/E2F2/NBR1的表达成反比(图8e-i)。此外,FISH、IF和IHC结果显示,LINC01232水平与E2F2/NBR1信号通路呈正相关。然而,MHC-I与LINC01232/E2F2/NBR1的表达成反比(图8j)。以上数据表明,LINC01232/E2F2/NBR1轴可以通过自噬-溶酶体途径调节MHC-I的表达。
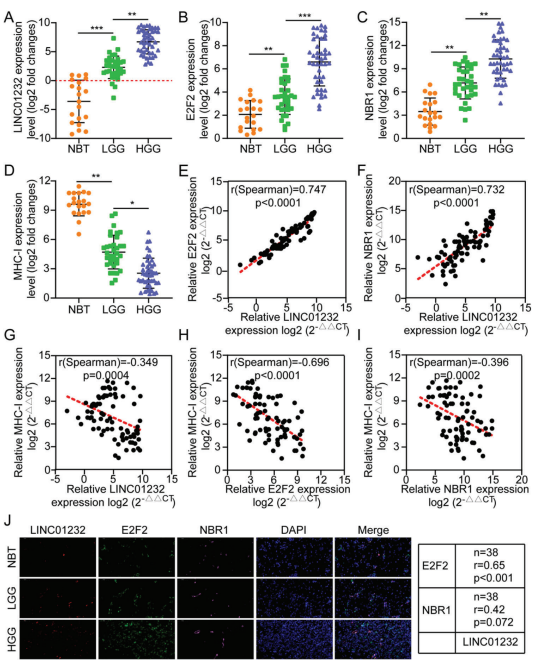
图8. LINC01232/E2F2/NBR1/MHC-I轴与临床进展的相关性
结论
综上所述,本研究揭示了TAMs与胶质瘤之间存在关键的分子交流,即TAMs分泌富含LINC01232的外泌体进入肿瘤细胞,通过LINC01232/E2F2/NBR1/MHC-I轴支持恶性肿瘤的生长,诱导肿瘤免疫逃逸,表明靶向该轴可能具有治疗潜力。
实验方法
细胞培养,质粒和siRNA转染,WB,qRT-PCR,生信分析,外泌体的分离与鉴定,ChIP,双荧光素酶报告实验,亚细胞分离分析,FISH,免疫荧光,免疫组化,免疫共沉淀,邻位连接技术(PLA),RNA pull-down,RIP,脑异种原位移植。
参考文献
Li J, Wang K, Yang C, Zhu K, Jiang C, Wang M, Zhou Z, Tang N, Wang Q, Wang S, Shu P, Yuan H, Xiong Z, Li J, Liang T, Rao J, Wang X, Jiang X. Tumor-Associated Macrophage-Derived Exosomal LINC01232 Induces the Immune Escape in Glioma by Decreasing Surface MHC-I Expression. Adv Sci (Weinh). 2023 Jun;10(17):e2207067. doi: 10.1002/advs.202207067. Epub 2023 Apr 25. PMID: 37097629; PMCID: PMC10265094.






