没跑了,TP53 R249S突变增加患癌风险——人肝脏类器官权威验证
如今,肝细胞癌(HCC)的主要基因组驱动因素已得到广泛认可,但建立它们在人类HCC发生过程中的作用模型仍然很少。本文作者利用人肝脏类器官作为实验系统,从TP53缺失和L3环R249S突变的遗传病变中模拟人类肝癌发生的早期阶段。此外,HCC细胞系的染色质免疫沉淀测序(ChIP-seq)揭示了TP53缺失导致的抑瘤功能丧失和p53突变导致的功能增益活动引发HCC的重要功能。本文于2023年9月发表在《Hepatology》IF:13.5期刊上。
技术路线

主要实验结果
1、ChIP-seq揭示L3突变体在染色质重塑和应激反应中的功能获得作用
在HCC中,TP53经常因错义突变而发生改变,占突变病例的一半以上(图1A),且大多集中在DNA结合域(DBD)Loops 1-3 内(图1B)。在TCGA数据集中所有携带TP53突变的HCC中,约60%同时携带TP53缺失和一个额外的改变蛋白质的错义突变(TP53missense/-)(图1C)。为系统评估HCC中TP53错义突变对转录激活的潜在增益,通过ChIP-seq实验,对四个TP53突变体(包括两个L3环突变(TP53R249S/-和TP53S241F/-)和两个非L3环突变(TP53L145R/-和TP53H168R/-)的TP53结合和赖氨酸H3K27ac的全基因组模式进行了数据分析。结果发现,无论TP53突变位点如何,WT TP53的全基因组结合在这4种突变体中大部分都丧失了,这意味着TP53错义突变的肿瘤中普遍丧失了传统的TP53转录活性(图1D)。值得注意的是,与WT TP53和其他两个非L3环突变体相比,一组TP53 结合峰仅在L3环突变体中被发现(图1E)。此外,还观察到R249S突变体特有的启动子近端TP53结合峰,这提供了其他转录调控特性的可能性(图1E)。相反,在非L3环突变体中观察到了罕见的独特结合峰。富集的H3K27ac信号在 L3环突变体结合区域的共定位进一步表明这些峰与活跃的转录有关(图1E)。此外,为说明潜在的转录因子,作者在内源性TP53R249S/-和TP53S241F/-细胞中定义了红细胞转化特异性和碱性螺旋-环-螺旋家族的核心结合基序(图1F)。
为确定这些TP53突变体的功能,使用靠近这三组TP53结合峰的基因进行通路富集分析。如预期的,WT-TP53主要参与细胞凋亡、细胞周期和DNA损伤的调节(图1Gi),这支持TP53在HCC中的抑瘤作用。L3环突变体与染色质重塑和生物合成过程相关的基因结合(图1Gii),而在TP53R249S/-中发现的独特结合峰则富集于其他通路,包括应激反应和蛋白质修饰(图1Giii)。
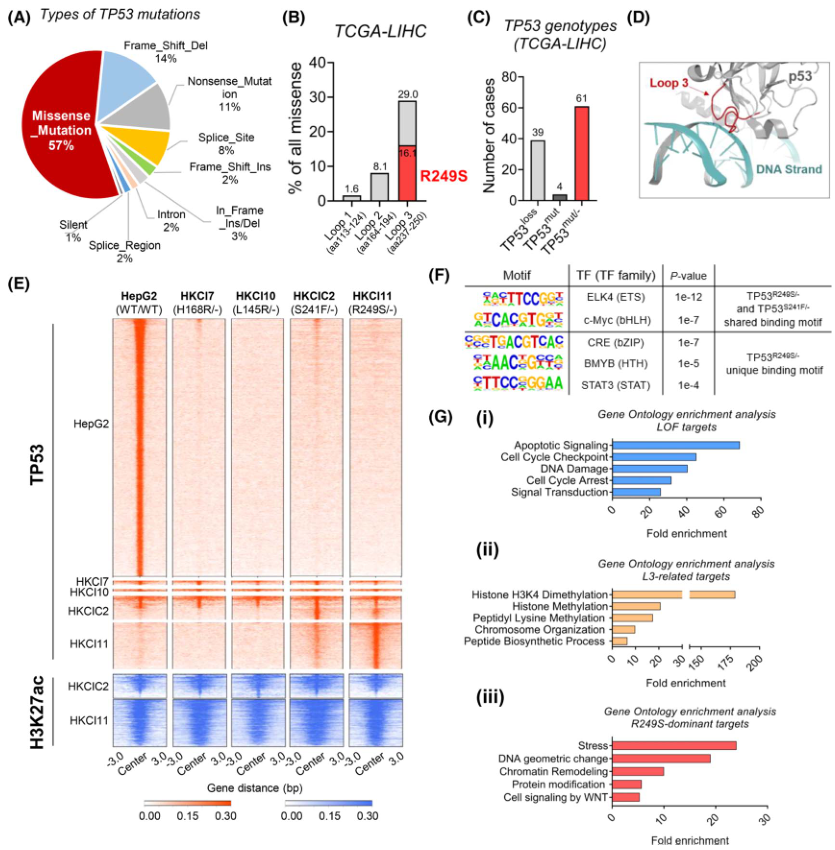
图1 TP53基因型的ChIP测序
为证实ChIP-seq发现的L3突变体新的结合位点,在HepG2(TP53WT/WT)、HKCIC2(TP53S241F/-)和HKCI11(TP53R249S/-)细胞中进行染色质免疫沉淀-qPCR,以验证TP53突变体与富集靶标的转录起始位点(TSS)区域的直接结合。首先,为确认TP53 L3突变体的功能缺失特性,测试了与内在凋亡信号转导相关的靶标EDA2R、PHLDA3和CDKN1A。TP53R249S/-和TP53S241F/-似乎不与这些基因结合,而HepG2 TP53WT/WT则显示出与TSS区域的富集结合(图2Ai、Aii)。接下来,在TP53R249S/-突变体和TP53S241F/-突变体中发现,参与染色体组织调控的L3相关靶标RCOR3和UBE2I显示出很强的TSS占有率,而在TP53WT/WT突变体中则没有发现(图2B)。此外,R249S显性靶标的功能还包括应激反应、CLTC和PSMF1、纺锤体组织SUN2以及染色质重塑BPTF在TP53R249S/-与TSS区的结合均显示出显著的富集,与TP53S241F/-和TP53WT/WT 相比(图2C)。
为证实L3突变体增强了基因表达,作者在配对的HCC和邻近非肿瘤肝脏的独立原发性队列中进行验证。这些标本根据目标捕获测序或Sanger 测序验证的TP53状态进行分组,包括WT(TP53WT/WT)、无效(TP53-/-)、TP53R249S、L3 环内的TP53错义突变(其他L3)和L3环外的错义突变(non-L3)。除TP53WT/WT 外,所有组的功能缺失靶点都明显减少(图2D)。在TP53 L3环突变的标本中,L3环靶点明显升高(图2E)。值得注意的是,与TP53WT 和其他突变组相比,TP53R249S病例中6个R249S显性靶标明显升高(图2F)。
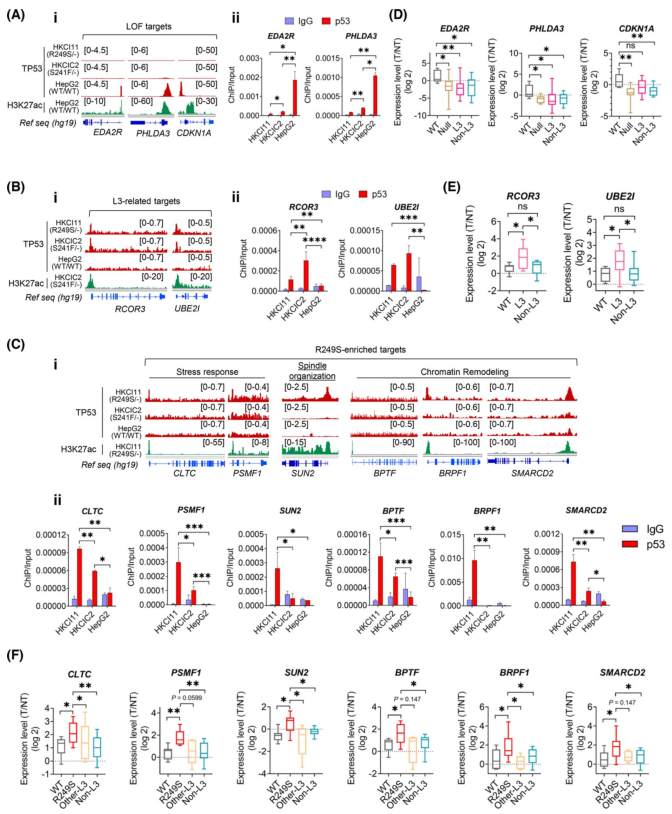
图2 功能丧失(LOF),回路L3和R249S富集靶标的验证
2、TP53 KO和R249S产生原发性肝类器官和致瘤诱导
为了解TP53KO和TP53R249S在HCC中的致癌作用,作者从新鲜的非肿瘤肝组织中培养了三个肝脏器官模型,即肝脏类器官模型1(Liver.Org 1)、肝脏类器官模型2(Liver.Org 2)和肝脏类器官模型3(图3A)。为模拟TP53R249S/-基因型,首先应用CRISPR/Cas9系统的两个single‐guided RNA在三个肝脏器官组织中 KO TP53(图3B)。随后通过pLV-Hygro-TP53R249S慢病毒进行相应的TP53 R249S 过表达(图3B)。TP53蛋白的丢失和获得被WB所证实(图3C)。从形态上看,WT(TP53WT)肝脏类器官的明视野成像和组织学染色都保持了单层分区的一致性(图3D)。相比之下,TP53KO和R249S过表达(TP53R249S)的类器官出现了不同的形态,可见增厚的管壁侵入管腔,并呈现多形性恶性特征,包括发育不良、色素沉着、不典型和频繁的有丝分裂、极性丧失和核与细胞质比率增加(图3D)。对Liver.Org 1的延时成像进一步验证了TP53KO和TP53R249S类器官中出现的生长模式变化的异常形态特征。与TP53WT对照组有机体的导管结构(图3E)相比,观察到TP53蛋白缺失后形成的紧凑有机体簇(图3E)。有趣的是,R249S过表达的类器官表现出非典型生长,类器官表面有大量芽状突起(图3E),这与HCC类器官的生长模式非常相似。通过高通量成像检测,量化了不同TP53状态下的形态差异。与组织学一致,单层有机体常见于TP53WT组,而肿瘤喜欢的多层或发育不良的有机体则广泛见于TP53KO和TP53R249S Liver.Org 1和Liver.Org 2组(图3F)。
此外,为评估TP53缺失或R249S突变是否会带来生长优势,注意到所有TP53WT对照组器官组织都在20次传代过程中停止生长(图3G)。令人惊讶的是,TP53KO和TP53R249S类器官在繁殖过程中继续增殖和扩张,在超过50次的传代过程中,每周的分裂率始终为1:4(图3G)。据报道,干性是促进细胞寿命的因素之一,因此评估了三个肝脏类器官中肝癌干性标志物CD44和CD133的表达。与TP53WT对照组相比,TP53KO和TP53R249S类器官中CD44和CD133的表达明显增加(图3H),表明癌症相关干性能力明显受到刺激。
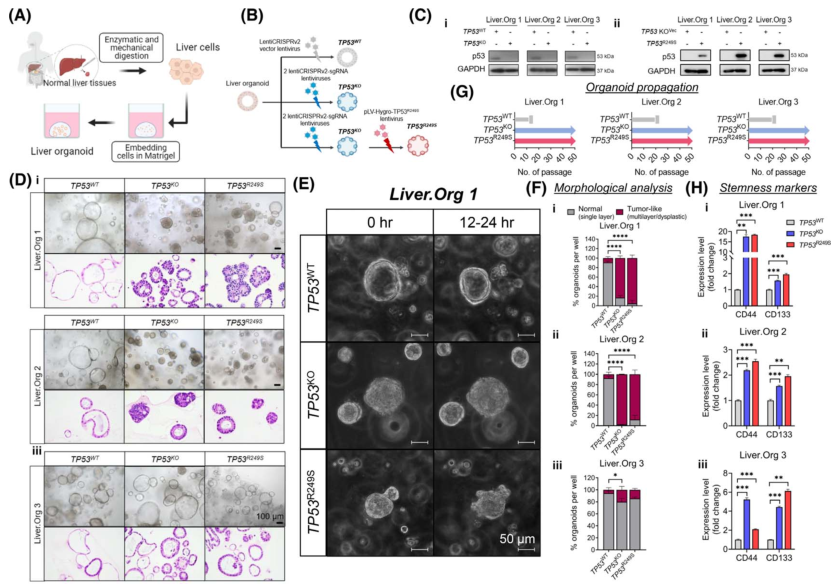
图3 TP53基因敲除(TP53KO)和TP53R249S的肝类器官表现出癌前特征
3、模型肝脏类器官中TP53R249S引发的肿瘤
接下来探讨突变体R249S和癌症相关应激在启动肝癌发展中的作用。首先验证了TP53功能缺失靶基因和R249S显性候选基因的表达,这些基因与编辑肝脏类器官中的应激反应和纺锤体组织有关。与在原发性HCC中发现的表达一致,在R249S高表达的肝脏组织细胞中检测到R249S优势靶基因的明显上调(图4A)。在分别过表达TP53 WT和R249S的Hep3B(TP53-/-)细胞中进行双荧光素酶检测,进一步确定了R249S突变体的直接转录效应。与TP53 WT对照组相比,TP53 R249S表达细胞中两个与应激相关的R249S优势靶标CLTC和PSMF1的启动子活性明显升高(图4B)。锚定非依赖性实验提示了一锅可能的肿瘤发生其实作用,表现为TP53R249S类器官中有大量致密的大球体,而TP53KO类器官中有大量的球体簇,而对照类器官中只有微小的散发性球体(图4C)。异种移植进一步证实了TP53R249S的致瘤潜力。2个月后,皮下类器官异种移植(ODXs)显示,与TP53缺陷类器官(17%)和WT对照(0%)相比,R249S高表达肝脏类器官(37%)的病变形成率增加(图4D)。组织学检查显示这些病变具有恶性特征,显示出腺体形成的非典型细胞,这些细胞表现出核多形性高色差、偶见空泡状胞质和突出的核小体(图4E)。这些发现表明,p53缺失和R249S基因突变同时存在是一种恶性转化。
接下来,研究R249S相关应激反应在肿瘤倾向中的促进作用。有几种类型的应激,如ER应激、氧化应激和代谢应激,会积极调控癌症的发展。使用不同的应激特异性刺激剂,包括ER应激诱导剂曲卡霉素、氧化应激诱导剂过氧化氢、依托泊苷产生的基因毒性应激以及营养缺乏培养基产生的代谢应激诱导剂。值得注意的是,TP53R249S只对曲奈霉素有明显的耐受性,而对其他诱导剂没有耐受性(图4F)。鉴于ER应激与活性氧(ROS)诱导之间的相互串扰,作者评估了ER应激刺激下的ROS水平。CellROX Red信号在TP53R249S类器官组织中被模糊地检测到,而在对照组中则被清晰地识别到(图4G),这意味着R249S的功能获得作用产生了ROS平衡水平。为确认ER应激耐受性与R249S显性应激靶标PSMF1之间的联系,通过敲除PSMF1对TP53R249S肝脏类器官进行拯救实验(图4H)。PSMF1沉默的肝脏类器官恢复了对妥卡霉素的自发敏感性,IC50值比对照低4-8倍(图4I)。
由于错误折叠蛋白的积累是ER应激的标志,作者检测了PSMF1下调的类器官中未折叠蛋白反应(UPR)的关键传感器和介质的表达。与对照相比,PSMF1缺陷型TP53R249S类器官中ATF6、GRP94、CHOP和GADD34 GADD的表达量在使用曲卡霉素处理时明显增加(图4J),这意味着PSMF1在通过防止UPR激活来缓解ER应激方面具有重要能力。
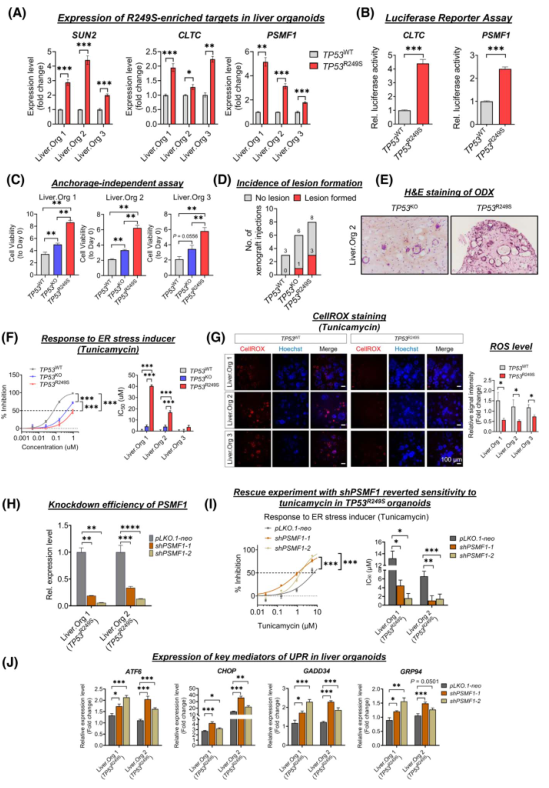
图4 TP53R249S肝类器官中的肿瘤发生
4、通过染色质重塑靶向TP53R249S的一个治疗窗
考虑到R249S显性靶标中"染色质重塑"GO的富集(图1Giii),作者首先确定了TP53R249S肝脏类器官中R249S显性靶标(BPTF、BRPF1和SMARCD2)的显著上调(图5A)。由于硫鸟嘌呤是一种抑制DNA合成和甲基化的表观遗传药物,所以作者在体外探讨了硫鸟嘌呤在TP53R249S类器官中的药理作用。结果显示,与WT对照组相比,TP53R249S类器官更容易受到硫鸟嘌呤的影响,其敏感性在IC50值方面显著增加4.5-7倍(图5B)。
为进一步证实硫鸟嘌呤的体内疗效,利用Liver.Org 1和Liver.Org 2的 TP53R249S 类器官建立ODX 模型。当肿瘤体积达到约50立方毫米时,随机给小鼠腹腔注射硫鸟嘌呤(1.5 mg/kg)或药物,连续注射14天。结果显示,TP53R249S ODX对硫鸟嘌呤更敏感,与药物对照组相比,治疗14天后肿瘤体积明显缩小(图5C、D)。两个治疗组的体重没有明显差异(图5E)。所有主要的器官组织学也都正常,这表明硫鸟嘌呤的副作用可以忽略不计(图5F)。总之,研究证明表观遗传药物硫鸟嘌呤在体外和体内针对与TP53R249S相关的功能获得脆弱性的治疗潜力。
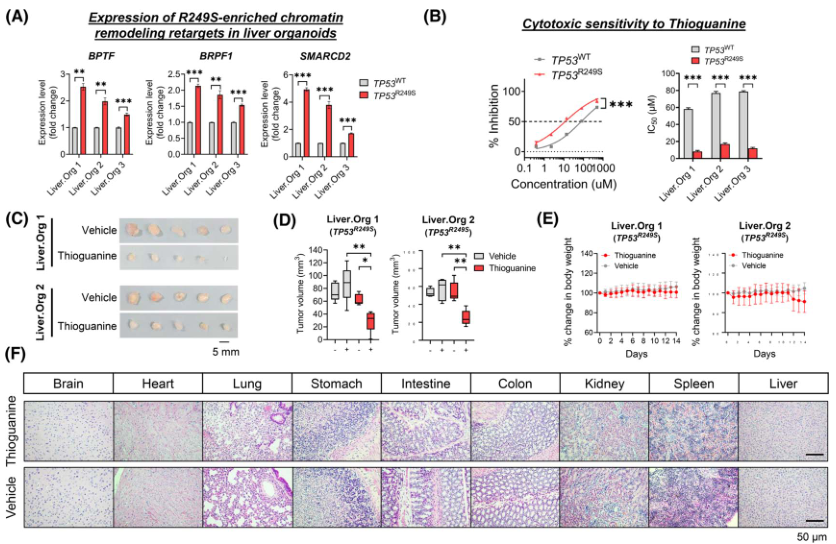
图5 靶向TP53R249S的一个治疗窗
总之,本文发现TP53缺失和L3 loop突变会产生不同的致瘤效应,它们共同赋予正常肝细胞早期克隆优势和促生存功能(图6)。

图6 图形摘要
实验方法
HCC临床样本收集,肝脏类器官培养,慢病毒转染类器官,类器官形态观察,压力敏感实验,肝脏类器官来源的异种移植瘤
参考文献
Lam YK, Yu J, Huang H, Ding X, Wong AM, Leung HH, Chan AW, Ng KK, Xu M, Wang X, Wong N. TP53 R249S mutation in hepatic organoids captures the predisposing cancer risk. Hepatology. 2023 Sep 1;78(3):727-740. doi: 10.1002/hep.32802. Epub 2022 Oct 11. PMID: 36221953






