P300/SP1复合体/METTL1/m7G/CDK14轴调控去势抵抗性前列腺癌
m7G修饰是除m6A修饰外更常见的一种表观遗传修饰。研究发现m7G修饰在mRNA转录、tRNA稳定性、rRNA加工成熟和miRNA生物合成等方面发挥着重要作用。然而, METTL1在肿瘤,特别是前列腺癌(PCa)中的作用尚未被揭示。在这里,我们发现METTL1在去势抵抗性前列腺癌(CRPC)中升高,并且METTL1升高的患者往往预后较差。功能上,在CRPC细胞中,METTL1的敲低显著限制了细胞的增殖和侵袭能力。在机制上,我们发现P300可以与SP1形成复合物,并通过SP1结合到METTL1基因的启动子区域,从而介导CRPC中METTL1的转录上调。随后,我们的研究结果表明,METTL1通过在其mRNA中添加m7G修饰,从而增强CDK14 mRNA的稳定性,最终促进CRPC的进展。本文于2023年8月发表于“Journal of Experimental & Clinical Cancer Research”(IF=11.3)上。
技术路线

结果
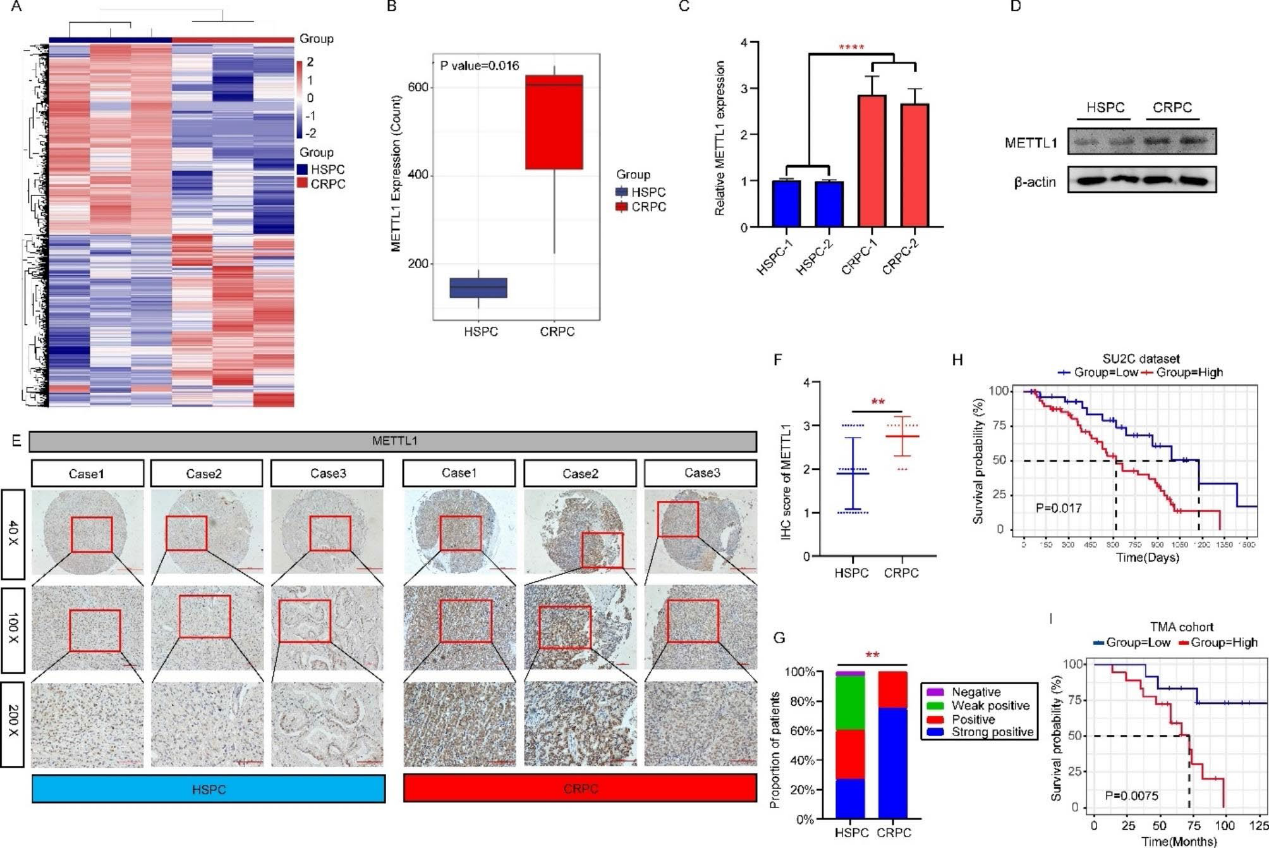
1)METTL1表达升高与CRPC患者预后不良相关
我们对3例CRPC和3例HSPC患者的肿瘤组织样本进行了全转录组测序。根据|Fold change| > 2和p值< 0.05的标准筛选差异表达基因,并以热图的形式显示差异表达基因(图1A)。根据差异基因的结果,我们发现与HSPC相比,CRPC中METTL1的表达异常升高(图1B)。为了验证测序结果的准确性,我们从HSPC和CRPC患者中获得肿瘤组织,提取mRNA和蛋白,分别检测METTL1在mRNA和蛋白水平上的差异表达。结果显示,与HSPC患者相比,METTL1在CRPC患者中的表达水平更高(图1C和1D)。免疫组化染色实验发现METTL1在CRPC中的总体表达水平更高(图1E和1F)。免疫组化染色“阳性”和“强阳性”的患者比例在CRPC中明显高于HSPC患者(图1G)。METTL1高表达的CRPC患者生存率较差(图1H)。根据患者的生存过渡和生存时间,我们还发现METTL1高表达组患者生存和预后较差(图1I)。综上所述,我们得出结论,METTL1在CRPC中表达异常上调,且METTL1高表达的患者生存率较差。
2)敲低METTL1抑制CRPC细胞的增殖和侵袭
为了阐明METTL1对CRPC恶性生物学行为的影响,我们在前列腺癌细胞系中进行了表型实验。我们首先检测了HSPC和CRPC细胞系之间METTL1水平的差异,发现与HSPC细胞系LNCaP相比,CRPC细胞系中METTL1水平的升高存在差异,其中以LNCaP- ai和C4-2最为突出(图2A和2B)。随后,我们以LNCaP- ai和C4-2细胞为研究载体构建了METTL1稳定沉默的细胞系(图2C-2E)。为了研究METTL1对CRPC细胞增殖能力的影响,我们进行了MTT实验和克隆形成实验。结果表明,敲低METTL1降低了细胞的增殖能力,减少了克隆集落形成的数量,并显著抑制了细胞的增殖能力(图2F-2K)。最后,我们在LNCaP-AI细胞和C4-2细胞中进行transwell实验,发现抑制METTL1的表达抑制了细胞的侵袭能力(图2L-2O)。综上所述,我们初步得出结论,METTL1的表达与CRPC细胞不良的生物学行为有关。限制METTL1的表达明显限制了细胞的增殖和侵袭能力。

3)P300的增加通过H3K27乙酰化修饰介导METTL1的高表达
为了探索CRPC中METTL1高表达的潜在分子机制,我们首先通过UCSC在线网站可视化了METTL1基因启动子的修饰形式。我们在METTL1基因的启动子区域发现了大量的组蛋白乙酰化修饰峰(H3K27ac),这表明METTL1可能通过染色质乙酰化进行调节(图3A)。接下来,我们用H3K27ac抗体进行染色质免疫沉淀实验,发现在LNCaP- AI和C4-2细胞中,METTL1启动子区H3K27ac修饰的丰富度高于LNCaP细胞(图3B)。这表明CRPC中METTL1水平的异常上调可能与METTL1基因启动子区H3K27ac的高修饰有关。考虑到P300是介导H3K27乙酰化修饰的关键酶,我们用P300抑制剂C646处理LNCaP-AI和C4-2细胞,发现用20 μM浓度的C646处理细胞48 h后,METTL1 mRNA表达显著下降(图3C和3D)。随后,我们用不同浓度梯度的C646处理细胞,在48 h时间点,我们发现,当C646浓度为20 μM时,METTL1 mRNA水平的下降最为明显(图3E和3F)。随后,我们还证实,在P300抑制剂C646 (20 μM,48 h)处理后,组蛋白H3K27ac和METTL1在蛋白质水平上都有所下降(图3G)。接下来,我们使用组织微阵列进行染色分析,发现P300和METTL1之间呈正相关(图3H和3I)。此外,我们设计了siRNA来抑制P300的表达(图3J),并证实P300的敲低可以抑制METTL1的表达(图3K和3L)。为了进一步证明P300的敲低导致METTL1 mRNA水平的降低是由于METTL1启动子区域H3K27ac水平的降低引起的,我们进行了染色质免疫沉淀实验。结果表明,P300的抑制也显著降低了METTL1基因启动子区域的H3K27ac水平(图3M和3N)。上述实验结果初步证明P300介导的METTL1启动子区H3K27ac的修饰是导致CRPC中METTL1 mRNA的上调的一个重要的机制。

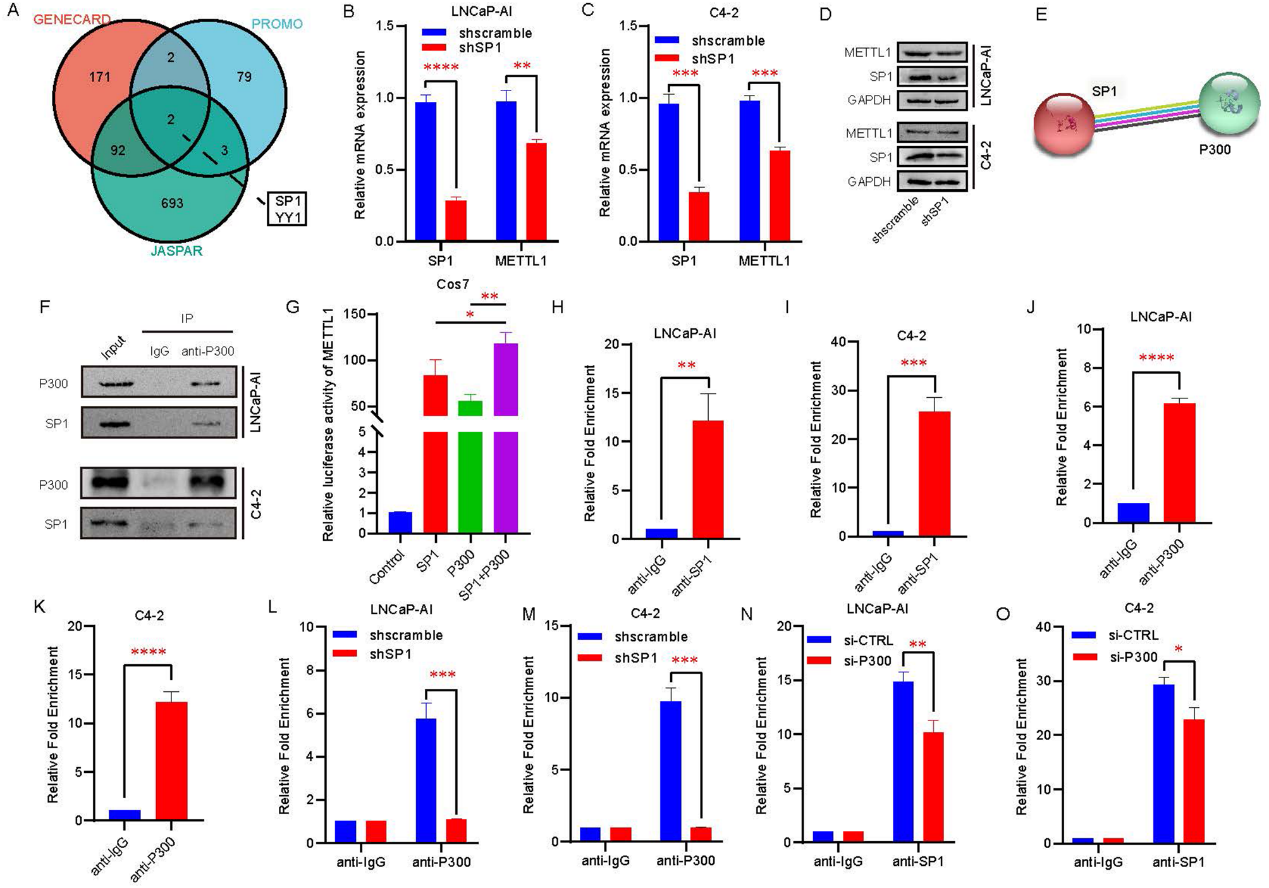
4)P300/SP1复合体调节METTL1的转录活性
为了进一步研究导致METTL1转录上调的分子机制,我们首先通过GENECARD、PROMO和JASPAR网站预测了METTL1的潜在转录因子。三个数据库发现SP1和YY1是共享的(图4A)。鉴于SP1在前列腺癌关键基因转录调控中的重要作用,我们构建了LNCaP-AI和C4-2中SP1稳定敲低的细胞系,发现SP1的沉默降低了METTL1的表达水平(图4B-4D)。P300作为一种重要的转录共激活因子,除了具有乙酰转移酶活性外,还经常通过不同的作用方式参与基因的转录调控。在这里,我们通过生物信息学手段预测SP1和P300可能相互作用(图4E)。随后,我们通过免疫沉淀实验证实了相互结合的存在(图4F)。接下来,我们在COS7细胞中通过荧光素酶报告基因实验验证,当SP1和P300同时存在时,METTL1的转录活性比它们单独存在时更强(图4G)。为了阐明SP1和P300复合物与METTL1启动子区域结合的方式,进行了一系列CHIP-qPCR实验。我们一方面发现SP1和P300可以直接或间接结合到METTL1启动子区域(图4H-4K),另一方面,我们发现在沉默SP1后,P300几乎不再结合到METTL1启动子区域(图4L和4M)。然而,在抑制P300后,SP1与METTL1启动子区域的结合减少,但结合仍然存在(图4N和4O)。这些结果表明,转录因子SP1能够与P300形成复合物介导METTL1的转录激活,并且SP1而不是P300可以直接结合到METTL1启动子区域启动转录。
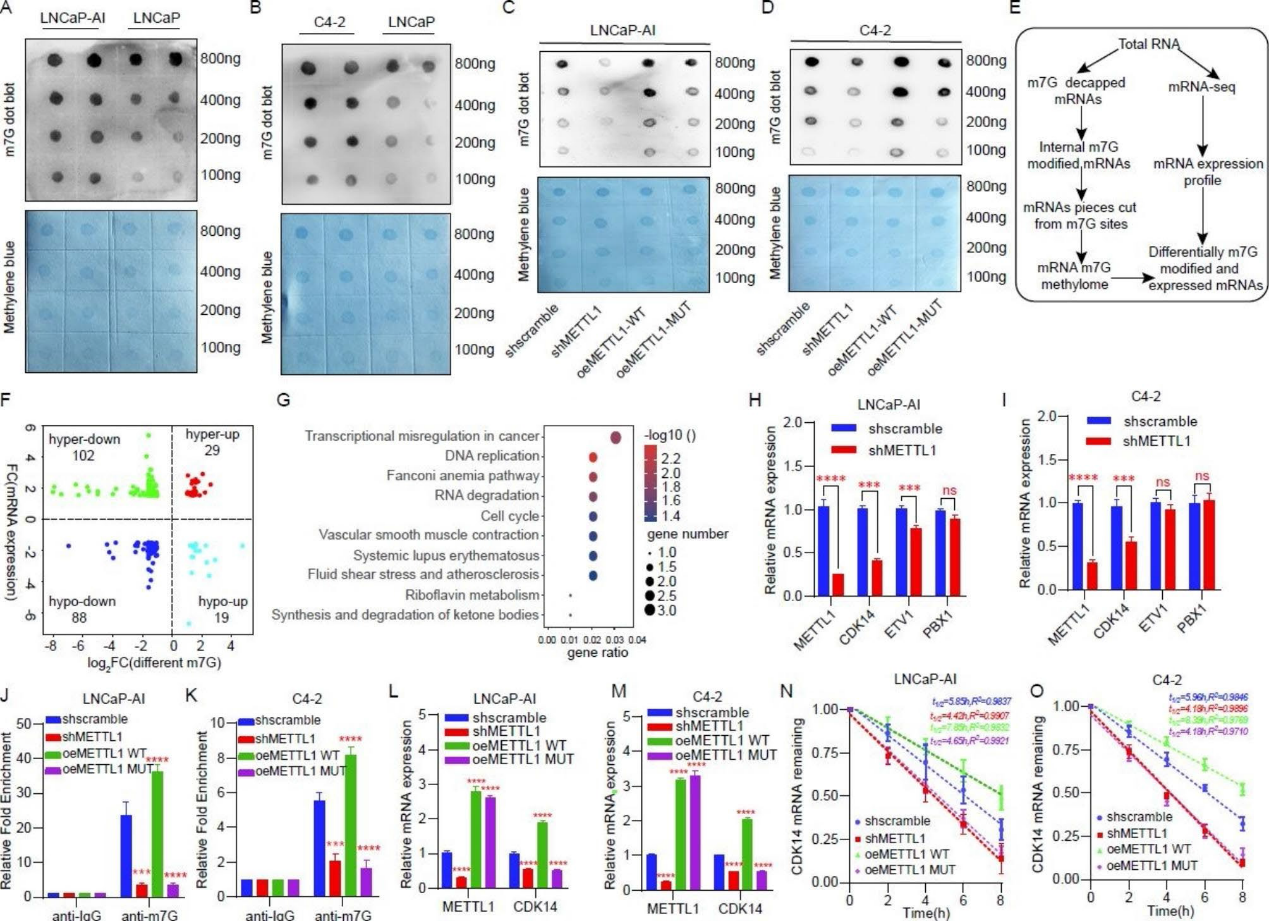
5)METTL1通过介导内部m7G修饰来稳定CDK14 mRNA
为了进一步探讨METTL1影响CRPC细胞系增殖和侵袭能力的分子机制,我们首先验证了其在CRPC中的生物学功能。考虑到METTL1是一种甲基转移酶,负责催化m7G修饰。我们检测了HSPC和CRPC细胞mRNA中m7G水平的差异。在用decapping酶处理细胞后,我们发现LNCaP-AI和C4-2细胞的mRNA中m7G修饰水平比LNCaP细胞更丰富(图5A和5B)。接下来,我们构建了METTL1野生型和酶活性突变型过表达质粒。我们发现,METTL1沉默后,CRPC细胞mRNA中的m7G水平显著降低,转染METTL1野生型过表达质粒后,mRNA中的m7G水平恢复,但转染METTL1酶活性突变质粒后,细胞中的m7G水平未见增加(图5C和5D)。这些结果表明,mRNA中的m7G修饰是由METTL1催化的。为了进一步阐明METTL1催化的mRNA内m7G修饰的生物学作用,我们进行了RNA-seq和mRNA内m7G AlkAniline-Seq联合分析(图5E和5F)。然后,我们对敲低METTL1导致mRNA和m7G水平下调的基因进行了功能富集分析,发现这些基因主要富集在癌症等通路的转录失调中(图5G)。然后我们验证了该通路中CDK14受METTL1调控最为显著(图5H和图5I)。为了弄清楚并证实METTL1对CDK14的调控依赖于甲基转移酶活性,我们一方面通过MeRIP-qPCR阐述了沉默METTL1后CDK14 mRNA内m7G水平下降,转染METTL1野生型质粒后m7G水平升高;而转染突变METTL1质粒后,m7G水平没有明显改变(图5J和5K)。另一方面,CDK14 mRNA水平与其m7G水平的变化一致(图5L和5M)。为了更深入地探讨mRNA内CDK14 mRNA和m7G水平变化一致的原因,我们进行了RNA降解试验。实验结果表明,METTL1的沉默导致CDK14 mRNA半衰期缩短。METTL1野生型质粒的过表达延长了CDK14 mRNA的半衰期,而突变型METTL1质粒的过表达对CDK14 mRNA的半衰期没有显著变化(图5N和图5O)。这些结果表明,甲基转移酶METTL1通过在CDK14 mRNA内引起m7G修饰来保护CDK14 mRNA免受降解。
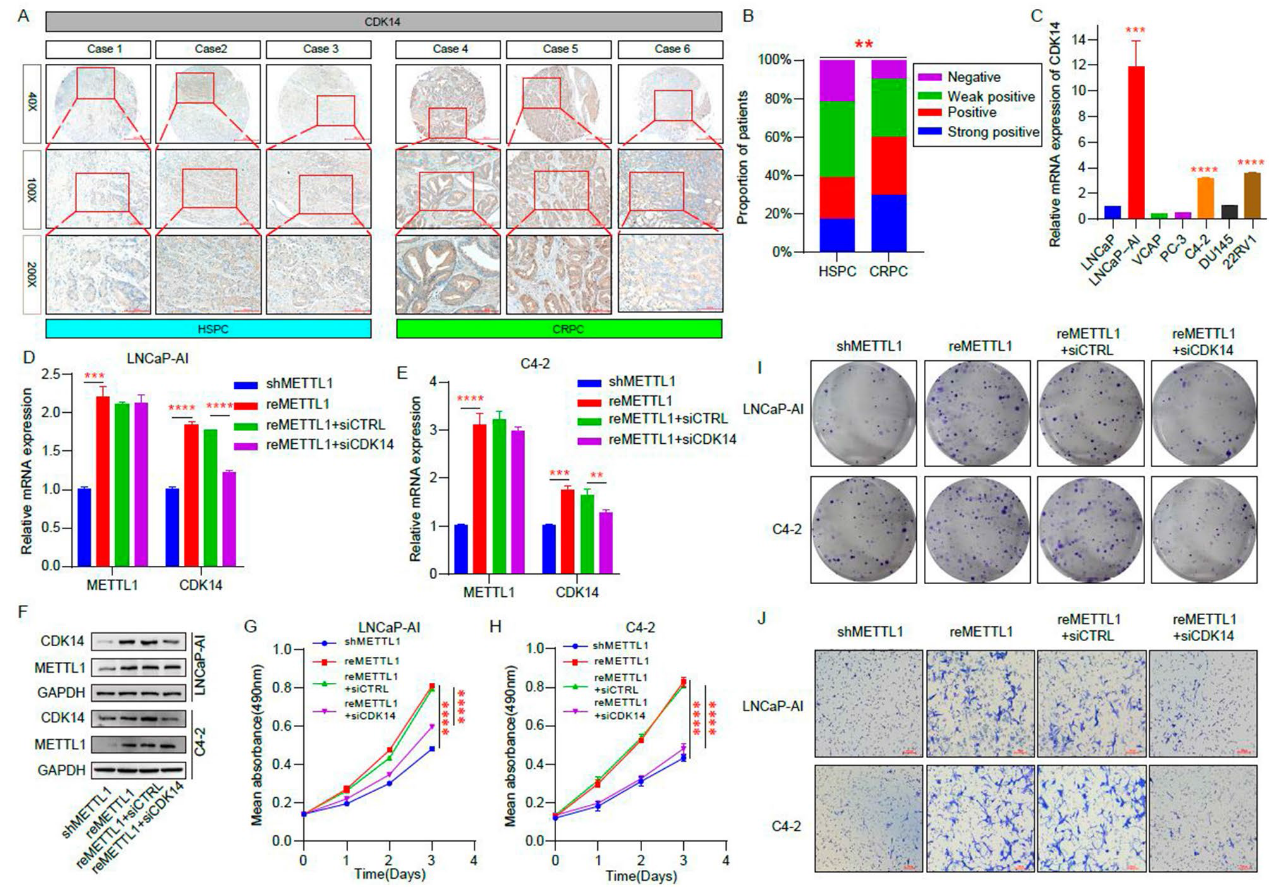
6)METTL1通过调节CDK14的表达调控CRPC的增殖和侵袭
为了进一步证实METTL1通过调节CDK14的表达对CRPC恶性生物学的影响,我们首先检测了CDK14在HSPC和CRPC组织中的表达,免疫组化染色结果显示,与HSPC患者相比,CRPC中CDK14的表达水平更高(图6A和6B)。此外,我们还发现CDK14在LNCaP-AI、C4-2和22RV1中显著上调(图6C)。然后,我们在稳定敲除METTL1 (shMETTL1)的细胞中过表达METTL1 (reMETTL1),同时使用siRNA (reMETTL1 + siCDK14)抑制CDK14的表达,并比较不同组之间增殖和侵袭能力的差异(图6D-6F)。MTT和克隆形成实验表明,与敲低METTL1组相比,过表达METTL1后细胞增殖增强,然而,在此基础上抑制CDK14表达降低了细胞增殖(图6G – 6I)。同样,transwell实验显示,过表达METTL1后,CRPC细胞的侵袭能力增强,而抑制CDK14表达则使CRPC细胞的侵袭能力受损(图6J)。以上结果表明,METTL1可以通过CDK14间接调节CRPC细胞的增殖和侵袭能力。
7)METTL1在体内促进CRPC的进展
为了确定METTL1在体内促进CRPC进展中的作用,我们使用免疫缺陷裸鼠进行皮下移植肿瘤实验。结果表明,与对照组相比,敲除METTL1组皮下移植肿瘤生长更慢,最终体积和质量更小。对照组裸鼠皮下移植瘤生长速度最快,体积和重量最大。同时,CTPB + shMETTL1组比DMSO+shMETTL1组生长更快,肿瘤体积和质量更大(图7A-7C)。通过免疫组化染色,我们发现METTL1抑制后CDK14和细胞增殖标志物PCNA均减少。与sh-scramble和shMETTL1组相比,CTPB饲养的裸鼠中CDK14和PCNA表达升高(图7D和7E)。体内实验更严格地证实了METTL1在促进CRPC进展中的重要作用。

结论
METTL1在CRPC的进展中起致瘤作用。从机制上讲,P300/SP1复合体促进了METTL1的转录激活,导致METTL1在CRPC中异常高表达。最后,作为m7G甲基转移酶,METTL1通过在其内部添加m7G修饰来保护CDK14 mRNA免受降解并最终导致CRPC进展。
实验方法
TMA,IHC,WB,RT-qPCR,MTT,克隆形成实验,transwell,m7G点印迹,Co-IP,CHIP,荧光素酶报告试验,MeRIP,mRNA稳定性实验,体内实验。
参考文献
Zhang M, Kan D, Zhang B, Chen X, Wang C, Chen S, Gao W, Yang Z, Li Y, Chen Y, Zhu S, Wen S, Niu Y, Shang Z. P300/SP1 complex mediating elevated METTL1 regulates CDK14 mRNA stability via internal m7G modification in CRPC. J Exp Clin Cancer Res. 2023 Aug 21;42(1):215. doi: 10.1186/s13046-023-02777-z.






