看一看国自然宠儿YTHDF1如何拿到20+

结直肠癌(CRC)是世界上最常见的癌症之一。YTHDF1作为m6A阅读器,可调控m6A修饰的mRNA。本研究中,作者阐明了YTHDF1在CRC肿瘤免疫微环境(TIME)中的功能和机制。他们发现YTHDF1通过m6A-p65-CXCL1/CXCR2轴促进CRC发展,且靶向YTHDF1联合抗PD1治疗CRC具有良好的疗效。该研究于2023年1月发表在《Gut》,IF:24.5。
技术路线



主要研究结果
1. YTHDF1调控CRC患者免疫抑制微环境
IFN-γ反应可诱导抗肿瘤免疫并且与免疫检查点阻断(ICB)治疗有关。作者研究发现,在多个m6A调节因子中,YTHDF1与IFN-γ相关基因mRNA的表达呈现强烈的负相关(图1A)。另一方面,CRC组织微阵列(TMA)免疫组化染色结果与TCGA数据分析结果一致,YTHDF1蛋白高表达与CD8+ T细胞低浸润有关(图1B和1C)。这些数据均表明,YTHDF1与抗肿瘤免疫受损和ICB治疗效果降低有关。
为研究YTHDF1在调节抗肿瘤免疫中的作用,作者利用CRISPR/Cas9敲除MC38(MSI-H-CRC)细胞中的Ythdf1(Ythdf1-KO),并将细胞注射到同系C57BL6小鼠中(图1D)。他们发现,与对照组(NC)相比,Ythdf1敲除可减少肿瘤体积和重量(图1E)。关于Ythdf1-KO是否影响TIME,作者从肿瘤中分离出CD45+免疫细胞,并进行单细胞RNA-seq(scRNA-seq)(NC:1480个细胞;Ythdf1-KO:1816个细胞)。与NC组相比,Ythdf1-KO肿瘤中的粒细胞样髓系来源抑制细胞(G-MDSCs)和中性粒细胞显著减少,而T细胞和NK细胞大量增加(图1F)。作者进一步将T细胞和NK细胞分为CD4+T细胞、CD8+T细胞、NKT细胞和NK细胞亚群,与对照组相比,它们在Ythdf1-KO肿瘤中同时增加(图1F)。通过检测MDSCs功能标志物Il1b、Arg2、Cxcr2和Ccr2,作者发现这些基因主要富集在Ythdf1未敲除肿瘤的MDSC细胞簇中(图1G)。以上数据结果均支持YTHDF1在CRC中发挥免疫抑制功能。
为验证scRNA-seq数据中的发现,通过流式细胞术检测MC38同系肿瘤小鼠中肿瘤浸润免疫细胞构成。作者已经证实了Ythdf1敲除显著抑制肿瘤的体积和重量(图1C),而流式细胞术结果显示,Ythdf1敲除降低MDSCs的同时,增加了肿瘤中CD8+T细胞和CD4+T细胞(图1H和1I)。在MDSCs中,G-MDSCs为主要亚群,Ythdf1敲除导致G-MDSCs显著减少(图1I)。作者观察到在Ythdf1-KO组中,功能性T细胞显著增加,其中包括IFN-γ+ CD8+T细胞、颗粒酶B+ CD8+T细胞和IFN-γ+ CD4+T细胞,这与MDSCs发挥免疫抑制功能一致(图1H和1J)。
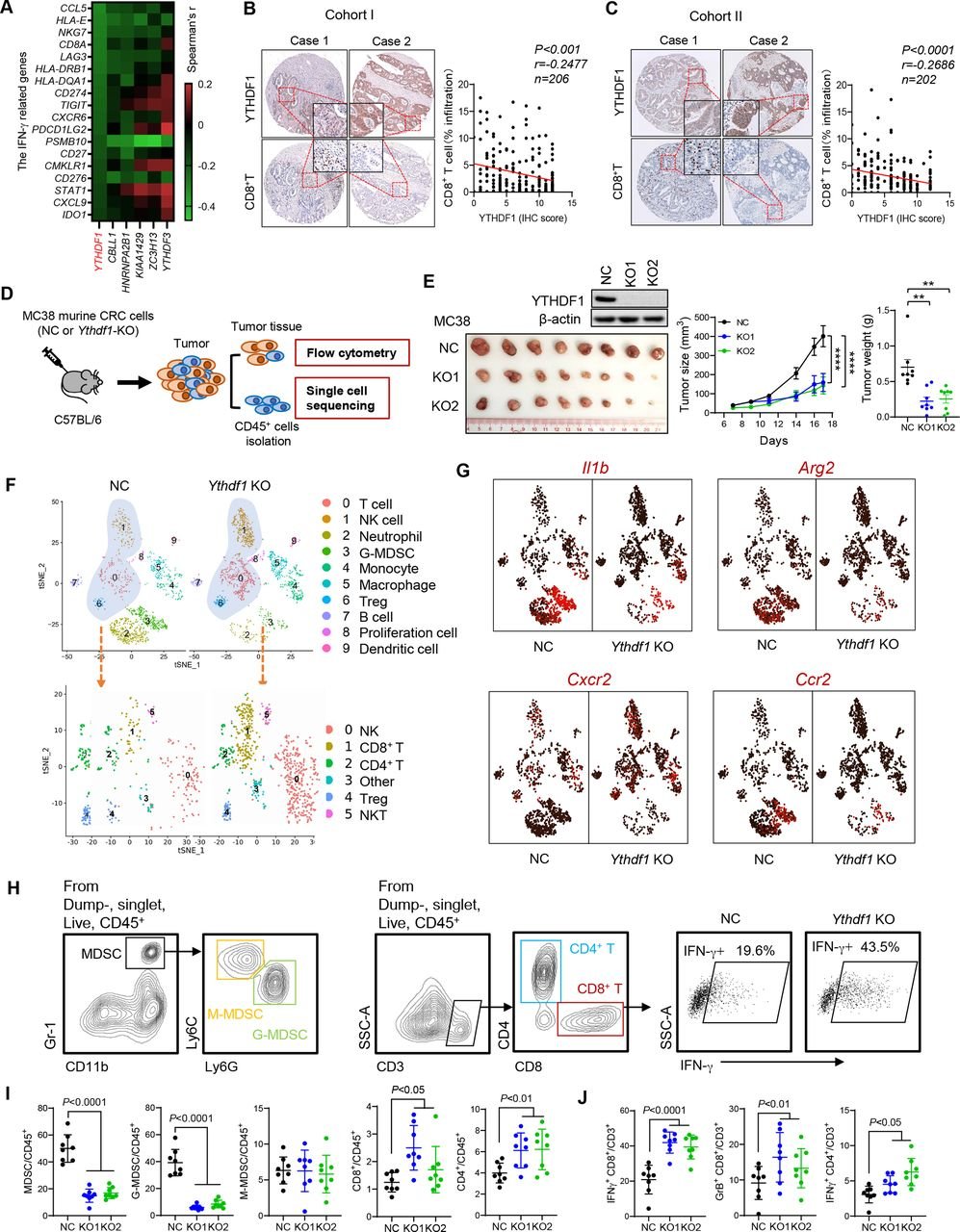
图1:YTHDF1与CRC免疫抑制微环境有关
2. Ythdf1敲除通过减少MDSC和增加功能性T细胞诱导抗肿瘤免疫
作者接下来在CT26(MSS-CRC)细胞中敲除Ythdf1,验证Ythdf1在抗肿瘤免疫调节中的作用。如预期,Ythdf1-KO导致CT26同系肿瘤小鼠的肿瘤体积和重量减小(图2A和2B),同时,功能性T细胞增加以及MDSCs浸润减少(图2C和2D)。免疫荧光染色也证实Ythdf1敲除使MC38和CT26同系肿瘤中MDSCs(CD11b+Gr-1+)浸润减少(图2E)。总而言之,CRC细胞中Ythdf1缺失减少MDSCs并提高功能性T细胞浸润。这些发现证明YTHDF1与CD8+T细胞和IFN-γ相关特征有关(图1A-C)。
关于Ythdf1-KO中肿瘤形成减弱是否依赖于CD8+T细胞抗肿瘤免疫,在MC38同系肿瘤模型中,作者利用CD8抗体耗竭CD8+T细胞。结果发现,CD8+T细胞耗竭恢复了Ythdf1-KO肿瘤生长(图2F和2G),这表明Ythdf1-KO对肿瘤的抑制部分依赖于CD8+T细胞。这在CT26同系肿瘤模型小鼠中得到证实, CD8抗体处理挽救了Ythdf1-KO组中肿瘤停滞生长(图2H和2I)。作者得出结论,Ythdf1敲除通过诱导CD8+T细胞依赖性抗肿瘤免疫抑制CRC生长。
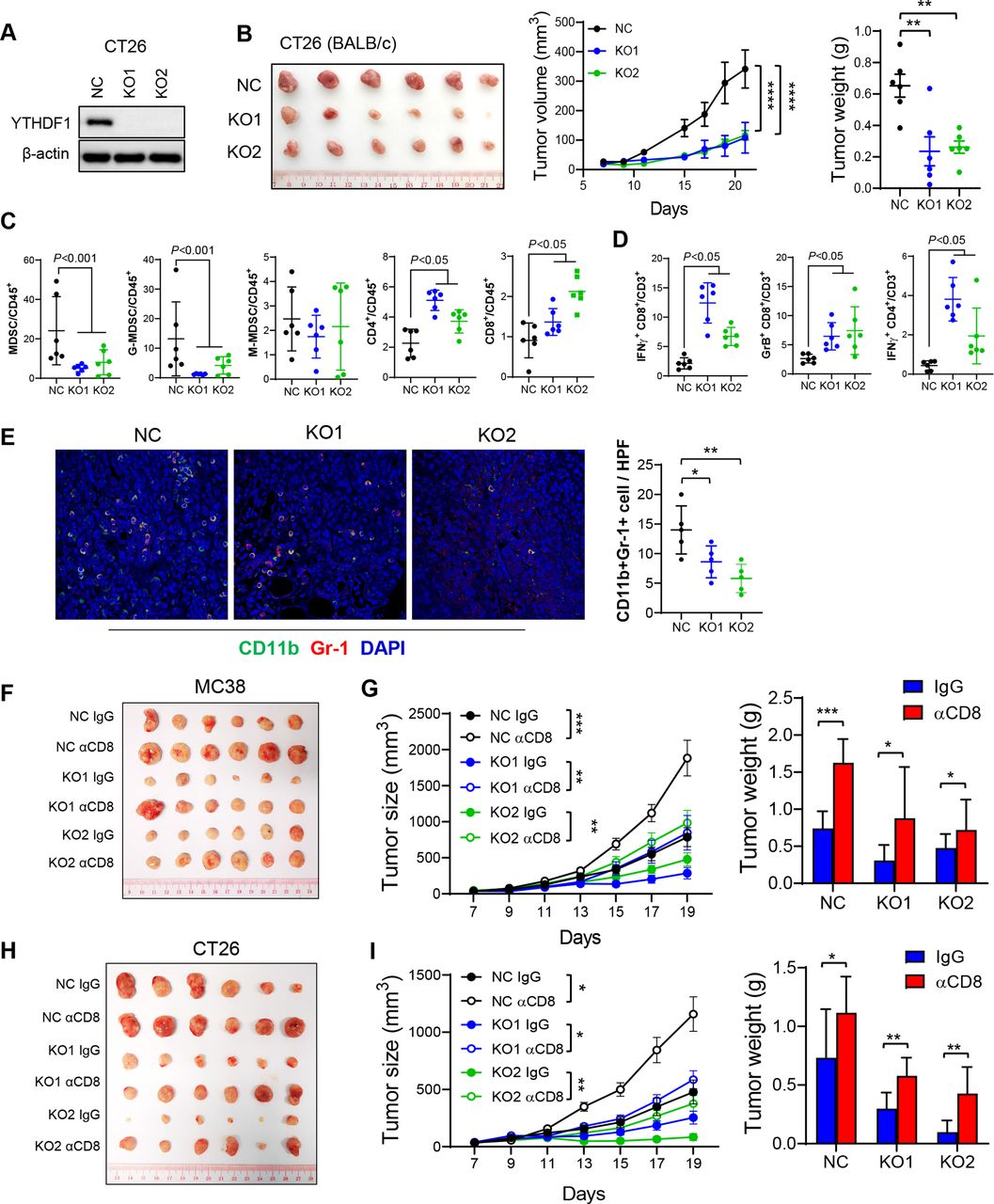
图2:Ythdf1-KO减少MDSCs的同时增加细胞毒性T细胞浸润
3. 肠道特异性Ythdf1敲入促进小鼠结肠肿瘤发生并抑制抗肿瘤免疫
为验证YTHDF1在自发性CRC发生中的作用,作者构建了肠道特异性Ythdf1敲入小鼠(Ythdf1loxp/loxpCDX2-cre),并通过AOM/DSS处理诱导小鼠CRC发生(图3A)。他们发现,在AOM/DSS模型中,Ythdf1过表达引起结肠肿瘤的数量和尺寸增加(图3C)。流式细胞术结果显示,与野生型小鼠相比,Ythdf1敲入小鼠结肠肿瘤MDSC浸润增加的同时,NK、CD4+T和CD8+T细胞减少(图3D)。此外,作者还发现Ythdf1敲入降低了通过颗粒酶B、INF-γ和TNF-α表达鉴定的功能性T细胞占比(图3E)。
接下来,作者通过建立ApcMin/+Ythdf1loxp/loxpCDX2-cre小鼠,在ApcMin/+造成的自发性CRC中验证这些结果(图3B)。与上述结果一致,相比于野生型,肠道特异性Ythdf1敲入的ApcMin/+小鼠生长出更大的结肠肿瘤(图3C)。肿瘤浸润免疫细胞分析结果表明,在Ythdf1敲入与ApcMin/+的影响下,肿瘤中NK细胞、CD4+T细胞和CD8+T细胞浸润显著减少的同时MDSCs增加(图3F)。此外,Ythdf1敲入降低了ApcMin/+小鼠中颗粒酶B+、INF-γ+或TNF-α+T细胞(图3G)。总而言之,这些结果均支持YTHDF1促进免疫抑制微环境从而促进自发性CRC。
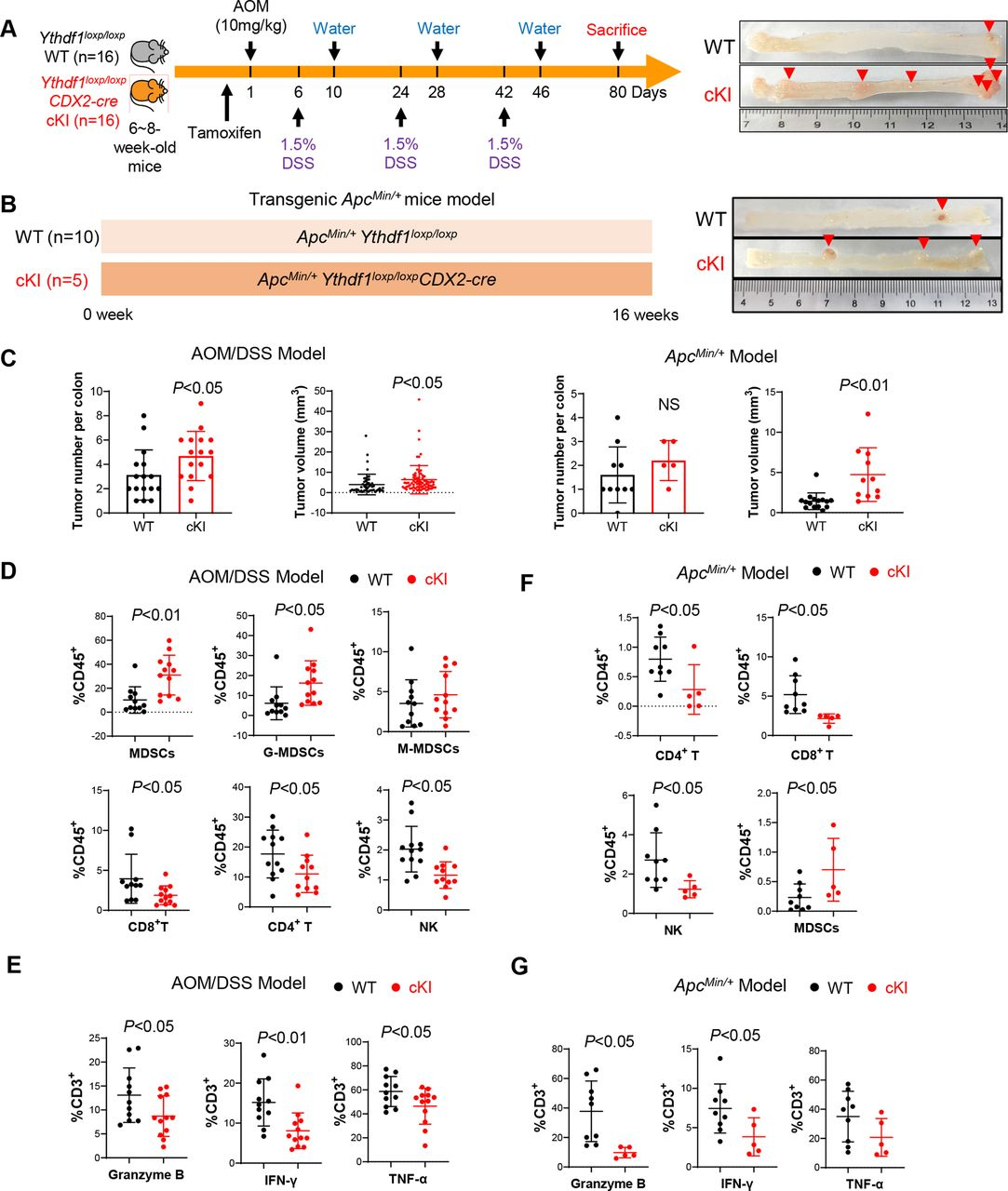
图3:Ythdf1-KO促进小鼠结肠肿瘤发生并抑制抗肿瘤免疫
4. VNP-siYTHDF1靶向YTHDF1增强CD34+人源化小鼠的抗肿瘤免疫
为证实YTHDF1在调节人类抗肿瘤免疫反应中的作用,作者建立了CD34+人源化小鼠模型,这种小鼠外周血单核细胞(PBMC)>20% 人类CD45+细胞(图4A)。作者使用了一种携带siRNA的VNPs,可以在体内靶向YTHDF1。待肿瘤达到50-100mm3,用VNP-siNC或-siYTHDF1处理携带有人CRC HCT116异种移植体的人源化NSG小鼠(图4B)。与VNP-siNC相比,VNP-siYTHDF1显著抑制肿瘤的体积和重量(图4B和4C)。同时,作者通过流式细胞术来分析TIME(图4D)。发现VNP-siYTHDF1降低MDSC浸润,增加CD4+T细胞、CD8+T细胞和NK细胞的累积(图4E)。此外,在VNP-siYTHDF1肿瘤中识别到更多的IFN-γ+、TNF-α+和颗粒酶B+ CD8+T细胞。
作者还通过测量肝脏(丙氨酸转氨酶和天冬氨酸转氨酶)和肾功能(肌酐和血尿素氮)的血清标志物来确定VNP-siYTHDF1的安全性,而用VNP-siNC或VNPsiYTHDF1处理的小鼠没有表现出异常的肝脏或肾功能指标,这表明VNP治疗具有良好的耐受性。因此,使用VNP-siYTHDF1靶向YTHDF1是增强人源化小鼠抗肿瘤免疫的安全有效手段。
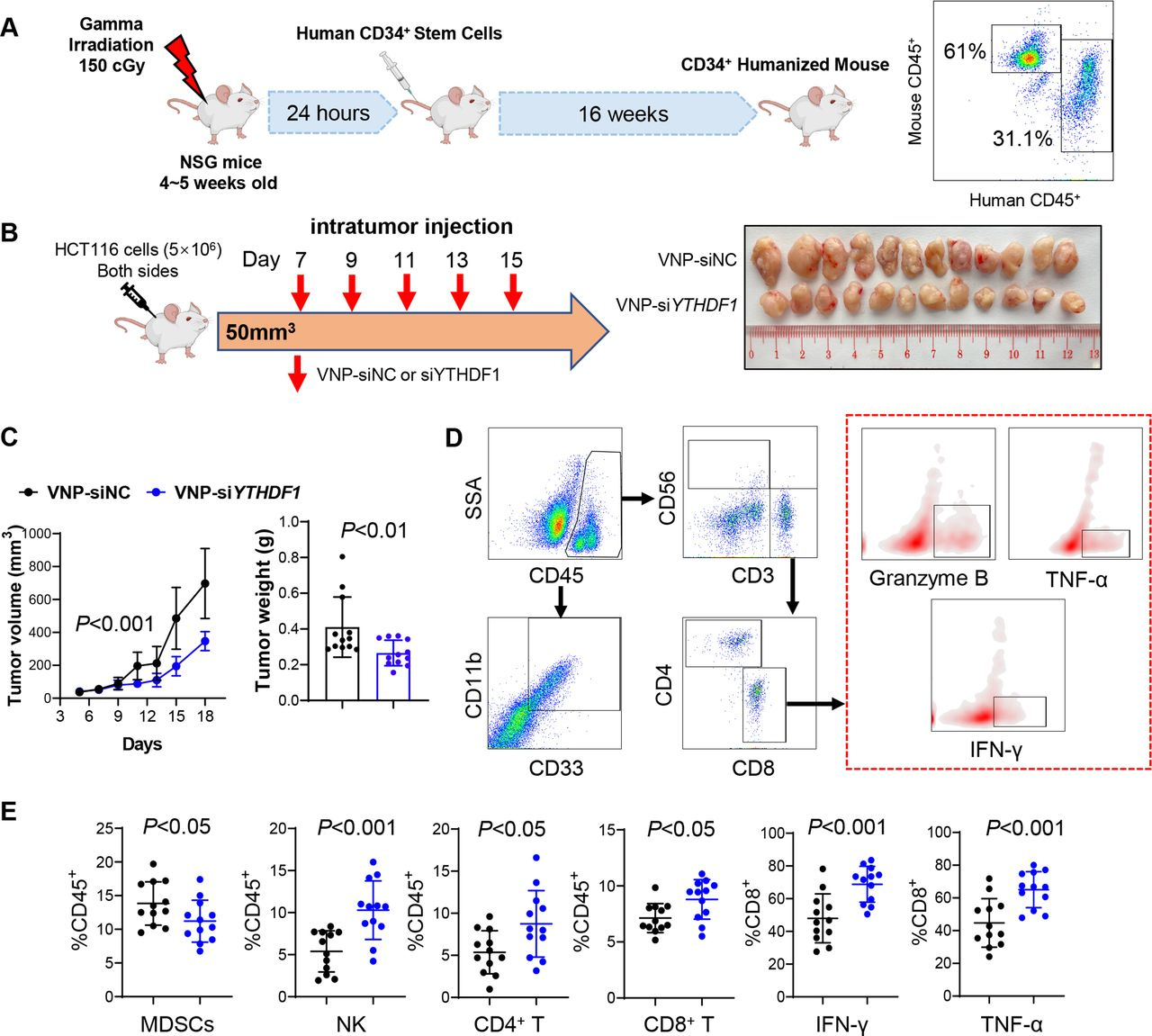
图4:VNP-siYTHDF1增强CD34+人源化小鼠抗肿瘤免疫
5. YTHDF1促进p65翻译激活TNF-κB信号传导
为鉴定YTHDF1引发免疫抑制的分子机制,作者对YTHDF1敲除或非敲除CRC细胞进行RNA-seq和Ribo-seq。其结果表明,YTHDF1敲除或非敲除之间的差异表达基因主要富集于TNF和NF-κB信号通路中。此外,Ribo-seq数据显示YTHDF1缺失与TNF信号失活显著相关;相应地,YTHDF1敲除降低了参与TNF信号传导的核糖体保护片段基因的丰度(图5A)。因此得出结论,YTHDF1可以通过促进蛋白质翻译来调节TNF-κB信号传导。YTHDF1作为m6A阅读器发挥功能,作者接下来对m6A进行MeRIP-seq确定m6A修饰的转录产物。通过筛选参与TNF信号传导的mRNA中的m6A峰,鉴定出两个靠近p65 mRNA终止密码子的m6A位点(图5B),MeRIP-qPCR得到了同样的验证结果(图5C)。重要的是,作者通过RIP测序和抗YTHDF1抗体的RIP-qPCR鉴定到YTHDF1和p65 mRNA之间的直接相互作用(图5D)。这说明p65 mRNA是YTHDF1的直接靶点。作者还发现,Ythdf1敲除在蛋白翻译水平上减弱了CT26和MC38细胞中p65蛋白的表达,尤其是核p65,但不影响NF-κB途径的其他调节因子的表达,比如IKKα和IκBα(图5E)。人CRC细胞野生型YTHDF1过表达提高p65蛋白表达,相反地,YTHDF1基因敲低降低人CRC细胞中p65蛋白表达(图5F)。抗YTHDF1的RIP-qPCR也证实人CRC细胞中YTHDF1和p65 mRNA之间的直接相互作用(图5G)。接下来,作者回归体内验证YTHDF1和p65的相关性。在Ythdf1敲入小鼠中,p65和磷酸化p65蛋白在结肠肿瘤中均有增加(图5H)。综上所述之,YTHDF1在体外和体内均促进p65蛋白表达以激活TNF和NF-κB信号传导。
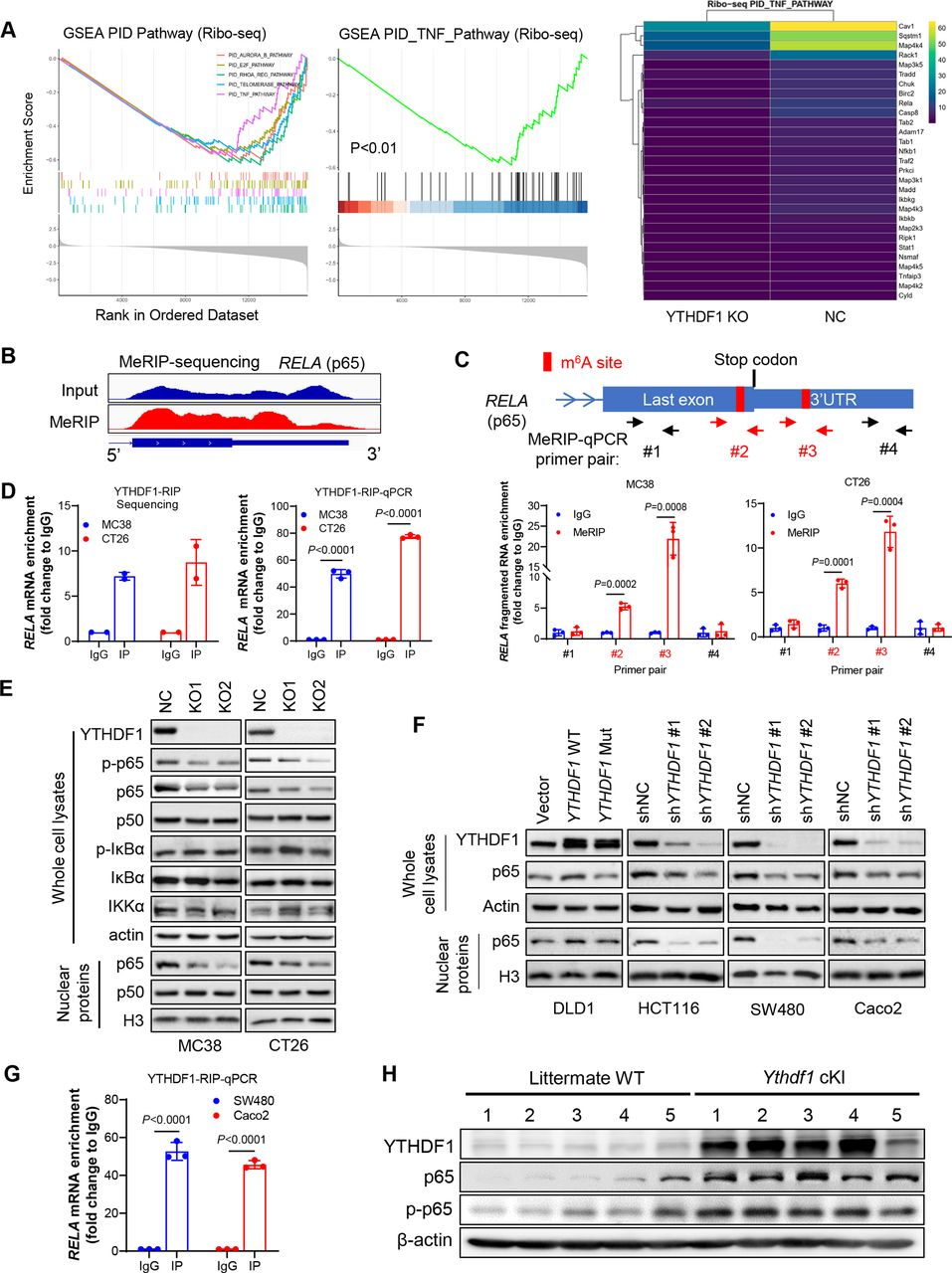
图5:YTHDF1通过促进p65 mRNA翻译促进CRC中TNF-NF-kB信号传导
6. YTHDF1通过p65-CXCL1轴促进MDSC迁移
为了解YTHDF1诱导的p65与其免疫抑制之间的联系,作者进行了细胞因子多重免疫测定,在CRC细胞、肿瘤裂解物的条件培养基和患有同系肿瘤的小鼠血清中检测到23种不同的小鼠细胞因子。在这些细胞因子中,经ELISA测定证实Ythdf1-KO持续降低CXCL1(图6A和6B)。CXCL1是NF-κB信号传导的转录靶点,它与受体CXCR2结合促进MDSC趋化。Ythdf1-KO在CRC TIME中减少MDSC浸润,为验证Ythdf1是否调节MDSC迁移,作者进行了体外MDSC迁移测定。他们发现野生型CRC细胞的条件培养基增强了MDSC的迁移,Ythdf1敲除后这种迁移效果减弱(图6C)。CXCR2抑制剂SB265610阻断CXCL1-CXCR2结合从而消除对照组和Ythdf1-KO培养上清在介导MDSC迁移方面的差异(图6C)。YTHDF1是通过CXCL1/CXCR2轴促进MDSC迁移。那么,YTHDF1是否可以调节Cxcl1 mRNA的表达呢?与预期一致,Ythdf1敲除显著抑制小鼠和人CRC细胞系中Cxcl1 mRNA表达水平(图6D)。
作者接下来研究YTHDF1是否影响MDSC功能。从MC38同系肿瘤中分离出CD11b+Gr-1+ MDSCs与T细胞体外共培养(图6E)。从对照肿瘤中分离的MDSCs抑制T细胞增殖;然而,与对照组MDSCs相比,Ythdf1-KO肿瘤MDSCs对CD8+T细胞和CD4+T细胞增殖表现出较低的抑制作用(图6F和6G)。这些数据证实了之前所报道的MDSCs对关键效应细胞(包括CD8+T细胞和CD4+T细胞)的免疫抑制功能,并支持CRC通过表达YTHDF1募集功能性MDSCs。

图6:Ythdf1缺失通过降低CXCL1分泌促进MDSCs减少
7. YTHDF1是CRC免疫疗法的潜在治疗靶点
MDSC浸润减少与各种类型癌症的免疫治疗效果增强有关,作者尝试靶向YTHDF1是否增强CRC中抗PD1治疗。作者发现敲除Ythdf1显著提高抗PD1在MC38(MSI-H)同系肿瘤中的疗效,并延长荷瘤小鼠生存率(图7A)。作者进一步利用VNPs将特异性Ythdf1-siRNA递送到肿瘤中。当MC38同系肿瘤达到50~100mm3时,用VNP-siYthdf1(或VNP-siNC)和抗PD1(或IgG)处理小鼠。与VNP-siNC相比,VNP-siYthdf1显著抑制MC38肿瘤生长,而VNP-siYthdf1与抗PD1联合处理对肿瘤生长产生最强抑制作用(图7B,C)。
基于同系CT26(MSS CRC)肿瘤模型,作者同样探讨了靶向YTHDF1能否解决MSS CRC中抗PD1的耐药性。将Ythdf1敲除CT26细胞注射同系肿瘤小鼠,并用抗PD1处理。结果发现,Ythdf1敲除显著增强抗PD1在CT26同系肿瘤中的治疗效果(图7D和7E)。
流式细胞术结果显示,在CT26和MC38同系模型中,Ythdf1沉默与抗PD1联合处理显著增加了肿瘤功能性CD8+T细胞浸润,包括IFN-γ+ CD8+T细胞和颗粒酶B+ CD8+T细胞。此外,二者联合处理显著降低MDSCs积累,并诱导CD4+T细胞和CD8+T细胞。因此,靶向YTHDF1不仅增强ICB在MSI-H CRC中的治疗效果,而且通过抑制MDSCs募集和改善CD8+T细胞的功能,克服MSS CRC中ICB抵抗。

图7:YTHDF1增强MSI-H和MSS CRC的抗PD1阻断治疗
结论
综上所述,CRC中YTHDF1表达通过激活m6A-p65-CXCL1轴招募免疫抑制性MDSCs抑制T细胞,从而促进CRC。靶向YTHDF1联合抗PD1治疗CRC具有治疗前景,这证实YTHDF1是CRC潜在的治疗靶点。
实验方法
细胞培养,免疫组化,流式细胞术,免疫荧光,CRISPR/Cas9,scRNA-seq,VPN-siRNA, Western blot, RIP-seq, Ribo-seq,RIP-q PCR, MeRIP,
参考文献
Bao Y, Zhai J, Chen H, Wong CC, Liang C, Ding Y, Huang D, Gou H, Chen D, Pan Y, Kang W, To KF, Yu J. Targeting m6A reader YTHDF1 augments antitumour immunity and boosts anti-PD-1 efficacy in colorectal cancer. Gut. 2023 Aug;72(8):1497-1509. doi: 10.1136/gutjnl-2022-328845. Epub 2023 Jan 30. PMID: 36717220.






