女性结直肠癌拯救之光——麦芽香肉杆菌(C. maltaromaticum)
结直肠癌(CRC)是一种常见且致命的恶性肿瘤。研究发现,女性结直肠癌(CRC)患者的麦芽香肉杆菌(Carnobacterium maltaromaticum)特异性减少。于是作者团队在两种CRC小鼠模型中去验证C. maltaromaticum是否以雌性特异性的方式减少肠道肿瘤的形成,发现雌激素通过增加结肠中SLC3A2与细菌DD-CPase结合的表达,增加了C. maltaromaticum的附着和定植。另外,通过代谢组学和转录组学分析显示,用C. maltaromaticum灌胃的小鼠,肠道中维生素D相关代谢物的丰度增加,并以肠道微生物组和维生素D受体(VDR)依赖的方式激活了黏膜中的维生素D受体(VDR)信号。通过体外发酵系统证实了C. maltaromaticum粪杆菌(Faecalibacterium prausnitzii)的代谢性交叉喂养,将C. maltaromaticum产生的7-脱氢胆固醇转化为维生素D,激活宿主VDR信号。总体而言,C. maltaromaticum以雌激素依赖的方式定植于肠道,并与其他微生物一起增加肠道维生素D的产生,激活宿主VDR以抑制结直肠癌。本篇文章于2023年8月发表在《Cancer Cell》,IF:50.3。

作用机制图解
技术路线
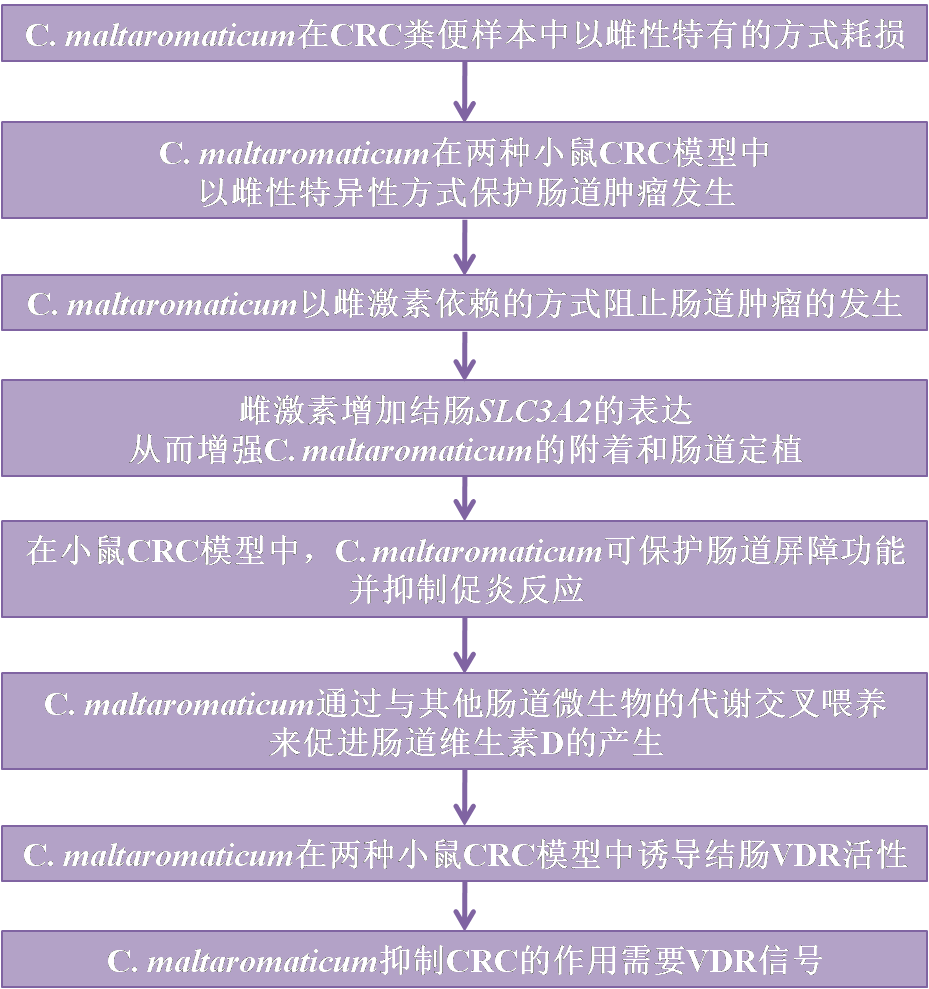
主要研究成果
1. C.maltaromaticum在结直肠癌粪便样本中以女性特有的方式被消耗
基于532份粪便样本(270例CRC患者和262例健康对照)的CRC shotgun宏基因组数据集的多队列分析,作者发现C. maltaromaticum在女性CRC患者中是一种缺失的细菌,但在男性CRC患者中没有观察到这种缺失(图S1A)。在癌症基因组图谱(TCGA)队列中,肿瘤内C. maltaromaticum丰度在女性CRC患者中的预后表现也比男性CRC患者更突出(图S1B)。因此,C. maltaromaticum的丰度在人类粪便样本中可检测到的5733种细菌中排名第803位(图S1C),表明C. maltaromaticum作为人类肠道微生物群的常见微生物,可能对CRC发挥性别特异性的疾病修饰作用。
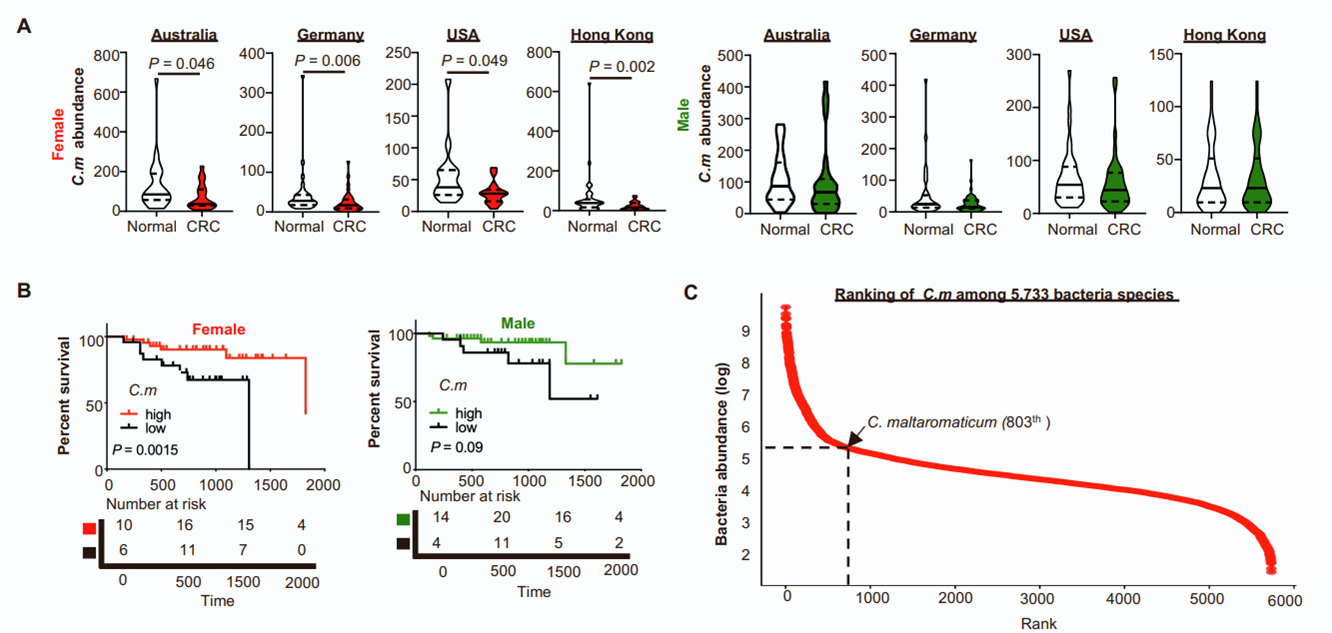
图S1 C. maltaromaticum在结直肠癌患者的粪便样本中以性别特异性的方式被耗尽
2. C. maltaromaticum在两种小鼠CRC模型中以雌性特异性方式保护肠道肿瘤发生
为了研究C. maltaromaticum是否能以性别特异性的方式发挥抗CRC作用,作者将雌性和雄性Apcmin/+小鼠(种系突变肠道肿瘤发生模型)每天口服200 mL含有1 × 108个菌落形成单位(CFU)的C. maltaromaticum(菌株ATTC B270,除非另有说明)的菌悬液。以相同体积的脑心输注(BHI)或相同数量的大肠杆菌(菌株mg1655)作为对照,以与C. maltaromaticum相同的方案给予小鼠12周(图1A和1D)。他们在结肠镜下观察到,与BHI或大肠杆菌处理相比,经C. maltaromaticum处理的雌性小鼠的肿瘤大小明显减小,而雄性小鼠则没有(图1B和1E),仅在雌性C. maltaromaticum - Apcmin/+小鼠中观察到结肠和小肠肿瘤数量和肿瘤负荷的显著减少,而在雄性小鼠中则没有(图1C和1F)。然后作者在致癌物诱导的CRC模型中验证了C. maltaromaticum抗CRC作用的性别特异性,在C57BL/6雌性和雄性小鼠中注射致癌物偶氮氧甲烷(AOM;10 mg/kg),每周1次,连续6周,然后口服C. maltaromaticum、E. coli或BHI。观察到C. maltaromaticum具有一致的女性特异性肿瘤抑制作用(图1G – 1L)。这些结果表明,C. maltaromaticum可能以雌性特异性的方式抑制肠道肿瘤的发生。

图1 C. maltaromaticum在两种小鼠CRC模型中以性别特异性的方式保护肠道肿瘤发生
3. C. maltaromaticum以雌激素依赖的方式阻止肠道肿瘤的发生
为了确定C. maltaromaticum的雌性特异性抗CRC作用是否依赖于雌激素,作者通过对雌性Apcmin/+小鼠进行卵巢切除术(OVX)建立了雌激素剥夺型CRC模型。小鼠接受OVX或假手术后,每天口服C. maltaromaticum、E. coli或BHI(图2A和2B)。OVX小鼠阴道涂片检查显示白细胞数量增加(图2C)和血清雌二醇水平降低(图2D),证实雌激素剥夺成功。在组织采集前,内镜检查显示假手术的OVX小鼠肿瘤大小减小,但经C. maltaromaticum处理的OVX小鼠肿瘤大小没有减小(图2E)。与此一致的是,只有在假手术的Apcmin/+小鼠中,用C. maltaromaticum处理后,肿瘤数量和肿瘤负荷才显著减少(图2F)。在另一组实验中,作者对雌性Apcmin/+小鼠进行OVX,但通过补充17β-雌二醇来恢复雌激素水平。
通过睾丸切除术(ORX)加17β雌二醇给药巩固雄性Apcmin/+小鼠的雌性化,(图2G-2I)。同样,在接受C. maltaromaticum的雌性化而非假手术的雄性小鼠中,作者在内镜下观察到肿瘤大小减小(图2J)。C. maltaromaticum也仅在雌性化后的雄性Apcmin/+小鼠中观察到肿瘤数量和肿瘤大小的减少(图2K)。
4. 雌激素增加结肠SLC3A2的表达,从而增强C. maltaromaticum的附着和肠道定植
接下来,作者研究了C. maltaromaticum的性别特异性效应是否由于其在雌性中的优先定植。通过qPCR(图3A)和荧光原位杂交(FISH)(图3B)检测,雌性小鼠或雌性化的雄性小鼠肠道组织中携带的C. maltaromaticum比缺乏雌激素的雌性小鼠或雄性小鼠多。进一步给雌性和雄性小鼠(窝仔)灌胃C. maltaromaticum两周,之后每天收集粪便样本。即使在最后一次灌胃后的第5天,在雌性小鼠的粪便样本中也可以检测到C. maltaromaticum,而在雄性小鼠中,只观察到C. maltaromaticum在2天内短暂过境。雌性小鼠的结肠组织也比雄性小鼠含有更多的C. maltaromaticum(图3C)。
众所周知,雌激素信号可以调节肠道微生物群。为了研究雌激素对C. maltaromaticum定植的影响,作者采用17β-雌二醇(10 mM)预处理正常的结肠上皮细胞NCM460 24小时,然后进行细菌附着试验、透射电子显微镜(TEM)和活/死细菌染色。观察到17β-雌二醇显著增加了C. maltaromaticum对NCM460的附着(图3D)。为了鉴定介导C. maltaromaticum附着于肠上皮细胞的宿主受体,作者进一步进行了基于生物素的far-Western和pull-down实验,从NCM460中鉴定出6个蛋白带,这些蛋白带被生物素化的C. maltaromaticum表面蛋白持续拉下(图3E)。结果显示,女性结肠SLC3A2的表达水平高于男性(图3F)。SLC3A2的敲低也抑制了C. maltaromaticum对NCM460的附着(图3G),这些观察结果表明,作为跨膜糖蛋白的SLC3A2可能是C. maltaromaticum的受体。
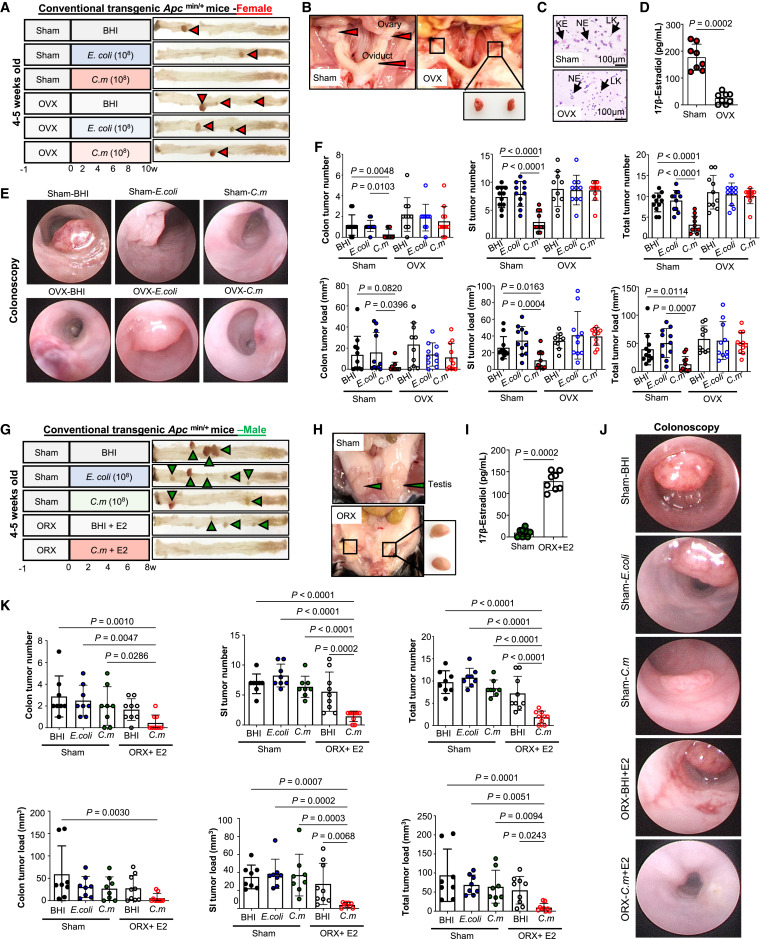
图2 C.maltaromaticum以雌激素依赖的方式保护肠道肿瘤的发生
然后作者对雌激素是否可以调节结肠SLC3A2的表达进行了探讨。他们用17β-雌二醇(10 mM)预处理NCM460增强了SLC3A2的表达(图3H)。活/死细菌共染色的免疫荧光证实了SLC3A2和C. maltaromaticum的共定位(图3I)。C. maltaromaticum对经17β-雌二醇预处理的NCM460的附着也增加(图3I和3J)。为了检验C. maltaromaticum的雌激素介导的附着表型是否仅依赖于SLC3A2,作者通过CRISPR敲除NCM460细胞中的SLC3A2(图3K),在SLC3A2基因敲除后,17β-雌二醇预处理不能再增加C. maltaromaticum对NCM460的附着(图3K)。研究结果表明,SLC3A2是介导性别特异性定植表型的主要NCM460表面蛋白。而其他蛋白质,包括含EF-hand结构域蛋白D2和半乳糖凝集素-3,可能以性别无关的方式参与C. maltaromaticum的附着。

图3 雌激素增加结肠SLC3A2的表达,从而增强C. maltaromaticum的附着和肠道定植
于是作者采用免疫沉淀-质谱法鉴定DD-CPase为C. maltaromaticum表面的SLC3A2结合蛋白(图3L)。此外,通过双分子荧光互补(BiFC)(图3M)和ELISA,重组SLC3A2、重组DD-CPase和一种针对DD-CPase的抗体(图3N),证实了DD-CPase和SLC3A2之间的直接相互作用。总的来说,这些发现表明雌激素通过细菌表面蛋白DD-Cpase增强结肠SLC3A2的表达,促进了C. maltaromaticum的粘膜附着和定植。
5. 在小鼠CRC模型中,C. maltaromaticum可保护肠道屏障功能并抑制促炎反应
已知肠道屏障功能障碍和细菌易位可促进结肠肿瘤的发生。在这方面,作者利用AOM/ DSS诱导的CRC小鼠,研究了C. maltaromaticum抑制的肠道肿瘤发生过程中肠道通透性的时间变化,因为这种疾病模型显示出广泛的肠道屏障损伤。给C57BL/6小鼠腹腔注射10 mg/kg AOM,然后给予1% DSS,持续1周。然后用C. maltaromaticum处理小鼠。以BHI和大肠杆菌分别作为空白对照和细菌对照。结肠镜检查用于监测结肠肿瘤的形成,测定肠道通透性是在多个时间点进行的(从肉眼没有肿瘤到肿瘤完全发展)。作者观察到C. maltaromaticum在未观察到宏观肿瘤的最早时间点显著降低了血清FITC-葡聚糖水平(图4A),表明C. maltaromaticum改善肠道通透性的作用早于抑制肠道肿瘤发生。这一观察结果与最近的一项研究报道的屏障功能障碍和细菌易位直接促进结直肠癌形成相一致C. maltaromaticum处理过福尔马林固定的AOM/ DSS诱导的结肠组织中细菌总负荷也有所减少(图4B),表明细菌渗透上皮细胞的减少与C. maltaromaticum的肿瘤抑制作用有关。此外,C. maltaromaticum灌胃显著增加了Apcmin/+小鼠结肠紧密连接蛋白TJP1 (ZO-1)、OCLN (Occludin)和CDH1 (E-cadherin)的表达(图4C)。用C. maltaromaticum灌胃Apcmin/+小鼠血清脂多糖(LPS)水平也显著降低(图4D)。透射电镜和阿利新蓝/周期性酸-希夫染色进一步表明,C. maltaromaticm降低了细胞-细胞连接处宽度,增加了含黏液层厚度(图4E)。同样,在aom诱导的CRC模型中,C. maltaromaticum的紧密连接基因表达增加(图4F),黏液层增厚(图4G)。

图4 在小鼠CRC模型中,C. maltaromaticum可保护肠道屏障功能并抑制促炎反应
肠道屏障的破坏与炎症有密切的关系。为了进一步揭示C. maltaromaticum改善炎症反应的作用,作者建立了急性DSS结肠炎模型,6周龄雌性C57BL/6小鼠给予1% DSS处理1周,然后C. maltaromaticum处理3周。作者观察到,与BHI和大肠杆菌处理的小鼠相比,在结肠镜检查下,C. maltaromaticum处理的小鼠结肠炎症/损伤(粘膜水肿和红斑)减少,结肠缩短减少,腹泻(即大便含水量%)明显改善(图4H和4I)。此外,使用炎症反应和自身免疫PCR阵列,观察到C. maltaromaticm处理小鼠结肠组织中炎症相关基因的显著下调以及肠道屏障功能的改善(图4J)。这些结果表明,C. maltaromaticum在CRC发展过程中可以维持肠道屏障功能,减少粘膜炎症。
6. C. maltaromaticum通过与其他肠道微生物的代谢交叉喂养来促进肠道维生素D的产生
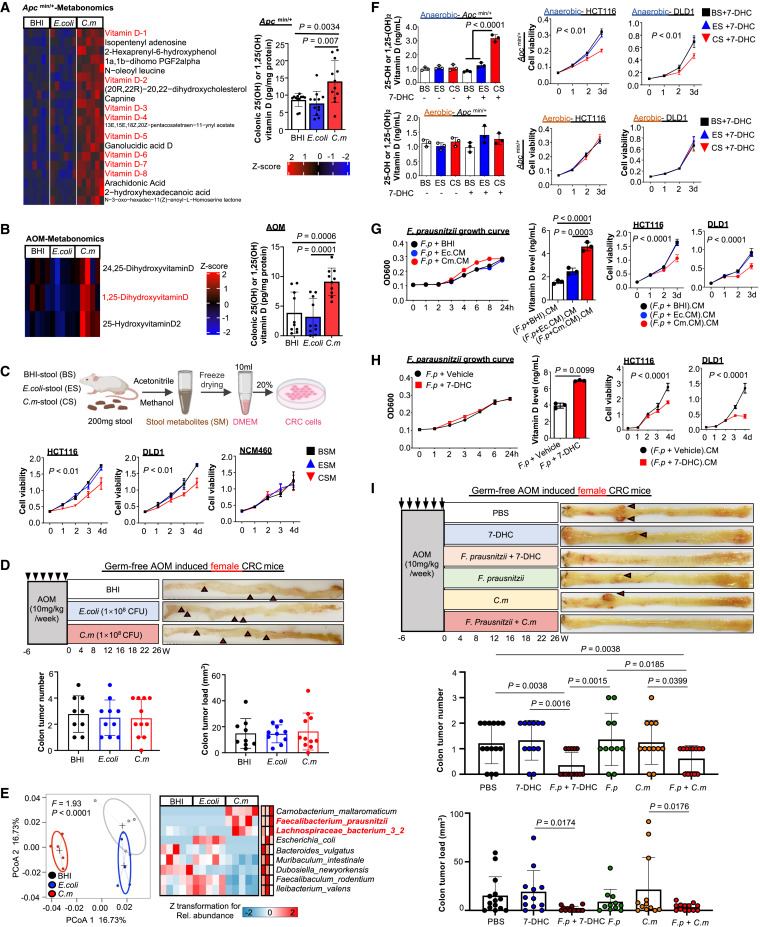
图5 C. maltaromaticum通过与其他肠道微生物的代谢交叉喂养来促进肠道维生素D的产生
采用液相色谱-串联质谱(LC-MS/MS)对Apcmin/+小鼠粪便代谢产物进行了分析。在C. maltaromaticum处理的小鼠中,肠道代谢物的总体组成发生了显著的变化(图5A),与两个对照组相比,发现19种代谢物富集(图5A)。在维生素D代谢产物中,1,25-二羟基维生素D3 (1,25(OH)2VD3)是活性形式,在CRC抑制中起重要作用。25-羟基维生素D3 (25- OHVD3)是1,25(OH)2VD3的直接前体。通过ELISA检测,研究发现C. maltaromaticum显著提高了结肠25- OHVD3 /1,25(OH)2VD3浓度(图5A)。作者成功验证了aom诱导的CRC模型的粪便代谢物中维生素D代谢物的富集,包括1,25(OH)2VD3 (图5B)。C. maltaromaticum显著提高了结肠25- OHVD3 /1,25(OH)2VD3水平(图5B) 。这些结果表明,C. maltaromaticum增加了结肠组织中维生素d相关代谢物的丰度。
为了研究C. maltaromaticum是否直接产生明显的抗crc作用,作者从Apcmin/+小鼠模型中提取粪便代谢物。与BHI- (BSM)或大肠杆菌灌胃小鼠(ESM)的粪便代谢物相比,C. maltaromaticum灌胃小鼠(CSM)的粪便代谢物显著抑制结肠癌细胞系(HCT116和DLD1)的活力(图5C)。对正常上皮细胞系NCM460无抑制作用。然后给AOM诱导的无菌结直肠癌小鼠注射了C. maltaromaticum。由此推测,C. maltaromaticum在无菌小鼠中没有产生明显的抗CRC作用(图5D)。
作者对Apcmin/+小鼠粪便样本进行微生物群分析,以确定C. maltaromaticum是否改变了肠道微生物群组成(图5E)。已报道具有产butyric acid能力的Faecalibacterium prausnitzii和Lachnispiraceae bacterium在C. maltaromaticum灌胃小鼠体内显著富集。与之相反的是,条件致病菌,包括Bacteroides vulgatus和Muribaculum testinale则表现出显著的减少(图5E)。值得注意的是,具有产butyric acid能力的细菌丰度与1,25(OH)2VD3浓度之间存在正相关,这表明C. maltaromaticum可能会调节肠道微生物群以合成维生素D。因此,作者利用体外发酵系统来验证肠道微生物是否有能力将7-DHC转化为下游维生素D代谢物。Apcmin/+小鼠模型的粪便样本在改良的BHI培养基中在好氧和厌氧条件下培养。48 h后,培养的细菌在黑暗中饲喂7-DHC 24 h。然后收集所得培养基进行25-OHVD3 /1,25(OH)2VD3测定。发现C. maltaromaticum灌胃小鼠(CS)的粪便细菌在厌氧条件下(“厌氧CS + 7-DHC”)有效地将刺入的7-DHC转化为25-OHVD3 /1,25(OH)2VD3。所得到的培养基也强烈抑制结直肠癌细胞的活力(图5F)。同样,在有氧条件下,CS没有增加25- OHVD3 /1,25(OH)2VD3水平,也没有抑制CRC细胞活力(图5F)。
代谢交叉喂养是指一种微生物产生的代谢物被另一种微生物作为营养物质利用的现象。在这方面,添加(Cm.CM)促进了F. prausnitizii的生长(图5G),提高了细菌培养基中25- OHVD3 /1,25(OH)2VD3的水平(图5G)。由此产生的培养基强烈抑制CRC细胞活力(图5G)。当F. prausnitzii直接喂食7-DHC时,观察到一致的结果(图5H)。在无菌小鼠中,C. maltaromaticum、F. prausnitzii或7-DHC单独不能抑制AOM诱导的结肠肿瘤形成,而C. maltaromaticum或7-DHC与F. prausnitzii联合使用可恢复抗CRC作用(图5I) ,表明L. bacterium也参与了与C. maltaromaticum的代谢交叉喂养以抑制CRC,但其作用与F. prausnitzii相比似乎较小。
7. C. maltaromaticum在两种小鼠CRC模型中诱导结肠VDR活性
1,25(OH)2VD3通过VDR介导其对结肠细胞的抗增殖作用,VDR是一种核配体依赖性转录因子通过RNA测序(RNA-Seq)鉴定的差异表达基因的基因集富集分析(GSEA)显示,C. maltaromaticum处理的Apcmin/+小鼠结肠组织中VDR信号显著富集(图6A)。这一发现在TCGA队列中得到了验证,在TCGA队列中,肿瘤内C. maltaromaticum丰度较高的CRC患者表现出更高的VDR mRNA水平(已知维生素D3以正反馈方式诱导VDR表达26)(图6B)。因此,RNASeq显示,20个VDR靶基因在C. maltaromaticum处理的Apcmin/+小鼠中表达上调(图6C) 。同样,在C. maltaromaticum处理的Apcmin/+小鼠结肠组织中,VDR上调得到证实(图6D)。在C. maltaromaticum处理的Apcmin/+小鼠结肠组织中,众所周知的VDR靶基因CAMP水平升高(图6D)和VDR核易位(图6E)进一步证实了VDR的激活。在AOM诱导的CRC模型中证实了C. maltaromaticum对VDR的激活,VDR和CAMP表达增加(图6F), VDR核易位增加(图6G)。这些结果表明,C. maltaromaticum可激活人和小鼠肠道VDR信号。
随后,作者检查了C. maltaromaticum诱导结肠VDR活性是否需要其他肠道微生物。CSM处理的HCT116细胞的RNA-Seq显示VDR信号和一组VDR靶基因上调(图6H)。此外,编码降解1,25(OH)2VD3酶的CYP24A1显著降低,而编码1,25(OH)2D3生物合成酶之一的CYP2R1升高。CSM在CRC细胞中通过诱导CAMP和VDR核易位进一步证实了VDR活化的增强(图6I)。此外,在两种小鼠CRC模型中,暴露于“厌氧CS + 7-DHC”培养基的细胞中,观察到VDR和CAMP的诱导(图6J), VDR核易位的增强(图6K) ,经(Cm.CM)喂养的F. prausnitzii培养基诱导VDR和CAMP显著增加(图6L)。当F. prausnitzii直接饲喂7-DHC时,观察到一致的结果(图6M)。
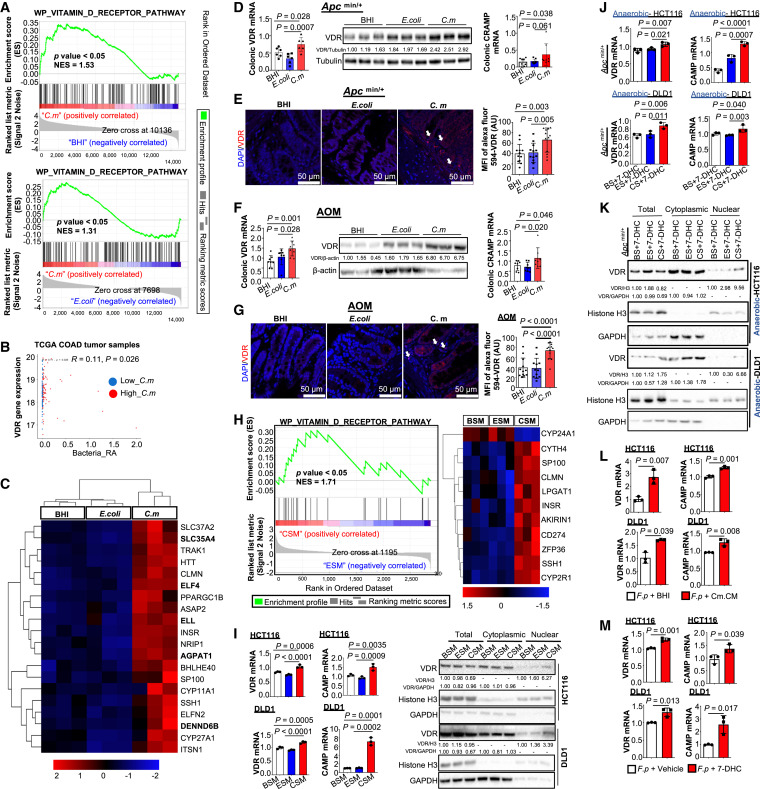
图6 C. maltaromaticum在两种小鼠CRC模型中诱导结肠VDR活性
8. C. maltaromaticum抑制CRC的作用需要VDR信号
作者使用TEI-9647进行VDR抑制,以确定C. maltaromaticum在CRC抑制中的VDR依赖性。TEI-9647 (40 nM)预处理细胞12 h,足以消除1,25(OH) 2VD3诱导的VDR mRNA表达(图S7A)。使用相同的方案,TEI-9647消除了C. maltaromaticum - Apcmin/+小鼠胃灌胃的“厌氧CS + 7-DHC”培养基对CRC细胞增殖的抑制作用以及对VDR和CAMP mRNA的诱导作用(图7A)。用AOM诱导的CRC模型的粪便发酵系统培养基观察到一致的结果(图7B)。此外,我们用TEI-9647 (10 mg/kg,每周两次)处理Apcmin/+小鼠,然后灌胃BHI、大肠杆菌和C. maltaromaticum。组织收获前进行小鼠结肠镜检查。观察到,在TEI -9647处理的小鼠中,C. maltaromaticum的抗crc作用消失(图7C)。C. maltaromaticum也未能诱导结肠Vd表达(图7D)。为了巩固C. maltaromaticum抗CRC作用的VDR依赖性,作者使用CRISPR完全敲除CRC细胞中的VDR(图S7B),发现“厌氧CS + 7-DHC”(图7E)和“厌氧CS + CM”的抗CRC作用。C. maltaromaticum灌胃Apcmin/+小鼠和AOM诱导的结直肠癌小鼠的CM”(图7F)培养基在VDR-KO-HCT116和VDR-KO-DLD1细胞中消失。这些数据表明,C. maltaromaticum的抗CRC作用依赖于VDR。

图7 C. maltaromaticum抑制CRC的作用需要VDR信号
结论:
这篇项研究揭示了C. maltaromaticum在女性肠道定植和抗CRC作用,这种性别偏向的肠道定植是通过雌激素应答性的结肠SLC3A2介导的。C. maltaromaticum的抗CRC作用依赖于宿主VDR信号的激活,其中C. maltaromaticum给药后增加的F. prausnitzii直接将C. maltaromaticum衍生的7-DHC转化为下游维生素D代谢物。综上所述,C. maltaromaticum可能作为一种基于益生菌的预防女性结直肠癌的药物,并强调了微生物群性别特异性差异在开发益生菌疗法中的重要性。
实验方法
DNA提取和纯化,细胞-细菌条件共培养,shotgun宏基因组分析,代谢组学分析,RNA测序(RNA- seq),逆转录定量PCR (RT-qPCR),WB测序,免疫荧光(IF)染色,癌症基因组图谱(TCGA)队列中RNA-Seq数据集的基因表达谱分析,蛋白提取,蛋白裂解物的提取,生物素pull-down实验,双分子荧光互补(BiFC)测定,ChIP-qPCR,细菌荧光
参考文献
Li Q, Chan H, Liu WX, Liu CA, Zhou Y, Huang D, Wang X, Li X, Xie C, Liu WY, Wang XS, Ng SK, Gou H, Zhao LY, Fong W, Jiang L, Lin Y, Zhao G, Bai F, Liu X, Chen H, Zhang L, Wong SH, Chan MTV, Wu WKK, Yu J. Carnobacterium maltaromaticum boosts intestinal vitamin D production to suppress colorectal cancer in female mice. Cancer Cell. 2023 Aug 14; 41(8):1450-1465.e8. doi: 10.1016/j.ccell.2023.06.011. Epub 2023 Jul 20. PMID: 37478851.






