LncRNA MGCG-胶质母细胞瘤的治疗靶点
胶质母细胞瘤(GBM)是成人最常见的原发性恶性脑癌。lncRNAs在癌症的发生发展中发挥着重要作用。为了阐明lncRNA在胶质母细胞瘤发展中的作用,我们使用了来自GBM患者的三个新分离的肿瘤组织样本和来自创伤患者的三个正常脑组织样本,进行了高通量RNA测序以获得转录本。随后,一种lncRNA MGCG在GBM中未被报道,被发现与患者预后相关。生物信息学分析结果显示,MGCG与自噬相关,且与自噬相关基因ATG2A的表达呈正相关。质谱数据表明,hnRNPK蛋白是与MGCG相互作用的直接靶点,MGCG/hnRNPK通过增强ATG2A的翻译和自噬促进GBM的发展。综上所述,本研究表明MGCG具有促进GBM发展的潜力,可能成为肿瘤分子诊断和治疗的候选药物。本研究于2023年7月发表于“Cell Death and Disease”(IF=9.0)上。
技术路线
结果
1)MGCG在GBM中高水平表达,与预后不良相关
为了获得lncRNAs和mRNA的表达谱,我们获得3个GBM组织样本和3个正常脑组织样本,并进行高通量RNA测序(GSE153692)。RNA测序结果显示,MGCG在GBM组织中的表达明显高于正常组织(图1A)。接下来,我们通过RT-qPCR验证了MGCG在22个正常脑组织样本(颅脑外伤患者)和47个GBM组织样本中的表达,结果表明MGCG在GBM组织中的表达水平明显高于正常组织(图1B)。RT-qPCR结果显示,MGCG在GBM细胞中的表达明显高于HEB细胞(图1C)。为了确定MGCG的细胞定位,我们对细胞核和细胞质RNA进行了RT-qPCR,数据显示MGCG优先位于细胞核中(图1D)。接下来,我们在LN229细胞中进行RNA FISH验证这些结果(图1 E)。RNA FISH结果显示,MGCG在GBM中与正常组织相比上调(图1F)。我们评估了MGCG表达与GBM患者预后之间的相关性。Kaplan-Meier分析和MGCG表达与临床患者生存期的相关性分析结果显示,MGCG表达较高的患者总体生存期较差(图1G)。综上所述,这些数据提示MGCG上调在GBM组织中普遍存在,且与预后不良相关。

2)MGCG促进GBM的肿瘤进展和自噬
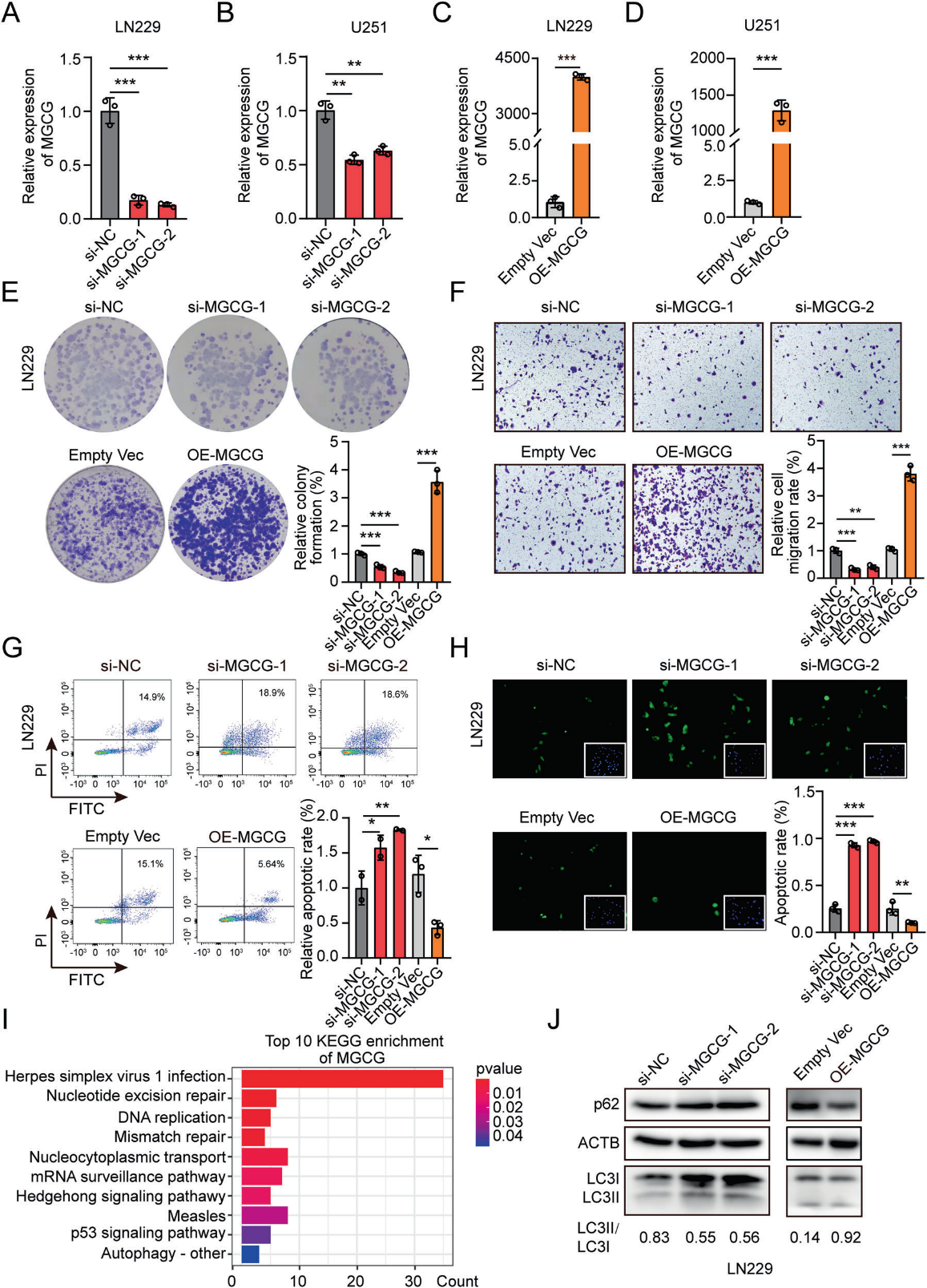
为了探索MGCG的生物学功能,我们设计了三种独立的siRNA来对抗MGCG,我们选择了两种siRNA来有效地抑制MGCG在LN229和U251细胞中的表达(图2A, 2B)。我们还构建了一个过表达质粒,并成功地在LN229和U251细胞中过表达MGCG(图2C, 2D)。集落形成实验的结果表明,MGCG的缺失显著抑制了细胞增殖。而MGCG的过表达促进了细胞活力(图2E)。我们在Transwell实验中证实,MGCG的下调显著降低了细胞的迁移能力;然而,MGCG过表达增加了细胞的迁移能力(图2F)。此外,流式细胞术和TUNEL实验结果表明,MGCG的敲低诱导细胞凋亡,上调MGCG的表达抑制细胞凋亡(图2G,2 H)。基于RNA测序数据研究MGCG在GBM中的作用,我们进行了生物信息学分析,并证明MGCG与自噬有关(图2I)。western blotting结果显示,MGCG过表达增加了LC3-II结合和p62降解,表明MGCG诱导了GBM细胞的自噬(图2J)。结果表明,MGCG的表达与GBM的恶性表型相关,MGCG促进了GBM的自噬。
3)MGCG通过调节ATG2A的表达促进GBM的进展
许多研究表明,自噬促进GBM的发展。一致地,我们证明了自噬在过表达MGCG的GBM细胞中升高。ATG2A是一种与自噬相关的基因,我们已经知道敲低ATG2A会抑制自噬,但对ATG2A的研究很少。RT-qPCR数据证明,在GBM组织临床样本中,MGCG的表达与ATG2A呈显著正相关(图3A)。接下来,我们敲低了ATG2A,发现LN229细胞中LC3-II与LC3-I的蛋白水平比值降低,p62蛋白水平升高(图3B)。为了研究MGCG是否调控ATG2A的表达,我们敲低了MGCG,分别根据RT-qPCR和western blotting的数据证实了ATG2A mRNA和蛋白的表达水平降低(图3C, 3D)。我们通过RT-qPCR验证了ATG2A在27个正常组织样本和42个GBM组织样本中的表达,证实了ATG2A在GBM组织中的表达水平显著升高(图3E)。此外,根据TCGA数据库,ATG2A的低表达与患者总生存率的提高相关(图3F)。此外,我们还研究了ATG2A对GBM进展的影响。首先,我们通过RT-qPCR和western blot检测ATG2A在GBM细胞中的敲除效率(图3G-3J)。ATG2A的下调抑制了GBM细胞的增殖(图3K)和迁移(图3L),促进了GBM细胞的凋亡(图3M)。然后,我们将含有ATG2A siRNA的质粒和过表达MGCG的质粒共转染到LN229和U251细胞中,我们证明了ATG2A的下调抑制了自噬,过表达MGCG恢复了自噬的抑制(图3N)。敲低ATG2A可消除MGCG过表达对细胞增殖、迁移和凋亡的影响(图3O-Q)。这些结果表明MGCG调节ATG2A的表达,促进细胞自噬。

4)MGCG直接与hnRNPK相互作用,促进ATG2A的翻译
为了进一步探索MGCG在GBM中的作用机制,我们使用特异性生物素标记的MGCG探针进行了RNA下拉实验。与阴性探针相比,银染色结果显示了几个额外的蛋白质条带,质谱分析鉴定出hnRNPK是与MGCG结合的主要蛋白质(图4A,B)。RIP实验的数据证实了MGCG和hnRNPK之间的直接相互作用(图4C)。FISH和IF数据显示,MGCG和hnRNPK在GBM细胞中共定位(图4D)。western blot分析结果显示,MGCG的敲低或MGCG的过表达分别抑制或升高了GBM细胞中hnRNPK的蛋白水平(图4E)。为了确定hnRNPK是否可以调节ATG2A的表达,我们进行了RT-qPCR,并证明了hnRNPK敲低后ATG2A的RNA水平没有变化(图4F)。western blotting结果显示,当hnRNPK被敲低时,ATG2A蛋白水平下调(图4G)。为了确定hnRNPK是否调控ATG2A在GBM中的翻译,我们使用RIP证明hnRNPK与ATG2A mRNA结合(图4H),RNA下拉结果表明hnRNPK与ATG2A mRNA之间存在相互作用(图4I)。接下来,我们进行了IP分析,证实了hnRNPK在GBM中与EIF4B结合(图4J)。我们通过far western blot进一步证实了hnRNPK与EIF4B之间的相互作用(图4K)。western blot结果显示,敲低EIF4B抑制ATG2A蛋白水平;然而,在LN229细胞中,下调EIF4B后,ATG2A的RNA水平没有变化(图4L, 4M)。敲低hnRNPK降低ATG2A蛋白水平;然而,过表达MGCG消除了hnRNPK敲低的作用(图4N)。这些结果表明,MGCG通过结合hnRNPK促进了ATG2A的翻译。

5)DNA低甲基化上调GBM中MGCG的表达
我们探讨了MGCG在GBM中高表达的机制。首先,我们利用UCSC基因组生物信息学网站确定了MGCG中的CpG岛(图5A),数据表明MGCG表达与DNA甲基化之间存在潜在关系。利用甲基化分析软件,我们在MGCG启动子区域检测到一个CpG岛。设计了两组特异性引物来检测该CpG岛DNA甲基化水平的变化(图5B)。接下来,使用甲基化特异性PCR (MSP),我们证明GBM细胞的甲基化水平低于HEB细胞(图5C)。为了进一步探讨MGCG中甲基化变化的机制,我们检测了DNA甲基转移酶(DNMT)在GBM细胞中的表达水平。RT-qPCR数据显示,与HEB细胞相比,DNMT3B在GBM细胞中的表达下调(图5D)。我们用DNMT3B特异性抑制剂DS-437处理LN229和U251细胞,发现MGCG在LN229和U251细胞中的表达增加,表明DNA去甲基化增加了MGCG的表达(图5E)。DNMT3B过表达导致MGCG甲基化水平增加(图5F)。过表达DNMT3B可显著抑制MGCG在GBM细胞中的表达(图5G)。这些发现表明DNMT3B促进了MGCG在GBM细胞中的表达。

6)MGCG/hnRNPK/ATG2A轴促进GBM的进展
为了研究MGCG在体内的作用,将2.5×105荧光素标记的MGCG敲低或sh-NC转导的GBM细胞注射到裸鼠体内,体内肿瘤异种移植实验方案如图6A所示。通过体内生物发光成像追踪肿瘤进展,携带MGCG敲低的GBM细胞的异种移植物在肿瘤生长方面表现出明显的退行(图6B,6C)。MGCG敲低导致小鼠存活率提高(图6D)。RNA FISH数据显示,MGCG敲低小鼠GBM细胞中MGCG表达降低(图6E)。免疫组化(IHC)显示,MGCG敲低后hnRNPK和ATG2A表达降低,cleaved caspase-3水平升高(图6F),这些结果表明MGCG/hnRNPK/ATG2A促进了GBM的进展。

结论
我们发现了一种新的lncRNA-MGCG,作为一种致癌基因,促进GBM的增殖和迁移。接下来,我们验证了MGCG与自噬有关。我们证明MGCG直接与hnRNPK结合,并且MGCG/ hnRNPK促进ATG2A的翻译。因此,本研究揭示了lncRNA调控GBM生长的机制,并确定了GBM治疗的潜在治疗药物靶点。
实验方法
qRT-PCR,FISH,克隆形成实验,transwell,TUNEL实验,流式,WB,Far WB,IF,RNA pull down,RIP,IHC。
参考文献
Chu F, Wu P, Mu M, Hu S, Niu C. MGCG regulates glioblastoma tumorigenicity via hnRNPK/ATG2A and promotes autophagy. Cell Death Dis. 2023 Jul 17;14(7):443. doi: 10.1038/s41419-023-05959-x.






