调节核糖体生物发生——TERT加速BRAF突变诱导甲状腺癌去分化与进展
栏目:最新研究动态
发布时间:2024-01-23
TERT再激活经常发生在人类恶性肿瘤中,尤其是晚期癌症。然而,TERT再激活在癌症进展中的体内功能及其潜在机制尚不完全清楚......
TERT再激活经常发生在人类恶性肿瘤中,尤其是晚期癌症。然而,TERT再激活在癌症进展中的体内功能及其潜在机制尚不完全清楚。在本研究中,作者在小鼠甲状腺上皮中特异性表达了TERT和/或活性BRAF (BRAF V600E)。虽然BRAF V600E单独诱导乳头状甲状腺癌(PTC),BRAF V600E和TERT共同表达导致低分化甲状腺癌(PDTC)。空间转录组分析显示,共表达BRAF V600E和TERT的小鼠肿瘤具有高度异质性,细胞去分化与核糖体生物发生呈正相关。从机制上讲,TERT通过与参与核糖体生物发生的多种蛋白质相互作用,促进核糖体RNA (rRNA)的表达和蛋白质合成。此外,作者发现CX-5461是一种rRNA转录抑制剂,能有效阻断甲状腺癌的增殖并诱导其再分化。因此,TERT通过诱导癌细胞去分化来促进甲状腺癌进展,而核糖体抑制是治疗TERT再激活癌症的潜在策略。本文于2023年8月发表在《Science Advances》IF: 13.6期刊上。
技术路线

主要实验结果
1、TERT再激活在多种癌症中经常发生,预示着较差的预后
由于TERT启动子没有被全外显子测序所覆盖,TERT再激活在癌症基因组学研究中被低估。最近,随着TERT启动子C228T和C250T突变的发现,TERT启动子状态在几项大规模泛癌症测序研究中得到检验。MSK-IMPACT、MSK-MET和China Origimed2020三个包括最丰富的癌症类型和样本的大型队列,分析了TERT启动子区域。考虑到TERT再激活主要通过启动子突变或基因扩增发生,作者扫描了这三个队列中的两种事件,以及癌症中的TERT扩增基因组图谱计划(TCGA)队列。作者发现TERT启动子突变(C228T或C250T)在甲状腺癌、黑色素瘤、膀胱癌、肝癌、胶质瘤和头颈癌中经常发生,而TERT扩增在肺癌、卵巢癌和膀胱癌中常见(图1A)。在不同的癌症类型中,黑色素瘤和甲状腺癌在不同的队列中表现出高度的一致性。此外,在纪念斯隆·凯特琳癌症中心(MSKCC)数据集显示,TERT启动子突变预测甲状腺癌、胶质瘤和膀胱癌的预后较差(图1B)。
作者还研究了503个细胞系,这些细胞系通过全基因组测序和/或靶向测序在癌细胞系百科全书(CCLE)数据集中定义了TERT启动子状态(24)。启动子突变是甲状腺癌和黑色素瘤中TERT激活的主要改变。在这两种癌症类型中,来自转移灶的细胞系显示出更高频率的TERT启动子突变(图1C),表明TERT激活在癌症进展和转移中的潜在功能。
TERT启动子突变(C228或C250)的频率与甲状腺癌的病理分期和分化状态有关。分化型甲状腺癌与良好的生存率相关,TERT启动子突变的发生频率为4%至12%。同时,约50%预后不良的低分化甲状腺癌(PDTC)和间变性甲状腺癌(ATC)存在TERT启动子突变(图1D)。值得注意的是,大多数TERT启动子突变的肿瘤也表现出BRAF或NRAS突变(图1E)。TCGA计划建立了甲状腺分化评分(TDS)系统,通过16个基因(TG, TPO, PAX8, DIO1, DIO2, DUOX1, DUOX2, FOXE1, GLIS3, NKX2-1,SLC26A4, SLC5A5, SLC5A8, THRA, THRB, TSHR)的mRNA表达水平评估甲状腺癌分化水平。表达分析显示,在CCLE甲状腺癌细胞系中,TERT表达水平与TDS评分呈负相关(R = - 0.73, Spearman P = 0.021)(图1F)。总之,这些结果表明,TERT再激活,特别是启动子突变,在各种癌症中经常发生,并与肿瘤进展和不良预后相关。

图1 TERT再激活预示着更糟糕的预后
2、TERT加速BRAF v600e诱导的甲状腺癌进展
如上所述,TERT启动子突变通常与BRAF或NRAS激活突变同时发生(图1E)。作者推测,TERT过表达可能会促进已有致癌信号的癌症进展,而不是启动癌变。先前的研究表明,TERT在体外诱导增殖、侵袭和许多其他肿瘤样行为。
为了阐明体内TERT再激活与肿瘤进展之间的潜在机制,作者通过将Loxp -stop- loxp- Tert - 3xFlag - IRES - EGFP序列插入Rosa26等位基因(RsmTERTLSL/+小鼠;图1G)建立了条件TERT转基因小鼠模型。然后将小鼠与TPOCreERT2小鼠杂交,产生甲状腺特异性Tert转基因小鼠模型(TC小鼠),该模型模拟肿瘤中TERT的高表达。然后,作者采用先前使用的甲状腺癌小鼠模型,通过在甲状腺滤泡细胞(BC小鼠)中表达BRAF V600E诱导,与Rs-mTERTLSL/+小鼠杂交,生成BTC小鼠(图1G)。
随访超声显示,在诱导后的前7 ~ 10个月,BC和BTC甲状腺肿瘤的生长模式无显著差异(图1,H ~ J)。然而,在10至14个月后,BTC小鼠的甲状腺肿瘤生长速度远快于BC小鼠(图1,H至J)。BTC和BC小鼠的肿瘤进展也通过18F-FDG正电子发射断层扫描-计算机断层扫描(PET-CT)进行了分析。12个月BTC甲状腺肿瘤的最大标准化摄取值(SUVmax)远高于12个月BTC和8个月BTC小鼠,而12个月的BC和8个月的BTC小鼠FDG SUVmax相似(图1K)。与上述结果一致,BTC组预后较差,中位生存期为406天,而BC组为486.5天(图1L)。总之,这些结果表明,当BRAF和TERT同时被激活时,肿瘤进展更快。
3、TERT促进BRAF v600e诱导的甲状腺癌的去分化
与BC小鼠相比,BTC小鼠肿瘤生长加快,预后更差(图1,J和L)。作者随后表征了不同阶段肿瘤的形态和分子变化。超声检查、解剖后的大体外观、hematoxylin和伊红(H&E)病理显示,大多数BTC肿瘤进展为10 ~ 14个月出现较大的PDTC(15 / 17, 88.2%)。与此形成鲜明对比的是,尽管一些老年BC小鼠(16 - 18个月)的肿瘤进展为PDTC(5 / 14, 35.7%),但大多数BC甲状腺肿瘤仍然是乳头状甲状腺癌(PTCs)(图2A)。免疫组化(IHC)结果显示,BC小鼠肿瘤中甲状腺癌标志物高表达,包括甲状腺球蛋白(TG)、甲状腺转录因子-1(TTF-1)、配对盒8(PAX8)、钠碘同向转运体(NIS;Slc5a5)和CK19。这些标志物已广泛用于临床甲状腺癌的鉴定。然而,TG和TTF-1在BC肿瘤中的表达低于邻近的正常滤泡细胞(图2A)。另一方面,BTC小鼠的肿瘤表达低水平的TG、TTF-1、NIS和PAX8,高水平的Ki67,表明过度增殖和去分化(图2A)。从异位Flag-TERT的表达可以看出,BTC小鼠的肿瘤起源于甲状腺滤泡细胞(图2A)。
晚期甲状腺癌经常转移到远处器官,包括肺。作者观察到BTC肺内广泛的转移灶(图2B)。转移灶细胞SP-C(AT2肺细胞的标志物)和TG呈阴性,TTF-1呈阳性,PAX8和NIS呈弱阳性,表明这些转移细胞起源于甲状腺(图2C)。
作者分析BC和BTC肿瘤的转录组,以确定细胞去分化和肿瘤转移的潜在机制。收集BC和BTC小鼠(n = 4和5)的肿瘤,进行RNA测序(RNA-seq)。主成分分析表明BTC和BC甲状腺肿瘤的基因表达谱明显不同(图2D)。整体评估显示BTC肿瘤的TDS评分要低得多(图2E)。在BTC肿瘤中,甲状腺特异性基因如Tg、Pax8、Tshr和Tpo下调,而多种肿瘤基因如Lgr5、Clu、Mmp9、Pappa2、Mki67和Arg1上调(图2F)。作者能够从BTC肿瘤(312BTC)中分离和永生化原代肿瘤细胞。这些结果与免疫组化分析一致,表明BTC小鼠肿瘤具有高增殖和去分化表型。
为确定与BTC小鼠从PTC到PDTC进展相关的关键癌症途径,对标记基因集进行基因集富集分析(GSEA)和基因集变异分析(GSVA)。几个癌症标志,如E2F靶点、G2-M检查点、上皮-间质转化、炎症反应、程序性细胞死亡1配体1(PD-L1)表达和程序性细胞死亡蛋白1(PD-1)检查点通路,在BTC肿瘤中被激活,而氧化磷酸化和脂肪酸代谢则被下调(图2、G、H)。此外,KEGG富集分析差异表达基因表明,细胞因子-细胞因子受体相互作用、磷脂酰肌醇3-激酶(PI3K)-AKT信号通路、白细胞介素-17(IL-17)信号通路、细胞外基质(ECM)-受体相互作用和肿瘤坏死因子(TNF)信号通路在BTC肿瘤中富集(图2I)。
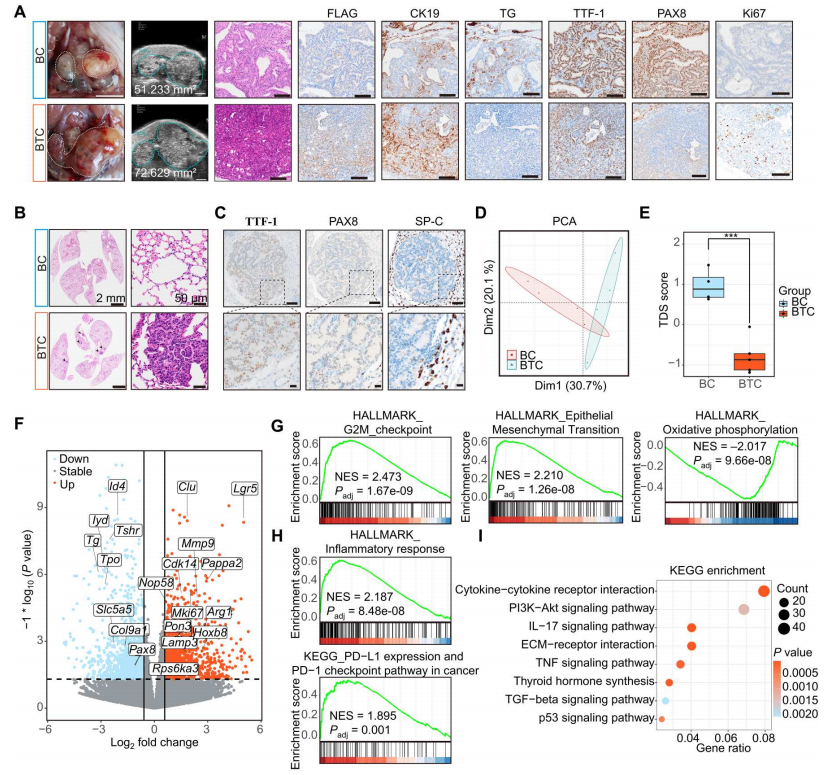
图2 TERT促进BRAF突变诱导的甲状腺癌的去分化
4、BTC肿瘤的空间转录组分析揭示了rRNA代谢相关的去分化
为了进一步探讨TERT在BRAF V600e诱导的甲状腺癌去分化中的作用,作者对来自BTC小鼠的具有高度异质性的肿瘤进行了Visium 10X空间转录组(ST)分析。肿瘤具有正常滤泡细胞、PTC和PDTC的特征区域,可能代表了甲状腺癌的整个发展轨迹(图3A)。
为探索甲状腺细胞的转录异质性,作者重新聚集了637个甲状腺上皮斑点(图3B和C)。簇0(c0)中的细胞表达高水平的Tg和Tpo,标志着分化良好的滤泡细胞(图3D)。一些TDS特征基因如Slc5a5、Thrb、Duox1、Duox2和Tshr在ST分析中未检测到;因此,作者定义一个以Tg、Tpo、Dio1、Fhl1和Sorbs2为特征基因的mST_TDS(小鼠ST TDS)。mST_TDS评分显示,c0是分化较好的聚类,其次是c1和分化较差的c2/c3/c4/c5(图3E)。
为了追踪甲状腺簇的进化动态,作者使用Monocle3进行了轨迹分析,并将分化良好的滤泡细胞c0作为轨迹起始根(图3F)。在UMAP投影显示,甲状腺细胞表现出“c0-c1/c2/c3/c4-c5”的进化模式,其中c0和c5分别收集在轨迹路线的起点和终点,其他四个簇分布在两者之间(图3G)。因此,作者可以假设甲状腺细胞从c0(表示为state1)进化,通过中间簇c2/c3/c4(state2),最终去分化为c5(state3)。为进一步确定分子途径的改变,使用AUCell计算三种状态的Reactome富集分数(图3H)。与c0正常甲状腺表现一致,state1富集于甲状腺素生物合成途径。State2呈现介于state1和state3之间的中间状态,主要富集ECM和免疫相关通路。有趣的是,state3在端粒维持中比stat1/2更活跃,并且在rRNA加工和翻译途径中富集,这反映了核糖体的生物发生和活性(图3H和I)。此外,细胞对缺氧和饥饿的反应等物理应激也在state3细胞中丰富(图3H)。这一观察结果表明,核糖体生物发生在c05/state3细胞中发挥重要作用。
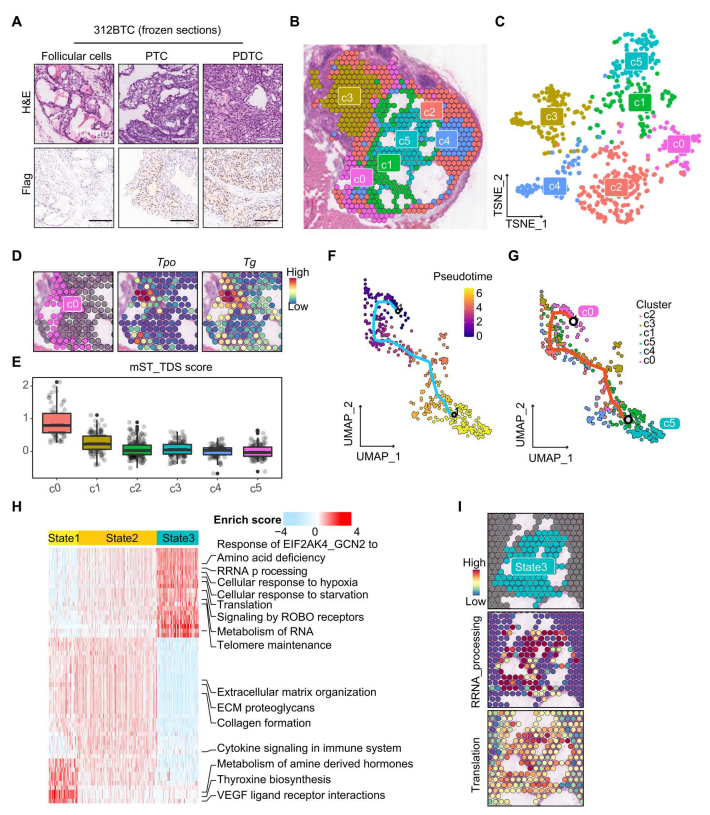
图3 空间转录组分析揭示了BTC小鼠甲状腺的异质性
5、TERT诱导rRNA合成和核糖体活性
细胞外信号调节激酶(ERK)激活被认为是rRNA转录的上游信号,可能通过上游结合转录因子(UBF)的磷酸化。此外,TERT已被证明可以诱导rRNA和tRNA转录。作者评估NTHYCTL、NTHY-B(BRAF V600E)和NTHY-BT(BRAF V600E)细胞中pre-45SrRNA水平。作者发现BRAF V600E上调pre-45SrRNA转录,并进一步被TERT诱导。因此,TERT和BRAF V600E可能共同促进核糖体的生物发生。
在癌细胞中,核糖体经常失控,导致不受控制的增殖和转移。探索TERT再激活是否与癌症中核糖体活性相关,作者分析CCLE数据集中与TERT共表达的基因。与TERT表达呈正相关的基因(Spearman R > 0.25, P < 0.01)参与细胞周期进程和rRNA代谢(图4A)。核糖体由rRNA和核糖体蛋白组成,核糖体的生物发生需要所有RNA聚合酶(Pol I/II/III),以及小核RNA(snoRNA)和参与rRNA过程和成熟的多种其他酶的参与。作者发现在CCLE数据库中TERT与rRNA转录调控因子UBTF、POLR3E和FBL以及rRNA外切酶EXOSC2呈正相关(图4B)。然后作者分析了最近的甲状腺癌单细胞RNA-seq(scRNA-seq)数据集。由于在scRNA-seq中没有有效检测到TERT,因此作者使用Reactome_端粒维持富集评分作为TERT活性的替代品。在甲状腺细胞(n = 42,708个细胞)中,Reactome_端粒维持富集评分与rRNA加工(R = 0.53, P < 2.2 × 10−16)和翻译(R = 0.56, P < 2.2 × 10−16)呈正相关(图4C)。这些结果表明TERT与核糖体代谢密切相关。
作者进一步检查TERT对不同癌细胞中rRNA的影响。在K1(甲状腺癌)、OCM1(黑色素瘤)和BCPAP(甲状腺癌)细胞(均有TERT启动子C228T或C250T突变)中TERT敲低后,观察到rRNA水平急剧下降(图4D至F)。rRNA的下调不仅发生在Pol I转录的18S、5.8S和28S中,也发生在Pol Ⅲ转录的5S rRNA中(图4E)。相反,异位TERT在甲状腺细胞系MDA-T41和结肠癌细胞系RKO和HT-29[均具有野生型(WT) TERT启动子]中显著诱导rRNA表达(图4F)。由于80%以上的细胞RNA是rRNA,因此采用乙基尿苷(EU)法标记新生RNA,尤其是rRNA。在K1和OCM1细胞中,TERT敲低显著抑制细胞核新生rRNA合成,而纤维蛋白(FBL;Cajal体成分)没有改变(图4G到J)。总之,这些结果表明TERT是最佳rRNA合成所必需的。
由于TERT是端粒酶的主要亚基之一,作者想知道端粒酶活性是否参与rRNA的合成。作者发现,在BCPAP细胞中,TERC(端粒酶的另一个主要成分)的敲低导致rRNA表达减少(图4K),表明TERT对rRNA合成的调控至少部分依赖于端粒酶活性。
核糖体的主要功能是翻译,以mRNA为模板合成蛋白质。由于TERT可以增强rRNA转录,作者想知道TERT是否可以调节翻译过程。在作者的ST数据和CCLE数据集中,高TERT表达与翻译相关(图3H和4L)。为了验证TERT在翻译中的作用,作者采用了两种方法来检验翻译效率。有趣的是,表面翻译感知(SUnSET)实验表明,TERT敲低导致BRAF和TERT启动子突变的K1和SW1736细胞中新生蛋白的产生减少(图4M)。在双顺反子报告实验中,TERT的敲低抑制了5’帽和内部核糖体进入位点(IRES)依赖的翻译效率(图4N)。因此,在TERT再激活的癌细胞中,蛋白质合成似乎依赖于TERT。

图4 TERT诱导rRNA合成和核糖体活性
6、TERT与核糖体支架相互作用并增强MTORC1活动
功能性端粒酶复合体除TERT和TERC外,还包括DKC1和核糖体生物发生因子1(PES1)等多种组分。DKC1和PES1与核糖体功能有关。因此,作者探究TERT是否通过与rRNA代谢相关蛋白相互作用参与核糖体途径。作者采用免疫沉淀和质谱法来鉴定TERT的潜在结合伙伴。已经确定参与RNA分解代谢过程、核糖体生物发生、翻译控制、rRNA加工和端粒维持的几种蛋白质(图5A)。此外,TERT与参与酵母和人pre-rRNA加工的Bystin Like (BYSL)之间的相互作用在人胚胎肾(HEK) 293T和甲状腺癌细胞K1中都被鉴定出来(图5B)。此外,作者在K1、HEK293T和小鼠原发性甲状腺癌细胞系312BTC中验证TERT与BYSL以及EIF2亚基之间存在蛋白相互作用(图5C)。总的来说,这些结果表明TERT可能通过与已知的核糖体调节剂相互作用来调节核糖体的生物发生。
PI3K-AKT和MTORC1信号通路在调节核糖体的蛋白质合成中起主要作用。在作者的整体和空间转录组分析中,PI3K-AKT和MTORC1信号通路在BTC肿瘤中富集(图5D)。与此一致的是,参与MTORC1通路的多个基因,如Rpn1、Xbp1、Eif2s2,在BTC组中上调(图5E)。此外,甲状腺癌的scRNA-seq数据显示,端粒维持与甲状腺细胞中MTORC1介导的信号传导存在显著相关性(R = 0.43, P < 2.2× 10−16)(图5F)。此外,作为MTORC1激酶活性的读数,p-S6水平在BTC小鼠肿瘤中显著增强(图5G)。为了进一步研究TERT在甲状腺癌MTORC1信号传导中的作用,作者在MDA-T41细胞中表达WT-TERT或DN-TERT(无端粒酶活性的突变体),并分析MTORC1已知下游效应物的磷酸化(图5H和I)。与体内实验结果一致,WT-TERT的表达有效地诱导了S6和S6K的磷酸化,特别是在血清饥饿条件下(图5I和J)。因此,MTORC1也可能参与TERT对核糖体的激活。

图5 TERT与核糖体支架相互作用,增强MTORC1活性
7、靶向抑制rRNA转录可阻断肿瘤进展
TERT下游的靶向机制,如核糖体生物发生和MTORC1信号传导,可能作为与TERT抑制剂相比副作用更小的替代抗肿瘤策略。作者分析癌症药物敏感性基因组学(GDSC)数据集,发现TERT表达水平较高的细胞对CX-5461更敏感,CX-5461是一种Pol Ⅰ介导的rRNA转录抑制剂,在正常体细胞中耐受。CX-5461呈现出与之前的端粒酶靶向药物如BIBR 1532和端粒酶抑制剂IX类似的模式(图6A)。采用BRAF V600E和TERT启动子共突变体BCPAP和OCM1细胞以及小鼠312BTC细胞检测CX-5461的作用。CX-5461以剂量依赖的方式抑制癌细胞增殖(图6B至D)。随后建立BCPAP, OCM1和小鼠611BTPC(Trp53失活的312BTC细胞)皮下肿瘤模型,并口服CX-5461在体内检测CX-5461的抗肿瘤作用。作者发现CX-5461在所有三种模型中都有效地抑制了肿瘤生长,并且在所测试的小鼠中没有或轻微的体重减轻(图6E至J)。此外,在CX-5461治疗后,肿瘤中Ki67的表达也降低了(图6K至C)。综上所述,这些结果表明CX-5461能够有效抑制BRAF突变和TERT再激活细胞的增殖。
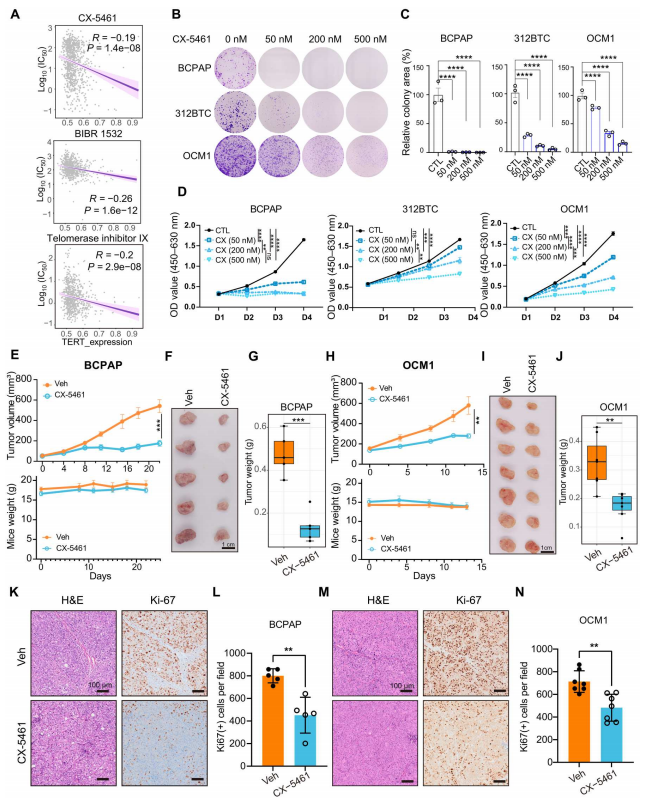
图6 CX-5461抑制多发性肿瘤进展
8、CX-5461诱导甲状腺癌再分化
放射性碘(RAI)治疗被认为是转移性甲状腺癌的一线治疗方法。然而,几乎所有的PDTC和ATC,以及一些分化良好的甲状腺癌,由于功能性甲状腺滤泡标志物尤其是碘转运蛋白NIS的表达减少,不能有效地吸收碘。这些患者被归类为RAI难治性,而难治RAI是甲状腺癌相关死亡的主要原因之一。鉴于TERT在肿瘤进展中的主要作用是诱导肿瘤去分化,阻断TERT或其下游效应物可能导致肿瘤分化。
因此,作者评估CX-5461对甲状腺癌细胞分化标志物的影响。在CX-5461处理24或48小时后,K1、BCPAP和SW1736细胞中PAX8、DIO1、THRA、THRB、FOXE1和TSHR的表达水平明显上调(图7A至C)。CX-5461治疗后,K1和SW1736细胞中的NIS和PAX8蛋白表达水平也升高(图7D至F)。随后,作者测试CX-5461治疗是否可以增加甲状腺肿瘤的碘摄取。采用611BTPC同基因肿瘤模型检测CX-5461给药前后肿瘤碘摄取的差异。结果显示,CX-5461治疗诱导了皮下611BTPC肿瘤的碘摄取,而原生甲状腺的碘摄取保持不变(图7G和H)。综上所述,rRNA转录阻断是诱导甲状腺癌再分化的有效途径。

图7 CX-5461诱导甲状腺癌再分化
结论
作者在本研究中证明了TERT的条件转基因表达促进了小鼠甲状腺BRAF V600E突变驱动的去分化和肿瘤转移。TERT在小鼠和人BRAF V600E肿瘤细胞中的表达诱导rRNA转录和核糖体生物发生。rRNA转录抑制剂CX-5461诱导肿瘤分化,减缓肿瘤进展(图8)。

图8 研究示意图
综合结合动物模型、ST测序、数据库分析和实验揭示了核糖体途径中的TERT。
实验方法
细胞培养;建立小鼠甲状腺原代细胞系;质粒和慢病毒包;质粒和siRNA转染;动物超声成像和PET-CT;活体[125I]摄取实验;免疫组织化学染色;RNA提取,cDNA合成和RT-qPCR;Bulk RNA-seq;ST样品制备,文库构建和测序;ST数据处理和可视化;轨迹分析;甲状腺癌单细胞数据集分析;单细胞或ST富集分析;EU assay;免疫印迹;免疫沉淀;液相色谱-质谱;端粒重复扩增实验;表面翻译感知;双链双荧光素酶报告基因;集落形成;细胞计数试剂盒;甲状腺癌患者OncoVee MiniPDX
参考文献
Yu P, Qu N, Zhu R, Hu J, Han P, Wu J, Tan L, Gan H, He C, Fang C, Lei Y, Li J, He C, Lan F, Shi X, Wei W, Wang Y, Ji Q, Yu FX, Wang YL. TERT accelerates BRAF mutant-induced thyroid cancer dedifferentiation and progression by regulating ribosome biogenesis. Sci Adv. 2023 Sep; 9(35): eadg7125. doi: 10.1126/sciadv.adg7125.






