Netrin-1 阻断可抑制子宫内膜癌的肿瘤生长和 EMT 特征
摘要
Netrin-1 作为一种促肿瘤机制在癌症中上调。在这里,我们描述了大多数人类子宫内膜癌 (EC) 中 netrin-1 的上调,并证明使用抗 netrin-1 抗体 (NP137) 阻断 netrin-1 可有效减少 EC 小鼠模型中的肿瘤进展。接下来,我们在一项由 14 名晚期 EC 患者组成的 I 期试验中检查了 NP137 作为一种首创的单一药物的疗效。我们观察到 8 例疾病稳定和 1 例 RECIST v.1.1 客观缓解。为了评估 NP137 的作用机制,对小鼠肿瘤基因进行了分析,我们观察到,除了诱导细胞死亡之外,NP137 还抑制上皮间质转化 (EMT)。通过对 NP137 试验中 EC 患者的治疗前和治疗中配对活检进行批量 RNA 测序、空间转录组学和单细胞RNA-seq,我们注意到肿瘤 EMT 的净减少。这与免疫浸润的变化以及癌细胞与肿瘤微环境之间相互作用的增加有关。鉴于 EMT 在抵抗当前护理标准中的重要性,我们在 EC 小鼠模型中表明,NP137 与卡铂-紫杉醇的组合优于单独的卡铂-紫杉醇。我们的结果确定 netrin-1 阻断是一种触发肿瘤减灭和 EMT 抑制的临床策略,从而有可能减轻对标准治疗的耐药性。
该研究于2023年8月发表在《Nature》,IF:64.8。
技术路线

结果
1、Netrin-1 和子宫内膜腺癌
我们通过逆转录定量 PCR (RT-qPCR) 分析了 72 个人类子宫内膜肿瘤队列中 netrin-1 的表达。netrin-1 在子宫内膜腺癌 (EC) 中显着上调,而级别或亚型没有具体变化。其主要受体 UNC5B 在肿瘤组织中的表达量也高于正常子宫内膜。通过免疫组织化学 (IHC) 监测大多数子宫内膜肿瘤的 Netrin-1(和 UNC5B)阳性率。
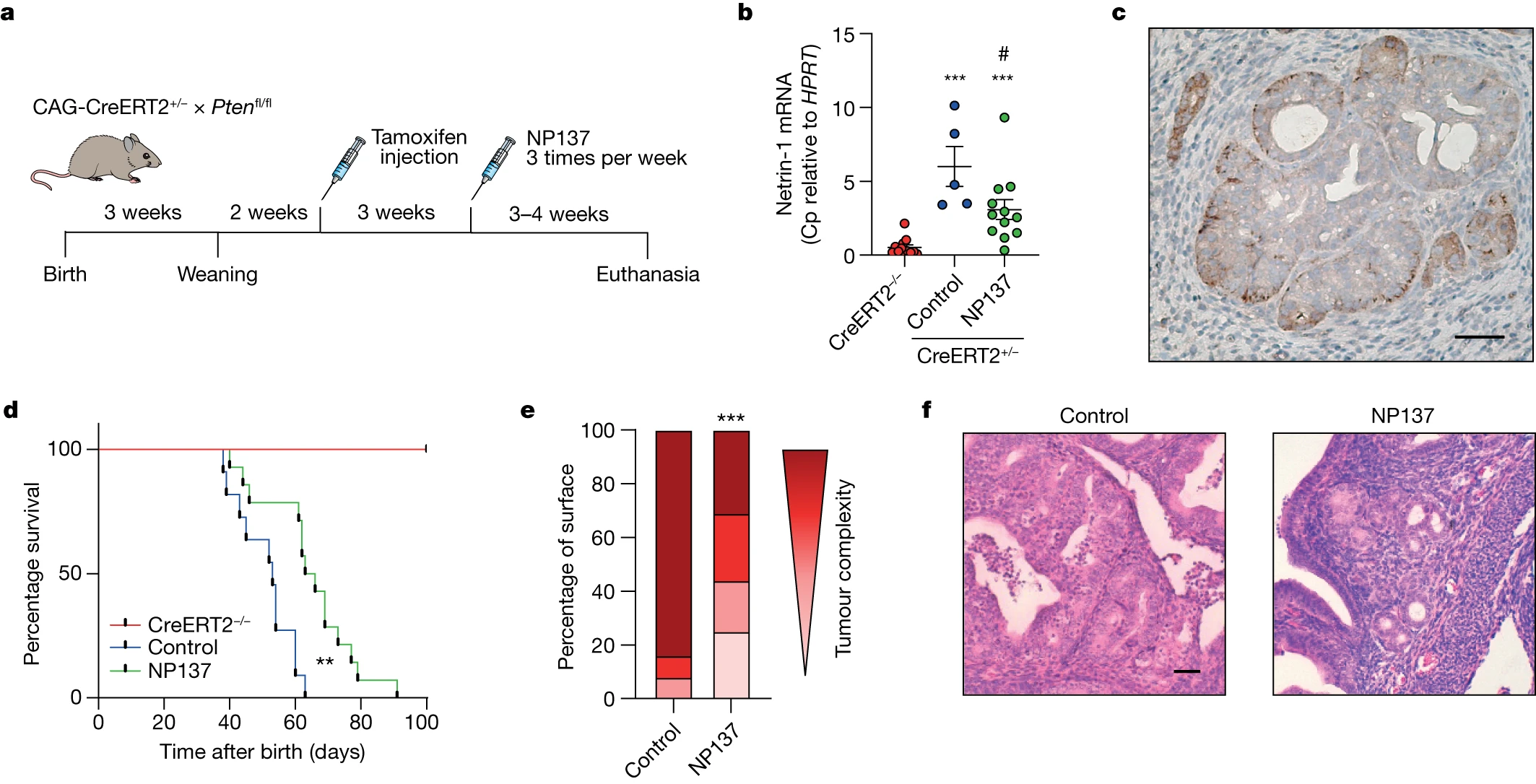
因此,我们转向使用基因工程、时间控制的 Pten f/f 缺失小鼠模型(即他莫昔芬诱导的 CAG-CreERT+/- 启动子)来概括 EC 发展的临床前模型,该模型已被证明可以发展 EC原位快速发生,以及甲状腺增生(图1a)。因此,我们用 NP137(10 mg kg-1,每周 3 次)治疗对照小鼠和 Pten 缺失小鼠 3-4 周,并分析 netrin-1 表达和肿瘤进展。如图1b、c所示,在Pten缺失后,netrin-1在小鼠肿瘤中上调,而在NP137治疗后这种上调有所减少。有趣的是,NP137 与子宫内膜肿瘤的发展减少和生存增加相关(图 1d;请注意,Pten 删除后 7 周后研究没有扩展,因为大多数小鼠表现出呼吸困难或其他症状。由于甲状腺肿瘤的发展而引起的疾病)。病理学家观察到 NP137 治疗后癌细胞数量减少(图 1e),子宫内膜组织更健康(图 1f)。同样,在接受 NP137 治疗的小鼠的甲状腺中也观察到了抗肿瘤活性。这些结果表明,针对 EC 中的 netrin-1 可以抑制肿瘤进展。
2、EC 患者的客观反应
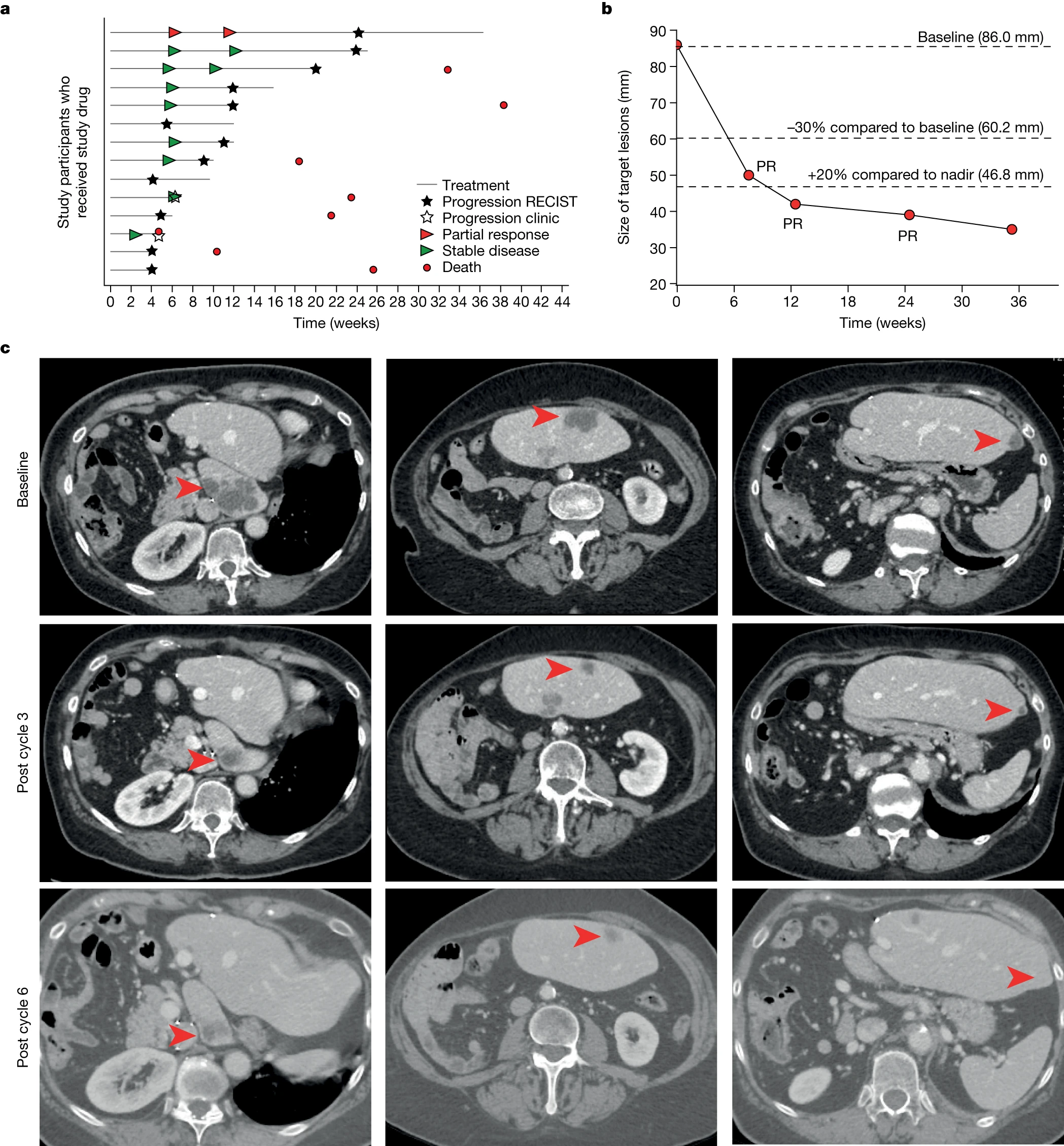
基于先前的结果表明 netrin-1 阻断是一种可行的癌症治疗策略,我们开发了一种 netrin-1 阻断抗体用于临床使用,并正在进行 I/II 期评估。我们从正在进行的 1 期研究中提取了 14 名 EC 患者的疗效数据。在这项研究中,NP137 作为单一疗法每 2 周 (Q2W) 给药一次,直至临床/放射学进展。如图 2a 和扩展数据表 1a 所示,没有观察到剂量限制性毒性,超过一半的患者的疾病控制为最佳反应。此外,一名患有晚期 EC 的 74 岁女性患者出现了 RECIST1.1 定义的部分缓解。该患者的最初诊断显示子宫内膜样起源、微卫星稳定表型以及 CK7、PAX8 和雌激素受体表达,但不表达 CK20 或孕激素受体。在给予 NP137 之前,她已接受多次治疗尝试,包括辅助放疗和卡铂-紫杉醇,随后使用 lurbinectedin 作为转移性疾病的一线治疗,并第二次尝试使用卡铂-紫杉醇,但尽管进行了这些治疗,肝转移仍出现进展。
纳入时进行的正电子发射断层扫描-计算机断层扫描 (PET-CT) 扫描证实了氟脱氧葡萄糖的强烈摄取(在 C1D1 之前)。她接受了 14mg/kg 静脉注射 NP137 Q2W,并在第 6 周(即 NP137 第 3 个周期后)接受了 PET-CT 扫描,根据 RECIST v.1.1 显示部分缓解,目标肝脏病变减少了 51%(图 2b、c)。 3 个月时 PET-CT 扫描证实部分缓解(图 2c),然后在 6 个月时再次确认,此时目标病灶尺寸缩小达到 55%。该患者最终在 NP137 17 个周期后出现疾病进展,并继续接受额外治疗,包括来曲唑 A、免疫疗法和他莫昔芬,但没有出现额外的客观反应。
3、Netrin-1 阻断抑制肿瘤 EMT
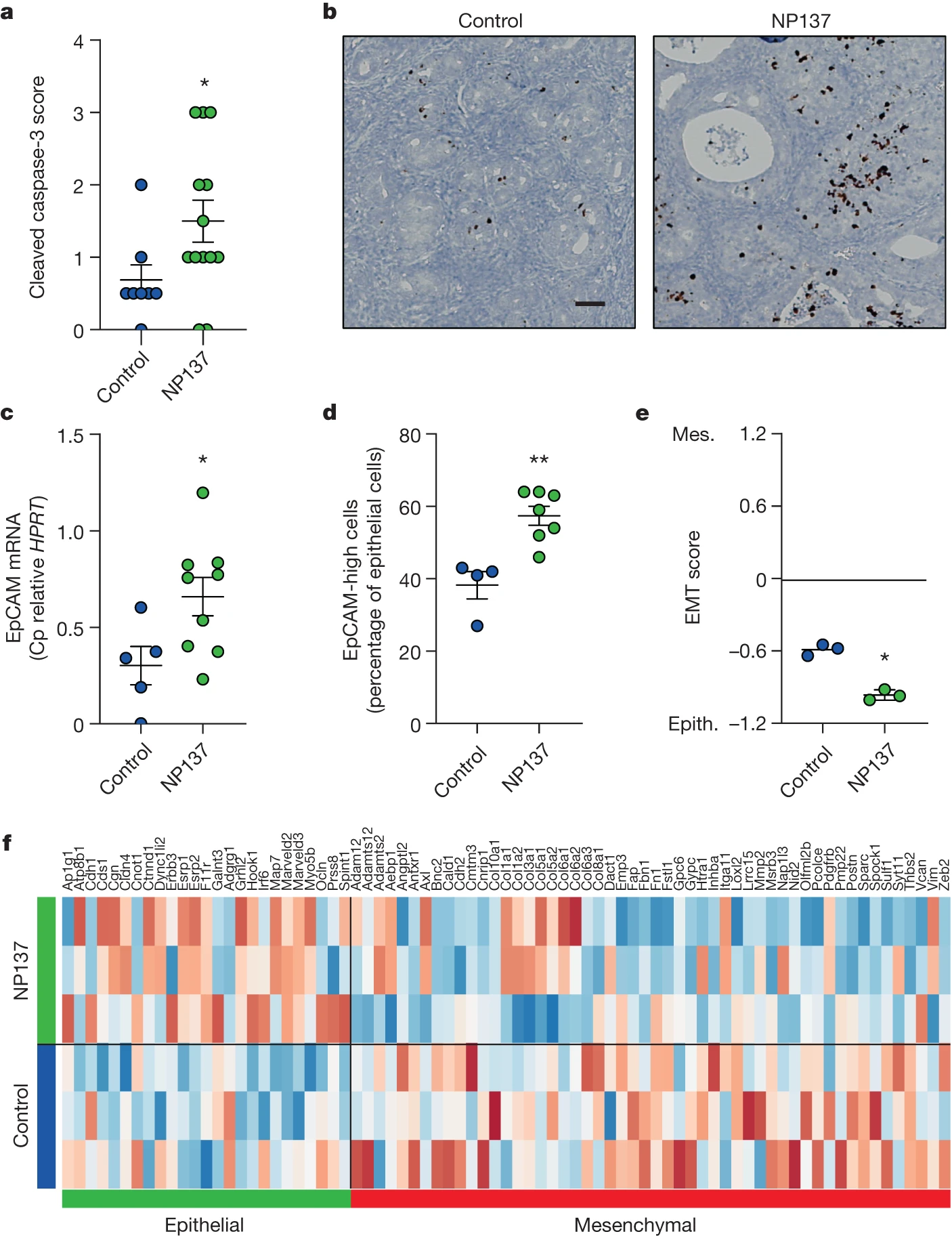
为了深入了解 netrin-1 阻断与肿瘤生长抑制之间的联系,我们首先根据 netrin-1 阻断的假设作用模式分析了肿瘤生长抑制是否与 Pten f/f 肿瘤中的肿瘤细胞死亡相关用NP137处理。如图 3a、b 所示,通过 IHC 对活性 caspase-3 进行测量,NP137 增加了癌症细胞凋亡。接下来,我们对经过 NP137 治疗的 Pten f/f 小鼠肿瘤与未经治疗的 Pten f/f 小鼠肿瘤进行了 RNA 测序。在 NP137 给药后调节的途径/基因中,我们注意到治疗后 EMT 相关基因的减少。几项体外研究表明 netrin-1 参与 EMT,通常与 PI3K/AKT 通路相关,该通路在子宫内膜癌中经常发生改变。然后我们研究了 NP137 是否可能影响 Pten f/f 小鼠模型中的肿瘤 EMT。我们首先评估了对照组与 NP137 治疗肿瘤中 EpCAM 上皮标志物的表达,并观察到该上皮标志物在 NP137 治疗肿瘤中显着增加(图 3c,d)。为了更全面地了解肿瘤基因表达,我们利用了常用的泛癌 EMT 特征,可用于确定 EMT 评分。我们观察到,NP137治疗降低了EMT评分(图3e),与间充质基因表达减少和上皮基因表达增加相关(图3f)。这些临床前数据支持这样的观点,即 netrin-1 阻断对肿瘤细胞具有双重作用:触发癌细胞死亡和抑制 EMT 特征,使整体 NP137 治疗的肿瘤更具上皮性。
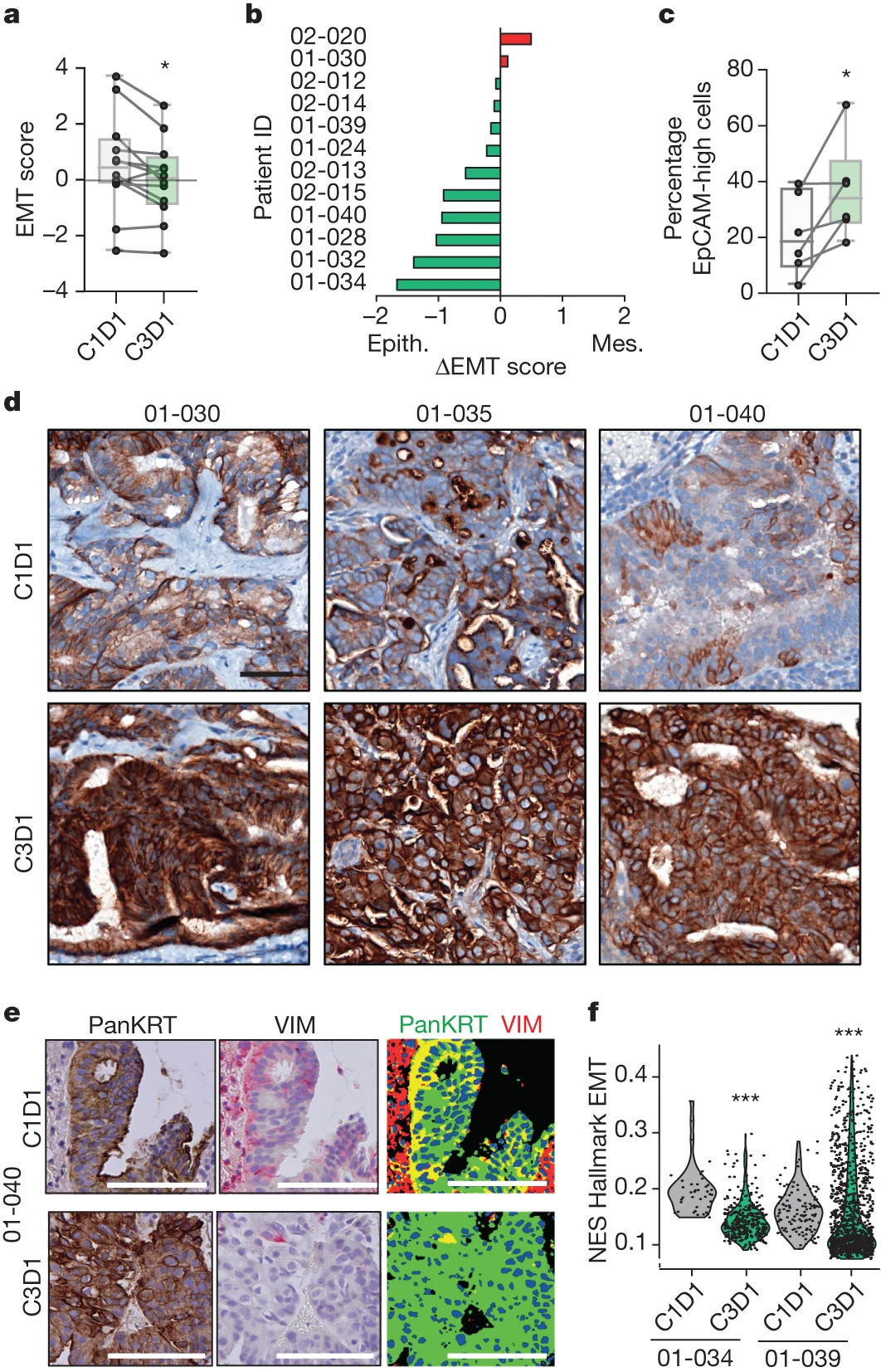
接下来我们确定在临床前模型中观察到的 EMT 特征的抑制是否也发生在接受 NP137 治疗的患者中。在 NP137 1 期试验中,在上述 EC 患者中,在纳入时 (C1D1) 以及使用抗 netrin-1 化合物治疗 1 个月后(即在第三次输注 NP137 之前 (C3D1) 收集配对活检))。对 12 个配对的治疗前和治疗中活检组织成功进行了批量 RNA 测序(补充表 1b),如图 4a、b 所示,发现两次 NP137 注射足以引发胰腺癌 EMT 评分显着下降如上所述,表明在用 NP137 治疗 1 个月后,患者的肿瘤总体上皮表型更多。经 NP137 治疗的患者肿瘤样本中 EpCAM IHC 染色的增加证实了向上皮表型的转变(图 4c、d)。我们还观察到共表达全细胞角蛋白和波形蛋白的肿瘤细胞比例下降(图4e)。
有趣的是,在分析基线和治疗活检之间 EMT 评分的变化时,我们观察到,以疾病进展作为对 NP137 最佳反应的患者样本(第 6 周首次评估时疾病进展)未能显示 EMT 评分的变化。相反,在疾病控制的患者样本中,EMT 评分出现统计学显着下降。
为了更正式地证明患者接受 NP137 治疗后出现的 EMT 评分的大量变化专门发生在癌细胞中,作为第一种方法,我们使用了与福尔马林固定石蜡包埋 (FFPE) 组织兼容的 10x Visium 空间基因表达系统。对两名 EC 患者的两对 C1D1/C3D1 FFPE 切片进行了分析,并在病理学家选择的感兴趣区域中进行了空间基因表达谱分析,其中H&E染色只能识别癌细胞。在这两种情况下,与 C1D1 相比,C3D1 的 EMT 评分均大幅下降(图 4f)。因此,在患者中,用 NP137 治疗 1 个月后,与治疗前状态相比,剩余的癌细胞表现出减少的 EMT 特征。
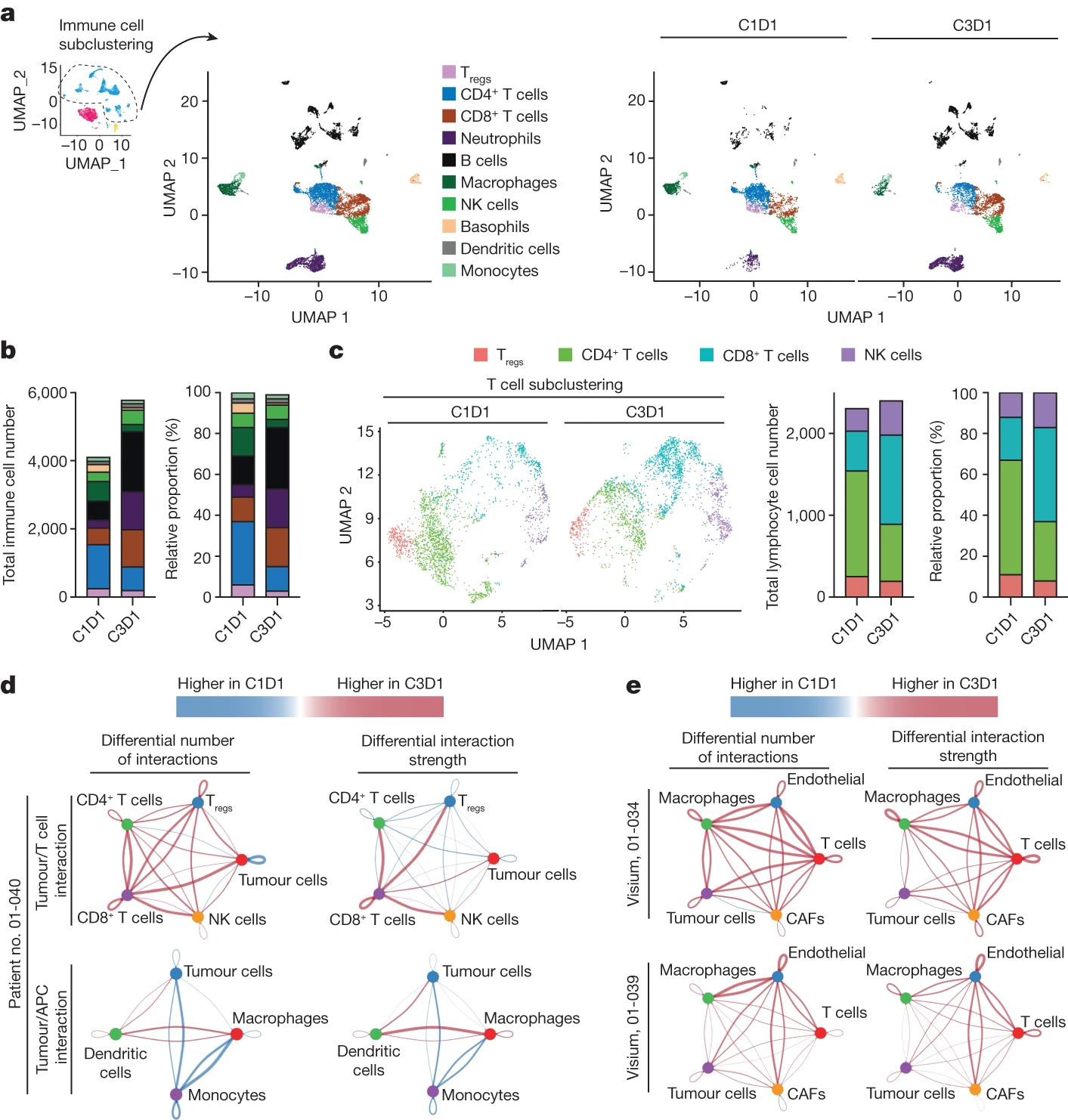
为了将这些研究扩展到单细胞水平,我们直接对 NP137 试验中纳入时和 1 个月后获得的新鲜活检组织(C1D1,9,216 个细胞)进行了 3′ 单细胞 RNA 测序(10x Genomics Next GEM 3′ 试剂盒)来自晚期 EC 患者(图 5a)的治疗结果(C3D1,7,159 个细胞)。无监督聚类显示存在不同的细胞群,包括肿瘤细胞(表达 EpCAM、PGR 和 TFF3 - ECs21 的所有标记)、免疫细胞(以 CD45 (PTPRC) 表达标记)、癌症相关成纤维细胞(CAF,以 αSMA (ACTA2 标记))和内皮细胞(PECAM1 阳性)(图 5b)。NP137 治疗导致肿瘤细胞区室显着减少(图 5b、c)。
经过两个周期的 NP137 治疗后,抗 netrin-1 治疗后的肿瘤细胞比例降低了 3.19 倍。有趣的是,除了癌细胞的净减少外,我们还注意到整个肿瘤区室的 EMT 评分在统计上显着下降,表明与 NP137 治疗相关的总体上皮表型更多(图 5d)。我们还仅在肿瘤细胞中进行了无偏差异表达和通路分析。值得注意的是,EMT 是最重要的术语,在暴露于 NP137 后下调。有趣的是,在 NP137 治疗后,大多数肿瘤细胞的亚区室以类似的方式减少,我们注意到肿瘤簇 2 的减少幅度最强,也显示出较高的 EMT 评分(图 5e-h;注意簇 2)具有高 EMT 评分,在 NP137 处理后未检测到,但我们不能排除它们未被捕获的可能性,因为这些簇在 C1D1 时已经具有很少的细胞)。
肿瘤区室中发生的变化也与基质细胞的变化相关(图5b、c和6)。值得注意的是,NP137 治疗显然对免疫细胞有影响(图 6a、b)。更具体地说,在NP137治疗后,我们注意到具有细胞毒功能的淋巴细胞(CD8+T细胞和自然杀伤(NK)细胞;图6c)增加。在用 NP137 治疗的 Pten f/f 小鼠中也注意到 CD8+ 细胞的类似增加。有趣的是,在 NP137 治疗后,我们在 2 号患者的单细胞分析中注意到了这两种情况。 01-40 号患者的空间转录组数据。 01-034和01-039增加了T细胞和肿瘤细胞之间相互作用的数量和强度(图6d,e)。特别是,单细胞RNA-seq数据显示CD8+T细胞和肿瘤细胞之间相互作用的数量和强度增加(图6d)。检测到 M2 巨噬细胞减少,同时主要组织相容性 I/II 类抗原呈递增加。 NP137 治疗与更有效的抗原呈递细胞 (APC) 相关,因为我们观察到与癌细胞相互作用的 C1D1 中的单核细胞明显转变为 C3D1 中的树突状细胞(图 6d、e)。

4、NP137 抑制化疗耐药
由于大量文献将 EMT 描述为化疗耐药的主要原因,并且我们的数据表明靶向 netrin-1 会抑制 EMT,因此我们评估了是否将 NP137 添加到卡铂-紫杉醇(卡博紫杉醇)(标准化疗药物)中。子宫内膜癌临床环境中使用的非护理化疗可能会增强 Pten f/f 小鼠子宫内膜腺癌模型中单独使用卡波紫杉醇的疗效。NP137/卡博他赛治疗被证明优于单独的卡博他赛,导致小鼠totally缓解。总而言之,这些临床前和临床数据表明,临床阶段的药物既能诱导肿瘤细胞减灭,又能引发 EMT 特征的全面抑制,从而有可能减轻对传统疗法的耐药性。
实验方法
RT–qPCR、Bulk RNA-seq、scRNA-seq、IHC分析、多重免疫组化、空间转录组学。
参考文献
Cassier, P.A., Navaridas, R., Bellina, M. et al. Netrin-1 blockade inhibits tumour growth and EMT features in endometrial cancer. Nature 620, 409–416 (2023).






