新发现!GAP43依赖性线粒体转移增强GBM致瘤性!
完整线粒体在异质细胞类型之间的转移已在包括癌症在内的各种环境中得到证实。然而,线粒体转移对肿瘤生物学的功能意义知之甚少。在这里,作者表明线粒体转移是胶质母细胞瘤(GBM)中普遍存在的现象,这是最常见和恶性的原发性脑肿瘤。该研究发现星形胶质细胞的水平线粒体转移是增强GBM肿瘤发生的机制。这是由参与神经元轴突再生和星形胶质细胞反应性的蛋白质生长相关蛋白43(GAP43)促进的。星形胶质细胞线粒体的获得推动线粒体呼吸的增加与增殖和与致瘤性相关的代谢途径的上调。在功能上,星形胶质细胞线粒体的摄取促进细胞周期进展到增殖性G2/M期,并增强GBM的自我更新和致瘤性。总的来说,研究结果揭示宿主-肿瘤相互作用,推动癌细胞的增殖和自我更新,为治疗开发提供机会。本文于2023年5月发表在《Nature cancer》IF:22.7期刊上。
技术路线

主要实验结果
1、GBM从微环境中获取线粒体
为评估非恶性宿主细胞是否可以在体内将线粒体转移到GBM中,该研究将表达绿色荧光蛋白(GFP)的同基因小鼠GBM模型(SB28和GL261)原位植入表达与定位肽融合的线粒体定位的mKate2荧光基团的转基因C57BL/6小鼠8(mito::mkate2小鼠;图1a)。来自mito::mKate2小鼠的GBM肿瘤的共聚焦显微镜显示在15-60%的GFP GBM细胞内的mKate2+斑点(图1b-f),表明宿主细胞线粒体是通过原位GBM肿瘤细胞在体内获得的。为确定线粒体转移是否发生在人体内GBM的情况下,作者首先将高滴度mitoDsRed慢病毒注射到裸鼠的大脑中,以用线粒体荧光标签转导正常脑细胞。7天后,在同一位置注射P3 GFP+人源性GBM干细胞(GSCs)(图1g)。高分辨率共聚焦图像证实线粒体从基质细胞转移到肿瘤细胞,支持小鼠体内数据(图1g)。当三维重建时,在GFP阳性的受体细胞中存在mitoDsRed信号。

图1 GBM细胞从TME获得宿主线粒体
为进一步阐明主要线粒体供体细胞群的身份,作者将流行的肿瘤浸润细胞类型与GFP+ GBM细胞以1:2的供体:受体比例共培养。2小时后评估mKate2+细胞作为线粒体转移标志物的百分比(图2a)。与体内观察一致,作者发现脑驻留的神经胶质细胞(星形胶质细胞和小胶质细胞)在每个细胞的基础上贡献的线粒体明显多于骨髓来源的巨噬细胞,星形胶质细胞具有更高的转移率(图2b)。虽然巨噬细胞进一步极化为M2或M1表型可能有利于增加线粒体转移,但平均而言,转移程度比体外脑驻留神经胶质细胞观察到的程度低五到十倍。
鉴于以前的观察,星形胶质细胞显示出高速率的线粒体转移到GBM小鼠模型,以及它们先前描述的在体内与GBM的相关性,作者将后续研究重点放在该神经胶质细胞群上。首先将mito-mCherry或mitoDsRed永生化的人星形胶质细胞与六种不同的人源性GSC(L1,DI318,3832,GG16,P3和BG5)共培养3-4天,以探究其发现在人类疾病模型中的适用性。与小鼠GBM模型一样,作者发现人类来源的GSC从星形胶质细胞中获得线粒体,流式细胞术显示转移率为5-40%(图2c,d)。接着通过GSC的共聚焦显微镜证实星形胶质细胞线粒体的内化,其中荧光蛋白标记的线粒体完全在GSCs内可视化,细胞质预先用CellTrace染料标记或表达GFP。使用图1g得出的人原位GBM模型(P3)确认星形胶质细胞到人GBM的线粒体转移在体内是相关的。作者通过鉴定mitoDsRed+星形胶质细胞(神经胶质纤维酸性蛋白(GFAP+)和GFP–)周围GFP GBM细胞与转移的mitoDsRed+线粒体(图2e)。最后,通过共定位分析证实,用mito-mCherry标记的转移线粒体表达线粒体外膜20(TOMM20)的线粒体蛋白易位子,并且该蛋白分布在接收GBM细胞的线粒体网络中。总之,作者观察到线粒体在体内和体外从TME转移到GBM,并确定星形胶质细胞是主要的线粒体供体。

图2 GBM细胞从星形胶质细胞中获取线粒体
2、GAP43+ MTs促进线粒体转移
作者认为线粒体转移可以通过分泌和/或细胞接触进行。为区分这两种机制,将共培养物的线粒体转移率与转移的供体条件培养基的线粒体转移率进行比较(小鼠模型)或由5 μm多孔Transwell插入物隔开的细胞(人体模型;图3a)。无论采用何种分离方法,转移主要发生在供体和受体细胞物理接触时,并且只有低水平的分泌物转移接近测定的检测限。表明这是一个主动的、依赖于能量的过程,而不是一个被动的事件。综上所述,这些结果表明,有效线粒体转移需要肿瘤和供体细胞的主动物理相互作用,这与体内脑肿瘤模型的成像一致(图1和2)。
MTs是GBM中细胞间通讯和网络形成的既定渠道,因此也是线粒体转移的潜在介质。为可视化GBM细胞界面内的线粒体,作者对TOMM20和肌动蛋白的共培养免疫染色进行共聚焦显微镜检查。除核周定位外,在肿瘤细胞之间的MT连接中还发现线粒体(P3模型;图3b),与先前的研究报告一致,即线粒体成分在体外定位在星形胶质细胞和GBM细胞连接之间。它们的管内位置由z堆栈确认。重要的是,用肌动蛋白免疫染色的mitoDsRed+星形胶质细胞和GFP+ P3共培养物的共聚焦显微镜显示MTs与mitoDsRed+线粒体连接两种细胞类型。这些存在于转移的线粒体附近(图3c)。同时还发现星形胶质细胞mitoDsRed+供体线粒体在连接的肿瘤受体细胞之间穿梭,表明星形胶质细胞线粒体可以在肿瘤-肿瘤连接的完整网络中进一步交换(图3c)。在可视化线粒体沿着含有肌动蛋白丝的细胞间连接运输后,作者假设肌动蛋白细胞骨架在促进线粒体转移方面至关重要。事实上,细胞松弛素B抑制肌动蛋白聚合导致转移速率显着降低,而不影响细胞活力。相比之下,用长春新碱抑制微管蛋白聚合对线粒体转移没有影响(图3d)。
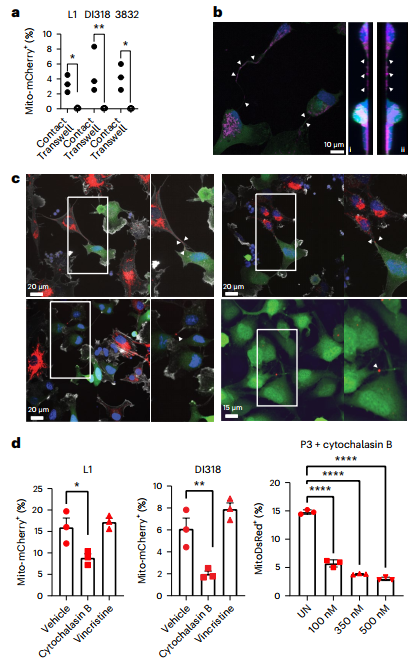
图3 星形胶质细胞通过基于肌动蛋白的细胞间连接将线粒体转移到GBM
先前的工作表明,GAP43促进GBM细胞在体内相互连接网络的形成,这使得连接蛋白43介导的钙波传播成为可能。GAP43是一种肌动蛋白相关蛋白,可通过生长锥促进神经突生长。作者设想GAP43也定位于共培养中GBM细胞和星形胶质细胞的细胞投影(图4a)。当敲低GAP43在人源性GSC中的表达时,观察到细胞投影的数量减少(图4b,c)。重要的是,作者发现当GAP43在单独的GSC中或同时在GSC和星形胶质细胞中被敲低时,来自星形胶质细胞的线粒体转移显著减少(图4d,e)。这些数据表明GAP43在促进线粒体从星形胶质细胞转移到GBM中起作用。
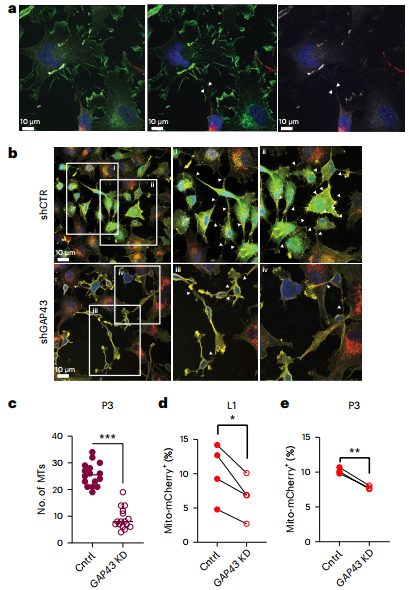
图4 GAP43通过肿瘤-星形胶质细胞MTs促进线粒体转移
3、星形胶质细胞线粒体代谢重编程GBM细胞
假设从星形胶质细胞接收整个细胞器将在受体GBM细胞中具有生物学上重要的下游功能后遗症。作者通过对从共培养物中获得(mKate2+)或没有(mKate2−)星形胶质细胞线粒体的分选小鼠GBM细胞进行批量RNA测序(RNA-seq),探究线粒体转移如何在转录上影响细胞。RNA-seq显示共培养细胞中上调基因在与线粒体生物学相关的电子传输和线粒体组织途径中富集。
鉴于线粒体在ATP产生中的核心作用以及RNA-seq分析结果,作者探究功能性线粒体通过转移的增加是否会导致代谢参数的可测量变化,特别是耗氧率。接着对GFP+受体细胞(P3模型)进行线粒体应激测试,与使用海马系统的相同共培养物的对照细胞相比,来自mitoDsRed+星形胶质细胞的线粒体高和低转移。测量基础呼吸速率后,作者依次添加电子传递链抑制剂以评估最大呼吸能力的变化。有趣的是,基础呼吸和最大呼吸速率均根据线粒体转移而增加(图5a-c)。当根据基础呼吸和糖酵解速率将细胞分成代谢亚组时,线粒体转移量最高的细胞比转移量较低的细胞和对照细胞更有氧、更有活力(图5d)。通过调整先前报道的代谢流式细胞术组合,作者进一步表征一组GSCs在与人星形胶质细胞共培养后的代谢谱。线粒体ATP合酶亚基ATP5A是受体GSCs中最一致的上调代谢蛋白之一(图5e)和GBM的小鼠模型。接下来评估这些具有较高呼吸能力和ATP合酶水平的细胞是否产生更多的ATP。在多个人类来源的GBM模型中,作者通过发光报告测定法测量得到从星形胶质细胞获得线粒体的GBM细胞也具有更高水平的ATP(图5f,g)。总的来说,这些数据表明转移的星形胶质细胞线粒体具有生物活性,并导致受体GBM细胞中线粒体呼吸和ATP产生增强。
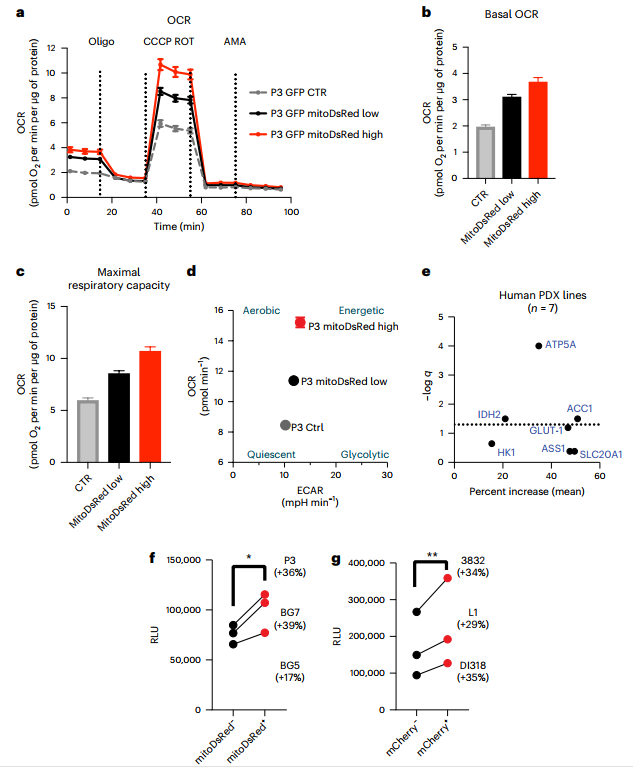
图5 星形胶质细胞线粒体的获得通过受体GBM细胞中的线粒体呼吸增强ATP的产生
线粒体可以通过调节不同的代谢途径进一步影响细胞生物学,并且越来越多的证据表明它们会影响细胞内磷酸化信号级联反应。因此,作者对来自与星形胶质细胞共培养的分选GBM细胞进行代谢物质谱测定和584位点蛋白质磷酸化阵列,以询问线粒体摄取的功能后果。代谢物富集分析显示,GL2和SB261小鼠模型共享的mKate2+ GBM细胞中存在多种上调的代谢途径(图6a)。这些途径包括氨基酸和核苷酸代谢,以前与GBM的增殖,自我更新和致瘤性有关。对分选的人源性L1细胞的代谢组学分析表明,mCherry+细胞的谷氨酸、α-酮戊二酸、谷胱甘肽和必需氨基酸的含量高于mCherry−细胞(图6b)。谷氨酸是谷胱甘肽中的三种氨基酸之一,谷胱甘肽是一种主要的细胞抗氧化剂,谷氨酸代谢是新生核苷酸合成中氮同化的主要途径,可促进胶质瘤中的许多致癌过程。这表明线粒体的转移可能有助于GBM细胞支持增殖并防止氧化应激。磷蛋白阵列揭示接受星形胶质细胞线粒体的人源GSCs中许多信号蛋白和效应蛋白磷酸化水平的变化,其中许多映射到增殖和细胞周期途径(图6c)。这些发现与受体细胞在线粒体呼吸增加之外的代谢重编程以及对细胞周期调节和其他过程具有潜在影响的细胞内信号传导一致。
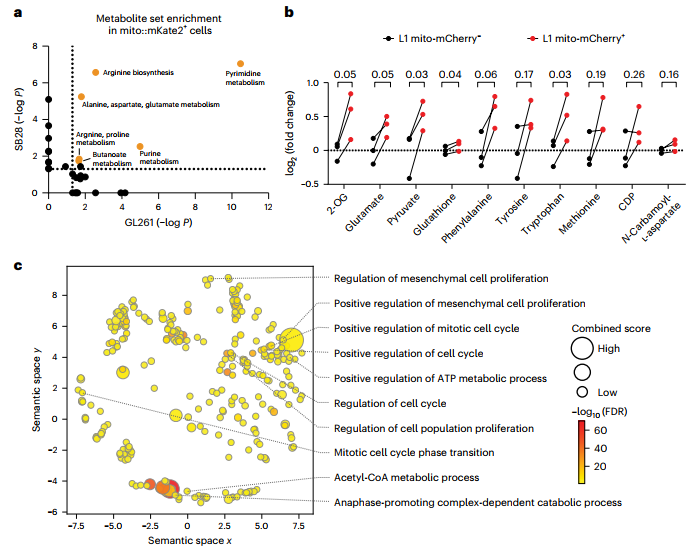
图6 星形胶质细胞的线粒体转移重新编程GBM代谢
4、线粒体转移增加GBM致瘤性
为确定在获得星形胶质细胞线粒体的GBM细胞中观察到的代谢和信号变化是否导致细胞周期调节的改变,作者通过DNA染色和流式细胞术在多种人源GSC模型中对线粒体转移模型进行细胞周期分析,观察到在获得星形胶质细胞线粒体后,细胞周期增殖G2/M期的细胞比例持续增加(图7a,b)。当分析mytho:: mKate2小鼠原位肿瘤的小鼠GBM模型时,这一观察结果在体内是一致的(图7c,d)。此外,源自获得星形胶质细胞线粒体的分选细胞的原位小鼠GBM肿瘤具有更高的有丝分裂指数,表明增加的增殖表型在体内保留。先前的报道表明,GSC可以吸收添加到细胞培养基中的分离的无细胞线粒体。将星形胶质细胞衍生的线粒体添加到人衍生的GSC中足以概括细胞周期G2/M期细胞比例增加的情况(图7e–g)。这些数据表明星形胶质细胞线粒体的转移影响人类GBM模型中的细胞周期调节。
为进一步评估线粒体获取对自我更新的影响,作者使用含有和不含有星形胶质细胞线粒体的分选GBM细胞进行限制性稀释球体形成测定。发现在人类和小鼠GBM模型中,获得星形胶质细胞线粒体的细胞具有显著更高的自我更新能力,表现为更高的估计干细胞频率(图7h)。虽然人类来源的GSC模型表达高水平的多能性转录因子SOX2,但随后发现获得星形胶质细胞线粒体的GSC进一步上调另一种自我更新的转录因子OCT4。这些发现表明,星形胶质细胞的线粒体转移由先前未描述的TME相互作用组成,该相互作用促进GBM自我更新。
增殖能力和自我更新的增加是癌症的核心标志;因此,作者假设星形胶质细胞的线粒体转移促进GBM的致瘤性。通过评估人源性GBM细胞的致死率(死亡时间或人道终点)和肿瘤起始能力来测试这一假设,这些细胞有或没有通过原位植入免疫功能低下的小鼠获得人星形胶质细胞线粒体。这些研究表明,当起源于从星形胶质细胞获得线粒体并且体内肿瘤起始能力显着更高的GSCs时,肿瘤导致症状或致命疾病的速度要快得多(图7i,j)。这一观察结果在小鼠GBM模型中相似。因此,除在体外改变GBM细胞的表型外,星形胶质细胞的线粒体转移增加动物模型中这些细胞的体内致瘤性。
综上所述,作者发现星形胶质细胞线粒体可以以GAP43依赖性方式水平转移到胶质母细胞瘤细胞,导致线粒体呼吸和代谢的变化,从而促进增殖和肿瘤生长。确定TME的线粒体转移是GBM的基本促肿瘤生成机制。研究核心发现是从TME的非恶性细胞转移线粒体促进了高度致瘤的细胞表型,其特征是增殖能力增加和自我更新(图7k)。这表现为原位肿瘤在体内具有更高的外显率和更快的致死率。研究结果表明,颅内肿瘤植入前星形胶质细胞线粒体获得驱动的增殖和自我更新增加的表型足以导致致瘤性增加,而在实验性肿瘤起始时缺乏这种表型会导致GBM细胞增殖降低。因此,线粒体转移和向氧化代谢的转变包括GBM与其微环境的基本促肿瘤相互作用。研究为这一研究不足的过程增加了机制上的理解,为未来的研究奠定了基础,这也可能广泛适用于中枢神经系统以外的肿瘤和其他病理背景。
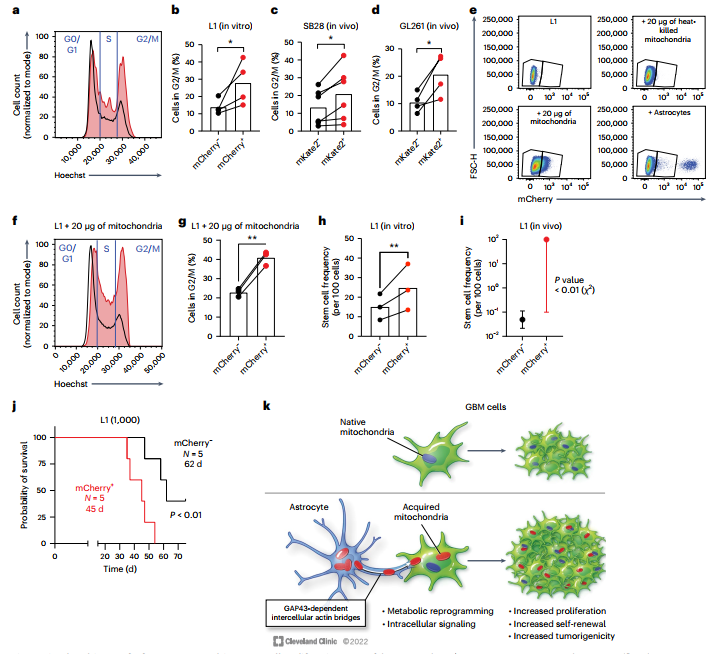
图7 星形胶质细胞的线粒体转移驱动GBM细胞增殖,自我更新和致瘤性
实验方法
慢病毒转导,流式细胞术,裸鼠原位异种移植物模型,免疫荧光,体外小鼠线粒体转移试验,小鼠巨噬细胞的产生和体外线粒体摄取测定,WB,ATP定量,代谢组学分析,磷蛋白阵列,RNA-seq,蛋白质-蛋白质相互作用和网络可视化,线粒体分离
参考文献
Watson D C, Bayik D, Storevik S, et al. GAP43-dependent mitochondria transfer from astrocytes enhances glioblastoma tumorigenicity. Nat Cancer. 2023; 4(5): 648-664. doi: 10.1038/s43018-023-00556-5






