tRF-Gln-CTG-026减少全局蛋白合成以改善肝损伤
tRNA来源的小RNA(tsRNAs)是压力应激的产物,对应激反应和损伤调节有相当大的影响。然而,tsRNAs是否可以改善肝损伤仍不清楚。在这里,本研究证实tsRNA可改善肝损伤通过利用NSun2的缺失作为tsRNAs发生模型。机制上,NSun2的缺失降低了tRNAs的m5U修饰和m5C修饰,导致产生大量的tsRNAs,特别是tRF-1s类。通过进一步筛选,作者发现tRF-Gln-CTG-026(tG026)是最佳的tRF-1,它通过削弱TSR1(pre-rRNA加工蛋白TSR1同源物)与pre-40S核糖体之间的关联,抑制全局蛋白合成,从而改善肝损伤。本文于2023年4月发表在《Signal Transduction and Targeted Therapy》IF:39.3期刊上。
技术路线

主要实验结果
1、在体外构建loss-of-NSun2作为tsRNA发生模型以缓解损伤
首先对小鼠进行肝损伤诱导,验证tsRNAs是否参与肝损伤和修复(图1a)。结果发现肝损伤小鼠中tsRNA的数量增加(图1b),表明tsRNA的产生与肝损伤有关。为进一步研究tsRNA与肝损伤的关系,建立tsRNA生成模型。通过筛选HL-7702细胞系中的三种tRNA修饰酶(NSun2、Mettl1和Dnmt2),在低损伤胁迫下,与ME-KD(Mettl1敲低)和DN-KD(Dnmt2敲低)相比,NSun2敲低(NS-KD)可导致增殖增加(图1c, e);此外,在高(致死)应激下,NSun2敲低可提高细胞存活率(图1d, e)。NS-KD也增加了H2O2处理下的细胞增殖(图1f)。相反,使用不同的高强度应激诱导剂(CCl4、对乙酰氨基酚和油酸混合物)并测量细胞存活率。结果显示,NS-KD提高了应激损伤下的细胞存活率(图1g, i)。正如预期的,NS-KD仅在压力下起作用,在基础条件下,NS-KD不影响细胞增殖(图1h, i)。总之,这些结果表明,肝损伤与tsRNA的产生有关,NS-KD可促进细胞增殖和存活,但不会改变体外压力下的细胞迁移。
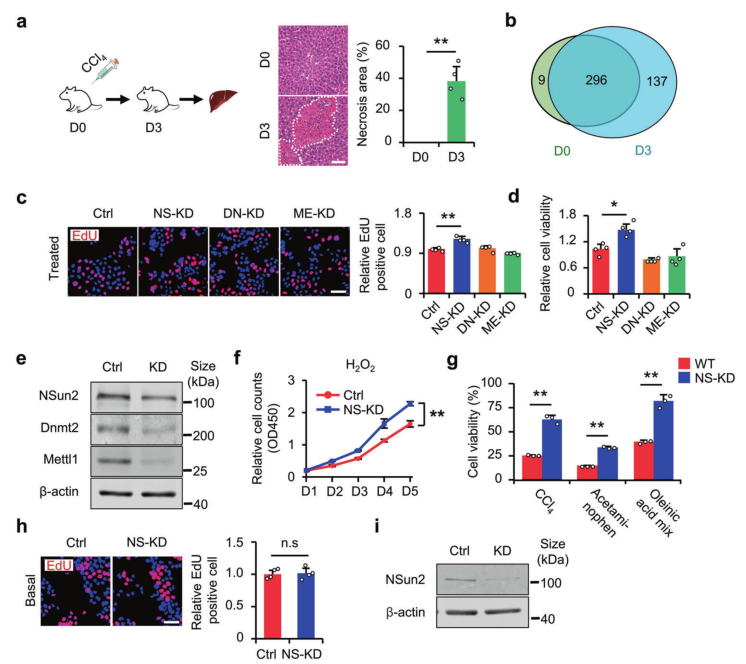
图1 NS-KD改善细胞损伤。
2、NS-KD在体内改善肝损伤
如上所述,NSun2的缺失是研究tsRNAs的一个合适模型,可以改善细胞在应激下的增殖和存活。因此,作者通过CRISPR/Cas9介导的NSun2基因第2外显子56 bp的缺失,产生了NS-KO小鼠(图2a)。在没有应激损伤的情况下,NS-KO没有引起肝脏形态学和病理生理的异常(图2b),这表明NS-KO和由此产生的tsRNAs在没有应激的情况下都没有功能。通过腹腔注射(i.p) CCl4模拟短期或长期肝损伤(图2c),证明NS-KO对应激损伤和肝损伤有反应。单次注射CCl4后第3天,肝脏出现坏死和炎症;第27天,观察到纤维化;NS-KO小鼠的坏死程度低于野生型小鼠(图2d)。随后检测了单次或多次注射CCl4后的血液生化指标。丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和碱性磷酸酶(ALP)浓度在单次注射CCl4后第3天达到最大值,表明肝细胞损伤相当严重,随后在重复注射CCl4后第27天降至相对正常水平;NS-KO小鼠的3项指标均低于WT小鼠,提示NS-KO小鼠肝损伤轻微(图2e, f)。此外,与WT小鼠相比,NS-KO小鼠在肝损伤第3天增殖肝细胞数量明显增加(图2g);相反,NS-KO小鼠的干细胞凋亡显著下降(图2h)。在应激状态下,促增殖、促生存和抗炎相关基因的表达增加,而抗增殖、抗生存和抗炎相关基因的表达受到抑制(图2i)。总之,在短期和长期肝损伤中,观察到NS-KO小鼠的肝损伤比WT小鼠轻,表明NSun2缺失可减轻体内肝损伤。

图2 NS-KO改善肝坏死、再生和活体存活
3、NS-KO衍生的小RNA可改善应激下的增殖和存活
作者假设,NS-KO可通过NS-KO衍生的小RNA防止肝损伤。为验证这一假设,首先敲除HL-7702细胞系中的NSun2,将没有酶活性的突变体NSun2(K190M或C271A)转染到HL-7702细胞系中,并细胞毒性刺激。EdU和细胞增殖实验表明,只有WT NSun2能抑制NSun2敲除引起的细胞增殖促进(图3a、b、d),而NSun2突变体(K190M或C271A)不能。同样,只有WT NSun2 能逆转NS-KD引起的细胞活力增加,而NSun2突变体则不能(图3c, d)。这些结果表明,NSun2的缺失主要通过tRNA甲基转移酶活性的丧失来促进细胞在胁迫下的增殖和存活。在NS-KO细胞中,tRNA表达降低(图3e)。变异最显著的修饰是tRNA m5U和之前描述的m5C,在NS-KO样本中,两者都显著降低(图3f, g)。
上述发现表明,NS-KO通过失去其甲基转移酶活性,同时减少tRNA m5U和m5C修饰来发挥作用。随后研究NS-KO衍生的小RNA是否足以改善细胞在压力下的增殖和存活。从WT和NS-KO小鼠体内分离出14-50 nt和50-100 nt的肝脏RNA片段(图3h)。由于tsRNAs的大小通常小于50 nt,所以将14-50 nt的RNA视为含tsRNAs的RNA,将50 - 100 nt的RNA视为非tsRNAs和阴性对照。EdU表明,转染NS-KO小鼠的14-50 nt RNA片段比转染WT小鼠的片段更能促进细胞增殖(图3i),而50 - 100 nt的RNA不改变两组的增殖。CCK-8实验显示,来自NS-KO小鼠的14-50 nt RNA片段,而不是来自WT小鼠的14-50 nt RNA片段和来自两种小鼠的50-100 nt RNA片段,增加损伤后的细胞存活率(图3j)。因此,NS-KO来源的14-50 nt RNA片段在促进损伤后细胞增殖和存活方面发挥了重要作用。

图3 NS-KO衍生的tsRNAs减轻肝损伤
4、tRF-1是NS-KO的核心产物
为全面分析tsRNAs的代谢特征,分析WT和NS-KO小鼠不同应激损伤后tsRNAs的差异,tsRNA-seq鉴定到841个未记录的tsRNA和104个记录在tRFdb数据库中的已知tsRNA(图4a)。NS-KO小鼠的tsRNAs在整个损伤过程中保持相对较高的水平,而tsRNAs在WT D3时达到峰值(图4b)。因此,作者猜想在整个CCl4重复注射过程中,第3天是肝细胞增殖和tsRNA生成最活跃的时间(图2g, 4b),NS-KO小鼠可能具有与WT D3小鼠相似的“促修复tsRNA模式”。
在进一步分析WT和NS-KO小鼠肝损伤不同阶段的tsRNAs图谱后,发现与其他tsRNAs相比,NS-KO小鼠的tRF-1s突然增加。在所有肝损伤时间点,NS-KO组的tRF-1s都明显多于WT组,但WT组只在第3天有所增加(图4c,d)。对tRF-1s的详细分析显示,tRF-1s的长度主要在14到23 nt之间(图4d)。总的来说,NSun2缺失主要在肝脏中产生14-23 nt的tRF-1s。此外,NS-KO小鼠的tRF-1表达高于WT小鼠,而其他类型的tsRNAs在NS-KO小鼠中的表达低于WT小鼠(图1e)。总之,tRF-1是NS-KO阻止肝损伤和响应压力应激的核心产物。
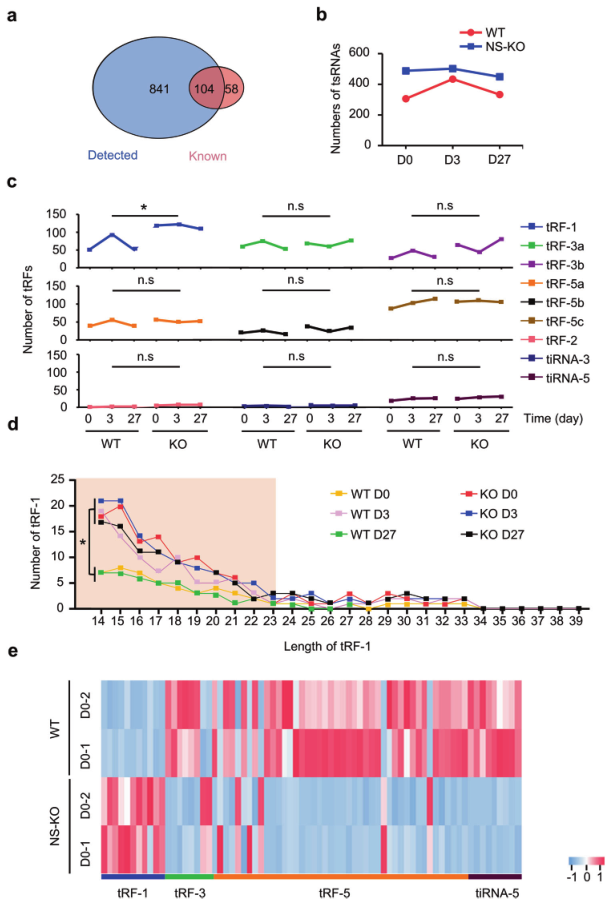
图4 tsRNA-seq显示应激条件下WT和NS-KO小鼠中tRF-1的特征
5、筛选的tRF-1在体外和体内对肝损伤有拯救作用
如上所述,肝损伤的副产物主要是tRF-1s。为阐明tRF-1s是否可以作为治疗肝损伤的一种潜在方法,人工合成了图4所示的68个tRF-1s。用硫代磷酸酯(PS)、2'-O-甲基(2'-OMe)和胆固醇修饰tRF-1s,以提高其稳定性和体内转染效率(图5a)。然后,将人工合成的 tRF-1s 转染到HL-7702细胞和原代人类肝细胞(PHH)中,并在体外和体内验证它们的功能。EdU试验表明,合成的tRF-1s能促进细胞增殖(图5b)。CCK-8检测显示,过表达tRF-1s后细胞活力提高(图5c)。在PHH中,也得到了一致的结果(图5d,e)。为验证改良合成的tRF-1s在体内的功能,给肝损伤小鼠静脉注射tRF-1s。首先,选择了一种tRF-1(tRF-Met-CAT-049)来测定小RNA在体内的代谢时间过程。结果显示,tRF-Met-CAT-049在注射后第1天开始表达,第3天达到峰值。因此,只注射一次tsRNAs就治愈了肝损伤小鼠(图5f-i),因为注射的RNAs可以在这段时间内保持高水平表达。之后,进一步从68个潜在的tRF-1中筛选出最有效的tRF-1。作者发现,筛选到的tG026在体内可以改善肝损伤(图5j, k),NS-KO后tG026的表达增加(图5l, m)。综上所述,通过筛选,tG026可以改善上述肝损伤。
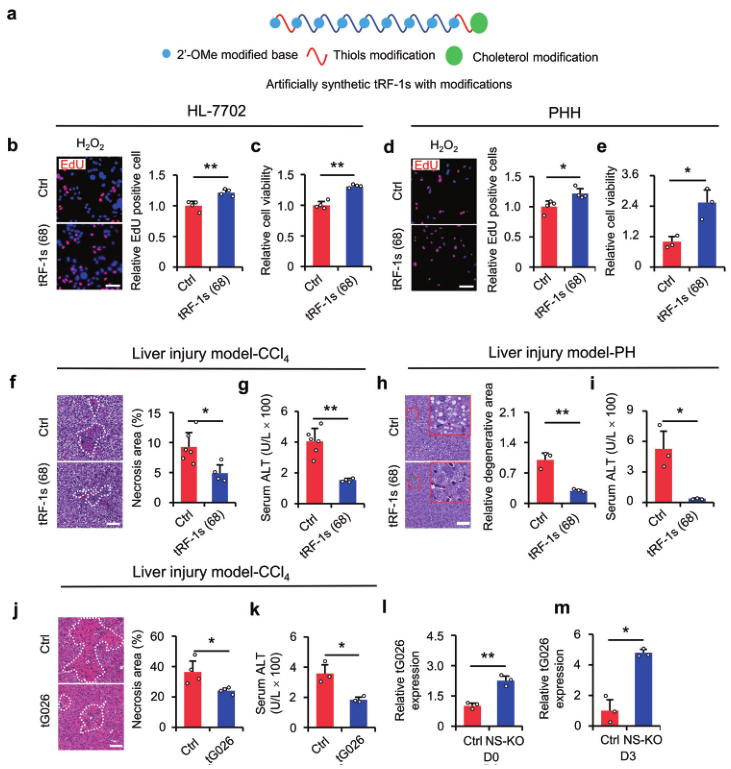
图5筛选的tG026促进了损伤后细胞的增殖和存活
6、tG026抑制TSR1与18S rRNA的相互作用以降低全局蛋白质合成
为探索tG026的潜在机制,进行RNA pull-down-LC-MS/MS检测,以筛选与tG026相互作用的蛋白质(图6a)。在寻找HL-7702和AML12细胞系中与tG026 相互作用的共同蛋白后(图6b),选择参与Pre-40S核糖体组装的前rRNA处理蛋白TSR1同源物(TSR1)进行后续实验。作者推测tG026可能会调控核糖体。通过RNA pull-down,验证了TSR1和tG026在两种细胞系中的相互作用(图6c,d)。tG026抑制TSR1与核糖体之间的相互作用,因为18S rRNA是核糖体复合物的重要组成部分(图6e, f)。最后,OP-Puro incorporation 实验证实tG026抑制全局蛋白质合成(图6g, h)。
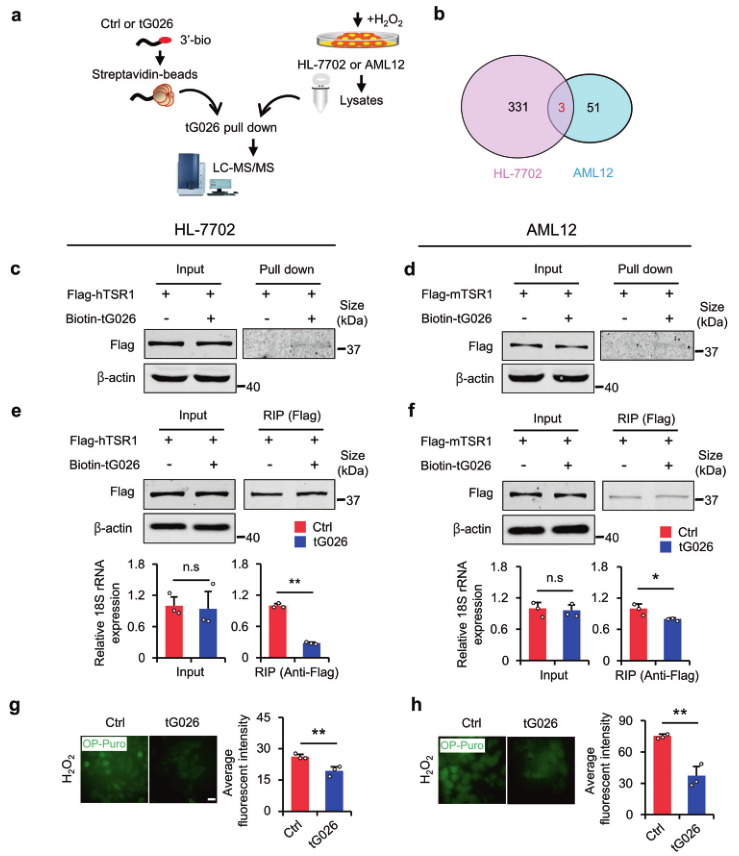
图6 tG026抑制TSR1与18S rRNA的相互作用以降低GPS
总而言之,缺失NSun2可减轻注射CCl4对肝脏造成的损伤。机制上,NSun2 的缺失会减少m5U和m5C的修饰。因此,tRNA变得不稳定并产生tsRNA,尤其是tRF-1。通过进一步筛选实验,发现tG026通过与TSR1相互作用,抑制了TSR1与18S rRNA之间的关联,从而减少了全局蛋白质合成,减轻肝损伤。
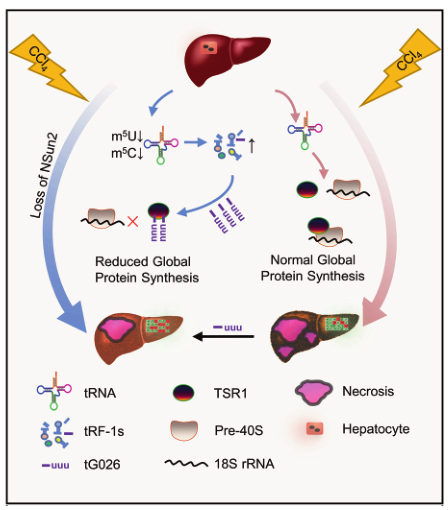
图7 tG026参与肝损伤的机制模型。
实验方法
肺损伤小鼠建模,转染,细胞增殖实验,细胞活力实验,WB,划痕实验,HE染色,免疫荧光,免疫组化,qRT-PCR,天狼星红染色,LC-MS检测tRNA修饰,small RNA测序,人工合成tsRNA和体内注射,肝部分切除术(PH),RNA pull-down,蛋白组学分析,RIP,体外和体内检测蛋白总体水平
参考文献
Ying S, Li P, Wang J, Chen K, Zou Y, Dai M, Xu K, Feng G, Zhang C, Jiang H, Li W, Zhang Y, Zhou Q. tRF-Gln-CTG-026 ameliorates liver injury by alleviating global protein synthesis. Signal Transduct Target Ther. 2023 Apr 3;8(1):144. doi: 10.1038/s41392-023-01351-5. PMID: 37015921; PMCID: PMC10073094.






