外泌体新发现!可抑制宫颈癌铁死亡!
摘要
诱导癌细胞铁死亡已被提议作为几种癌症类型的潜在治疗方法。肿瘤相关巨噬细胞(TAM)在促进肿瘤恶性进展和治疗耐药性方面起关键作用。然而,TAM在调节肿瘤铁死亡中的作用和机制仍未被探索,仍然是个谜。这项研究表明,铁死亡诱导剂在体外和体内对宫颈癌显示出治疗效果。已发现TAM可以抑制宫颈癌细胞铁死亡。从机制上讲,包装成外泌体的巨噬细胞衍生的miRNA-660-5p被转运到癌细胞中。在癌细胞中,miRNA-660-5p减弱ALOX15表达以抑制铁死亡。此外,巨噬细胞中miRNA-660-5p的上调取决于自分泌IL4/IL13激活的STAT6途径。重要的是,在临床宫颈癌病例中,ALOX15与巨噬细胞浸润呈负相关,这也增加巨噬细胞降低宫颈癌中ALOX15水平的可能性。此外,单因素和多因素Cox分析均显示ALOX15表达是独立的预后因素,与宫颈癌的良好预后呈正相关。总之,这项研究揭示靶向TAM在基于铁死亡的治疗和ALOX15作为宫颈癌预后指标中的潜在效用。本文于2023年6月发表在《Acta Pharmaceutica Sinica B》IF:14.5期刊上。
技术路线

主要实验结果
1、肿瘤相关巨噬细胞抑制宫颈癌铁死亡
为测试巨噬细胞在调节宫颈癌细胞铁死亡方面的功能,作者测试用巨噬细胞CM处理的HeLa细胞对铁死亡诱导剂erastin的敏感性,该诱导剂抑制胱氨酸/谷氨酸抗转运系统Xc活性。如图1A和C,通过使用PI染色的细胞死亡检测,用来自TAM(TAMs-CM)的CM处理的HeLa和SiHa细胞相对于用单核细胞CM(Mo-CM)和M0巨噬细胞CM(M0-CM)处理的细胞对erastin具有更高的抗性。通过使用CCK-8测定来测量用TAMs-CM和三种铁死亡诱导剂处理的宫颈癌细胞HeLa和SiHa的细胞活力,发现TAMs-CM显着抑制厄拉斯汀,RSL3(GPX4抑制剂)和索拉非尼(系统Xc抑制剂)在这两个细胞中的细胞活力降低(图1B)。
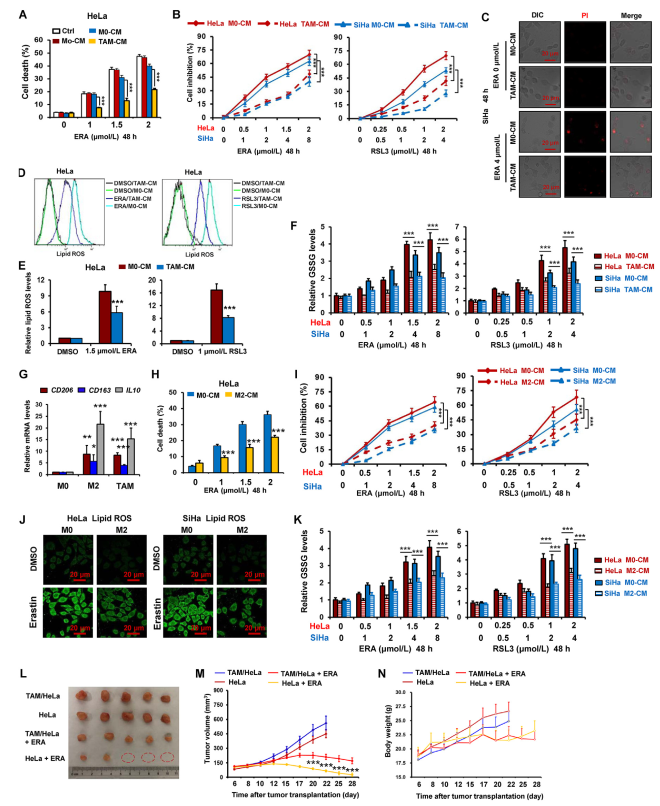
图1肿瘤相关巨噬细胞抑制宫颈癌的铁死亡
鉴于脂质过氧化是铁死亡过程中的重要事件,因此作者研究TAM对erastin和RSL3产生脂质ROS的影响。如图1D和E所示,TAM显著抑制HeLa细胞中这两种药物引起的脂质ROS的爆发。在索拉非尼处理的HeLa细胞中观察到相同的结果(图1)。通过检测另外两个铁死亡标志物MDA和GSSG,作者进一步验证TAM抑制宫颈癌细胞HeLa和SiHa中的铁死亡(图1F)。
先前的研究显示TAM类似于M2型巨噬细胞。因此,作者探究M2巨噬细胞是否也能减轻宫颈癌细胞的铁死亡。如图1G所示,在TAMs和IL4诱导的M2巨噬细胞(M2)中M2巨噬细胞标志物CD206、CD163和IL10的水平明显升高。图1H和I表明,由erastin和RSL3诱导的细胞死亡被M2 CM显著降低。此外,在HeLa和SiHa细胞中,厄拉斯汀和/或RSL3对脂质ROS,GSSG和MDA的诱导显著减弱(图1J和K)。
为进一步测试TAMs对体内宫颈癌细胞铁死亡的影响,作者评估裸鼠HeLa细胞混合TAMs异种移植物中erastin的抗肿瘤活性。如图1L和M所示,厄拉斯汀显著抑制肿瘤生长,erastin的抗肿瘤作用被TAMs明显减弱。此外,在接受erastin治疗的小鼠中没有观察到明显的体重损失(图1N),这表明该药物在体内的毒副作用很小。
2、TAMs通过外泌体抑制宫颈癌铁死亡
先前的研究表明,肿瘤微环境中的微囊泡和外泌体促进肿瘤进展和转移。为探究TAM分泌的外泌体是否增强宫颈癌对铁死亡的抵抗力,采用超高速离心去除TAMs-CM中的外泌体,然后利用TAMs-CM联合erastin和RSL3治疗HeLa和SiHa细胞。作者推测TAMs衍生的外泌体可以预防铁死亡。为验证这一假设,通过离心收集TAMs-CM中的外泌体。外泌体的大小分布和形态分别采用NTA和TEM表征。如图2A-C所示,外泌体大小异质,TAMs-CM的平均直径为128±25 nm,M159-CM的平均直径为21±0 nm。通过蛋白质印迹,作者进一步检测外泌体的阳性标志物CD63和CD81,以及表征外泌体的阴性标志物Calnexin。图2D表示CD63和CD81在M0和TAM的外泌体中均高表达,在M0和TAM中表达低。此外,在M0和TAM的外泌体中都没有Calnexin的表达(图2D)。
为评估来源于巨噬细胞的外泌体在调节宫颈癌细胞铁死亡中的功能,分离巨噬细胞外泌体并与erastin处理的HeLa细胞共培养。作者发现,TAMs和M2巨噬细胞来源的外泌体显著抑制erastin诱导的铁死亡(图2E)。此外,通过CCK-8测定,在用TAMs或M2巨噬细胞衍生的外泌体与erastin或RSL3或索拉非尼联合处理的HeLa和SiHa细胞中测量细胞活力。结果表明,TAM和M2巨噬细胞来源的外泌体都明显减弱三种铁死亡诱导剂对细胞活力的降低(图2F,G)。通过检测脂质ROS、MDA和GSSG,进一步验证TAMs来源的外泌体抑制宫颈癌症细胞HeLa和SiHa中的铁死亡(图2H,I)。
为可视化宫颈癌细胞中的外泌体摄取,从TAM中分离外泌体并用CM-DiI标记,然后将HeLa和SiHa细胞与CM-DiI标记的外泌体孵育不同时间。然后,通过流式细胞术检测外泌体的内化。如图2J和K所示,具有CM-DiI标记的外泌体的细胞数量以时间依赖性方式增加。通过共聚焦显微镜,在0和24小时观察到内化荧光标记的外泌体。如图2L和M所示,作者发现HeLa和SiHa细胞都可以有效地吸收外泌体。
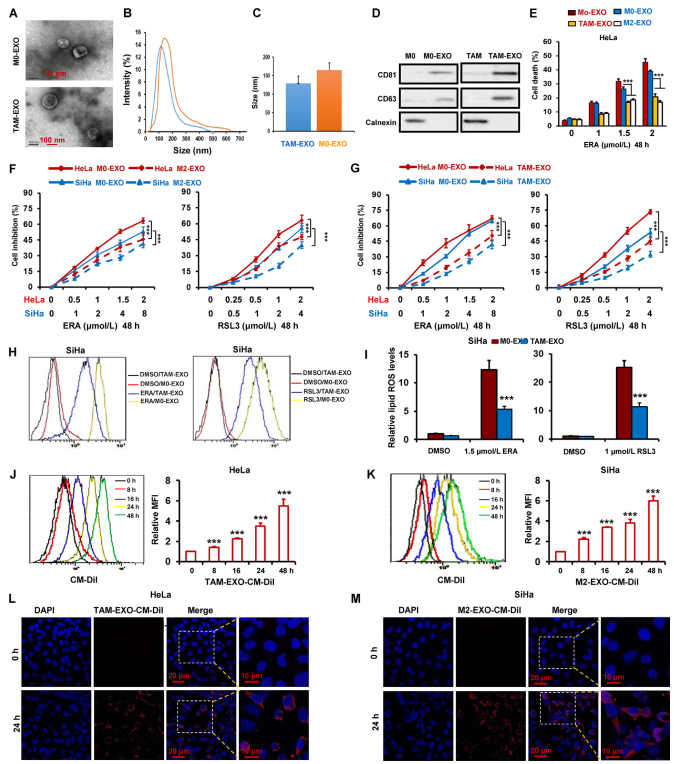
图2 TAM通过外泌体抑制宫颈癌铁死亡
3、TAMs对宫颈癌铁死亡的抑制与ALOX15的下调有关
为探究TAMs抑制铁死亡的分子机制,作者通过RT-PCR检测铁死亡相关基因的mRNA水平,包括NCOA4,BECN1,FTH1,ALOX12,ALOX15,NRF2,FSP1,SCD1,TFRC,LPCAT3,HMGCR,CBS,ATP5G3,CS,P53,ACSL4,GPX4,SLC7A11和LSH。如图3A所示,通过与M0-CM相比,作者发现TAMs-CM显著降低HeLa和SiHa细胞中的ALOX15 mRNA水平并略微增加GPX4 mRNA水平。为同时将TAMs-CM改变的基因水平上的倍数变化与全局水平的统计学意义相关联,以log2倍变化为x轴,log10(P值)为y轴。如图3B和C所示,火山图显示TAMs-CM处理组相对于HeLa和SiHa细胞中M0-CM组的基因表达差异。红点代表选定的ALOX15基因。这些结果表明,ALOX15是两个宫颈癌细胞中TAMs-CM最显著的下调基因。为进一步确认TAMs-CM降低的ALOX15的表达,用PBMC和THP-1衍生的TAM或M2巨噬细胞的条件培养基或纯化外泌体处理HeLa细胞。然后,分别通过RT-qPCR和蛋白质印迹检测ALOX15 mRNA和蛋白质水平。如图3D-F所示,ALOX15的mRNA和蛋白质水平因条件培养基或TAM或M2巨噬细胞来源的外泌体而显著降低。在用TAM-CM处理的HeLa细胞中检测到几种重要的铁死亡调节因子FSP1,ACSL4,DHODH和GPX4蛋白表达。
此外,作者在异种移植肿瘤组织中检测到ALOX15的表达。如图3G所示,ALOX15在混合TAMs异种移植细胞肿瘤组织中的表达比HeLa细胞异种移植物单独存在时显著降低。为检测ALOX15下调与铁死亡抑制相关,两个宫颈癌细胞中ALOX15的表达被siRNA敲低,然后用erastin处理细胞。如图3H和I所示,敲低ALOX15显著减少erastin诱导的细胞死亡。为进一步证明ALOX15参与TAMs抑制的宫颈癌细胞铁死亡,ALOX15被TAMs处理的癌细胞中的siRNA耗尽,然后研究erastin诱导的铁死亡。如图3J和K所示,当ALOX15敲除时,TAM不能显著减弱宫颈癌铁死亡。
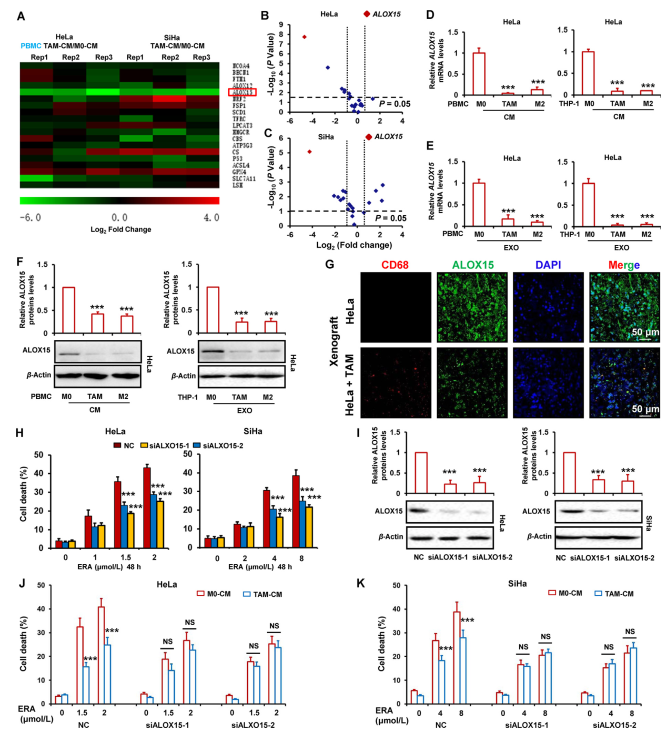
图3 TAM对宫颈癌症铁死亡的抑制与ALOX15的下调有关。
4、TAMs来源的外泌体miR-660-5p减弱ALOX15表达以抑制宫颈癌细胞中的铁死亡
研究表明巨噬细胞释放外泌体以将microRNA穿梭到肿瘤微环境中的相邻癌细胞中。据报道,42个microRNA在M2巨噬细胞来源外泌体中显著上调,PBMC来源的M2巨噬细胞中有667个microRNA显著增加。作者从这两项研究中获取microRNA的交集,发现10种常见的microRNA(图4A,B)。接下来,作者将这10个microRNA模拟物转染到HeLa细胞中并检测ALOX15表达。如图4C所示,ALOX15水平被miR-936和miR-660-5p降低。MiR-660-5p对ALOX15表达的抑制作用最显著。此外,miR-660-5p在TAMs和M2巨噬细胞中的表达明显高于单核细胞(Mo)和M0巨噬细胞,以及HeLa和SiHa细胞(图4D)。在TAM、Mo、M0和M2巨噬细胞的外泌体中也检测到miR-660-5p水平。如图4D所示,相对于Mo和M0巨噬细胞,TAMs和M2巨噬细胞衍生的外泌体中miR-660-5p水平显著增加。
为研究miR-660-5p在介导TAMs抑制宫颈癌症细胞ALOX15表达中的作用,用miR-660-5p抑制剂转染HeLa细胞,然后用M0巨噬细胞和TAMs的CM和外泌体处理。通过RT-qPCR和蛋白印迹分别检测ALOX15的mRNA和蛋白水平。图4E和F表明,相对于对照M0巨噬细胞,ALOX15的表达被TAMs的CM或外泌体显著抑制,而miR-660-5p抑制剂明显逆转CM或TAMs来源外泌体对ALOX15表达的减少。
由于microRNA主要通过与基因的mRNA结合来减弱基因表达,因此作者探究miR-660-5p是否与ALOX15基因的mRNA结合。利用在线miRNA靶生物信息学预测数据库miRWalk预测ALOX660编码序列(CDS)中保守的miR-660-5p靶位点(图4G)。为进一步确认miR-660-5p对ALOX6605的靶向,进行荧光素酶活性测定。将ALOX15的野生型(WT)或突变型(MT)CDS克隆到pGL3荧光素酶报告载体中萤火虫荧光素酶编码区的下游。载体与miR-660-5p模拟物或抑制剂共转染到HeLa细胞中。正如预期的那样,作者发现miR-660-5p模拟物急剧降低荧光素酶活性,而miR-660-5p抑制剂显著增加荧光素酶活性(图4H)。此外,在转染MT报告载体的HeLa细胞中,miR-660-5p模拟物和抑制剂对荧光素酶活性没有明显变化(图4H)。在HeLa和SiHa细胞中,作者也显示出模拟物和抑制剂可以明显降低和诱导ALOX15 mRNA表达(图4I)。用荧光素酶报告载体转染的HeLa细胞与ALOX15的WT或MT CDS进一步用TAM-和M2巨噬细胞-CM处理,然后检测荧光素酶活性。图4J表明TAMs和M2巨噬细胞-CM 显著下调WT CDS转染HeLa细胞报告载体中的荧光素酶活性,但不下调MT CDS。
为研究miR-660-5p在TAMs抑制的铁死亡中的作用,用miR-660-5p抑制剂转染HeLa和SiHa细胞,并与TAM的CM和外泌体一起孵育。然后用erastin和RSL3处理这些细胞。通过检测细胞死亡,作者发现CM和外泌体对细胞死亡的减少被miR-660-5p抑制剂完全阻断(图4K和L)。这一结果表明,宫颈癌细胞中内源性miRNA-660-5p的表达太低,无法影响细胞铁死亡反应。
此外,采用肿瘤异种移植裸鼠模型评估miR-660-5p在介导TAMs诱导的宫颈癌体内铁死亡抵抗中的作用。如图4M,在厄拉斯汀治疗后,异种移植肿瘤与miR-660-5p抑制剂高表达HeLa细胞和TAMs联合生长比TAMs和对照HeLa的肿瘤生长更快,更大。然而,在那些单独使用HeLa的肿瘤中,miR-660-5p抑制剂未能改变肿瘤对erastin的敏感性。
为直接观察TAMs衍生的miRNA进入肿瘤细胞,将HeLa和SiHa细胞与在宫颈癌细胞中转染FAM标记的miR-660-5p模拟物的TAM共培养(图4P),并通过荧光显微镜观察。图4N显示HeLa和SiHa细胞中都存在FAM荧光。此外,流式细胞术分析显示,用FAM标记的microRNA转染的两个癌细胞(图4O).
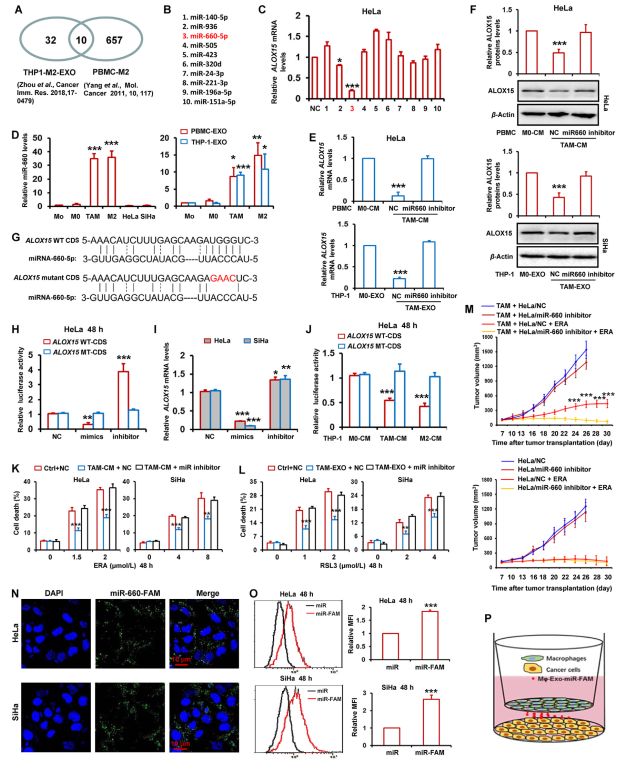
图4 TAMs来源的外体miR-660-5p减弱ALOX15的表达,以抑制宫颈癌细胞铁死亡
5、IL4/IL13通过激活STAT660途径诱导miR-5-6p表达
作者发现miR-660-5p在TAM和M2巨噬细胞中均过表达。据报道,TAM的许多特性也是M2巨噬细胞的特征。几种细胞因子在两种细胞中均有表达,如IL6、IL10、IL4、IL13和TGF-β。因此,作者想知道这些因素的表达是否与miR-660-5p有关。通过RT-qPCR测定,作者发现在TAMs中,IL4和IL13以剂量依赖的方式增加miR-660-5p的水平(图5A),而IL6,IL10和TGF-β不影响miR-660-5p水平(图5B和C)。先前的研究表明,STAT3和STAT6激活是IL4和IL13的原因。因此,作者假设TAM中IL3和IL6激活的STAT4和STAT13与miR-660-5p表达相关。通过抑制TAM中STAT3和STAT6的活化,作者发现IL660和IL5对miR-4-13p的诱导被STAT6抑制剂而不是STAT3抑制剂显著减弱(图5D和F)。蛋白质印迹结果显示,两种抑制剂分别显著降低p-STAT6和p-STAT3(即活化的STAT6和STAT3)(图5E和G)。图5H还表明IL4和IL13均显著增加TAMs外泌体中的miR-660-5p水平,而IL660和IL5诱导的miR-4-13p水平明显减弱。通过检测巨噬细胞中的miR-660-5p和p-STAT6表达,作者发现miR-660-5p和p-STAT6在TAMs和M2巨噬细胞中的水平明显高于M0巨噬细胞(图5I-L)。为研究STAT660抑制剂对miR-5-6p表达的抑制是否减弱TAM诱导的铁死亡抵抗力,将带有Hela混合TAM的异种移植肿瘤与STAT6抑制剂和erastin联合治疗。如图5M所示,STAT6抑制剂显著减弱TAM诱导的对erastin的耐药性。然而,在单独使用Hela的异种移植肿瘤中,作者发现STAT6抑制剂还增强erastin(图5N)。在两种肿瘤模型中,单独使用STAT6抑制剂发挥一定的抗肿瘤作用(图5M和N)。这表明STAT6抑制剂增强erastin-抗肿瘤作用可能参与TAM中miR-660-5p表达的抑制和肿瘤细胞中STAT6活性的抑制。此外,注射erastin和STAT6抑制剂的小鼠体重没有显著变化(图5O和P)。
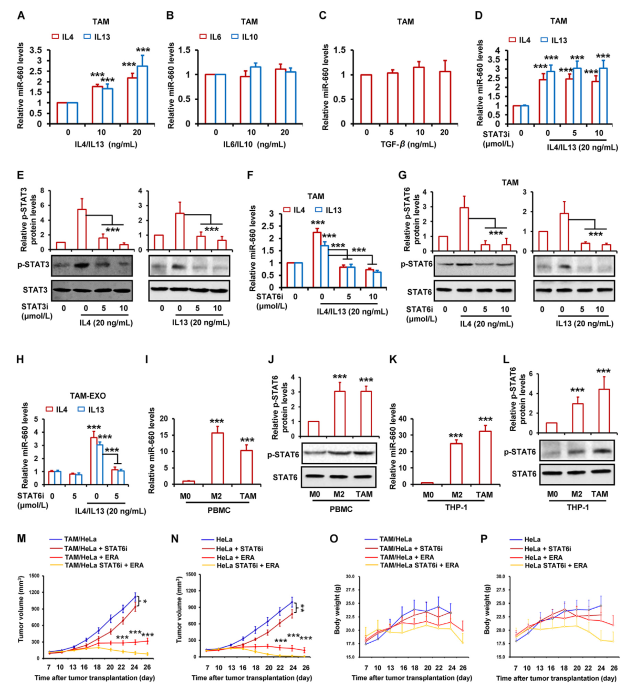
图5 IL4/IL13通过激活STAT6途径诱导miR-660-5p表达
6、ALOX15与巨噬细胞浸润呈负相关,与良好预后呈正相关
为进一步证实TAMs抑制宫颈癌中的ALOX15表达,分析TCGA中高表达与低表达ALOX15宫颈癌组织中免疫细胞群的丰度。图6A显示高表达ALOX15宫颈癌组织中巨噬细胞丰度显著降低。此外,作者通过热图来可视化28个浸润免疫细胞群(图6B)。结果表明,与高表达的ALOX15组织相比,低表达ALOX15宫颈癌组织中巨噬细胞的标准化ssGSEA评分显著更高。上述结果提出浸润TAMs抑制宫颈癌细胞ALOX15表达的可能性。
此外,ALOX15表达与TCGA中宫颈癌症OS和无病生存率呈正相关(图6C和D)。此外,郑州大学进一步分析ALOX15表达与宫颈癌预后的关系。通过使用IHC染色,研究ALOX15在147个石蜡包埋的存档宫颈癌组织中的表达。组织包括53个Ib1期,28个Ib2期,31个IIa1期和35个IIa2期肿瘤。在147个样品中,在82个样品中检测到ALOX15蛋白的高表达,在其余65个样品中观察到ALOX15的低水平(表1和图6E)。患者生存率分析显示,宫颈癌症患者的ALOX15表达与OS之间存在明显的正相关性(图6F)。
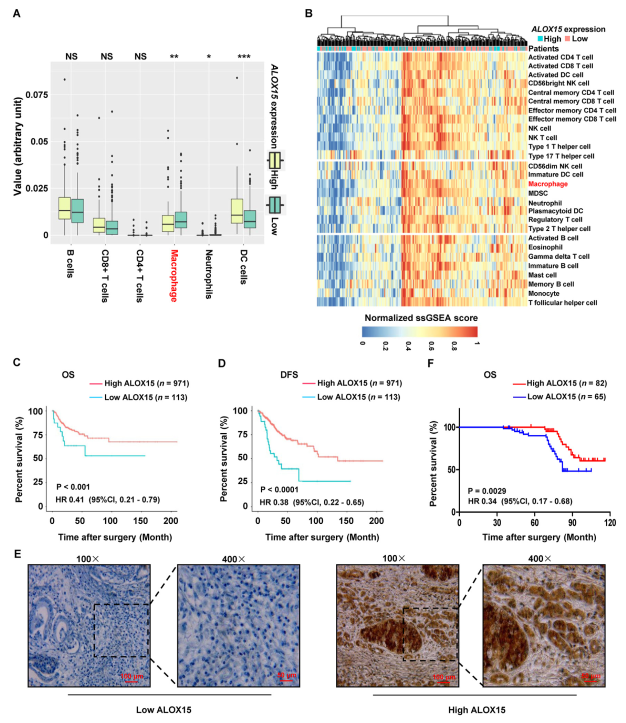
图6 ALOX15与巨噬细胞浸润和良好预后有关
根据宫颈癌患者IHC评分,分析ALOX15水平与临床病理特征的相关性。如表1,高ALOX15表达与肿瘤大小、复发率和5年内生命状态呈显著负相关。然而,其他不良的临床病理特征,如年龄和FIGO分期,与ALOX15表达没有显著相关性。为验证ALOX15表达与宫颈癌预后之间的关系,作者进行单变量和多变量Cox分析。单因素分析显示,肿瘤大小、淋巴血管间隙受累、T分类、盆腔淋巴结转移和ALOX15表达是OS的预后因素(表2)。多因素分析显示,淋巴血管间隙受累、T分类和ALOX15表达是独立的预后因素(表2)。
最后,该研究提供一个TAM增强宫颈癌对铁死亡抗性的示意图(图7)。
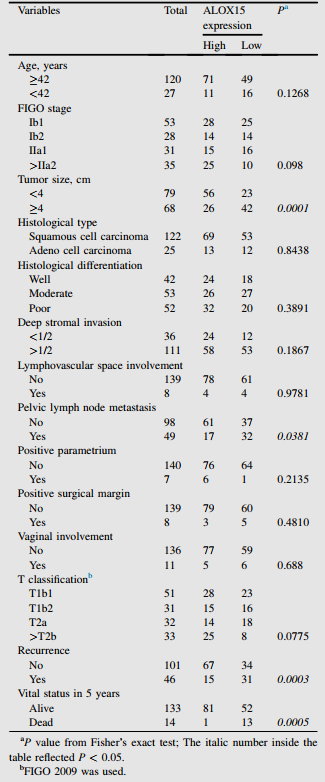
表1 ALOX15表达与宫颈癌临床病理特征的相关性
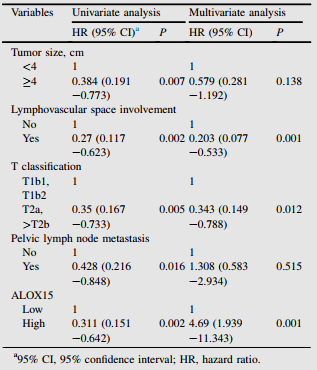
表2 癌症临床病理特征与总生存率相关的单变量多变量Cox回归分析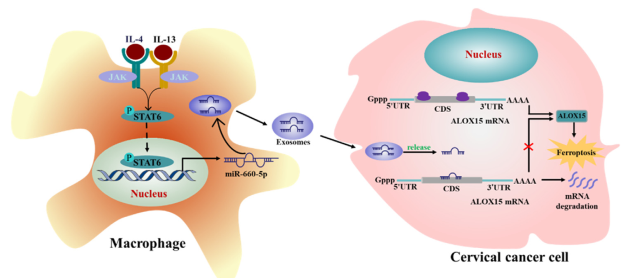
图7 TAM增强癌症对铁死亡抗性的示意图。一个说明TAM来源的外泌体miR-660-5p在调节ALOX15诱导的宫颈癌症细胞铁死亡中作用的假说模型。
总之,该研究表明TAMs通过分泌外泌体传递特殊信号分子来抑制宫颈癌细胞铁死亡的新功能。研究还为TME抑制的癌细胞死亡机制提供新的见解。此外,STAT6抑制剂增强铁死亡诱导剂的抗肿瘤作用,表明STAT6抑制剂与铁死亡诱导剂的联合应用可能是宫颈癌新的有前景的治疗方法。同时发现ALOX15表达与患者总生存期和无病生存期呈显著负相关,表明ALOX15可能是宫颈癌的预后标志物。
实验方法
细胞活力和细胞死亡测定,脂质ROS分析,丙二醛(MDA)和谷胱甘肽的测定,RNA干扰,双荧光素酶活性测定,RT-qPCR,WB,免疫荧光,外泌体纯化和标记,小鼠异种移植宫颈癌模型,透射电子显微镜(TEM)测定,免疫组织化学(IHC)分析
参考文献
Luo Y, Chen Y, Jin H, et al. The suppression of cervical cancer ferroptosis by macrophages: The attenuation of ALOX15 in cancer cells by macrophages-derived exosomes. Acta Pharm Sin B. 2023; 13(6): 2645-2662. doi:10.1016/j.apsb.2023.03.025






