己糖激酶2在肝细胞癌中通过促进AIMP2的自噬依赖性降解赋予放疗抵抗
随着技术的进步,放疗(RT)已成为肝细胞癌(HCC)有效的非手术治疗手段,全面提高了肝癌患者的局部控制率。然而,一些HCC患者在放疗后仍会出现放疗抵抗、癌症复发和远处转移。我们之前的研究表明,己糖激酶2 (HK2)是一种强效癌基因,在放疗抵抗的HCC细胞系中过表达;然而,其在HCC放疗抵抗中的作用尚不明确。本研究证实了HK2在HCC组织中的上调与HCC患者的不良预后有关,并证明HK2在HCC细胞系中通过减轻细胞凋亡和促进细胞增殖发挥抗放疗作用。HK2下调与电离辐射联合作用表现出良好的协同致死效应。机制上,HK2通过与AIMP2络合,增强其自噬溶酶体依赖性降解,从而减轻电离辐射介导的细胞凋亡,从而增加HCC的放疗抵抗。药理学上,酮康唑可作为HK2的抑制剂,协同增强RT的疗效。我们的研究结果表明HK2在肝细胞癌的放疗抵抗中起重要作用,可能是提高RT疗效的潜在治疗靶点。本文于2023年8月发表于Cell Death and Disease(IF=9.0)上。
技术路线
结果
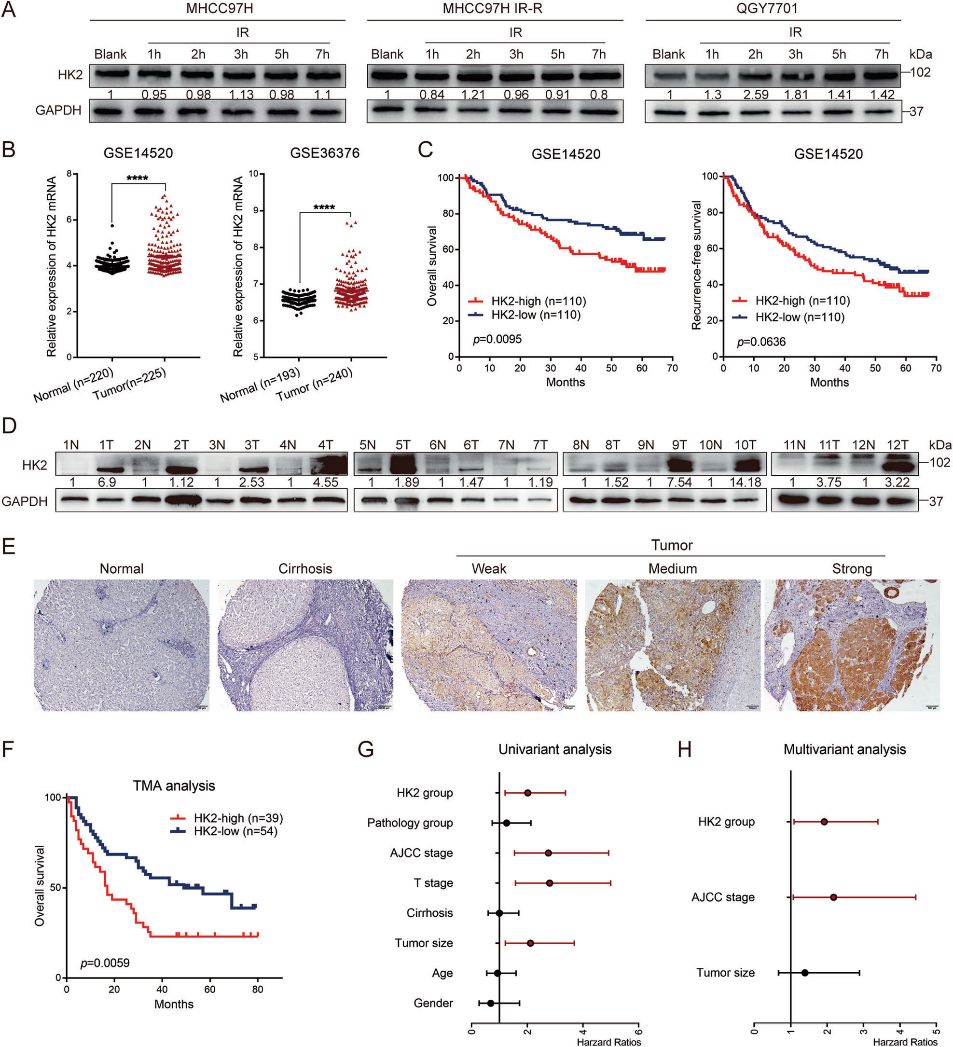
1)高HK2表达有助于肝细胞癌的放疗抵抗,并预示预后不良
在本研究中,我们观察到HK2蛋白水平在固有IR-R (QGY7701) HCC细胞系中随着时间的推移而升高,而在放疗敏感的HCC细胞系MHCC97H和MHCC97L中则保持不变。此外,在获得的IR-R细胞系中,HK2并没有随着时间的推移而上调(图1A),这可能是因为在IR-R细胞系构建过程中持续的放疗使高表达HK2的细胞群存活。因此,我们假设HK2是HCC中的放疗抵抗基因。为了评估HK2在HCC患者中的表达,我们分析了GEO数据库(GSE14520和GSE36376)。与邻近正常组织相比,HCC组织中HK2 mRNA水平升高(图1B)。Kaplan-Meier生存分析证实,较高的HK2 mRNA表达预示着较差的总生存期(OS)。虽然没有统计学差异,但高HK2表达的患者有更短无复发生存期(RFS)的趋势(图1C)。Western blotting显示,来自患者的HCC样本显示出更高的HK2蛋白水平(图1D)。HK2的免疫组化染色(IHC)显示,高HK2表达可预测较短的OS(图1E, 1F)。单因素和多因素分析显示,HK2高表达是HCC患者预后不良的独立危险因素(图1G,1 H)。这些数据验证了HK2在HCC组织中mRNA和蛋白水平上调,与HCC患者预后不良呈正相关。
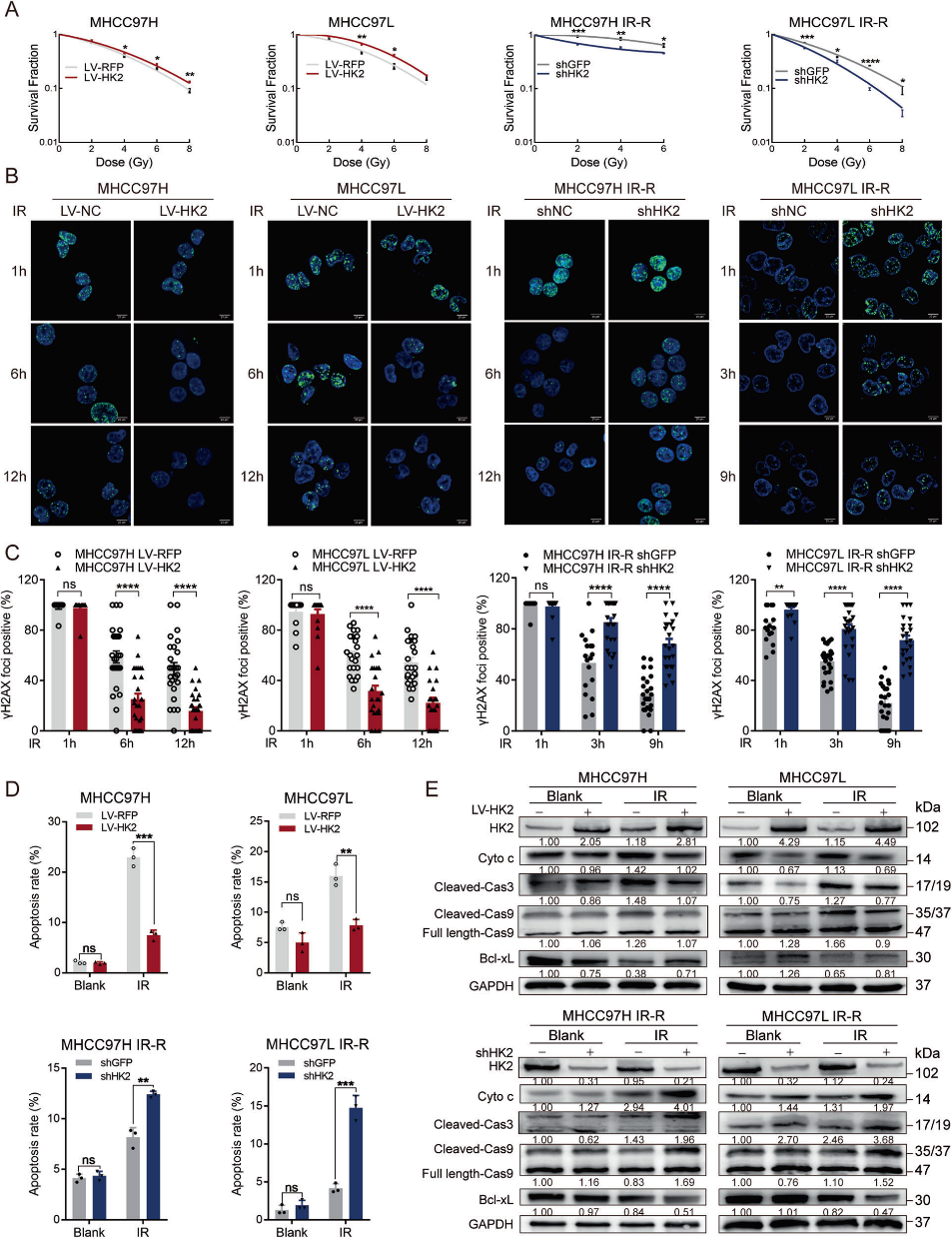
2)HK2在HCC细胞中引起显著的放疗抵抗
为了进一步研究HK2介导的放疗抵抗,我们在放疗敏感细胞系(MHCC97H和MHCC97L)中构建了稳定的HK2过表达细胞,在放疗抵抗细胞系(MHCC97H IR-R、MHCC97L IR-R和QGY7701)中构建了稳定的HK2敲低细胞。对这些编辑细胞系中的CCK8和集落形成进行了评估。经IR处理后,LV-HK2显著促进了放疗敏感细胞系的生长,而shHK2显著降低了放疗抵抗细胞系的生长(图2A)。为了评估HK2是否调节细胞对IR损伤的反应,在指定时间进行了组蛋白2A(pH2AX-Ser139)磷酸化的免疫荧光(IF)测定,这是DNA损伤修复的有效指标。pH2AX-Ser139核焦点在LV-HK2细胞中比在对照细胞中消散得更快,而shHK2在放疗抵抗细胞中则发挥相反的作用(图2B、2C)。由于IR可导致细胞死亡,我们对不同HK2水平的细胞进行了凋亡的流式细胞术(FCM)。虽然HK2的表达在没有IR的情况下对细胞凋亡没有显著影响,但LV-HK2可以减少IR诱导的细胞凋亡(图2D)。与平行细胞相比,shHK2与IR联合可协同促进放疗抵抗细胞的细胞凋亡(图2D)。Western blotting进一步证实,凋亡相关蛋白,包括Cyto c、Cleaved Caspase 3和Cleaved Caspase 9的水平下降,而抗凋亡蛋白Bcl-xL则随着HK2的过表达而升高(图2E)。这些结果表明HK2在体外调节HCC放疗抵抗中起着不可或缺的作用。
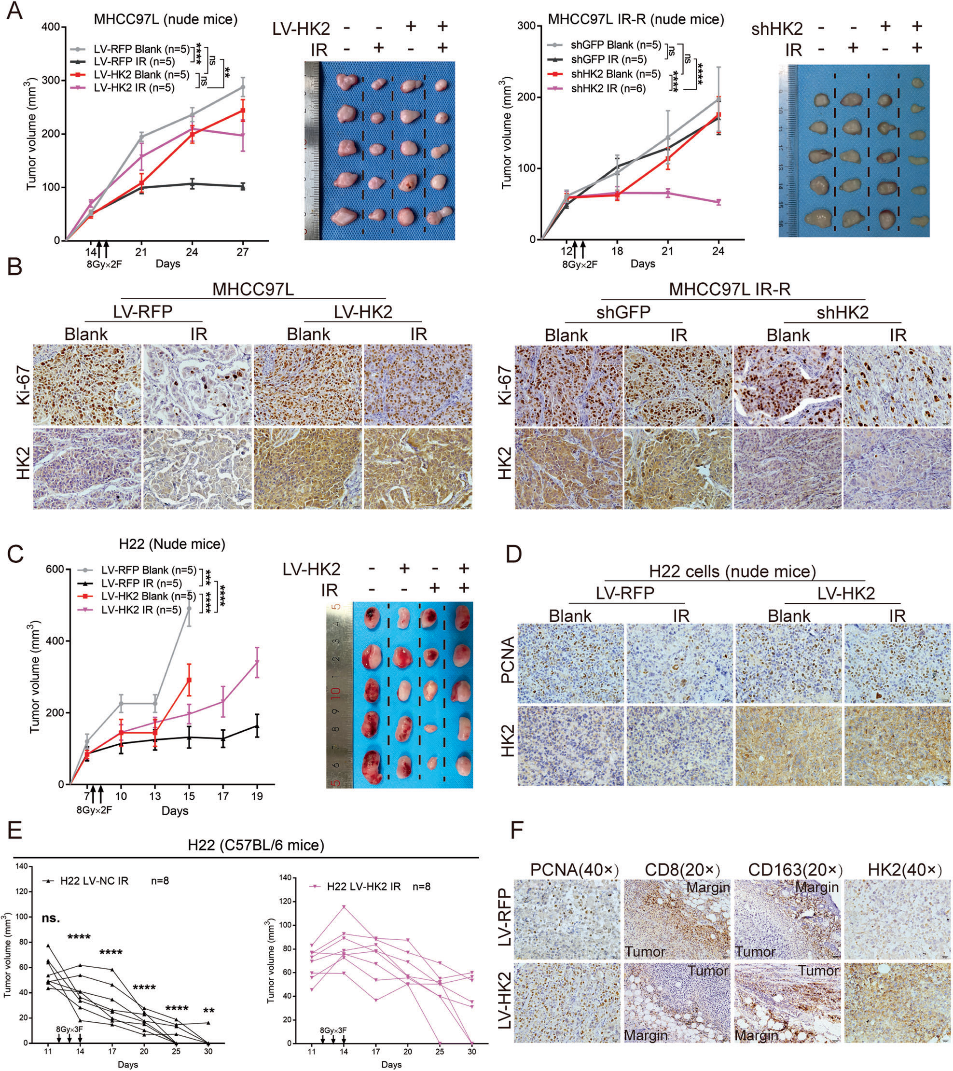
3)HK2在体内是一种抗放疗基因
在体外实验的基础上,我们通过建立裸鼠皮下异种移植模型来研究HK2在体内的作用。HK2过表达可以有效增强放疗抵抗,而HK2的低表达可以提高放疗敏感并抑制肿瘤生长(图3A)。我们通过IHC检测Ki67,观察到IR在平行组中显著抑制细胞增殖。而在HK2过表达组中,IR对细胞增殖的抑制作用不明显(图3B)。在放疗抵抗组中,IR对Ki-67的比例影响较小,而在shHK2组中,IR可显著抑制皮下肿瘤中Ki-67的比例(图3B)。我们进一步将小鼠来源的H22 HCC细胞植入裸鼠和C57BL/6小鼠皮下异种移植模型。在裸鼠模型中,IR后HK2过表达组的生长速度高于平行对照组(图3C)。通过检测增殖细胞核抗原(PCNA)阳性细胞的比例,我们发现LV-HK2在IR后增加了放疗抵抗并维持了增殖(图3D)。皮下接种H22 LV-RFP的C57BL/6小鼠中,肿瘤消退更快,更频繁(图3E)。随后的PCNA免疫组化表明,H22 LV-HK2细胞在IR后比H22 LV-RFP细胞增殖更活跃(图3F)。我们还研究了CD8+ T细胞和M2巨噬细胞的浸润情况。我们的数据显示,与接种H22 LV-RFP细胞的小鼠相比,接种H22 LV-HK2细胞的小鼠CD8+ T细胞浸润减少,M2巨噬细胞(CD163+)增加(图3F),这意味着HK2可能与IR协同作用抑制免疫系统,从而促进HCC的放疗抵抗。
4)HK2通过调节溶酶体依赖性自噬抑制AIMP2蛋白
为了探索HK2介导的放疗抵抗的分子机制,进行了免疫沉淀(IP)和银染色试验。使用特异性抗原带的质谱法获得AIMP2蛋白。这些结果在IR后MHCC97H LV-HK2和MHCC97L LV-HK2细胞中得到证实(图4A)。Western blotting结果显示,IR处理后,AIMP2在HK2过表达细胞系中显著下调,而在HK2敲低细胞系中上调(图4B)。根据先前的研究,HK2不作为转录因子。因此,我们推断HK2通过转录后修饰介导AIMP2下调。为了确认未编辑细胞中HK2和AIMP2之间的关系,我们进行了Co-IP。我们观察到HK2和AIMP2仅在IR后才在蛋白水平上共定位(图4C)。同时进行了IF。IR后,细胞质中HK2信号与AIMP2信号重叠,而没有IR时则不重叠(图4D)。这些结果证实了HK2和AIMP2在细胞和蛋白水平上的共定位。接着,我们使用自噬抑制剂氯喹(CQ)或蛋白酶体抑制剂MG-132预处理放疗敏感的LV-RFP和LV-HK2细胞,然后进行IR预处理。CQ处理成功逆转了AIMP2的下调,而MG-132处理则没有(图4E)。为了进一步研究自噬在AIMP2降解中的作用,WB检测了经典自噬相关蛋白LC3、P62和Beclin1的表达。与IR联合使用时,与LV-RFP组相比,LV-HK2上调Beclin1水平,增强LC3 II脂化,下调P62水平;而shHK2的作用则相反(图4F)。LC3 II的IF也与HK2的表达呈正相关(图4G, H)。自噬泡的透射电镜(TEM)图像显示,放疗抵抗细胞系在IR后比放疗敏感细胞系产生更多的自噬泡,进一步证明了HK2与自噬之间的关系(图4I)。转染mCherry-GFP标记的LC3 II后,在放疗抵抗细胞系中观察到更多的自噬泡和自噬通量上调(图4J)。这些结果表明HK2与IR联合上调自噬,并进一步降低AIMP2蛋白水平。
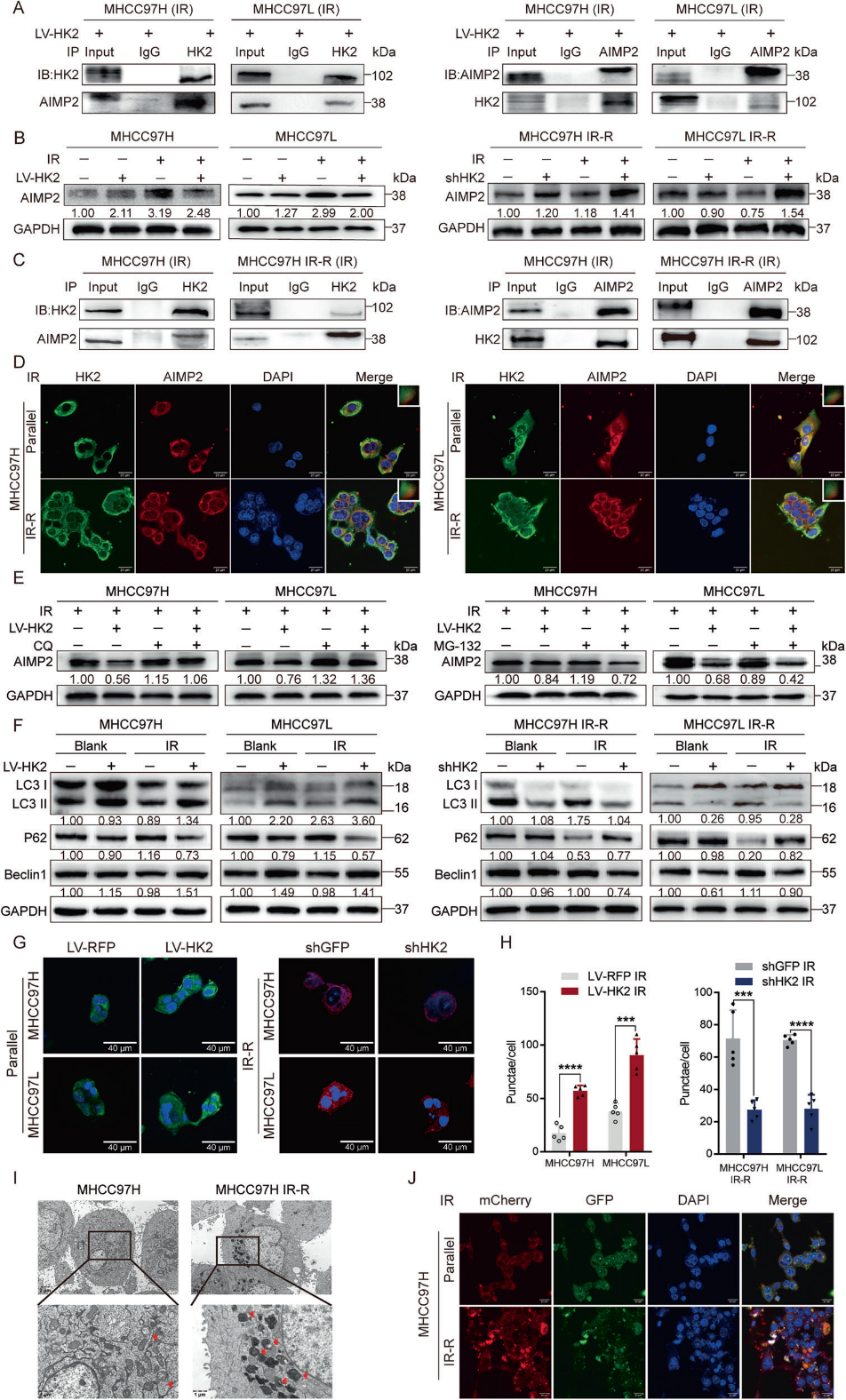
5)HK2的抗放疗效应部分是由AIMP2降解引起的
我们假设HK2在放疗抵抗中的作用部分是由AIMP2功能受损介导的。Western blotting和FCM显示siAIMP2能够部分逆转IR后shHK2引起的细胞凋亡上调(图5A, 5B)。相应地,LV-AIMP2部分促进IR后由于LV-HK2而减少的细胞凋亡(图5A,5B)。在体内,在IR后的MHCC97H LV-HK2和LV-RFP细胞中,AIMP2过表达减缓了肿瘤的生长。在LV-HK2组中,与对照组相比,高水平的AIMP2导致HK2过表达引起的肿瘤体积增加的保持(图5C)。Cyto C和Ki67的免疫组化表明,AIMP2的高表达增强了LV-HK2细胞的凋亡,部分抑制了HK2过表达引起的增殖增加(图5D)。这些结果表明HK2的放疗抵抗功能部分是由于AIMP2在体内的降解。
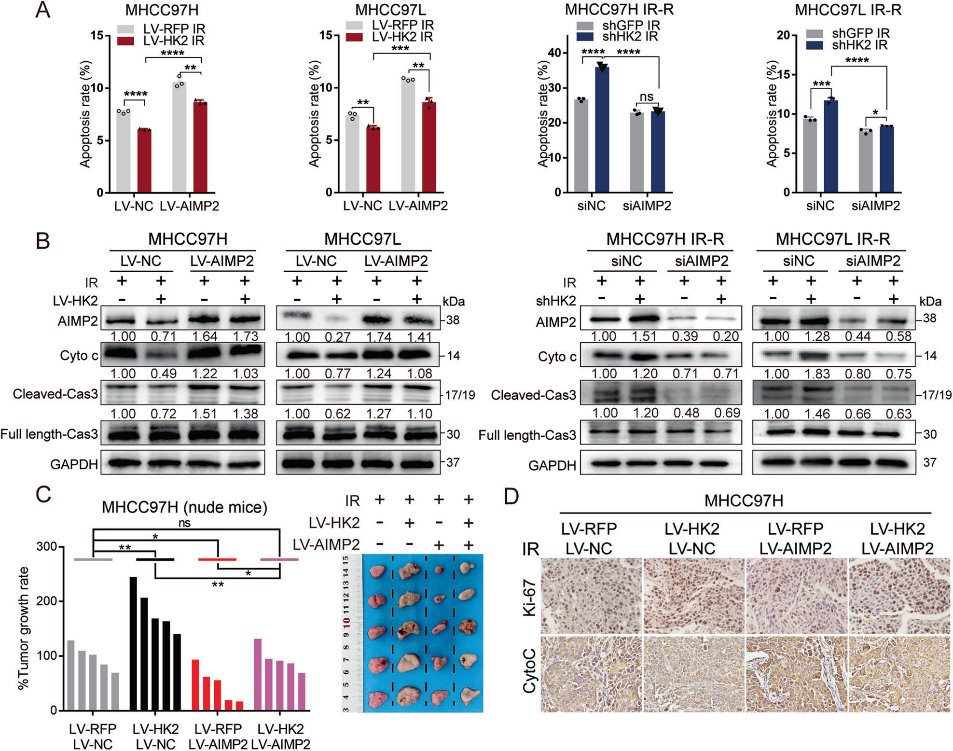
6)药理抑制HK2可显著减轻其抗放疗作用
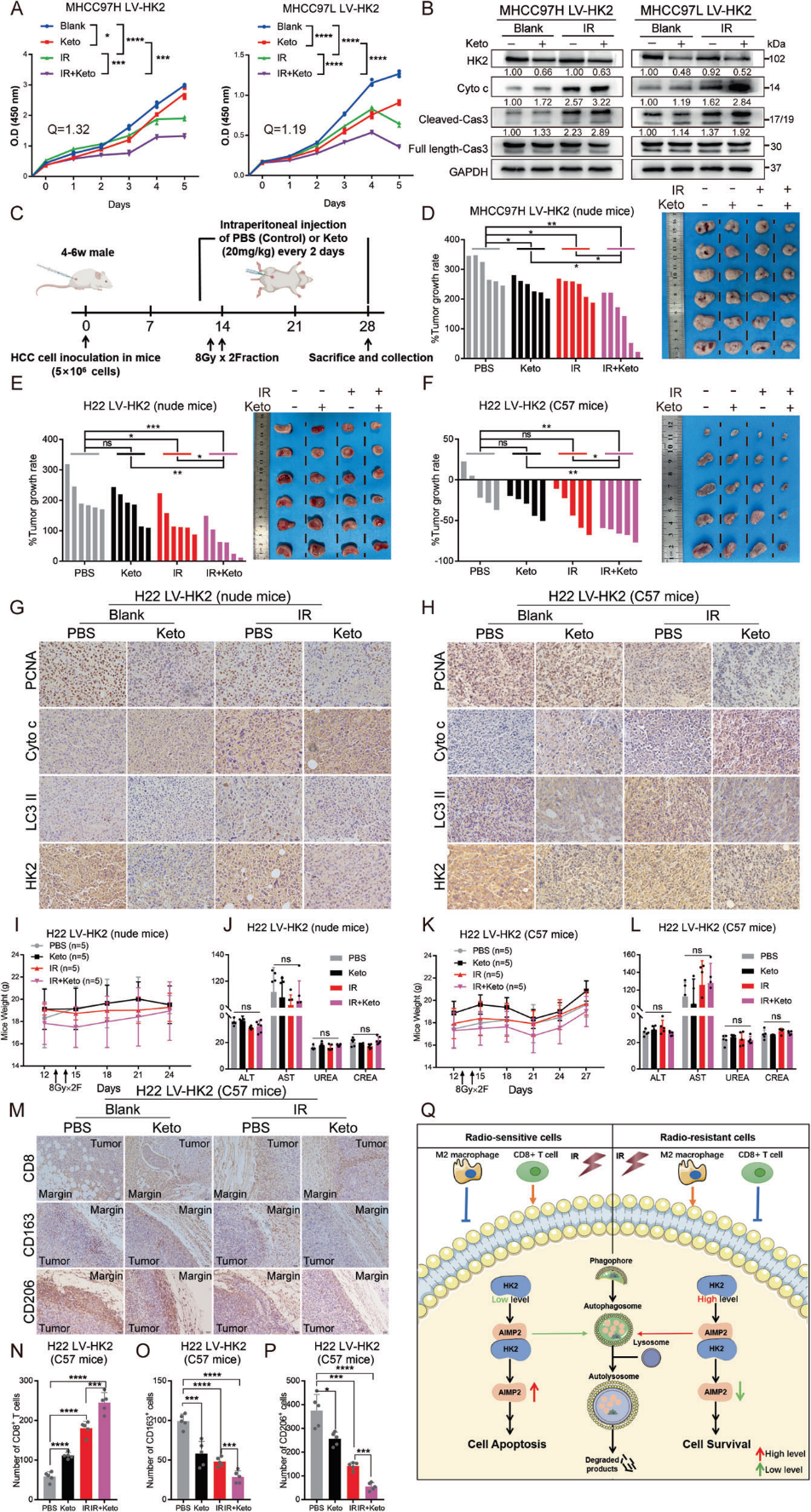
考虑到HK2在HCC中的主要表达,我们推测HK2抑制可能对HCC具有高度选择性。酮康唑(Ketoconazole, Keto)是FDA批准的常用抗真菌药物,通过靶向HK2抑制胶质母细胞瘤细胞增殖。CCK8实验显示,Keto治疗部分抑制细胞存活,而Keto和IR联合治疗进一步促进了协同致死效应(图6A)。Western blotting显示,Keto部分增强了LV-HK2细胞的凋亡水平,与IR结合进一步增加细胞凋亡(图6B)。随后建立MHCC97H LV-HK2或H22 LV-HK2裸鼠皮下异种移植模型。在IR治疗前一天开始腹腔注射Keto,并以20 mg/Kg的浓度每两天维持一次(图6C)。Keto和IR治疗均部分减少肿瘤体积并抑制肿瘤细胞增殖,而联合治疗可协同抑制肿瘤体积和生长速率(图6D, 6E)。免疫组化实验显示,与单独使用Keto或IR相比,Keto联合IR显著抑制了增殖和自噬,并提高了凋亡(图6G)。Keto治疗对小鼠体重和肝肾指标没有影响(图61、6J)。同样,联合治疗对H22 LV-HK2皮下移植C57BL/6小鼠肿瘤生长的抑制作用较其他治疗组明显(图6F)。免疫组化实验也显示了同样的结果(图6H)。同样,小鼠的体重和活力也没有受到影响(图6K、6L)。此外,联合治疗组肿瘤中CD8+ T浸润增加,M2巨噬细胞减少,表明联合治疗对免疫缺陷的逆转效果更好(图6M-6P)。这些体外和体内实验结果表明,HK2的药理靶向可能是HCC中IR的有效辅助手段,具有很大的临床转化潜力。
结论
这项研究揭示了HK2在HCC放疗抵抗中的作用。HK2可能成为HCC放疗的潜在治疗靶点。
实验方法
CCK8,克隆形成实验,WB,IHC,qRT-PCR,流式,免疫共沉淀,银染,免疫荧光。
参考文献
Zheng Y, Zhan Y, Zhang Y, Zhang Y, Liu Y, Xie Y, Sun Y, Qian J, Ding Y, Ding Y, Fang Y. Hexokinase 2 confers radio-resistance in hepatocellular carcinoma by promoting autophagy-dependent degradation of AIMP2. Cell Death Dis. 2023 Aug 1;14(8):488. doi: 10.1038/s41419-023-06009-2.






