抑制小胶质细胞和巨噬细胞自噬导致先天免疫反应加剧与脑损伤恶化!
创伤性脑损伤(TBI)后过度和长期的神经炎症会导致长期的组织损伤和不良的功能结果。然而,脑损伤后炎症反应加剧的机制仍然知之甚少。作者之前研究表明,小鼠脑外伤后神经元的巨噬/自噬通量受到抑制,并导致神经元细胞死亡。本研究中,作者证明自噬在活化的小胶质细胞和浸润性巨噬细胞中也受到抑制,这增强损伤诱导的神经炎症反应。巨噬细胞/小胶质细胞特异性敲除关键自噬基因Becn1导致TBI后神经炎症总体增加。特别是,作者观察到先天免疫反应的过度激活,包括I型干扰素和炎性体途径。损伤后小胶质细胞和巨噬细胞自噬缺陷与负责激活细胞先天免疫反应的危险/损伤相关分子模式(DAMP)的吞噬清除减少有关。作者的数据还证明精确自噬在靶向和降解先天免疫途径成分(如NLRP3炎性体)中的作用。最后,抑制小胶质细胞/巨噬细胞自噬导致脑损伤后神经变性增加和长期认知结果恶化。相反,在野生型小鼠TBI后,用雷帕霉素治疗增加自噬可以减少炎症并改善结果。总之,作者表明,抑制小胶质细胞和浸润性巨噬细胞的自噬有助于脑损伤后过度的神经炎症,从长远来看可能会阻止炎症的消退和组织再生。本文于2023年7月发表于《Autophagy》期刊IF:13.3;Q1。
技术路线

主要实验结果
1.脑损伤后活化小胶质细胞和浸润单核细胞的自噬受到抑制
作者之前证明,在小鼠中度控制性皮质冲击(CCI)脑损伤后,不同细胞类型的损伤皮质内自噬通量的抑制发生在不同的时间点,激活的AIF1/IBA1阳性免疫细胞在损伤后3天出现自噬体积累高峰。
参与TBI神经炎症反应的免疫细胞包括活化的常驻小胶质细胞和浸润的单核/巨噬细胞。为区分这些细胞,作者对小胶质细胞和浸润性髓细胞中表达Cx3cr1启动子绿色荧光蛋白(GFP)的Cx3cr1-GFP小鼠进行适度的CCI。作者使用免疫荧光(IF)对皮层切片进行共染色,同时检测抗ADGRE1/F4/80抗体和自噬受体蛋白SQSTM1/p62,前者在浸润的单核细胞/巨噬细胞中的表达水平高于小胶质细胞,后者在自噬清除受损的细胞中积累(图1A-B)。与作者之前的数据一致,免疫细胞中SQSTM1的积累在损伤后3天达到峰值。在该时间点,所有定量的CX3CR1+细胞中有13%的SQSTM1阳性;然而,在所有定量的CX3CR1+ ADGRE1+细胞中,有65%的细胞SQSTM1阳性(图1C-D)。因此,尽管损伤后SQSTM1积累在小胶质细胞(ADGRE1low CX3CR1+)和浸润性单核细胞(ADGRE1high CX3CR1+)中均发生,但在浸润性细胞群中更为明显。
利用Ccr2-RFP报告小鼠,在巨噬细胞和募集到炎症部位的单核细胞中特异性表达来自Ccr2启动子的RFP,证实浸润性单核细胞的自噬抑制。损伤后3天,作者观察到CCR2+细胞中自噬标志物LC3和SQSTM1共定位90%,证实浸润细胞内自噬通量明显受到抑制(图1E-F)。
作者使用流式细胞术作为补充技术来评估TBI后驻留小胶质细胞(PTPRC/ CD45int ITGAM/CD11B+)和浸润髓细胞(PTPRChigh ITGAM+,主要是LY6C+单核细胞和中性粒细胞)的自噬动力学(图1G)。为评估自噬水平,作者使用针对LC3和SQSTM1的抗体,以及在溶酶体抑制的活细胞中荧光标记自噬体的Cyto-ID®PH敏感自噬染料。所有标记均显示共定位,证实相同的细胞积累自噬体和SQSTM1,与自噬通量的抑制一致(图1H-I)。作者观察到损伤后LC3+、SQSTM1+、自噬dye+小胶质细胞和浸润性髓细胞数量增加,并在损伤后3天达到峰值(图1J-L)。与作者的IF数据一致,与常驻小胶质细胞相比,所有标记物在浸润单核细胞中积累的程度更高,表明这些细胞的自噬抑制程度更高。
尽管大脑中激活的小胶质细胞,特别是浸润性髓系细胞的总数在初始峰值后下降,但大量剩余细胞显示出持续抑制自身吞噬的迹象,这可以从自噬染料在损伤后28天的积累中看出(图1L)。损伤后自噬dye+循环血液单核细胞百分比保持不变。这表明单核细胞内的自噬损伤仅限于那些穿过受损的血液脑屏障并进入脑实质的单核细胞。

图1脑外伤后活化的小胶质细胞和巨噬细胞自噬受到抑制
2.自噬的抑制与促炎标志物的表达增加有关
为确定自噬通量受到抑制的活化小胶质细胞和浸润单核/巨噬细胞的炎症状态,作者在TBI后1、3和7天对Cx3Cr1-GFP小鼠皮质脑切片进行抗SQSTM1抗体和几种炎症标记物的IF共染色。与先前发表的数据一致,作者观察到损伤皮质CX3CR1+细胞中促炎症标志物NOS2/iNOS(一氧化氮合酶2,诱导型),NLRP3和CYBB/NOX2(细胞色素b-245,β多肽)的显著积累,并在损伤后3天达到峰值(图2A-D)。大多数促炎小胶质细胞和巨噬细胞也积累高水平的SQSTM1,表明这些细胞的自噬通量受到抑制。损伤后3天,69%的CX3CR1+ NOS2+细胞、90%的CX3CR1+ NLRP3+细胞和89%的CX3CR1+ CYBB+细胞SQSTM1阳性。这些发现表明在小胶质细胞和浸润的单核细胞/巨噬细胞中炎症极化与自噬通量的抑制有关。
作者使用流式细胞术量化自噬通量高低水平的小胶质细胞和浸润性髓细胞的炎症。作者使用反映自噬体积累的Cyto-ID®自噬染料,鉴定具有高/正常水平自噬通量(dye-)的细胞,以及具有低水平自噬通量/抑制自噬通量(dye+)的细胞,然后在假手术和TBI小鼠中评估这些细胞群中促炎细胞因子的水平。从损伤后1天开始,与同一时间点的dye-小胶质细胞相比,dye+小胶质细胞表达更高水平的促炎细胞因子、TNF/TNF-α和IL1B/IL-1β(图2E-G)。与dye-小胶质细胞相比,dye+小胶质细胞中IL1B的高表达持续到损伤后28天,而与dye-小胶质细胞相比,dye+小胶质细胞中TNF的高表达在急性时间点仍具有统计学意义,但在损伤后28天失去统计学意义(与28天的dye-小胶质细胞相比,p = 0.062)。在浸润性髓系细胞中,作者也观察到损伤后dye+细胞中TNF和IL1B水平升高(图2H-J),然而,直到较晚的时间点(损伤后7天和28天),这一点才有统计学意义。这些发现证实,抑制小胶质细胞和浸润性髓细胞的自噬与促炎细胞因子的产生水平升高有关。

图2 自噬的抑制与TBI后促炎标志物的表达增加有关
3.抑制自噬会加剧体外炎症反应
作者进行体内研究结果表明,损伤后小胶质细胞和单核/巨噬细胞的自噬抑制与促炎表型有关。为确定自噬抑制是否可能导致神经炎症加剧,作者使用小鼠小胶质细胞(IMG细胞)和小鼠巨噬细胞(RAW 246.7细胞)进行体外研究。作者用针对不同阶段自噬的抑制剂处理细胞:巴菲霉素A1(BafA)抑制溶酶体酸化和自噬体-溶酶体融合;3-MA抑制自噬体形成所必需的III类磷脂酰肌醇3-激酶活性;MRT68921抑制ULK1和自噬起始。通过NOS2和NLRP3蛋白水平升高和一氧化氮生成增加评估,使用自噬抑制剂处理的IMG和RAW细胞炎症均增加(图3A-F)。这在基线条件下是正确的,在用脂多糖(LPS)预处理激活的细胞中也是如此。LPS处理不影响自噬通量(图3G)。事实上,所有三种自噬抑制剂都增加促炎标志物的水平,这表明调节巨噬细胞和微胶质细胞的自噬(而不仅仅是该途径的一种特定成分)可以直接改变体外炎症反应。作者在原代小鼠骨髓来源的巨噬细胞中观察到类似的结果(图3H)。
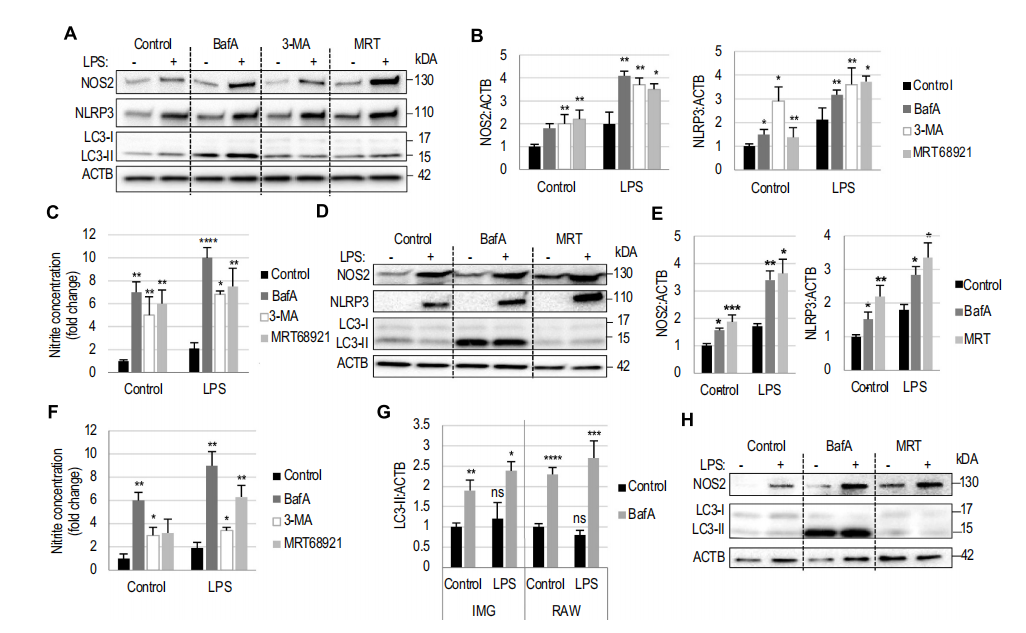
图3 抑制巨噬细胞和小胶质细胞的自噬会加剧体外炎症反应
4.抑制小胶质细胞和浸润单核细胞的自噬会加剧脑损伤后的炎症反应
从Lyz2(溶菌酶2)启动子表达Cre重组酶的Lyz2/LysM-cre小鼠已被广泛用于巨噬细胞和中性粒细胞的基因功能解剖。然而,使用Lyz2-cre小鼠靶向小胶质细胞中的基因尚不确定。作者使用ROSA26-lox-STOP-lox-tdTomato (ROSA-tdTomato)报告小鼠检测Lyz2-cre在小胶质细胞中的作用,这些小鼠仅在cre介导重组后才表达荧光蛋白tdTomato。流式细胞术数据显示,从假手术和TBI Lyz2-cre/ROSA-tdTomato小鼠大脑中分离的小胶质细胞(PTPRCint ITGAM+)中约有一半表达tdTomato,表明Cre介导的重组。正如预期的那样,在TBI小鼠中,超过80%的浸润单核细胞(PTPRChigh ITGAM+)是tdTomato+(图4A)。因此,Lyz2-cre在大约一半的小胶质细胞和大多数浸润性单核细胞中活跃,使其成为研究小胶质细胞和巨噬细胞在脑损伤后神经炎症中作用的有用驱动因素。
所有归一化基因计数的偏最小二乘判别分析(PLS-DA)显示,四个实验小鼠组(对照假手术、becn1 cKO假手术、对照TBI、becn1 cKO TBI)在前两个主坐标上聚类,分别占样本总变异的75.2%(损伤效应)和4.5%(基因型效应)(图4B)。欧几里得距离和病房聚类分析证实组间差异,根据损伤和基因型将小鼠分为四组(图4C)。根据聚类模式,作者观察到对照假手术组和becn1 cKO假手术组之间有轻微的重叠;对照TBI组和becn1 cKO TBI组分离效果较好。这表明becn1 cKO小鼠小胶质细胞和巨噬细胞的自噬抑制导致神经炎症相关的转录变化,并且这些变化在TBI后加剧。
组间的两两比较证实基因型和损伤诱导的转录差异(图4D)。对照假手术组与becn1 cKO假手术组、对照TBI组与becn1 cKO TBI组的两两比较显示,假手术组和TBI组之间存在显著的基因型依赖差异(图4D)。对becn1 cKO TBI小鼠与对照TBI小鼠之间差异表达基因的通路分析显示,“先天免疫反应”是最富集的通路(图4E)。重要的是,“自噬调节”也被列为最重要的差异表达途径之一。单个基因NanoString数据分析证实,与对照TBI组相比,becn1 cKO TBI中先天免疫相关基因表达上调,自噬调节基因下调(图4F-G)。
作者在RNA和蛋白质水平上确认NanoString数据。在TBI后3天,与对照组相比,Becn1 cKO TBI脑组织中LC3-II和SQSTM1蛋白的积累增加(图4H-I)。作者的分析还证实,与对照TBI相比,becn1 cKO TBI中促炎症基因如Cybb和Nfkb1上调,而抗炎症基因如Tgfb和Il10并未持续改变(图4J-K)。免疫荧光染色证实becn1 cKO小鼠损伤后自身吞噬被抑制,神经炎症增加。在损伤后3天,作者观察到损伤皮质AIF1阳性免疫细胞中SQSTM1和促炎标志物NOS2的积累增加(图4L)。
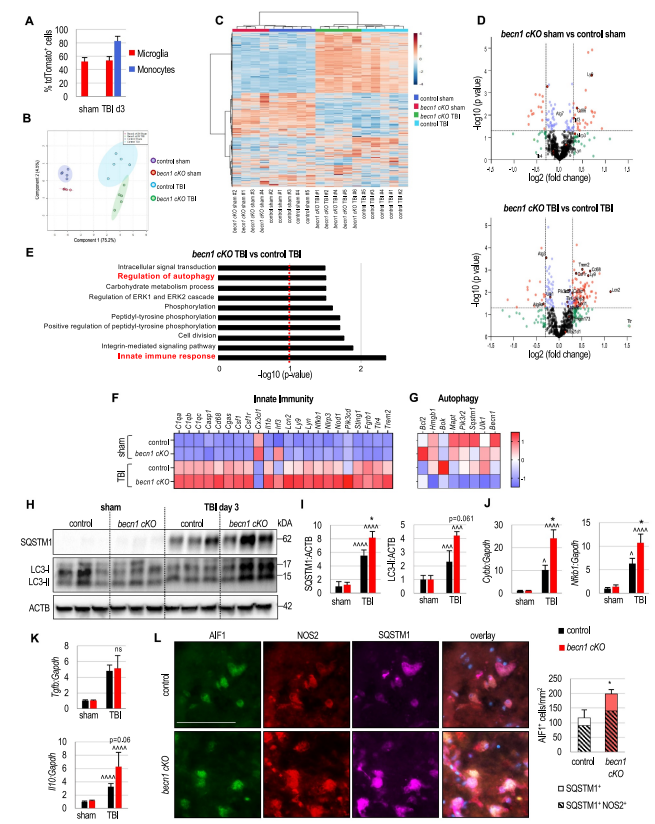
图4 小胶质细胞和单核细胞特异性自噬抑制加剧脑外伤后的炎症反应
6.抑制精确自噬会加剧脑损伤后的先天免疫反应
作者的NanoString通路分析表明,与对照小鼠相比,先天免疫反应是becn1 cKO中过度TBI神经炎症的介质。这包括炎症体和I型IFN通路的恶化。作者使用qRT-PCR证实这两种途径的参与,结果显示,与对照TBI小鼠相比,becn1 cKO TBI中I型IFN通路基因Sting1、Cgas和Ifnb1以及炎性体通路基因Nlrp3、Casp1和Il1b的mRNA水平升高(图5A-B)。这些发现在蛋白水平上得到证实,在损伤后3天,作者观察到与对照组小鼠相比,becn1 cKO中促炎CYBB、CGAS、STING1和NLRP3蛋白水平升高(图5C-D)。流式细胞术分析进一步证实炎症小体的激活加剧,损伤后becn1 cKO的小胶质细胞和浸润单核细胞中的IL1B水平均高于对照小鼠(图5E-H)。
通过精确自噬,先天免疫途径的成分可以直接靶向自噬降解。与一般的自噬受体(如SQSTM1)不同,精确自噬依赖于三结构域蛋白(TRIM)家族的成员来靶向先天免疫的特异性细胞质调节因子。MEFV/TRIM20已被证明可靶向炎性体成分,包括NLRP3、NLRP1和proCASP1 (caspase 1),用于自噬降解。MEFV还作为ULK1、BECN1和ATG16L1复合物组装的平台。这表明MEFV作为一种自噬受体,可递送炎性小体成分进行自噬降解。除NLRP3外,作者还观察到与对照TBI小鼠相比,becn1 cKO TBI皮层中MEFV蛋白的积累增加(图5I-J)。Mefv mRNA水平保持不变(图5K)。这与在SQSTM1中观察到的情况相似(图4H-J),表明在蛋白质降解水平上进行调控。免疫沉淀分析表明,与假手术皮层相比,损伤皮层中含有ULK1、MEFV和NLRP3的蛋白复合物的积累增加(图5L),这支持精密自噬抑制是加剧神经炎症的一种机制。
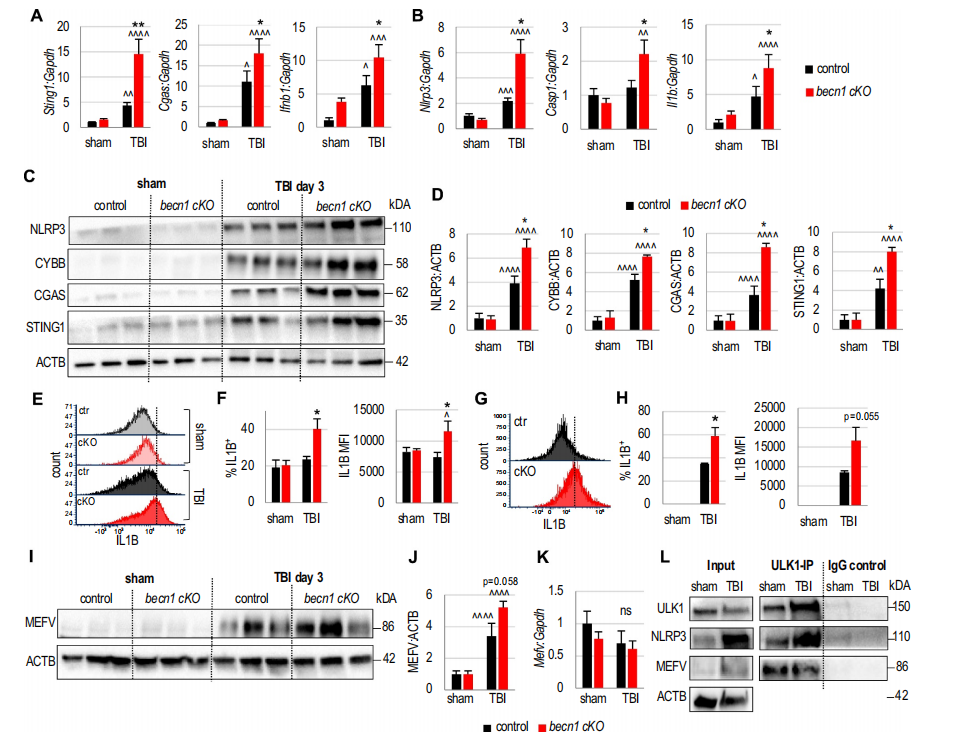
图5 抑制小胶质细胞/单核细胞的精确自噬有助于加剧TBI后的先天免疫反应
6、抑制小胶质细胞和浸润性单核细胞的自噬导致吞噬缺陷和DAMPs的积累
受损细胞释放DAMPs,DAMPs作为内源性危险信号,诱导死亡细胞和细胞碎片(胞葬作用)吞噬,并在非感染性炎症期间激活先天免疫反应。通过免疫印迹(WB),作者观察到与对照组相比,becn1 cKO小鼠在TBI后的SPTAN1/α-FODRIN和PRDX6的裂解水平更高,这表明可能存在去除DAMP的缺陷(图6A,B)。这可能不是由货物识别缺陷引起的,因为作者的NanoString数据表明,与对照TBI小鼠相比,becn1 cKO TBI中清除剂受体的表达增加而不是减少(图6C)。
除典型自噬外,BECN1也是LC3相关吞噬(LAP)的非典型自噬途径所必需的,LAP利用自噬途径的成分来介导DAMPs的胞葬作用和吞噬作用。利用流式细胞术,作者检测becn1 cKO和对照小鼠脑内小胶质细胞和浸润单核细胞吞噬荧光乳胶珠的能力。作者观察到,与对照组小鼠相比,损伤后becn1 cKO小胶质细胞的吞噬活性显著降低(图6D-F)。
除自噬机制的组成部分外,LAP还需要NADPH氧化酶-2(CYBB/NOX2)复合物在LC3相关吞噬体上的募集和活性。为确定LAP是否可能参与损伤后的DAMP清除,作者对表达GFP-LC3自噬报告基因的假手术和第3天TBI转基因小鼠进行IF染色切片。作者观察到损伤后激活的小胶质细胞/巨噬细胞中GFP-LC3和CYBB的积累,证实LAP的潜在参与(图6G-H)。在高倍镜下,一些GFP-LC3细胞内小点CYBB阳性,这表明它们是LAP吞噬体而不是自噬体(图6I)。这些数据表明,与整体自噬类似,LAP在损伤后激活的小胶质细胞和巨噬细胞中可能被抑制,导致DAMP去除障碍和神经炎症增加。
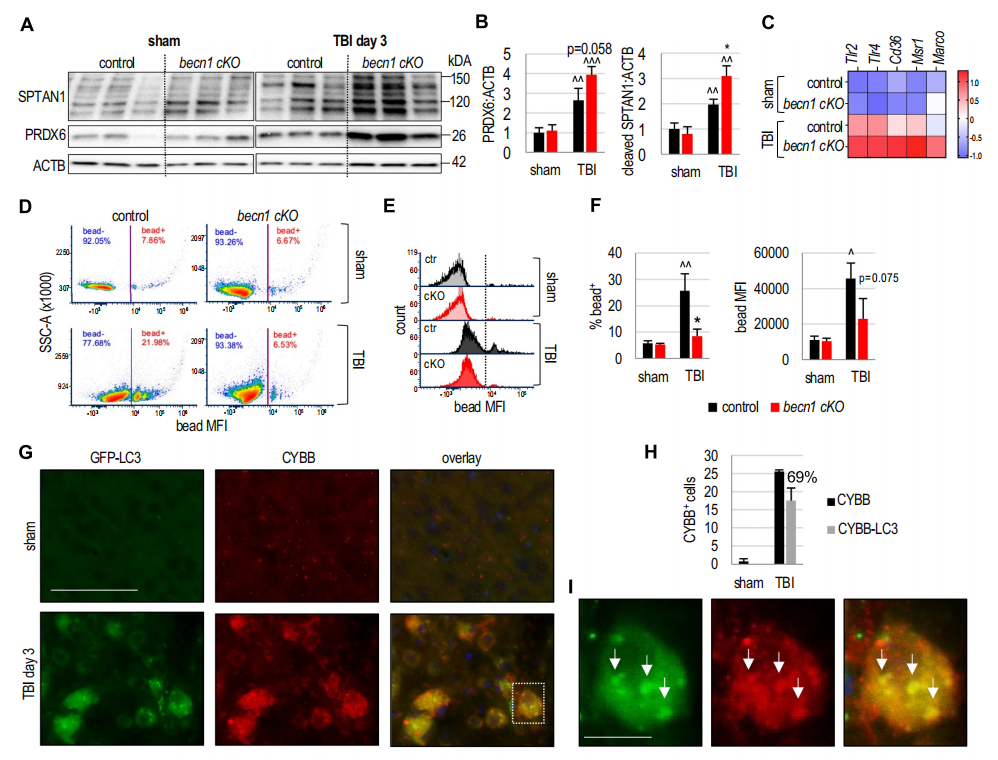
图6 抑制小胶质细胞/单核细胞的精确自噬导致TBI后吞噬缺陷和DAMPs积累
7、抑制小胶质细胞和浸润性单核细胞的自噬恶化损伤后的功能恢复
作者评估抑制小胶质细胞和单核细胞的自噬是否会影响损伤小鼠的运动和记忆功能。在脑损伤后21 ~ 25天采用Morris水迷宫(MWM)测试空间学习记忆能力。在探索试验期间,becn1 cKO TBI小鼠在逃避象限的时间明显少于对照TBI组,表明空间学习缺陷加剧(图7A)。作者还观察到在探索试验期间使用的搜索策略的显著差异。becn1 cKO 假手术组小鼠和对照假手术组小鼠均使用空间或顺序搜索策略。虽然两个TBI组越来越多地依赖于循环策略来定位平台,但与对照TBI(50%)小鼠相比,becn1 cKO TBI(68.5%)更为明显(图7B-C)。
为评估非空间陈述性记忆,作者在损伤后15-17天进行新物体识别测试。在测试阶段,与相应的假手术组相比,TBI小鼠在新物体上花费的时间更少,证实预期的损伤效果。然而,与对照TBI小鼠相比,becn1 cKO TBI小鼠在新物体上花费的时间明显减少(图7D),这表明抑制小胶质细胞和单核/巨噬细胞的自噬加剧损伤后的陈述性记忆障碍。
为测试小胶质细胞和浸润单核细胞自噬抑制对TBI后整体组织损伤和神经变性的影响,作者比较becn1 cKO TBI小鼠和对照组TBI小鼠在损伤后28天的海马损伤体积和神经元细胞计数。然而,与对照TBI小鼠相比,becn1 cKO TBI小鼠同侧海马锯齿回(DG)中的神经元细胞计数显著减少,表明神经元损失增加(图7E-F)。总之,这些数据表明,通过小胶质细胞和浸润单核细胞的自噬抑制介导的炎症增加加剧TBI诱导的神经变性。qRT-PCR数据还显示,在损伤后第28天,becn1 cKO TBI小鼠的整体先天免疫基因表达仍高于对照组TBI小鼠,但个体差异未达到显著性(图7G)。

图7 小胶质细胞/单核细胞的自噬抑制恶化,而自噬刺激可改善脑损伤后的长期认知结果
8、增加自噬可减少神经炎症并改善脑损伤后的功能结果
数据表明,自噬的抑制导致脑损伤后神经炎症延长和功能恢复不良。为确定增加自噬是否可以用于治疗减少神经炎症和改善功能结果,作者用MTOR抑制剂和已知的自噬诱导剂雷帕霉素治疗野生型小鼠。在接受雷帕霉素治疗后,TBI小鼠在MWM和Y型迷宫任务中的表现,与药物治疗的TBI小鼠相比,显示出记忆力的改善(图7H)。损伤后3天的qRT-PCR分析显示,先天免疫和炎症相关基因的表达总体下降,但个体基因数据没有达到显著性(图7I)。另一方面,雷帕霉素治疗导致NLRP3、CGAS和STING1蛋白水平显著降低(图7J-K)。这与增加的自噬通过蛋白质降解来控制先天免疫介质水平的能力是一致的。总之,这些数据为TBI后自噬增加的抗炎作用提供进一步的证据。
结论
总之,本研究表明抑制小胶质细胞和浸润性巨噬细胞的自噬有助于脑损伤后过度的神经炎症,从长远来看可能会阻止炎症的消退和组织再生。因此,再激活或增加自噬是一种有希望的干预途径,可以解决多种细胞类型的多种脑损伤病理,强调需要更好地了解其机制和功能。
实验方法
控制性皮质冲击(CCI);细胞系;BMDM隔离和培养;体外药物治疗;雷帕霉素治疗;Western blot;总一氧化氮检测试剂盒;免疫组织化学;流式细胞术;qRT-PCR;NanoString 分析;免疫沉淀;神经行为测试;组织学。
参考文献
Hegdekar N, Sarkar C, Bustos S, Ritzel RM, Hanscom M, Ravishankar P, Philkana D, Wu J, Loane DJ, Lipinski MM. Inhibition of autophagy in microglia and macrophages exacerbates innate immune responses and worsens brain injury outcomes. Autophagy. 2023 Jul;19(7):2026-2044. doi: 10.1080/15548627.2023.2167689. Epub 2023 Jan 18. PMID: 36652438; PMCID: PMC10283445.






