膀胱癌中TRMT6 / 61A依赖的碱基甲基化调控基因沉默活性和未折叠蛋白反应
RNA修饰是RNA功能的重要调控元件。然而,大多数RNA修饰的全基因组图谱都集中在信使RNA和转移RNA上,但缺乏小RNA的此类数据集。在这里,作者绘制了细胞小RNA空间中的N1 -甲基腺苷(m1 A)。以合成的m1 - A RNA为基准,作者的工作流程确定了含有m1 - A的小RNA的特定组,否则不成比例地代表性不足。特别是,22个核苷酸长的3 ' tRNA片段高度富集于位于种子区的trmt6 / 61a依赖性m1 A。TRMT6/ 61a依赖性m1 - A负性影响trf -3的基因沉默。在TRMT6/61A过表达的膀胱尿路上皮癌中,检测到tRF上较高的m1 A修饰,与tRF靶组失调相关。最后,TRMT6/61A调节参与未折叠蛋白反应的tRF-3靶点。总之,作者的研究结果揭示了通过小RNA的碱基修饰调节基因表达的机制。这篇文章于2022年4月发表于《Nature Communication》IF:16.6。
技术路线

技术路线图
主要研究结果
1. 小RNA空间中m1A位点的系统制图
已知m1A会中断常规的沃森-克里克A:U碱基配对(图1a),并在为HTS准备文库时导致逆转录酶(RT)停滞。该特性可用于通过m1A位置的错配(错误结合)来绘制m1A位点。为了系统地绘制小RNA(<50个核苷酸长)中潜在的m1A位点,作者结合了两种独立的方法(图1b): m1A抗体富集,然后进行小RNA测序(m1A- rip -seq)和m1A诱导的错配测序。为了首先确定用于标准小RNA测序的m1A兼容RT,使用具有单个m1A位点的合成小RNA测试了三种候选RT (protoscriptii -一种常用的M-MuLV RT,tgir -模板切换组II逆转录酶和工程HIV RT-1306)。选择TGIRT和RT-1306进行测试是基于它们之前在测序含有m1a的mRNA和tRNA方面的成功。实验流程(图1c,左下)如下:小RNA先与3′端接头连接,然后与5′端接头连接,然后引物启动RT反应生成cDNA,然后用覆盖两个接头序列的引物进行PCR扩增。作者的策略确保只有可读取的产品将被克隆并用于下游的错配分析,以进行m1A修改估计。通过在RT步骤之前包括5 '接头连接,作者消除了由于与PCR扩增的5 '引物缺乏互补性而导致任何RT延迟产物被克隆为截断产物的可能性。这种方法对于小RNA是首先考虑的,因为它们通常只有几个碱基不同,特别是对于trf。例如,18-nt tRF-3和22-nt tRF-3已被证明通过不同的机制调节LTR功能。使用这一工作流程,合成m1A位点的错配指数(由A到T/G/C突变计算)对于TGIRT和RT-1306来说,在不同的m1A化学计量中都显示出很高的灵敏度和动态范围(图1c)。然而,当m1A存在于<=60%的合成短RNA中时,通常用于短RNA测序的逆转录酶ProtoScriptII产生的错配率低于5%(图1c)。与TGIRT和RT-1306相比,克隆频率较低,当100%的RNA具有m1A时可以看出(图1d)。最后,当与m1A抗体富集(m1A- rip)结合使用时,TGIRT和ProtoScriptII都能够检测到插入细胞小RNA的合成m1A RNA的富集(图1e)。基于上述分析,作者选择了TGIRT来进一步鉴定内源性m1A小RNA。
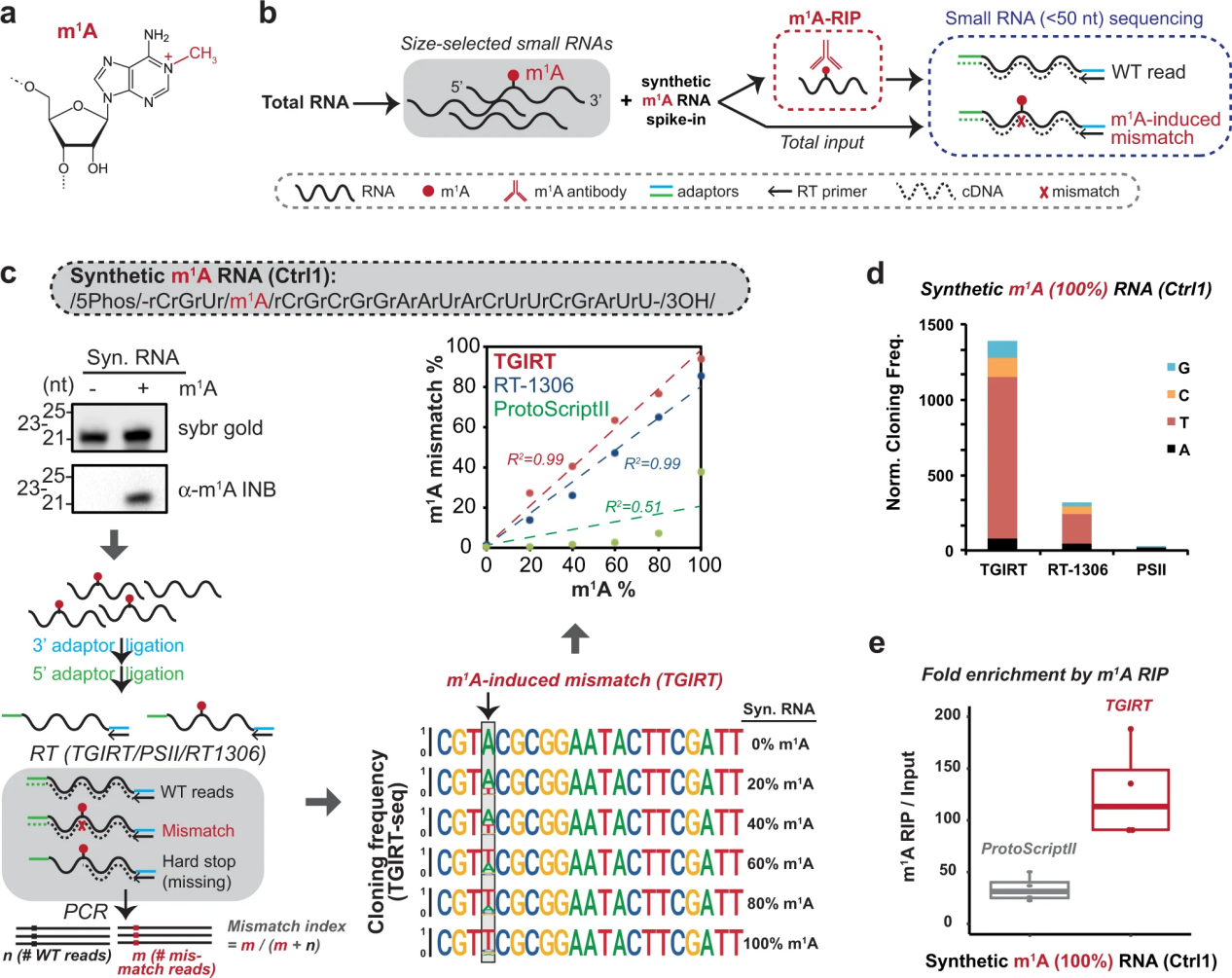
图1小RNA空间中m1A位点的系统制图
2. 特异性tRNA衍生片段高度富集于m1A
为了鉴定内源性含有m1A的小RNA,将m1A RIP应用于细胞中纯化的短RNA。HEK293T细胞中m1A修饰的tRNA通过m1A RIP富集并洗脱成功(图2a)。对于有一个碱基错配的tRF reads, m1A RIP的富集更为突出,可能是在m1A修饰的位点(图2b)。在microRNAs或其他小RNA中,m1A RIP未观察到这种错配相关的富集(图2b)。在m1A RIP后,大多数含有错配的tRF读取具有A到C/G/T不匹配(细胞质tRF为90%,线粒体tRF为95%)(图2b),表明修饰的(容易错配的)腺苷特异性富集,最有可能是m1A。
根据起始和结束位置,tRNA片段可以分为三组(图2c)22,30,34:(1)映射到成熟tRNA的极端3 ' CCA端的tRF-3s,(2)映射到成熟tRNA的极端5 '端的tRF-5s,以及(3)包含前体tRNA的尾链序列(通常以poly-U结尾)的tRF-1s。成熟tRNA的3′端trf优先被m1A抗体富集,而5′端trf相对microRNA轻度富集,tRF-1s不富集(图2d, e)。此外,与18-nt tRF-3a相比,22-nt tRF-3b被m1A抗体特异性富集(图2f),这表明只有22-nt而不是18-nt tRF-3s含有m1A。值得注意的是,tRF-3b(图2f)的富集程度与峰值控制的m1A RNA(图1e)相似。输入样品的TGIRT误掺入特征也得到了m1A在特定trf -3上的位置和化学计量。在所有22 nt的tRF-3b的第四个位置(A4)观察到最高的错配率(图3b, c)。这种高错配率具有高度特异性:在tRF-3b的其他位置(图3c)或18 nt的tRF-3a上没有观察到。有趣的是,一些microRNA被m1A RIP显著富集(图2d),但未能显示位点特异性错配模式,因此作者在本报告中没有将它们报道为真正的含有m1A的小RNA(在Discussion中进一步讨论)。这些都表明tRF-3b是含有m1a的小RNA。
由于确定的大多数m1A位点都处于高化学计量,因此作者跳过了m1A RIP,仅使用TGIRT错配特征来量化特定位点的m1A,以便进行以下分析。

图2特异性tRNA衍生片段高度富集于m1A
3. 22个核苷酸3 ' tRNA片段上的m1A依赖于TRMT6/61A
22-nt tRF-3b上的A4位置与成熟tRNA上的A58位置相对应(图3a)。胞质tRNAs上的m1A58由异源二聚体酶复合物TRMT6/TRMT61A(或酵母中的GCD10/GCD14)催化。为了测试tRF-3b上的m1A是否由TRMT6/61A引入的修饰(可能在亲本tRNA上),在TRMT6/61A敲低后评估了错误合并特征(图3b-e)。当TRMT6/61A被敲除(图3d)时,除了tRNAiMet中的trf -3外,m1a依赖的trf -3错结合在全球范围内减少(图3b, c)。在HeLa和U251细胞中也观察到siTRMT6/61A或单独使用siTRMT61A的较低的tRF-3b A4错掺率(图3f)。尽管TRMT6/61A敲除后,携带ProtoScriptII的tRF-3b的克隆频率显著增加,但Northern blots未检测到tRF-3b和tRNA的稳态水平有任何变化(图3g)。这证实了携带m1a的小RNA在这种常用的ProtoScriptII RT中代表性不足。
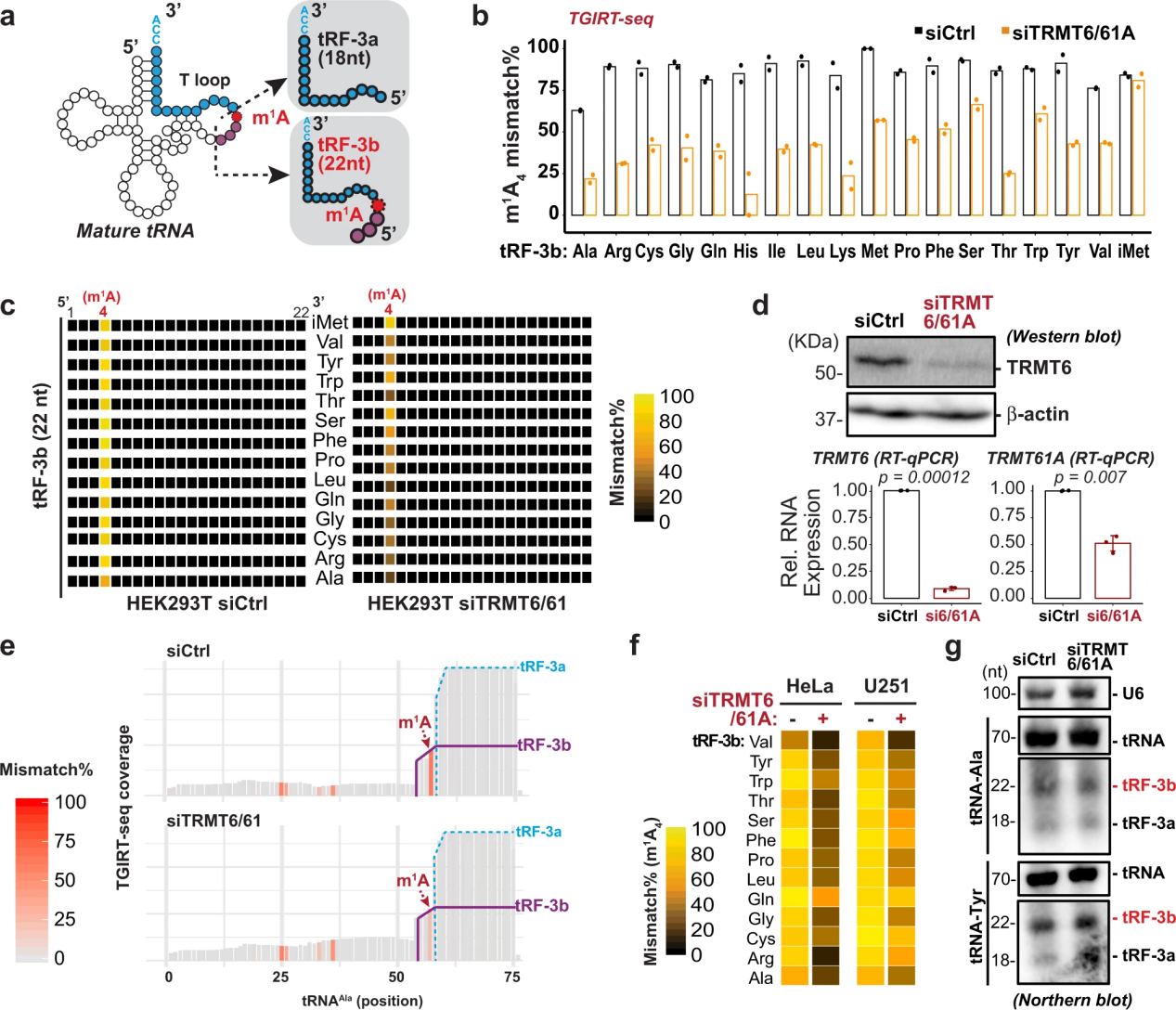
图3 22个核苷酸3 ' tRNA片段上的m1A依赖于TRMT6/61A
4. m1A减弱了trf -3的基因沉默
m1A在tRF-3上特定位置的存在提出了一种有趣的可能性,即它可能调节tRF-3的功能,特别是如果它涉及碱基配对或蛋白质结合。已经在多种生物学途径中发现了trf -3,特别是依赖于引导小RNA(trf -3)与靶RNA之间碱基配对的基因沉默途径(图4a)。这些依赖ago的基因沉默机制可能受到tRF-3s 4位m1A的影响,该位置位于与目标RNAs25,45碱基配对所必需的种子区。
为了直接测试m1A对tRF-3b基因沉默活性的影响,作者生成了双荧光素酶报告基因,在Renilla荧光素酶基因的3 ' UTR中有tRF-3靶位,可以归一化为萤火虫荧光素酶信号(图4b)。只有未经a4修饰的tRF-3b触发了基因沉默,而m1a4修饰的tRF-3b则消除了这种基因沉默(图4c-f)。对来自不同氨基酸群的四个不同的tRF-3b序列(tRNALeu的tRF-3009b, tRNAAla的tRF-3021b, tRNATyr的tRF-3030b和tRNAGln的tRF-3004b)观察到这种效应。
为了确保tRF的抑制不是过度表达的产物,作者还通过LNA(锁定的核酸)敲低了内源性tRF-3。抗tRF-3021特异性地抑制了tRF-3021报告因子的活性(图4)。同样,tRF-3009、tRF-3030和tRF-3004报告基因活性被相应的LNAs去抑制(图4h-j)。
总的来说,这表明由于种子退火到靶mRNA的问题,m1A减弱了tRF-3b的基因沉默。
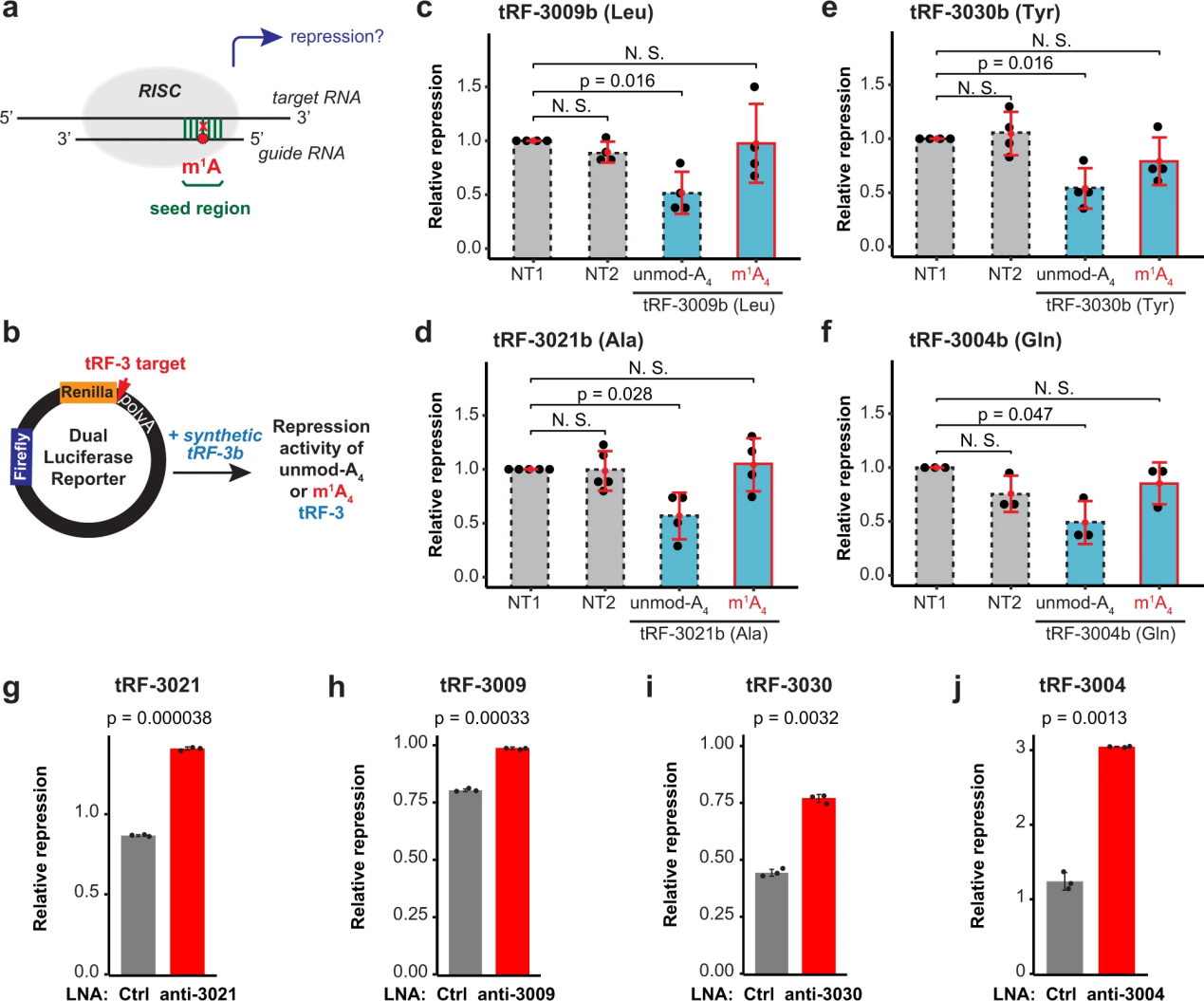
图4 m1A减弱了trf -3的基因沉默
5. TRMT6 / 61A依赖性m1A不降低tRF-3b的Argonaute相关性
由于tRF-3b上的m1A阻止了tRF-3b的沉默(图4),作者测试了这种修饰是否降低了内源性trf -3与Ago2的关联。为此,作者创建了一个稳定表达flag - ha标记的Ago2的细胞系(图5a)。tgrt -seq在前100个与ago2相关的小RNA中鉴定出了trf -3(图5b)。敲除TRMT6/61A后(图5c),与m1A修饰相对应的读段错配百分比在与ago2相关的片段中(a)减少,但在与ago2相关的片段中(b)相对于输入片段而言,没有增加或减少(图5d)。因此,TRMT6/61A对两个片段中trf -3上的m1A的调节是相同的。m1A修饰不排除tRF-3b进入与Argonaute的复合物。在敲除TRMT6/61A后,ago2相关部分中有几种trf -3的少量(1-3倍)增加,但没有超过FDR <0.05的阈值(图5e)。相对于输入部分,Ago相关部分中tRF-3水平没有任何变化,这表明trmt6 /61依赖的m1A对tRF-3种子区域的修饰不会显著影响Ago的直接结合。有趣的是,尽管在输入和Ago结合的部分中,TRMT6/61A调节了总tRF-3b错配(m1A修饰)的百分比(图5d)。综合来看,m1A修饰的tRF-3s不会降低它们的Ago关联,因此基因沉默的衰减很可能是因为与目标mRNA的碱基配对减少(图4)。
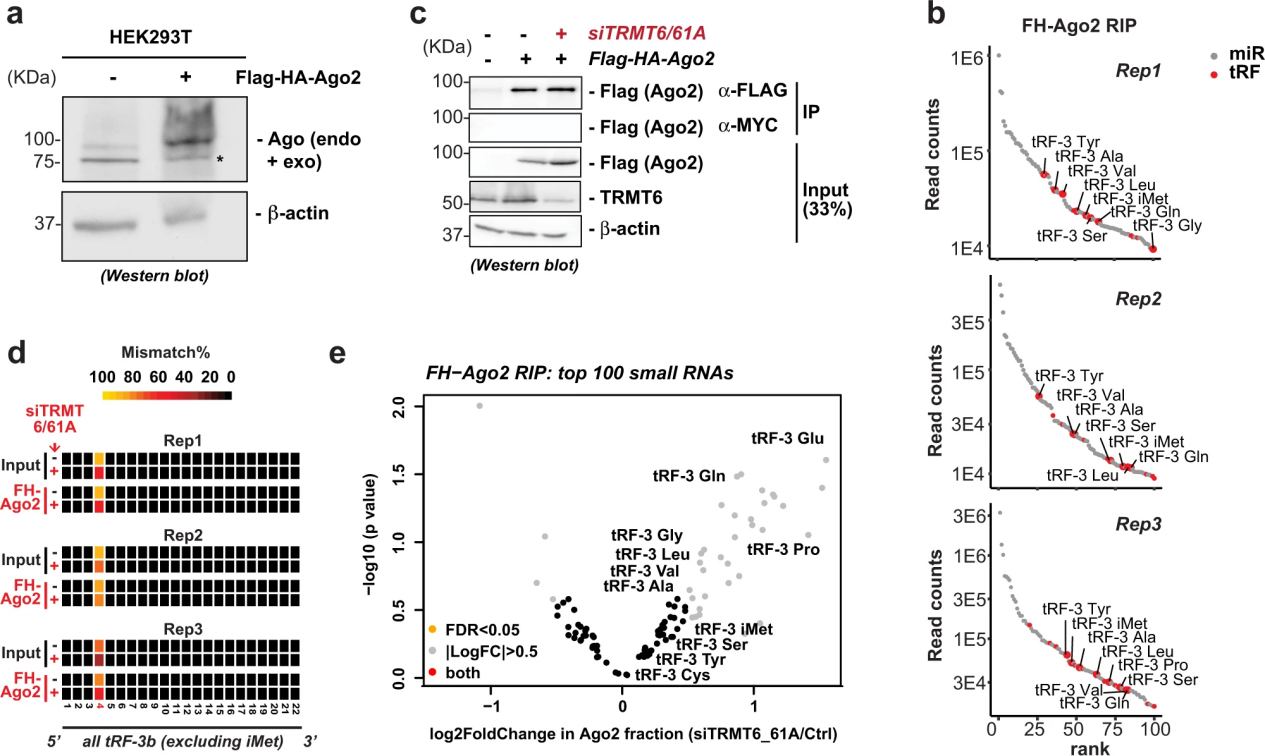
图5 TRMT6 / 61A依赖性m1A不降低tRF-3b的Argonaute相关性
6. tRF-3b介导的m1a依赖性基因沉默变化
引导RNA 2-4位的碱基配对对于ago介导的基因沉默至关重要45。tRF-3b上的m1A特异性位于第4位(图2和图3)。由于m1A阻断了典型的A:U碱基配对,作者假设,m1A在tRF-3种子区与靶RNA的碱基配对减弱,解释了含有m1A的tRF-3中观察到的基因沉默活性降低(图4)。为了验证这一假设,作者首先通过图6a总结的策略确定了可能受m1A状态调节的潜在tRF-3靶RNA。作者确定了顶部ago2相关的tRF-3b中的哪些种子(图6b)也是TRMT6/61A敲除后m1A修饰减少最多的种子,以确定最有可能遭受生物学上显著的靶标预测干扰的种子(图6c)。作者根据3 ' UTR中的互补性预测这些种子的靶标。RNA-seq显示,当TRMT6/61A被敲除,tRF-3b在第4位被m1A低修饰时,这些种子的靶标比非靶标明显受到抑制(图6d)。
预测具有8-mer和7-mer匹配的靶标比种子中与6-mer匹配的靶标受到更显著的抑制(图6d, e)。在siTRMT6/61A之后,分别通过qPCR验证了最显著抑制的8/7-mer tRF-3靶标(TIMP3, CREB3L2, MBTPS1, CDK19, HIPK2, HERPUD1, RMND5A, ELMOD2和HLTF)的抑制(图6f)。
为了证实这种基因抑制是由靶向3 ' UTR的tRF-3介导的,作者将具有单个进化保守的tRF-3靶向8-mer位点的内源性MBTPS1 3 ' UTR序列克隆到双荧光素酶报告基因中。MBTPS1 3 ' UTR报告基因确实被siTRMT6/61A抑制(图6g)。另一个8-mer靶基因CREB3L2也得到了类似的结果(图6g)。这两个8-mer位点均由种子序列“TCAAATCT”预测,由tRNAGln中的tRF-3b代表(图6b)。与预测一致,通过从tRNAGln中过表达未经修饰的tRF-3004b可以模拟sitrmt依赖性抑制,而TRMT6/61A的表达不会减少(图6h),而m1a修饰的tRF-3004b对3 ' UTR报告基因的抑制能力明显较弱(图6i)。综上所述,tRF-3可以通过种子与目标3 ' UTRs配对来调节基因的全局表达,而这一过程受到tRF-3种子区m1A修饰的干扰。
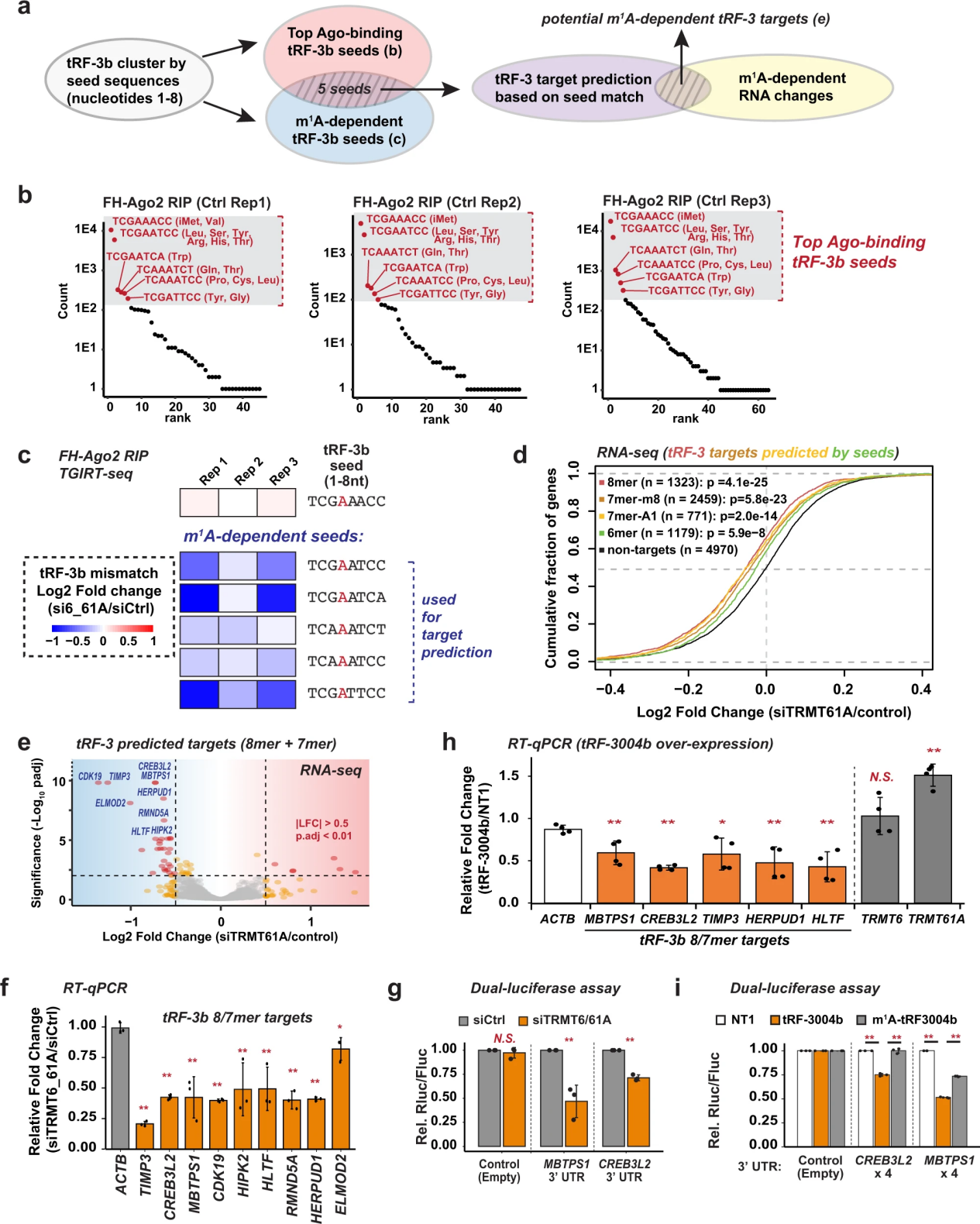
图6 tRF-3b介导的m1a依赖性基因沉默变化
7. 膀胱癌中trf - 3m1a水平及tRF-3靶点的改变
据报道,一些tRNA修饰酶,包括TRMT6/61A,在几种癌症类型中显著上调47。TRMT6上调在膀胱尿路上皮癌(BLCA)中是显著的(图7a)。最重要的是,通过western blotting检测到肿瘤样品中TRMT6和TRMT61A蛋白水平的显著上调(图7b, c)。
TRMT6表达水平与tRF-3b整体m1A错配水平呈正相关,并且在BLCA肿瘤样本中m1A错配显著增加,这与TRMT6/ 61a较高的表达水平一致(图7d, e)。与较高水平的干扰m1A修饰相一致,在作者的实验数据中,与正常相比,通过种子-mer匹配预测的tRF-3b靶RNA在BLCA肿瘤样本中比非靶点上调(图7f)。组合种子和补充图7e:单个种子)。此外,在TCGA BLCA数据中,TRMT6水平高的肿瘤诱导了tRF-3b靶点(图7g)。有趣的是,在被siTRMT6/61A抑制的9个trmt3靶点中,有8个(图6e)在TCGA膀胱患者样本中与TRMT6的表达呈显著正相关(图7h)。综上所述,这些结果表明TRMT6/61A调节肿瘤中tRF-3上的m1A水平,并且BLCA中TRMT6/61A的升高与肿瘤中tRF-3靶点的预期诱导有关。

图7膀胱癌中trf - 3m1a水平及tRF-3靶点的改变
8. TRMT6/61A修饰tRF-3b对于维持未折叠蛋白的反应至关重要
为了探索m1a依赖性tRF-3靶点的潜在生物学功能,作者通过RNA-seq数据的基因集富集分析,重点研究了siTRMT6/61A显著下调和高trmt6肿瘤样本中显著上调的生物学途径。针对1532个Reactome通路的富集分析在细胞系和患者数据中发现了7个重叠通路。其中一种途径是未折叠蛋白反应或UPR(图8a, b)。
m1a依赖的tRF-3靶点,特别是MBTPS1(也称为1位点蛋白酶或S1P)和CREB3L2,先前与UPR和蛋白质分泌有关48,49,这表明TRMT6/61A可能通过去抑制这些tRF-3靶点来帮助维持生长细胞中的UPR。MBTPS1 (S1P)因其切割和激活高尔基体上不同蛋白质底物的作用而闻名,包括转录因子ATF6和creb3l250,51,52。为了直接测试TRMT6/61A是否在内质网应激下调节UPR,作者使用了一个由最小启动子驱动的荧光素酶报告子,该启动子带有内质网应激反应元件2 (ERSE2),可被ATF6转录因子53激活。报告显示,正如预期的那样,荧光素酶活性增加依赖于内质网反应元件和内质网应激(tunicamycin, Tm)。在HEK293T和T24膀胱癌细胞系中,TRMT6/61A敲低可显著抑制UPR诱导的应激反应(图8c)。转染未修饰的tRF-3004b,而不转染m1A修饰的tRF-3004b,相对于NT1和NT2非靶向RNA,可以降低UPR报告基因的活性(图8d),这表明tRF-3b上的m1A状态可以直接调节未折叠蛋白的反应。为了确保内源性tRF-3004b抑制参与UPR的靶基因,作者通过LNA敲低了内源性tRF-3004b,这在ER应激后显著增加了靶细胞基因CREB3L2、HERPUD1、MBTPS1和HLTF的水平(图8e、f)。总之,这表明trmt6 / 61a介导的trf -3上的m1A修饰对维持UPR稳态很重要。
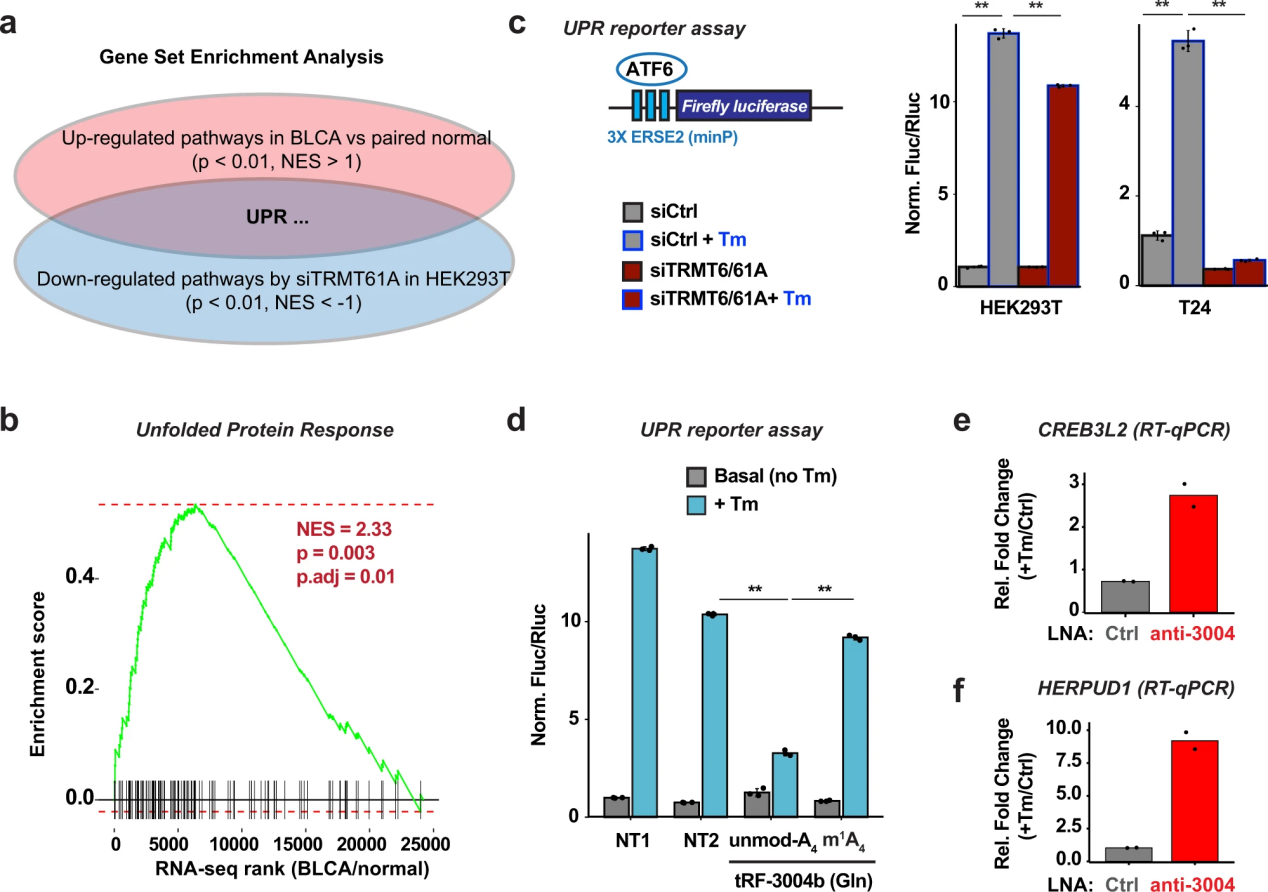
图8 TRMT6/61A修饰tRF-3b对于维持未折叠蛋白的反应至关重要
结论
最后,快速增殖的癌细胞通过激活促存活UPR来维持蛋白稳态以减轻内质网应激。因此,UPR与癌症特征的许多方面密切相关,并已成为有希望的治疗靶点。先前已经注意到,在包括膀胱癌在内的几种癌症类型中,uprr相关基因在全球范围内上调68。在这里,作者发现TRMT6/61A最可能通过修饰tRF-3来促进UPR,并去抑制tRF-3在UPR通路的ATF6分支中的靶点MBTPS1和CREB3L2。有趣的是,MBTPS1和CREB3L2可以被tRNAGln中的tRF-3004b靶向,tRNAGln是一种被发现在酵母中调节UPR的tRNA 69。当然,作者不排除TRMT6/61A通过修饰tRNA和mRNA对UPR产生额外影响的可能性。作者如何利用本文描述的机制使肿瘤细胞对促凋亡UPR敏感将是未来另一个有趣的研究课题。
实验方法
细胞培养,RNA净化,合成m1A RNA寡核苷酸,RIP免疫沉淀反应,小RNA-seq文库制备,小RNA-seq图谱和错配分析,敲低TRMT6/61 A,Northern blot,双荧光素酶报告试验,锁定核酸(LNA)敲除内源性tRF,RT-qPCR,RNA-seq文库的制备和分析,蛋白提取和Western Blot,未折叠蛋白反应报告试验。
参考文献:
Su Z, Monshaugen I, Wilson B, Wang F, Klungland A, Ougland R, Dutta A. TRMT6/61A-dependent base methylation of tRNA-derived fragments regulates gene-silencing activity and the unfolded protein response in bladder cancer. Nat Commun. 2022 Apr 20;13(1):2165. doi: 10.1038/s41467-022-29790-8. PMID: 35444240; PMCID: PMC9021294.






