前列腺癌中UBC9缺乏增强免疫刺激巨噬细胞激活和抗肿瘤T细胞反应
前列腺癌(PCa)的进展受肿瘤微环境(TME)中存在的多种细胞类型的调控,CD8+T细胞是主要的杀瘤效应细胞群,通常存在于肿瘤反应性基质中,并不断被周围的共抑制信号灭活。前列腺癌并不容易对ICB治疗有反应,这归因于肿瘤浸润性CD8+T细胞的激活不足及肿瘤相关巨噬细胞的作用。作者的数据证明了UBC9介导的STAT4 summoylation在TAM相关的免疫抑制中起着至关重要的作用,并为PCa治疗的免疫疗法的发展提供了重要的前景。本文于2023年2月发布于《Journal of Clinical Investigation》,IF=15.9。
技术路线

主要研究结果
1、UBC9表达与巨噬细胞激活缺陷和前列腺癌预后不良有关
为了研究SUMOylation在PCa中的临床相关性,作者关注了最关键的SUMO E2偶联酶UBC9,并查询了一系列PCa患者的表达和生存数据集。作者比较了前列腺癌与正常组织、不同肿瘤分期和病理分级之间UBC9的表达水平。值得注意的是,UBC9在PCa中的表达明显更高(图1A),并且与晚期(图1B)和更高的Gleason评分(图1C)相关。接下来,作者进行了生存分析,观察到较高的UBC9转录水平与较差的生化无复发生存(图1D)和无转移生存(图1E)相关。此外,作者内部前列腺肿瘤和正常组织样本qPCR和Western blotting证实,与邻近正常前列腺部位相比,UBC9在肿瘤组织中表达上调(图1、F和G)。综上所述,这些结果表明,UBC9高表达的PCa患者比UBC9低表达的PCa患者预后更差。上述结果促使作者评估UBC9对前列腺肿瘤组织中不同免疫亚群的潜在贡献。通过CIBERSORT分析发现,在UBC9hiPCa样本中,经典活化的巨噬细胞(M1)是免疫细胞类型下降最明显的,而调节性T细胞是免疫细胞类型增加最显著的(图1H)。之前,作者证明了UBC9介导的SUMOylation通过调节巨噬细胞极化影响调节性T细胞的诱导。因此,作者假设TAM在针对肿瘤细胞的先天免疫设置中起关键作用。作者接下来分析了UBC9hi和UBC9lo集群之间的差异表达基因(DEGs),并表征了与“抗原呈递(MHC I相关)”、“先天免疫”和“T细胞活化”相关的基因呈负相关;在UBC9hi前列腺癌患者中,与“肿瘤进展”和“免疫检查点”呈正相关(图1I)。接下来,作者进行了基因集富集分析,发现在UBC9hiPCa受试者中,与癌组织中“破骨细胞分化”、“TNF信号通路”、“JAK-STAT信号通路”和“PD-1和PD-L1检查点”相关的基因富集(图1J)。最后,作者通过染色UBC9和人巨噬细胞标志物CD68进行免疫荧光检测。UBC9在PCa中高表达,尤其是在TAM中(图1K)。总的来说,这些发现强调了UBC9表达与TAM激活之间的关联,这与其抗原呈递能力有关。
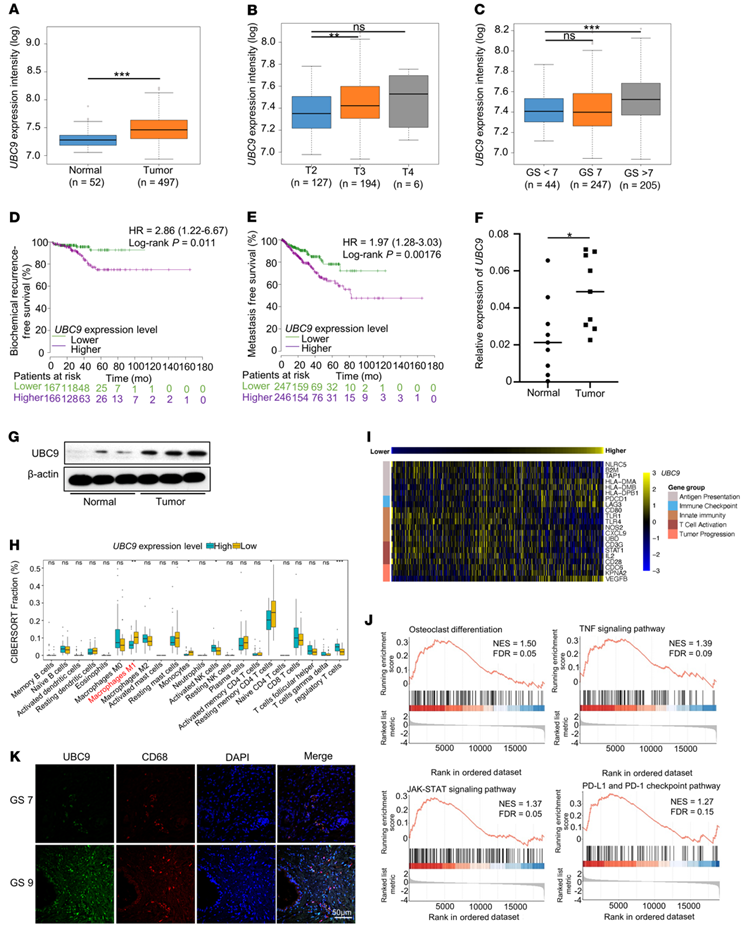
图1. UBC9表达与巨噬细胞激活缺陷和前列腺癌预后不良有关
2、抑制UBC9可阻止PCa的进展
为了检验UBC9是否在体内介导PCa肿瘤生长,作者用UBC9抑制剂2-D08 (10 mg/kg,每3天,瘤内注射)或DMSO作为对照治疗RM-1荷瘤C57BL/6J小鼠(图2A)。TUNEL染色显示,注射2-D08明显抑制肿瘤生长(图2B),减少肿瘤质量(图2、C和D)。具体而言,2-D08处理组和对照组TAM浸润频率无显著差异(图2E),但CD86+巨噬细胞频率更高(图2F), 2-D08处理组TAM中MHC I表达升高(图2G)。此外,2-D08处理导致更高比例的CD8+T细胞浸润(图2H)。有趣的是,作者还注意到,在2-D08处理组中,PD-1+CD8+T细胞显著增加(图2J),这可能是继发于T细胞激活状态的增强。鉴于前列腺肿瘤细胞也表达UBC9,作者下一步试图检查2-D08对前列腺肿瘤生长可能的直接影响。为此,作者首先分别用2-D08和TAK-981(一种选择性和有效的sumo激活酶E1的小分子抑制剂)治疗肿瘤细胞生长情况。综上所述,这些数据支持UBC9抑制剂不仅通过促进TAM和CD8+T细胞的活化,而且通过直接抑制肿瘤细胞的生长来阻碍PCa的进展。
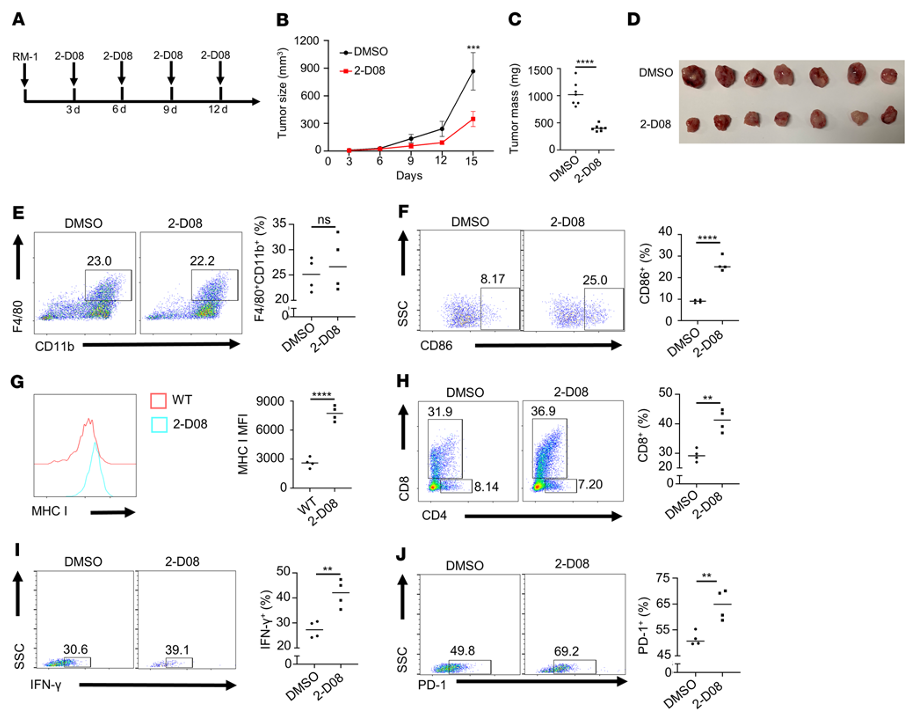
图2.抑制UBC9可抑制PCa的进展
3、巨噬细胞中UBC9缺乏抑制PCa的进展
为了进一步确定TAM在UBC9介导的PCa进展中的作用,作者构建了携带前列腺肿瘤的LyzM-Cre-UBC9-loxP巨噬细胞条件敲除小鼠模型(图3A)。作者发现UBC9-/-小鼠植入的前列腺肿瘤生长速度要慢得多(图3B),体积要小得多(图3C和D)。然而,两组间浸润性TAM未见差异(图3E)。相比之下,UBC9-/-小鼠中CD86+ TAM的比例(图3F)和TAM中MHC I的表达水平(图3G)明显更高。重要的是,UBC9-/-小鼠表现出相似比例的肿瘤浸润CD4+ T细胞,但肿瘤内CD8+T细胞比例明显更高(图3H)。与这些观察结果一致,从UBC9-/-小鼠分离的肿瘤中IFN-γ+CD8+T细胞的百分比增加(图3I),并且在UBC9-/-小鼠肿瘤中也观察到更高比例的表达pd-1的CD8+T细胞(图3J)。通过免疫荧光染色,作者发现TAM与肿瘤浸润性CD8+T细胞非常接近(图3K),表明它们之间存在密切的相互作用。综上所述,这些结果表明巨噬细胞中UBC9的缺乏通过动员抗肿瘤CD8+T细胞显著减缓了PCa的进展文。
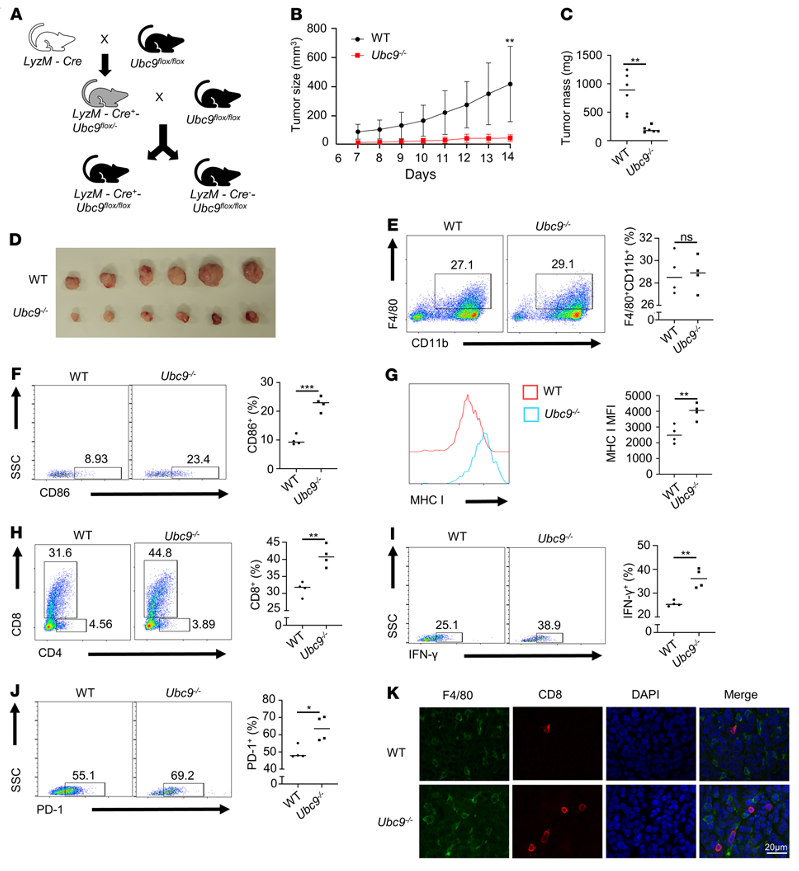
图3.巨噬细胞中UBC9缺乏抑制PCa的进展
4、UBC9缺失可增强巨噬细胞M1程序
(M1)巨噬细胞的经典活化导致促炎细胞因子和表面共刺激分子的上调,这是最佳抗肿瘤反应所必需的。通过实时qPCR检测,用2-D08预处理LPS刺激的骨髓源性巨噬细胞(BMDMs)可诱导CD86、MHC I和促炎细胞因子如IFN-γ和TNF-α的高表达(图4A)。流式细胞术分析CD86、MHC I(图4B)、IFN-γ和TNF-α(图4C)显示它们在2-D08处理的BMDMs中相对丰富,ELISA检测相应培养上清中也检测到较高浓度的IFN-γ和TNF-α(图4D)。为了进一步证实上述发现,作者比较了M1条件下分化的WT和UBC9缺陷BMDMs的激活标记。同样,通过实时qPCR(图4E)、流式细胞术(图4、F和G)和ELISA分析(图4H),在UBC9-/-BMDMs中,CD86、MHC I和促炎细胞因子(IFN-γ和TNF-α)的表达也明显增强。总之,作者的数据支持UBC9缺陷促进与抗肿瘤反应相关的巨噬细胞M1程序。
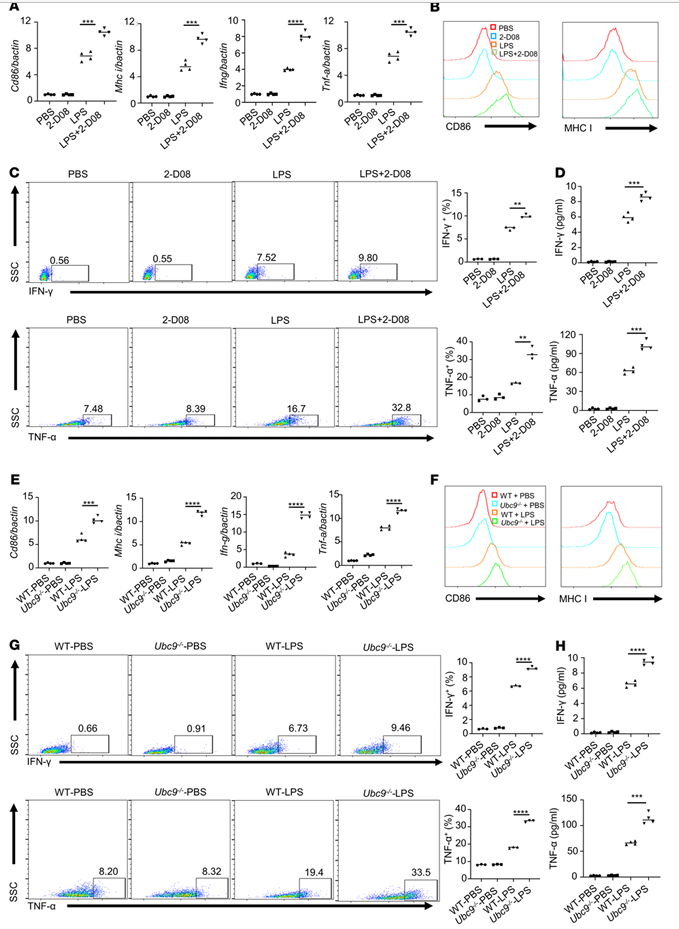
图4.UBC9的缺失促进巨噬细胞的激活
5、缺乏UBC9的巨噬细胞能激活抗原特异性CD8+T细胞
为了确定UBC9对巨噬细胞激活效应CD8+T细胞功能的影响,作者使用了B16-OVA黑素瘤小鼠。简单地说,在第3天和第10天,将LPS和OVA脉冲的WT和UBC9-/-巨噬细胞在B16-OVA肿瘤附近进行皮内转移(图5A)。与上述结果相似,UBC9-/-巨噬细胞转移的肿瘤表现为生长速度减慢(图5B),体积变小(图5、C和D)。有趣的是,两组小鼠的TAM比例没有明显差异(图5E)。然而,在UBC9-/-巨噬细胞中,CD86+TAM的比例更高(图5F), MHC I的表达也更高(图5G)。瘤内CD4+ T细胞的比例相当,但在UBC9-/-组中检测到瘤内CD8+T细胞的比例要高得多(图5H),其特征是IFN-γ(图5I)和PD-1(图5J)表达增强。这些数据表明,UBC9-/-巨噬细胞在激活肿瘤浸润性CD8+T细胞方面更有效。为了进一步证实上述观察结果,作者将WT或UBC9缺陷的ova脉冲巨噬细胞与OT-I CD8+T细胞共培养。正如预期的那样,与WT对照组相比,UBC9-/-巨噬细胞显著增强了CD8+T细胞中Ki67(图5K)、颗粒酶B(图5L)和IFN-γ(图5M)的表达。为了排除肿瘤细胞直接抑制CD8+T细胞介导的免疫监视的可能性,作者在存在或不存在UBC9抑制剂2-D08的情况下处理B16-OVA细胞,然后与OT-I CD8+ T细胞共培养。总的来说,作者的数据表明,UBC9的缺失促进巨噬细胞M1程序,同时增强抗原递呈能力,从而诱导CD8+T细胞活化。
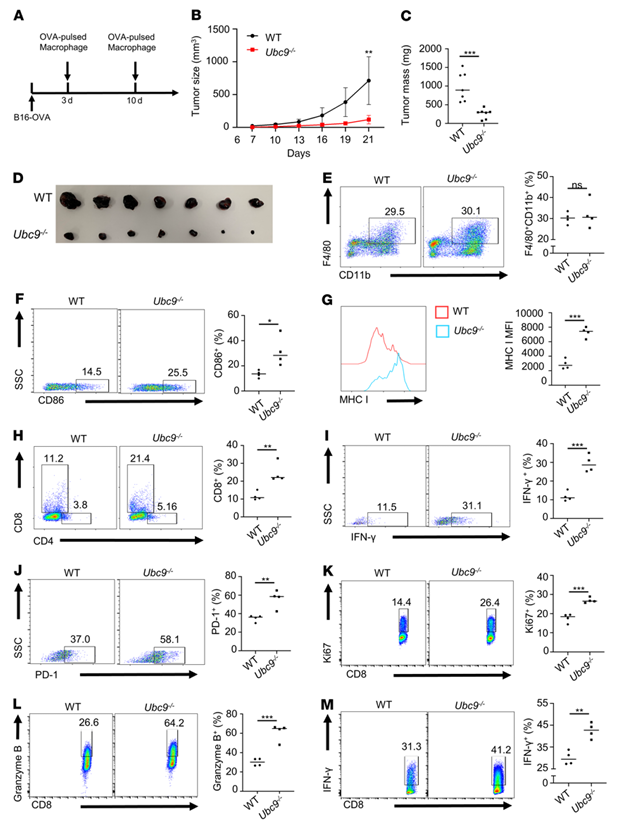
图5.巨噬细胞中UBC9的缺失激活抗原特异性CD8+ T细胞
6、UBC9介导的STAT4 summoylation抑制巨噬细胞M1程序
为了进一步探索UBC9抑制巨噬细胞M1程序的机制,作者对WT和UBC9-/-前列腺荷瘤小鼠的TAM进行了转录组学分析。基因本体(GO)分析发现,JAK/STAT信号通路是UBC9-/-TAM中被上调的DEGs富集的最突出的信号通路(图6,A和B)。由于STAT4是巨噬细胞中介导IL-12依赖性IFN-γ产生的关键转录因子,因此作者检查了UBC9是否在IL-12刺激后介导STAT4 summoylation。用BSA或IL-12刺激BMDMs,然后用STAT4抗体进行免疫沉淀,所得产物用SUMO1抗体探测。在IL-12刺激的BMDMs中更明显地检测到分子量为STAT4+ SUMO1的反应带(图6C)。此外,STAT4的summoylation在异位UBC9表达的BMDMs中得到进一步证实(图6D)。接下来,携带FLAG标记的Stat4-WT和Stat4-K350R(350位赖氨酸残基被精氨酸取代)的腺病毒被转导到BMDMs中,随后进行IL-12刺激,然后使用FLAG抗体进行免疫沉淀。正如预期的那样,一旦赖氨酸350突变,SUMO1活性带就消失了(图6E)。为了检查SUMOylation对STAT4的功能影响,收集上述转导的BMDMs,在IL-12刺激后,使用FLAG抗体分析STAT4的异位亚细胞定位。通过免疫印迹和免疫荧光染色,在STAT4 - k350r转导的细胞中检测到明显更高的异位STAT4核比例(图6、F和G),表明SUMOylation抑制STAT4核易位。为了进一步检查SUMOylation是否会影响STAT4的稳定性,作者将上述转导的BMDMs用环己亚胺处理以阻断蛋白质合成,然后分析异位STAT4水平。在STAT4 - k350r转导的细胞中检测到更高水平的异位STAT4(图6H),这促使作者检查其泛素化状态。为此,用MG-132(一种蛋白酶体抑制剂)处理细胞。事实上,SUMOylation显著提高了STAT4的泛素化水平(图6I),这促进了蛋白酶体依赖的降解机制。与这些观察结果一致,STAT4- k350r转导的细胞在mRNA和蛋白水平上均表现出更高的IFN-γ和TNF-α表达(图6,J和K)。为了确定STAT4 summoylation对巨噬细胞抗肿瘤发展的功能影响,首先在3'-非翻译区转染STAT4 siRNA以敲低内源性STAT4,然后用STAT4 - wt或STAT4 - k350r腺病毒转导BMDMs,然后与CD8+T细胞共培养。在stat4k350r转导的BMDMs培养中,CD8+T细胞的增殖和活化明显增加(图6L)。为了证实这一观察结果,作者采用了将Stat4-K350R或stat4 - wt转导的巨噬细胞转移到前列腺肿瘤的邻近部位。总的来说,这些发现支持STAT4在赖氨酸350处的SUMOylation抑制STAT4的稳定性和转录活性。
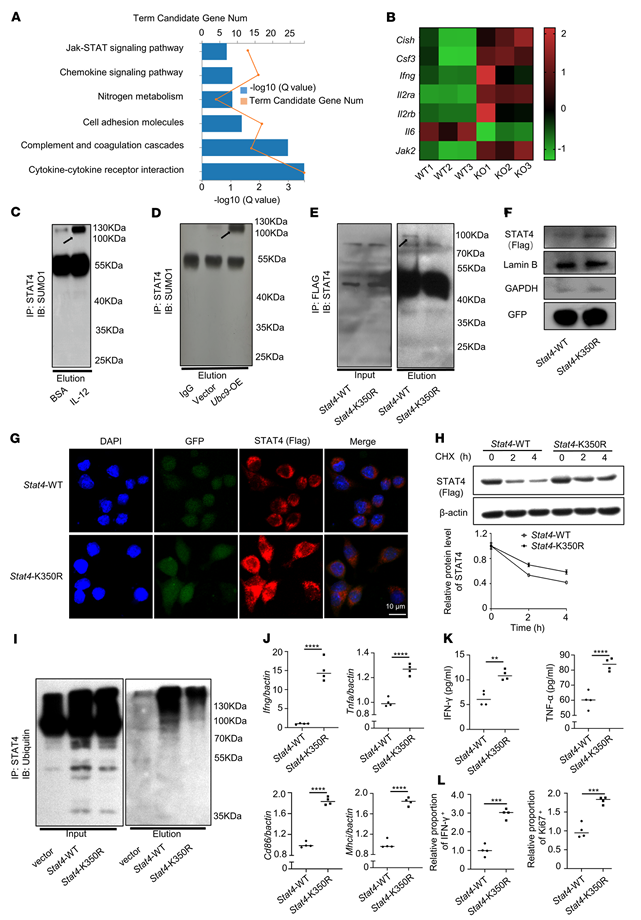
图6.UBC9介导的STAT4 SUMOylation抑制巨噬细胞活化
7、抑制UBC9与抗PD-1治疗协同抑制前列腺肿瘤生长
最后,作者试图将上述发现转化为临床环境。作者首先检查了CD8+T细胞耗竭对肿瘤生长的影响。CD8+T细胞的缺失导致肿瘤生长最快,几乎消除了巨噬细胞特异性UBC9缺陷的治疗效果(图7,A-C),这进一步支持了TAM的抗肿瘤作用主要是由于CD8+T细胞的启动的观点。鉴于UBC9-/- TAM上调CD8+T细胞上PD-1的表达,作者假设UBC9抑制剂与抗PD-1治疗协同抑制PCa。为此,在PCa模型中评估了联合治疗(2-D08加抗PD-1)与单一治疗(2-D08或单独抗PD-1)的治疗效果(图7D)。值得注意的是,2-D08联合抗PD-1抑制前列腺肿瘤进展的效果远高于单独使用2-D08或抗PD-1 (图7,E-G)。在2-D08联合抗PD-1治疗后,前列腺肿瘤中CD8+T细胞频率(图7H)的增加更为明显,CD8+T细胞中IFN-γ+ T细胞的比例也更高(图7I)。总的来说,这些发现表明,UBC9抑制剂联合PD-1阻断抗体可能是临床治疗前列腺癌的可行策略。
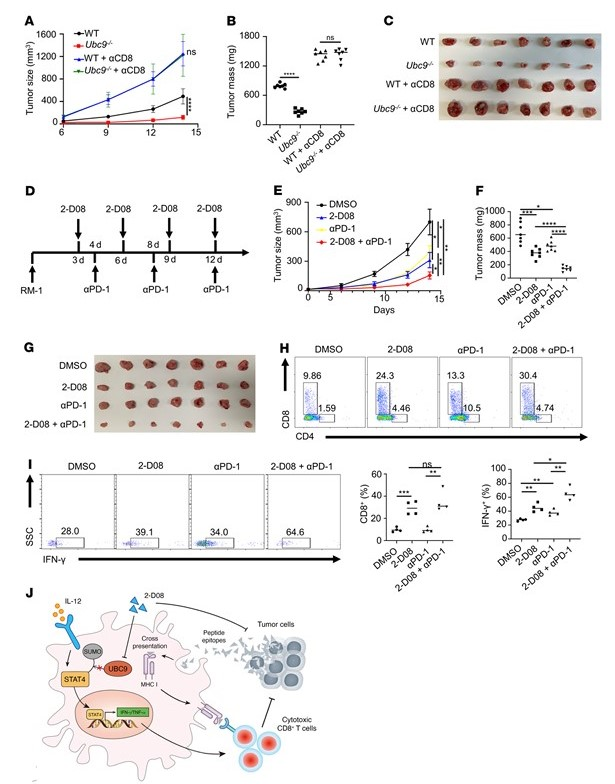
图7.抑制UBC9与抗pd -1治疗协同抑制前列腺肿瘤生长
结论
综上所述,缺乏UBC9的巨噬细胞表现出STAT4表达和转录活性的增强,这有利于TAM M1极化和CD8+效应T细胞的激活。鉴于肿瘤中SUMOylation过程的抑制会对其他TME组分产生全球性的影响,作者不能排除UBC9的化学阻断除了TAM和肿瘤细胞之外还存在其他机制的可能性。尽管如此,作者的重点是解决与CD8+效应T细胞激活相关的UBC9对巨噬细胞极化的影响。在这种情况下,作者提供了分子和细胞对TAM肿瘤活性操纵的见解,并提出了重塑抗肿瘤TME的有价值的方法。总的来说,作者的数据支持使用UBC9抑制剂和PD-1阻断剂可能是临床治疗PCa的可行方法。
实验方法
转基因小鼠模型构建、生信分析、细胞培养、异种移植肿瘤模型、流式细胞术、RNA提取、qPCR、WB、共聚焦显微镜分析、肿瘤浸润白细胞的分离、细胞活力分析、ELISA、体外SUMO化蛋白翻译后修饰实验、STAT4稳定性分析、CD8+T细胞共培养实验、IF、IHC
参考文献
Xiao J, Sun F, Wang YN, Liu B, Zhou P, Wang FX, Zhou HF, Ge Y, Yue TT, Luo JH, Yang CL, Rong SJ, Xiong ZZ, Ma S, Zhang Q, Xun Y, Yang CG, Luan Y, Wang SG, Wang CY, Wang ZH. UBC9 deficiency enhances immunostimulatory macrophage activation and subsequent antitumor T cell response in prostate cancer. J Clin Invest. 2023 Feb 15;133(4):e158352. doi: 10.1172/JCI158352. PMID: 36626227; PMCID: PMC9927932.






