新发现!外泌体是这样促进血管生成作用的!
摘要
小胶质细胞的激活在视网膜新生血管性疾病的发生发展中起着关键作用。因此,有必要揭示其病理生理和分子机制,以干预疾病的进展。在这里,使用公开可用的单细胞RNA测序数据集来鉴定在视网膜血管生成模型中通过外泌体从M1小胶质细胞向M0小胶质细胞的细胞间通信增加。此外,在体外和体内的结果表明,M1小胶质细胞衍生的外泌体促进活化和增强静息小胶质细胞的促血管生成能力。基于外泌体的miRNA测序结合基因干扰,进一步的结果表明,活化的小胶质细胞衍生的外泌体通过miR-155-5p向M0小胶质细胞传递极化信号来促进小胶质细胞活化。随后,miR-155-5p抑制Socs1并激活NFκB通路,最终导致炎症级联反应并放大促血管生成作用。此外,上调的Irf1驱动miR-155-5p在活化的小胶质细胞中的表达,从而导致miR-155-5p被外泌体包裹的趋势增加。因此,本研究阐明不同类型的小胶质细胞之间的细胞间通讯在复杂的视网膜微环境中血管生成过程中的关键作用,并有助于临床视网膜新生血管的新的,有针对性的和潜在的治疗策略。本文于2023年5月发表在《International journal of biological sciences》IF: 9.2期刊上。
技术路线

主要实验结果
1、通过生物信息学分析,OIR模型中的外泌体增加从M1小胶质细胞到M0小胶质细胞的细胞间通讯
OIR模型允许直接询问视网膜的血管生成反应。为更好地了解小胶质细胞对视网膜血管生成的潜在贡献,作者分析从对照视网膜中提取的单细胞的转录组和出生后第17天的OIR小鼠,基于公开的单细胞RNA测序数据集(accession no. GSE152928)。在质量控制过滤器后,分别从对照和OIR小鼠获得9045和6140个视网膜细胞。然后对细胞谱进行无偏聚类,根据多个公认的标记,发现小胶质细胞/巨噬细胞相关基因主要分布在八个簇中,并且一个细胞簇表现出内皮细胞(ECs)的特征。使用已知的小胶质细胞亚型特异性标志物,进一步将小胶质细胞/巨噬细胞相关簇分为两大类,包括M0小胶质细胞簇和M1小胶质细胞簇(图1A-B)。Il1β和Tnfα是促炎M1极化的两个特征基因,在OIR视网膜的M1小胶质细胞簇中明显增加(图1C),表明M1小胶质细胞簇在病理过程中具有更高水平的极化和更活跃的状态。为进一步解释活性M1小胶质细胞对各种细胞的影响,作者将受体配体对映射到细胞类型上,以构建假定的细胞通讯。观察到与对照组小鼠相比,OIR小鼠的视网膜细胞间质细胞通讯网络中的M1小胶质细胞活性增强(图1D-E)。具体来说,从M1小胶质细胞到血管EC的细胞间通讯或M0小胶质细胞增加。由于许多研究已报道活化小胶质细胞与EC在血管生成中的关联,因此作者重点关注M1极化小胶质细胞与处于静息稳态的小胶质细胞之间的关系。然而,活化和静息小胶质细胞之间的通讯机制尚不清楚。
既往研究表明,外泌体是细胞通讯的重要介质,外泌体内化可由配-受体介导的内吞作用介导。因此,来源于M1小胶质细胞的外泌体对于OIR中静息小胶质细胞至关重要。与预期一致,OIR视网膜的M63小胶质细胞簇中的特异性外泌体标志物Cd63和Sdcbp显著增加(图1F-G)。因此,这些发现表明,在OIR诱导的血管生成中,从M1小胶质细胞到M0小胶质细胞的细胞间通讯增加,M1小胶质细胞衍生的外泌体可能介导上述过程。
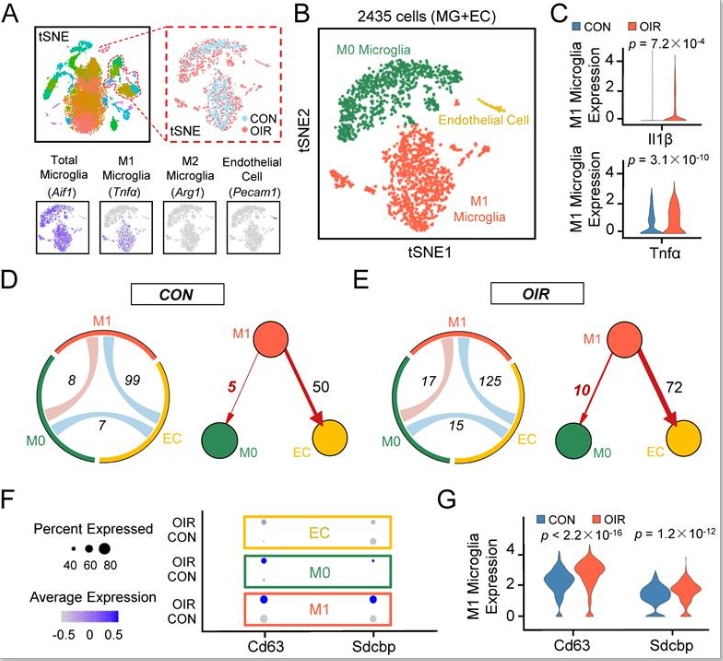
图1 单细胞RNA-seq发现,在视网膜血管生成模型中从M1小胶质细胞到M0小胶质细胞的细胞间通讯增加
2、M1小胶质外泌体促进体外小胶质细胞M1极化
为阐明M1极化小胶质细胞衍生外泌体的作用,作者利用BV2细胞(一种小鼠小胶质细胞)进行进一步实验。BV2细胞通过添加1ng/ml LPS极化为M100表型,这是激活小胶质细胞的典型方法。如图2A所示,LPS处理促进细胞转变为具有许多假足的不规则形式。与添加PBS相比,对照组中活化小胶质细胞的比例增加(图2B)。此外,活化小胶质细胞标志物的表达均显著增加,包括用于小胶质细胞活化的CD68,以及用于M1表型的iNOS和Il1β(图2C-E)。此外,基于使用流式细胞术对CD11b和CD86阳性(M1表型小胶质细胞表达的另一个标志物)细胞的分析,作者发现LPS显著诱导BV2小胶质细胞极化为M1表型(图2F-G)。
为更好地了解来源于M0型和M1型BV2细胞的外泌体的功能,首先通过超速离心分离外泌体进行鉴定。在透射电子显微镜(TEM)下观察到典型的杯形膜囊泡形态(图2H)。纳米颗粒示踪分析(NTA)表明,M0和M1 BV2细胞外泌体的粒径分布主要在30-150 nm范围内(图2I)。蛋白质印迹图显示,已知的外泌体特征标志物(包括Cd63和Tsg101)在外泌体中含量很高。此外,细胞裂解物富含钙连接蛋白(一种内质网蛋白),而在外泌体中未检测到钙连接蛋白,这表明分离的外泌体相对纯净,没有污染其他细胞区室(图2J)。
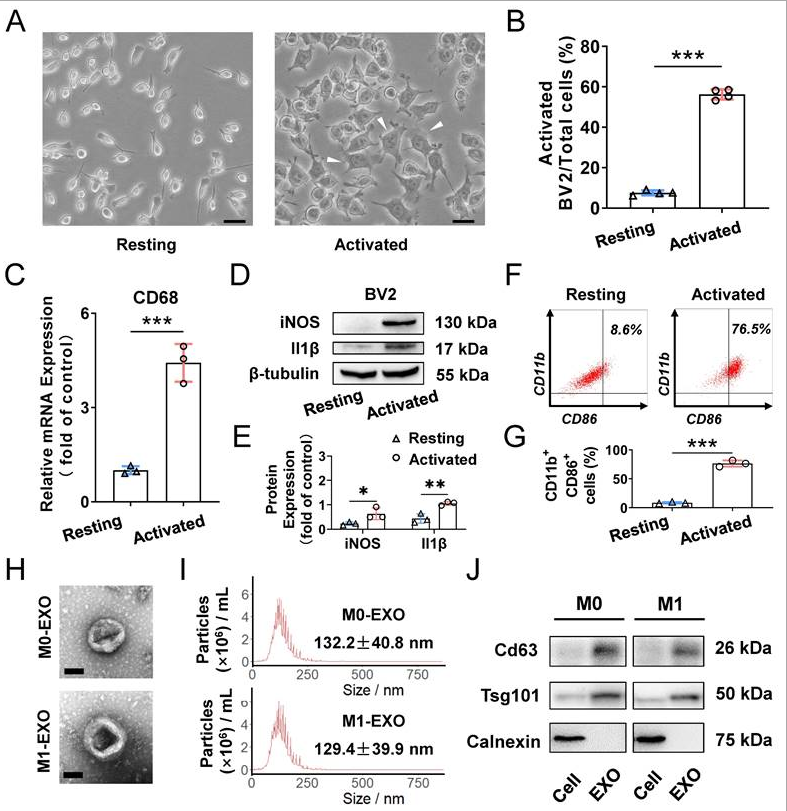
图2 源自静息和LPS激活的M1小胶质细胞的外泌体的表征
接下来,作者专注于外泌体对原代视网膜小胶质细胞(PMG)的影响。培养的PMG与PKH26标记的外泌体(红色)一起孵育,这些外泌体是从BV2衍生的条件培养基中收集的。在处理后24小时,用Iba1+(一种特定的小胶质细胞标志物)对细胞进行染色。数据显示M0-EXO和M1-EXO(红色)都位于Iba1阳性PMG(绿色)的细胞质中,表明外泌体被PMG吞噬(图3A)。此外,在PMG中用M1-EXO处理24小时诱导细胞形态变化(白色箭头)(图3B)。与PBS组和M0-EXO处理组相比,M1-EXO处理组观察到更多的变形虫和不规则形状的Iba1阳性细胞(图3C)。为表征活化小胶质细胞的极化表型,作者通过蛋白质印迹进一步测量M1激活的标记物iNOS和Il1β的表达水平。结果表明,与PBS组和M0-EXO处理组相比,M1-EXO组iNOS和Il1β表达显著增加(图3D-E)。此外,如图3F-G所示,流式细胞术的结果进一步证实,M1-EXO处理M1小胶质细胞的百分比显著增加。综上所述,结果表明在体外M1外泌体治疗后,PMGs向M1促炎状态极化。

图3 M1小胶质细胞外泌体在体外促进原发性视网膜小胶质细胞的M1极化
3、M1小胶质细胞通过体外外泌体增强M0小胶质细胞的促血管生成潜力
为评估用小胶质细胞外泌体处理后PMG的促血管生成能力,用下述条件培养基处理HUVEC。例如,用M0-EXO,M1-EXO和PBS作为对照处理PMG。然后,收集条件培养基作为PBS处理的PMG条件培养基(pPMG-CM),静息外泌体处理的PMG条件培养基(rPMG-CM)和活化的外泌体处理的PMG条件培养基(aPMG-CM)。如图4A所示,与用pPMG-CM或rPMG-CM处理的细胞相比,aPMG-CM显著促进HUVEC的增殖。同样,与pPMG-CM或rPMG-CM处理相比,aPMG-CM处理增加毛细管样管和液络部的数量。定量后,rPMG-CM显著加强血管的形成(图4B)。CM对HUVECs迁移的影响通过迁移伤口愈合测定法进行评估。结果显示,在用aPMG-CM治疗后24小时和48小时,在光学显微镜下观察到明显较小的剩余伤口面积(图4C-D)。此外,在治疗后24小时从HUVEC中提取整个蛋白质,以评估血管生成相关蛋白的表达。ELISA显示,与pPMG-CM或rPMG-CM组相比,aPMG-CM组的Sdf1表达显著增加(图4E)。此外,如图4F-G所示,蛋白质印迹测定表明,用aPMG-CM处理的HUVECs中Cxcr4、Hif1α和Vegf均显著升高。
总的来说,这些数据表明M1-EXO处理的小胶质细胞在体外促进血管生成;换句话说,M1小胶质细胞外泌体激活M0小胶质细胞,随后放大其促血管生成活性,这表明血管生成与源自活化小胶质细胞的外泌体之间存在间接联系。

图4 来源于M1小胶质细胞的外泌体在体外提高小胶质细胞的促血管生成能力
4、M1小胶质细胞外泌体促进体内M1视网膜小胶质细胞的极化
为在体外确认结果,作者使用成年小鼠模型检查玻璃体内注射M0-EXO或M1-EXO后视网膜的变化,使用PBS和假组的阴性对照(图5A)。如图5B所示,玻璃体内注射两天后,通过小鼠视网膜中的3D共聚焦图像检测到PKH26标记的外泌体(红色),外泌体定位于Iba1+小胶质细胞(绿色)的细胞质。在注射后六周,将视网膜冷冻并切成切片或径向切割并固定在载玻片上,然后用针对Iba1阳性(红色)的抗体染色(图5C),发现在核层中用M1-EXO处理后,迁移的小胶质细胞数量增加(图5D),这是活化小胶质细胞的典型细胞特征。此外,细胞密度的定量表明,M1-EXO处理显著增加小胶质细胞的极化水平,而其他组之间没有显著差异(图5E-F)。这些发现表明,来源于M1 BV2细胞的外泌体促进视网膜驻留小胶质细胞的活化,这与体外结果一致。
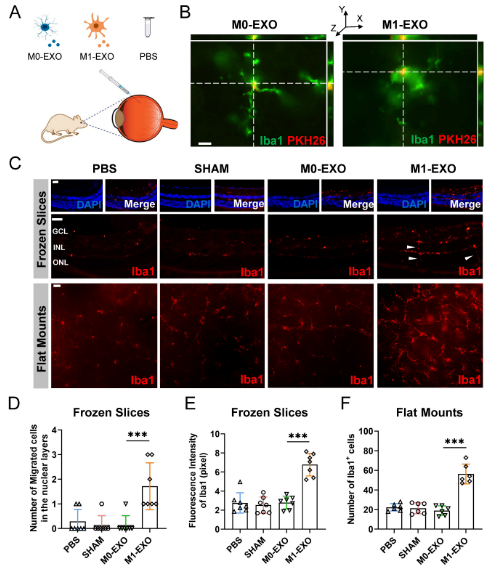
图5 M1小胶质细胞外泌体促进体内视网膜小胶质细胞活化
5、M1小胶质细胞外泌体在体内视网膜小胶质细胞活化后诱导血管生成
在成年小鼠模型中M1-EXO玻璃体内注射后,免疫荧光分析显示,在PBS、SHAM或M4-EXO治疗后,血管生成的标志物Cxcr4和Sdf1均显示沿视网膜外缘和脉络膜中微弱的非特异性染色。相比之下,Cxcr4和Sdf1在M1-EXO-注射小鼠的切片中强烈阳性(图6A)。此外,视网膜血管内皮细胞增殖是参与病理性新生血管形成的生物学过程。因此,视网膜组织切片进一步用针对Pecam1和Ki67的抗体进行双重染色,前者是血管内皮细胞的标志物,后者是增殖细胞的标志物。在对每节向前延伸至内限膜的Ki67-和Pecam1-阳性细胞进行计数后,与其他三组相比,仅在M1-EXO治疗组中观察到内皮细胞增殖(图6B)。与体外结果一致,M1小胶质细胞外泌体促进体内视网膜异常内皮细胞增殖。
考虑到体内视网膜微环境的复杂性,为进一步证明M1-EXO可能激活静息小胶质细胞从而增强小胶质细胞介导的血管生成的假设,作者使用米诺环素(一种典型的小胶质细胞活化抑制剂)建立干预组。如图6C所示,米诺环素处理显著减少活化小胶质细胞的数量(图6D)。此外,米诺环素显著抑制Pecam1 +细胞突破M1-EXO诱导的内部限制膜(图6E)。这些结果表明,米诺环素通过抑制视网膜小胶质细胞的活化来缓解M1-EXO的促血管生成作用,并提供大量证据表明M1小胶质细胞外泌体的促血管生成作用是由活化的视网膜小胶质细胞介导的。换句话说,M1-EXO通过激活M0小胶质细胞来放大小胶质细胞相关的促血管生成作用。然而,确切的机制仍有待阐明。

图6 来源于M1小胶质细胞的外泌体促进体内血管生成,抑制视网膜小胶质细胞的活化可逆转这种作用
6、M1小胶质细胞外泌体通过外泌体miR-155-5p诱导静息小胶质细胞活化
新出现的证据表明,外泌体富含miRNA,并进一步递送miRNA以调节受体细胞的功能。为阐明M1-EXO激活小胶质细胞的具体机制,作者对来自BV1细胞的外泌体在静息和M2激活条件下进行miRNA测序。如火山图(图7A)所示,发现与M103-EXO相比,M1-EXO中有103个差异表达的miRNA,包括16个上调和87个下调miRNA。使用热图进一步可视化已鉴定的miRNA的组内和组间差异(图7B)。此外,通过使用qRT-PCR,作者发现M1 BV2细胞和M1-EXO中只有miR-155-5p的水平显著高于各自的对照(图7C)。然而,miR-146b-5p、miR-181d-3p和miR-5121的变化在细胞和外泌体之间并不一致。因此,miR-155-5p可能在外泌体中起关键作用,并进一步测试。
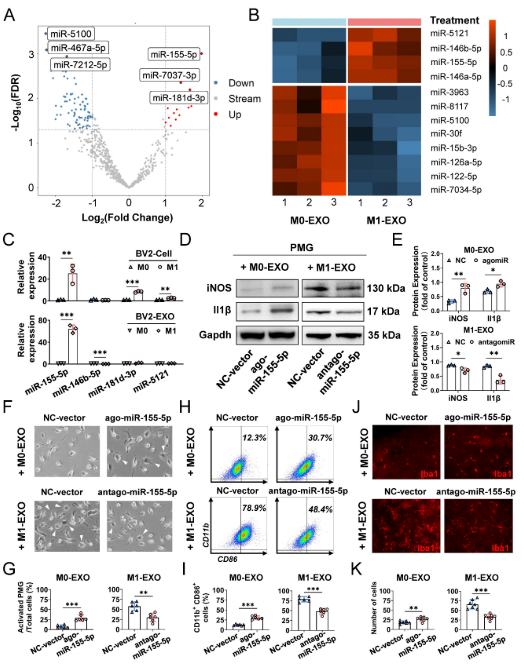
图7 来自M1小胶质细胞的外泌体miR-155-5p在体外和体内诱导静息小胶质细胞活化
为进一步阐明miR-155-5p在BV2细胞来源的外泌体中的确切作用,调节miR-155-5p在外泌体中的表达模式,并观察修饰的外泌体对PMG的作用。首先,作者通过agomir转染在M0-EXO中过表达miR-155-5p,其最初在miR-155-5p表达中较低(ago-miR-155-5p组)。其次通过在最初高表达miR-155-5p的M1-EXO中antagomir转染抑制miR-155-5p(antago-miR-155-5p组)。然后分别鉴定用改良EXO处理的PMG的M1活化曲线。利用三种M1表型标志物(iNOS、IL1β、CD86)来鉴定M1活化谱。数据显示,miR-155-5p在M0-EXO中的过表达显著引起显著的形态学变化(图7F-G)和促进静息PMG的M1极化(图7D-E、图7H-I)。值得注意的是,当miR-155-5p在M1-EXO中被antagomiR-155-5p下调时,M1-EXO促进M1极化的能力被显著抑制,这反映在减少的形态学异常(图7F-G)和活化标志物(图7D-E)。
接下来,为确认miR-155-5p在体内的生物活性,将转染有agomiR或antiagomiR的外泌体注射到玻璃体室中。视网膜平片的结果表明,外源性miR-155-5p补充有助于M0-EXO诱导PMG活化,并且M1-EXO的miR-155-5p下调减轻小胶质细胞活化(图7J-K)。因此,外泌体miR-155-5p可以调节小胶质细胞的极化状态,可能是外泌体介导的小胶质细胞活化的关键分子。
7、外泌体miR-155-5p通过调节Socs1/NFκB途径参与小胶质细胞活化
为探究miR-155-5p激活和炎症转换静息小胶质细胞的机制,作者利用生物信息学分析预测miR-155-5p的潜在靶基因。利用五个数据库(miRanda,miRDB,PITA,TargetScan和PicTar)获得32个交叉的mRNA(图8A)。对重叠的候选mRNA进行进一步的功能富集分析,以确定与炎症相关的途径。基于一系列生物信息学分析,Socs1被认为是miR-155-5p的关键靶标,因为它介导免疫和炎症信号传导。因此,为确认生物信息学分析的结果,作者构建含有Socs3 mRNA的1'-UTR的双荧光素酶报告质粒系统。荧光素酶报告质粒和miR-155-5p模拟物或加扰模拟物共转染到PMG中。荧光素酶活性分析表明,miR-155-5p直接与Socs1 3'-UTR相互作用并降低Socs1的表达(图8B);因此,Socs1的调节可能是破译外泌体miR-155-5p与视网膜炎症之间机制的关键。
先前的研究表明,Socs1通过与NFκB亚基p65相互作用来限制NFκB信号传导和核NFκB活性,而NFκB转录因子家族的激活是调节小胶质细胞活化和促炎分子表达的关键步骤。因此,Socs1可能通过调节NFκB参与M1-EXO介导的细胞活化,这已被蛋白质印迹测定证实。如图8C-D所示,M1-EXO显著抑制Socs1的表达,其次是磷酸化NFκB和两个促炎标志物(iNOS,Il1β)的上调。
为进一步证明M1-EXO的促炎作用是由Socs1和下游转录因子NFκB介导,作者进行功能丧失实验(图8E)。如图8F所示,antagomiR-155-5p转染的M1-EXO显著促进Socs1的表达,并下调PMG中磷酸化NFκB的表达。与空载体转染相比,通过siRNA转染敲低Socs1到PMGs也显著减轻antagomiR-155-5p的抑制作用(图8F-G)。因此,Socs1的敲低可以模拟外泌体miR-155-5p的类似促炎作用。这些结果表明,miR-155-5p的靶标Socs1在小胶质细胞活化和视网膜炎症中起着至关重要的作用。

图8 外泌体miR-155-5p通过靶向Socs1调节NFκB通路促进小胶质细胞活化
8、转录因子Irf1促进小胶质细胞中的细胞和外泌体miR-155-5p
基于上述结果,作者证实M155激活的小胶质细胞中细胞miR-155-5p水平升高,从而导致外泌体中miRNA水平升高,最终在小胶质细胞中传播激活信号和炎症反应。然而,miR-155-5p在活化的小胶质细胞中究竟如何增加仍然难以捉摸。越来越多的证据表明,转录因子(TFs)可以直接或间接触发miRNA的表达。为确定负责miR-155-5p上调的潜在TF,在静息BV2细胞和活化的BV2细胞之间进行mRNA测序以筛选差异表达的基因(图9A)。此外,JASPAR数据库预测的差异表达基因和潜在转录因子的交叉分析表明,三个候选基因可能负责miR-155-5p的表达(图9B)。在这些候选细胞的GSEA之后,作者发现与静息细胞相比,转录因子Irf1相关途径在活化的小胶质细胞中大大富集(图9C)。此外,与静息BV1小胶质细胞相比,活化的BV2小胶质细胞中Irf1的蛋白表达显著增加(图9D)。
已知miR-155-5p是从miR155宿主基因(miR155HG)加工而来的。为证实转录因子Irf1与miR155HG的启动子结合并随后促进miR-155-5p的表达(图9E),构建miR155HG启动子-荧光素酶报告质粒系统,并将其与Irf1过表达质粒共转染到BV2细胞中。转染后检测到荧光素酶活性。图9F显示Irf1可以激活miR155HG的启动子。此外,Irf1的过表达显著促进miR155HG和miR-155-5p在BV2小胶质细胞中的表达(图9G)。所有这些结果表明,上调的Irf1直接结合miR155HG的特异性DNA序列,并促进miR-155-5p在活化小胶质细胞中的表达。
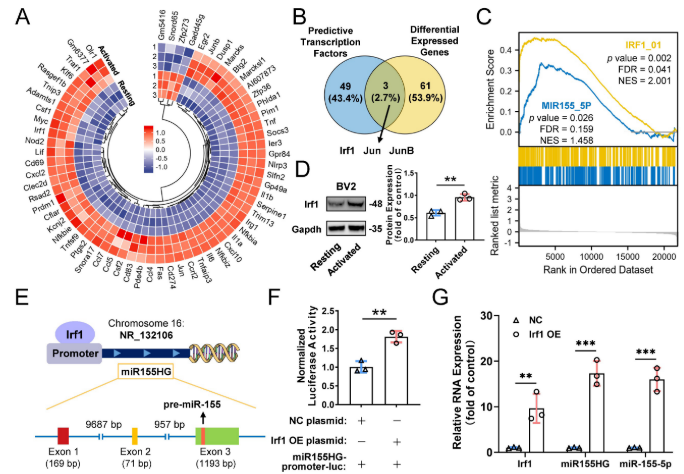
图9 转录因子Irf1促进M1激活的小胶质细胞中miR-155-5p的表达
这是第一项揭示M1小胶质细胞外泌体介导的静息小胶质细胞活化和迁移,炎症级联反应和视网膜血管生成的新机制的研究。具体机制包括:(1)上调的Irf1直接结合miR155HG的特异性DNA序列,促进miR-155-5p在活化小胶质细胞中的表达。(2)来自M155活化小胶质细胞的外泌体miR-155-5p通过静息小胶质细胞内吞。(3)外泌体miR-155-5p通过选择性抑制Socs1激活NFκB途径和小胶质细胞激活状态。(4)增加和聚集的M1小胶质细胞引起炎症级联反应,(5)放大促血管生成作用,最终诱导视网膜异常内皮细胞增殖。
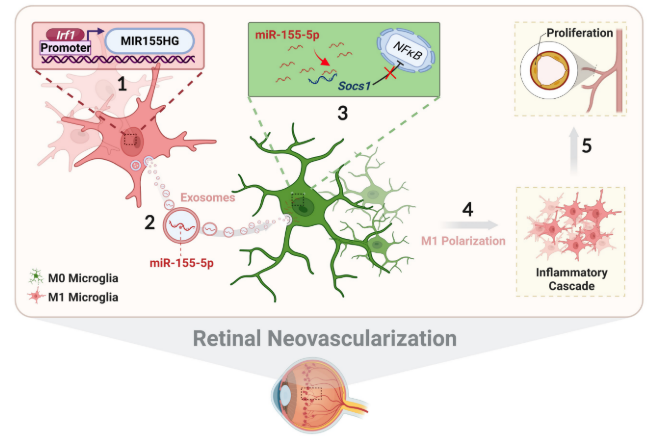
图10 说明M1小胶质细胞中Irf1介导的外泌体miR-155-5p调节Socs1表达,以促进静息小胶质细胞的活化并放大促血管生成作用的示意图
实验方法
单细胞测序、细胞培养、外泌体分离、WB、流式细胞术、CCK8细胞活力测定、伤口愈合实验、血管形成测定、ELISA、免疫荧光、qRT-PCR、过表达与敲除、转染、miRNA靶标预测、荧光素酶报告基因检测、miRNA-Seq、mRNA-Seq。
参考文献
Chen X, Wang X, Cui Z, et al. M1 Microglia-derived Exosomes Promote Activation of Resting Microglia and Amplifies Proangiogenic Effects through Irf1/miR-155-5p/Socs1 Axis in the Retina. Int J Biol Sci. 2023;19(6):1791-1812. Published 2023 Mar 21. doi:10.7150/ijbs.79784






