胃癌源性LBP通过促进肝内纤维化微环境形成促进肝转移

胃癌(GC)是世界范围内发病率第6位的恶性肿瘤,死亡率很高。肝转移(LM)是胃癌主要的血液学转移,约4-14%的胃癌患者在初诊期被检测到。此外,它占接受根治性胃切除术的胃癌患者术后复发率的37%。不幸的是,由于检测的延迟和目前治疗的有限疗效,GC-LM患者的预后仍然非常差,5年以上的生存率低于10%。因此,有必要进一步研究GC-LM的机制以确定潜在的诊断标志物和有效的治疗靶点,以便早期发现和改进干预。肿瘤转移是一个复杂的过程,肿瘤细胞从原发部位扩散到外来器官,最终建立继发性肿瘤。根据“种子和土壤”假说,肿瘤细胞和靶器官微环境之间的沟通在很大程度上决定了转移的疗效。新证据提示,原发肿瘤可通过分泌可溶性因子重塑外来器官的微环境,从而启动转移。这一过程创造了允许和支持的微环境,促进癌细胞在远处器官的定植和生长。这些有利于转移的微环境被称为转移前微环境(PMNs)。PMNs具有多种特征,包括细胞外基质(ECM)重编程、免疫抑制、炎症、血管生成/血管通透性、淋巴管生成、器官趋向性。越来越多证据表明,分泌蛋白作为肿瘤细胞与外界微环境之间的主要介质,可通过诱导PMNs促进肿瘤转移。然而,GC分泌蛋白在GC-LM中的作用尚不清楚。鉴定肝内PMNs的关键分泌蛋白可能是早期检测GC-LM的新策略,研究其潜在机制可能为开发有效预防和控制GC-LM提供新的治疗靶点。该研究发表在《Journal of Experimental & Clinical Cancer Research》,IF:11.16。
技术路线

主要研究结果
1. LBP分泌与胃癌肝转移相关,并与胃癌患者较差的预后相关
采用DIA-MS对5例GC-LM患者和5例GC-NLM患者的血清样本进行检测,筛选可能与GC-LM相关的肿瘤分泌蛋白。两组中检测到49种失调的分泌蛋白,如图1A所示。此外,研究者在之前的研究中对24对胃癌和匹配的正常胃黏膜进行了mRNA表达微阵列分析,以确定胃癌中最失调的基因(图1B)。随后,通过ELISA(图1C)和qRT-PCR,LBP被验证为与GC-LM相关的最显著的分泌蛋白。对一个胃癌患者队列进行WB和IHC,发现胃癌组织中LBP的表达高于癌旁正常组织(图1D,E);此外,研究者观察到,与GC-NLM组织相比,LM组织的LBP表达高于原发肿瘤(图1E,F)。对30例GC-LM患者和30例GC-NLM患者既往血清学LBP水平的ROC曲线分析表明,血清学LBP水平有可能作为GC-LM的诊断生物标志物(图1G)。在另一个胃癌患者队列中进一步进行了无LM生存分析,发现血清LBP水平较高的患者在根治性胃切除术后更容易发生肝转移(图1H)。综上所述,这些结果表明,GC来源的LBP与GC-LM相关,并与胃癌患者的不良预后相关。
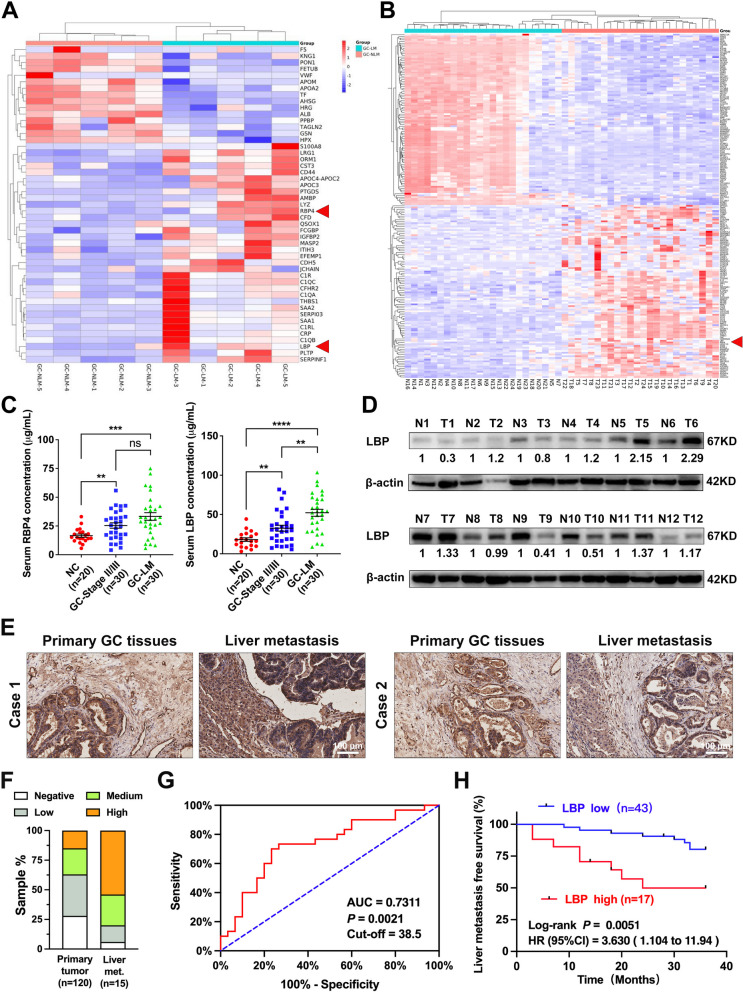
图1 LBP分泌与胃癌肝转移相关,并与不良预后相关
2. LBP促进GC-LM
通过WB和qRT-PCR检测7种胃癌细胞株和正常胃黏膜上皮细胞株(GES-1)中LBP的表达水平。结果表明,与GES-1细胞相比,大多数胃细胞系具有更高的LBP表达水平(图2A)。此外,MKN45细胞的条件培养基(CM)含有最高水平的LBP(图2A)。这些结果得到了IF染色的证实(图2B)。接下来,利用短发夹RNA构建LBP稳定过表达的胃癌细胞株AGS和LBP高水平内源性LBP稳定敲低的胃癌细胞株MKN45,通过qRT-PCR和WB进行验证。研究者开发了LM的新型改良脾内注射小鼠模型,以在BABL/c裸鼠体内验证LBP在LM中的功能作用(图2C)。值得注意的是,每周进行一次的活体生物发光成像(BLI)显示,在AGS细胞中LBP的过表达显著加剧了脾内注射后LM的进展(图2D)。脾内注射后第5周处死小鼠,收集肝脏和脾脏,分别进行光子通量定量分析、称重、HE染色和肝表面转移结节计数。与此一致,AGS细胞中LBP过表达显著增强了肝转移负荷(图2E,F);相反,在MKN45细胞中,通过短发夹RNA敲低LBP显著抑制LM的进展(图2G)和减少肝转移负荷(图2H-K)。这些结果证明了LBP在GC-LM中的促转移作用。

图2 LBP在体内对GC-LM有促进作用
3. LBP通过诱导肝内纤维化PMN促进胃癌细胞在早期肝脏定植和生长
为了研究LBP促进GC-LM的机制,研究者首先研究了LBP对肿瘤细胞内在恶性程度的影响。EdU实验和克隆形成实验检测LBP过表达和敲低后对MKN45和HGC-27细胞增殖的影响。这些结果表明,LBP对GC细胞的增殖没有显著影响(图3A)。同样,通过MKN45和HGC-27细胞的流式细胞术分析,LBP对胃癌细胞的凋亡没有显著影响(图3B)。同样,皮下接种异种移植瘤进一步证实LBP在体内对皮下肿瘤的生长没有显著影响(图3C,D),Ki-67的IHC染色显示LBP对皮下肿瘤的增殖没有显著影响(图3E)。此外,伤口愈合、Transwell实验、IF和WB表明LBP对胃癌细胞的侵袭、迁移和上皮-间充质转化(EMT)有轻微影响(图3F-G)。因此,研究者提出LBP通过微环境依赖的方式促进GC-LM。
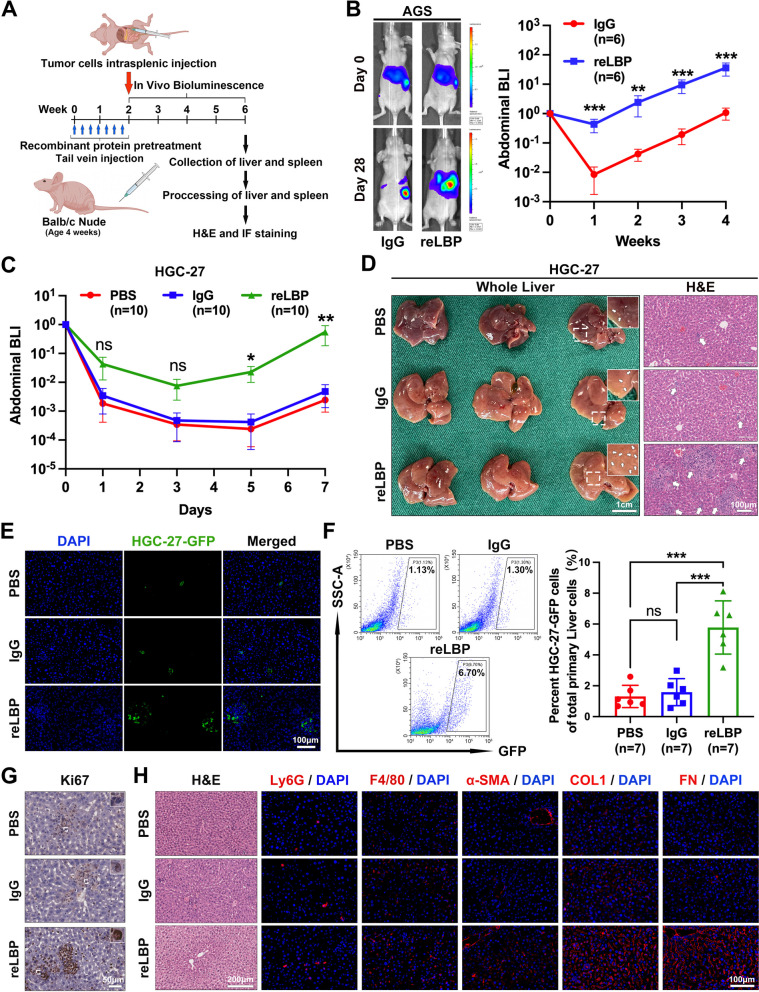
图3 内源性LBP对胃癌细胞增殖、凋亡、侵袭迁移和间质转化无明显影响
为了证实这一假设,研究者利用重组蛋白进行了预建模,建立了小鼠模型,以证明外源性LBP对LM和肝内微环境的影响(图4A)。小鼠尾静脉注射重组LBP(reLBP)或IgG,隔日1次,连续2周后,脾内注射荧光素酶标记的GC细胞。如图4B所示,外源性LBP显著加剧了脾内注射AGS细胞后LM的进展,最终导致肝转移负荷显著增加。值得注意的是,BLI分析显示,使用外源性LBP预建模显著增加了癌细胞在肝脏中的定植,即使在脾内注射后的第一周(图4B)。此外,在脾内注射HGC-27细胞后的第一周内,每天对生物发光信号的分析一致表明,LBP在早期阶段增加了GC细胞在肝脏中的定植和生长(图4C)。脾内注射后第7天处死小鼠。代表性照片和HE染色显示,reLBP预建模后,肝脏中GC细胞接种和生长增加(图4D)。肝脏IF染色和流式细胞术分析进一步证实了这一结果(图4E-F)。此外,肝脏切片的Ki-67 IHC染色提示,reLBP预建模诱导了肝脏中处于种子期的GC细胞增殖(图4G)。因此,结果表明,外源性LBP在早期诱导PMN促进胃癌细胞在肝脏的种植和生长。
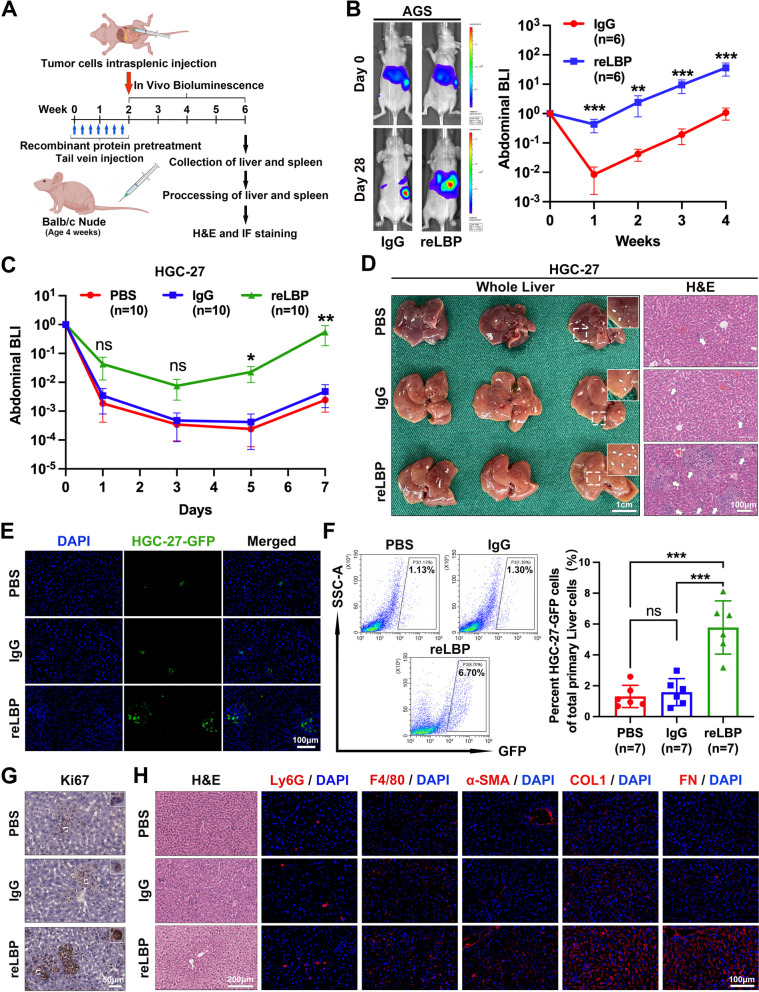
图4 LBP通过诱导肝内纤维化PMN形成促进GC细胞在预造模小鼠模型早期肝脏定植和生长
正如之前的报道,髓系细胞聚集和ECM沉积被确定为PMN的关键特征。因此,通过尾静脉注射PBS、IgG和reLBP,隔日1次,连续2周,观察小鼠肝内基质浸润髓样细胞和ECM的变化。正如预期的那样,通过IF和IHC染色,研究者发现,与对照组小鼠相比,reLBP预建模小鼠的肝脏出现了hsc(α-平滑肌肌动蛋白,α-SMA)的激活增加,同时I型胶原(COL1)和纤维连接蛋白(FN)的沉积显著增加(图4H)。虽然观察到reLBP处理的小鼠肝脏中浸润的髓系细胞比对照小鼠多,但差异不显著(图4H)。研究者的数据表明,髓系细胞对ECM在肝脏的沉积并不是必需的,这与之前的研究结果一致。综上所述,研究者的结果表明,LBP通过诱导肝内纤维化PMN形成来促进胃癌细胞在早期肝脏中的种植和生长。
4. 肝内巨噬细胞介导LBP诱导的PMN形成
为了阐明LBP诱导PMN形成的机制,研究者首先通过尾静脉将GFP标记的reLBP(GFP-LBP)注射到小鼠体内,以研究LBP的器官趋向性。与预期一致的是,荧光强度分析分析显示,与其他器官相比,肝脏中GFP-LBP的积累显著增加(图5A)。此外,通过IF染色鉴定肝脏中的主要细胞类型,以确定LBP的“受体”细胞。有趣的是,研究者发现LBP主要与F4/80 Kupffer细胞(kc)共定位(图5B),但与HSC(结蛋白阳性细胞)不共定位。此外,从未处理的小鼠分离的原代混合肝细胞在体外与GFP-LBP蛋白孵育,结果表明GFP-LBP主要被巨噬细胞(F4/80细胞)“摄取”(图5C)。随后,研究者在体外用reLBP处理的THP-1细胞的CM处理LX-2(人HSC系)细胞。IF染色显示,与对照培养基相比,reLBP处理的THP-1的CM显著增加了LX-2细胞中α-SMA、COL1和FN的表达(图5D)。WB进一步证实了这些结果(图5E)。此外,在预建模小鼠模型中,通过腹腔注射CEL去除肝脏中的F4/80细胞,以确定肝内ECM重塑。正如预期的那样,肝内巨噬细胞清除后,reLBP未能诱导HSC活化以及COL1和FN在肝脏中的沉积(图5F)。综上所述,这些结果表明肝内巨噬细胞介导了LBP诱导的PMN。
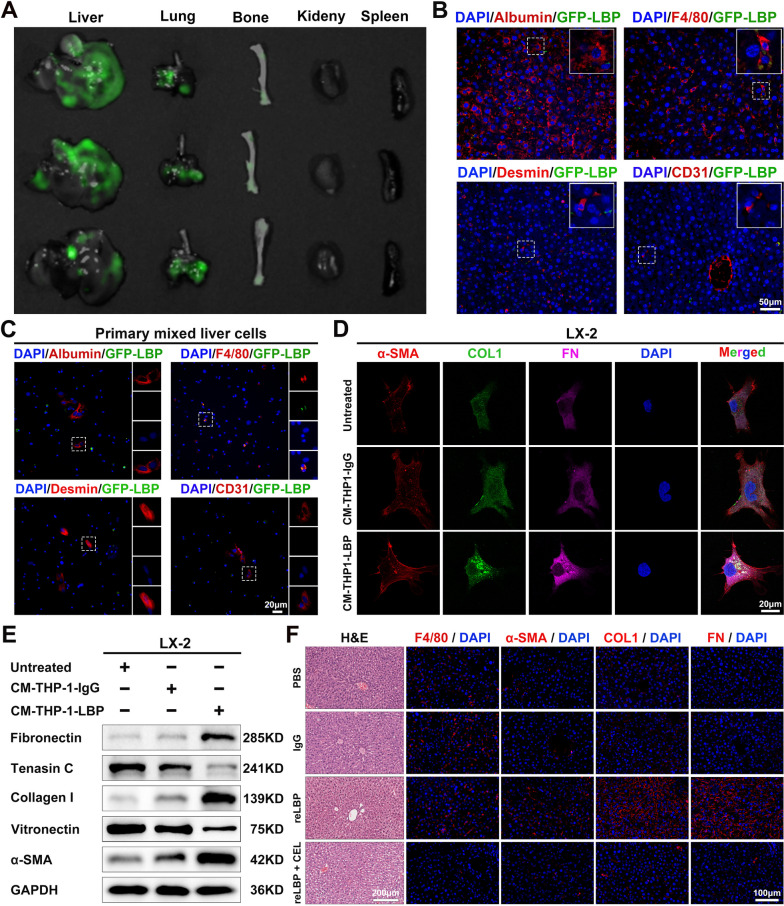
图5 GC来源的LBP主要聚集在肝脏,并与肝内巨噬细胞共定位
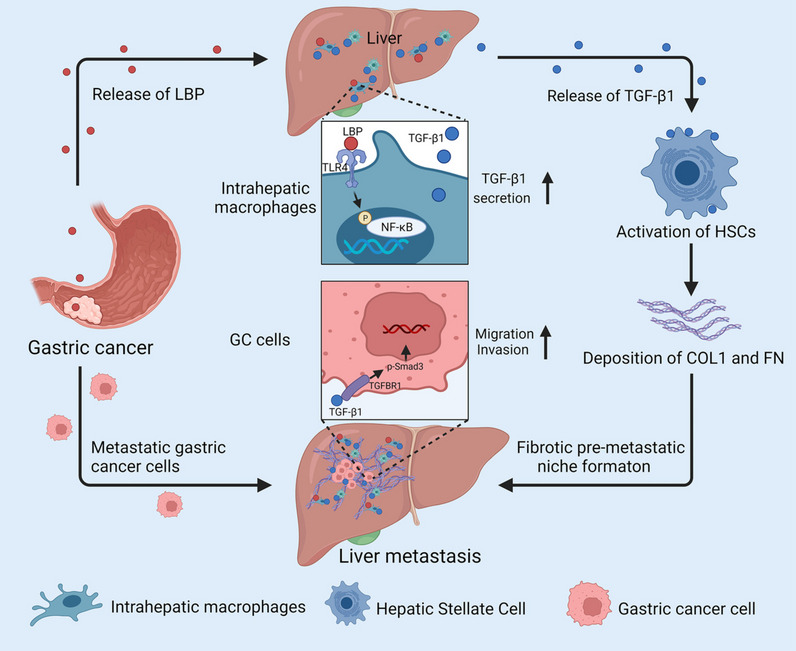
5. LBP通过激活肝内巨噬细胞TLR4/NF-κB通路,促进TGF-β1分泌,TGF-β1激活HSC,引导肝内纤维化PMN的形成
为了进一步研究肝内巨噬细胞在LBP诱导的PMN形成中的作用,研究者进行了免疫沉淀分析,然后在PMA-THP-1细胞中进行了SDS-PAGE和质谱分析(图6A)。通过对质谱结果和STRING数据库的预测进行重叠分析,研究者确定TLR4是与LBP相互作用的有前景的受体蛋白(图6B)。Co-IP实验表明,在PMA-THP-1细胞中同时过表达LBP和TLR4后,LBP和TLR4之间存在相互作用(图6C)。

图6 LBP通过激活肝内巨噬细胞TLR4/NF-κB通路,促进TGF-β1分泌,TGF-β1激活hsc,引导肝内纤维化PMN的形成
为了确定LBP在巨噬细胞中的功能靶点,通过mRNA测序比较IgG和reLBP处理的PMA-THP-1细胞的基因表达谱。KEGG通路分析显示,NF-κB信号通路是reLBP影响最多的通路之一。此外,研究者观察到TGF-β1是上调最高的基因之一(图6D)。ELISA结果进一步证实,reLBP处理的THP-1细胞上清中TGF-β1蛋白含量明显高于对照上清(图6E)。IF染色(图6F)和WB显示LBP通过激活TLR4/NF-κB通路上调PMA-THP-1细胞中TGF-β1的表达。与此同时,研究者发现,与体内对照小鼠相比,reLBP预建模小鼠的肝脏在肝内巨噬细胞(f4/80细胞)中TGF-β1的表达显著增加(图6G)。随后,应用抗TGF-β中和抗体和选择性TGF-βⅰ型受体激酶抑制剂galunisertib在体外验证TGF-β1是否直接调控LX-2细胞的活化。正如预期的那样,IF染色显示,抗TGF-β中和抗体和galunisertib减弱了来自reLBP处理的THP-1细胞的CM诱导的LX-2中α-SMA、COL1和FN的过表达(图6I)。同样,WB也证明了抗TGF-β1抗体和galunisertib抑制TGF-β/Smad信号通路,从而阻断reLBP处理的THP-1细胞的CM诱导的LX-2活化(图6J)。综上所述,这些结果表明LBP激活肝内巨噬细胞的TLR4/NF-κB通路,促进TGF-β1分泌,进而激活HSC,指导肝内纤维化PMN的形成。
6. galunisertib选择性靶向TGF-β/Smad通路可有效预防小鼠GC-LM
鉴于TGF-β/Smad通路在枸杞多糖诱导的肝纤维化中的关键作用,本研究旨在探讨靶向枸杞多糖或TGF-β/Smad通路能否有效防治GC-LM。体内实验采用抗LBP抗体和选择性TGF-β受体I激酶小分子抑制剂galunisertib。在脾内注射MKN45细胞的小鼠中,两种治疗均显著抑制了LM的进展(图7A),最终减轻了肝转移负荷(图7B)。免疫组织化学染色显示肝转移组织中TGFBR1的表达水平较高(图7C)。此外,划痕实验和Transwell实验显示,reLBP处理的THP-1细胞的CM显著增强MKN45细胞的迁移和侵袭能力。然而,galunisertib治疗显著减弱了这些作用(图7D-F)。同样,研究者发现,来自reLBP处理的THP-1细胞的CM通过激活TGF-β/Smad信号通路显著增加MKN45细胞的肌动蛋白重构,而galunisertib通过下调p-Smad3的表达显著抑制这种肌动蛋白重构(图7G)。这些结果表明,GC来源的LBP诱导肝内TGF-β1表达增加,可增强转移性胃癌细胞的迁移和侵袭能力,进一步促进癌细胞在肝脏的定植。综上所示,选择性靶向TGF-β/Smad信号通路的galunisertib通过抑制纤维化中性粒细胞的形成和减少肝脏转移性胃癌细胞的迁移和侵袭来有效预防GC-LM。

图7 galunisertib选择性靶向TGF-β/Smad信号通路可有效预防小鼠GC-LM
结论
该研究揭示了GC衍生的LBP在GC-LM中的新作用。具体地,研究者确定了GC来源的LBP激活了肝内巨噬细胞的TLR4/NF-κB通路,导致TGF-β1的分泌增加。随后,TGF-β1进一步激活HSC,调控肝内纤维化PMN的形成。此外,肝内TGF-β1增强了转移性胃癌细胞在肝内的迁移和侵袭。重要的是,这些发现表明,血清LBP可以作为一种新的诊断生物标志物,用于早期检测GC-LM。此外,galunisertib选择性靶向TGF-β通路是一种有前景的GC-LM预防和治疗策略。
机制图
实验方法
微阵列分析,细胞培养,RNA提取和定量PCR处理,质粒和慢病毒转染,蛋白质印迹,流式细胞术,酶联免疫吸附法,H&E染色和免疫组织化学(IHC)染色,免疫荧光(IF)染色,mRNA测序,免疫沉淀和质谱,EdU测定,伤口愈合试验,小鼠实验
参考文献
Xie L, Qiu S, Lu C, Gu C, Wang J, Lv J, et al. Gastric cancer-derived LBP promotes liver metastasis by driving intrahepatic fibrotic pre-metastatic niche formation. J Exp Clin Cancer Res. 2023 Oct 3;42(1):258. doi: 10.1186/s13046-023-02833-8.






