Malat1抑制在三阴性乳腺癌肿瘤免疫微环境中具有重要作用!

长链非编码RNA(lncRNA)在正常组织和癌症基因调控中发挥重要作用。靶向lncRNAs是一种有前景的治疗方法,通过开发间隙反义寡核苷酸(ASO)使其变得可行。转移相关肺腺癌转录物(MALAT1)是一种丰富的lncRNA,其表达在多种癌症中上调。尽管Malat1增加了肿瘤细胞的迁移和侵袭特性,但其在肿瘤微环境(TME)中的作用尚未得到很好的定义。作者使用几种免疫活性临床前同系Tp53-null三阴性乳腺癌(TNBC)小鼠模型探索Malat1与肿瘤免疫微环境(TIME)之间的联系,这些模型模拟了人类乳腺癌中发现的异质性和免疫抑制性TME。使用Malat1 ASO能够敲低Malat1 RNA表达,导致原发性肿瘤生长延迟、增殖减少和凋亡增加。此外,肿瘤浸润淋巴细胞的免疫表型显示,Malat1抑制随着时间的推移而改变,免疫抑制性肿瘤相关巨噬细胞(TAM)和髓系衍生抑制细胞(MDSC)减少以及细胞毒性CD8+T细胞增加。肿瘤细胞、TAM和MDSC中Malat1消耗减少免疫抑制细胞因子/趋化因子的分泌,其中T细胞Malat1抑制增加了炎性分泌和T细胞增殖。Malat1 ASO与化疗或免疫检查点阻断(ICB)组合改善了临床前模型中的治疗反应。这些研究强调了Malat1抑制在TNBC中的免疫刺激作用、Malat1 ASO治疗的益处以及其与化疗和免疫治疗联合使用的潜力。该研究于2023年9月发表在《Cancer Immunol Res》,IF:10.1。
技术路线

主要研究内容
1. 单剂Malat1 ASO延迟TNBC临床前小鼠模型中原发性肿瘤生长
为确定Malat1抑制对体内乳腺肿瘤进展的影响,作者使用了已建立的同系Tp53-null源自BALB/c小鼠模型,其概括了TNBC的攻击性和异质性。使用富含中性粒细胞的2208 L luminal肿瘤亚型和富含巨噬细胞的T12和T11 Claudin低肿瘤亚型,因为它们具有高度免疫抑制性的髓细胞区室,这有助于肿瘤发生、转移和对可用治疗的耐药性。Gapmer ASOs允许Malat1靶向降解,并且在先前研究中已经证明可以有效实现敲低。WT BALB/c小鼠将Tp53-null肿瘤块植入乳腺脂肪垫中,一旦可触及,就连续5天皮下注射Malat1靶向ASO或scramble对照ASO,并给予2天药物假期(图1A)。治疗5天后,Malat1 ASO导致约60%-75%的Malat1 RNA表达减少,该表达使用5天和2天休息治疗方案维持(图1B和C)。Malat1抑制导致T12和2208L肿瘤中原发性肿瘤生长延迟,治疗14天后,两种模型的肿瘤体积均显著减少(图1D和E)。在2208L和T11长期治疗研究中,Malat1抑制维持了2208 L荷瘤小鼠的肿瘤进展延迟。肿瘤切片IHC染色显示,Malat1 ASO处理的肿瘤具有增殖标记物磷酸组蛋白3的染色减少和细胞凋亡增加,如切割的caspase 3染色增加所示(图1F)。这些结果表明,由于细胞死亡增加和细胞增殖减少,使用ASO特异性靶向Malat1和随后的Malat1抑制导致肿瘤体积减小。
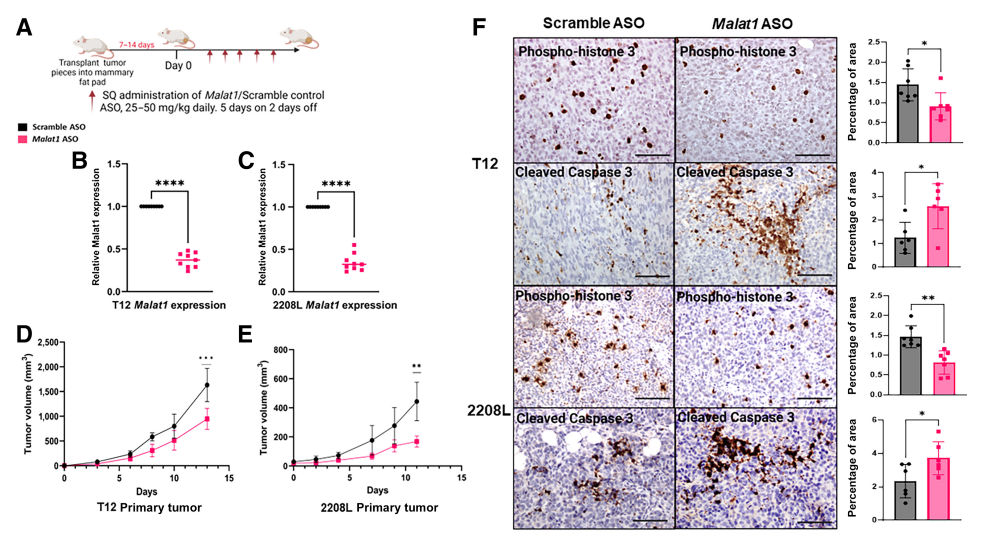
图1:单剂Malat1 ASO延迟TNBC临床前小鼠模型中原发性肿瘤生长
2. Malat1抑制降低了TME中免疫抑制性骨髓细胞
Malat1先前已被证明通过增加肿瘤细胞增殖和侵袭来促进癌症的进展,但对TIME的影响知之甚少。为研究Malat1敲低对TIME的影响,从Malat1 ASO治疗14天的T12和2208L肿瘤中分离肿瘤浸润淋巴细胞(TIL),并使用流式细胞术对髓细胞标志物进行定量(图2A和E)。Malat1缺失的T12 Claudin低肿瘤是高度富集巨噬细胞肿瘤,该肿瘤减少了F4/80+巨噬细胞。此外,在存在的巨噬细胞中,CD206+ 精氨酸-1(Arg-1)+ F4/80+细胞增加,他们是免疫抑制M2样巨噬细胞的代表(图2B和D)。相反,CD86+ F4/80细胞略有增加,CD86是M1样巨噬细胞存在的炎症标志物(图2C)。在高度富集中性粒细胞的2208L肿瘤中,Malat1抑制导致粒细胞MDSC(G-MDSC)的Cd11b+Ly6ClowLy6Ghigh细胞减少(图2F)。以Cd11b+Ly6ChighLy6Glow为特征的单核细胞MDSC(M-MDSC)区室在治疗组之间没有显示出显著差异(图2G)。先前研究表明,当一个髓细胞群体被耗尽时,在单独的髓细胞群体中可能存在补偿性富集,但在Malat1 ASO治疗中,作者观察到2208L肿瘤中Arg-1+巨噬细胞也减少(图2H)。肿瘤切片用F4/80和中性粒细胞标记物S100a8染色,以阐明髓细胞空间分布。IHC显示骨髓细胞广泛分布在整个肿瘤中,T12肿瘤中存在大量巨噬细胞,2208 L肿瘤中存在更多中性粒细胞。Malat1缺失的肿瘤F4/80和S100a8染色均减少(图2I)。
为确定可能导致骨髓细胞群减少的肿瘤内在效应,用Malat1 ASO处理肿瘤来源的T12和2208L细胞系,并收集上清使用炎性细胞因子/趋化因子试验进行分析。两种细胞系中的Malat1缺失改变了肿瘤分泌谱。在T12癌细胞中,募集免疫抑制巨噬细胞和中性粒细胞募集到肿瘤部位的趋化因子减少(图2J)。在Malat1 ASO处理的肿瘤细胞中,有助于募集M1样巨噬细胞到TME的炎性趋化因子Cxcl9和Cxcl10也减少,这为肿瘤细胞Malat1抑制不负责将巨噬细胞复极为更具炎症表型提供证据。类似于T12,Malat1 ASO处理的2208L肿瘤细胞中免疫抑制细胞因子/趋化因子分泌减少。趋化因子Cxcl1、Gm-csf和Tnfa降低,同时Ccl5和细胞因子IL6显著降低。已知这些因素可促进MDSCs的募集和发展并支持免疫抑制。Vegf是血管生成和髓细胞富集的启动子,在两种细胞系中均减少(图2J)。这些分析表明,Malat1抑制降低了TNBC微环境中免疫抑制免疫细胞的频率,肿瘤细胞分泌谱发生一致性变化,导致骨髓细胞向原发性肿瘤的募集减少。然而,由于两个骨髓细胞室都没有完全消除,作者接下来检查了剩余骨髓细胞的功能。
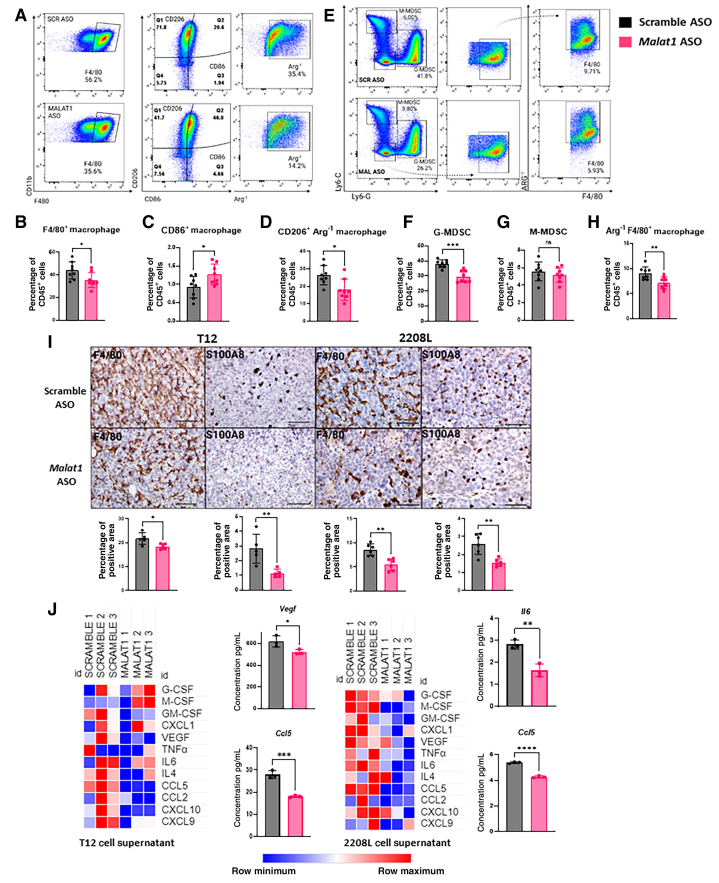
图2:Malat1抑制降低TME中的免疫抑制性骨髓细胞
3. Malat1抑制降低了TAM和MDSC的免疫抑制功能
在确定肿瘤细胞中Malat1缺失可以影响免疫抑制性骨髓细胞向TME募集之后,作者接下来想了解Malat1抑制对TAM和MDSC功能的影响。分别从T12和2208L肿瘤中提取的TAMs和MDSCs均具有丰富的Malat1 RNA表达,这与肿瘤细胞相当。单细胞测序研究表明,在与肿瘤细胞直接接触前和直接接触后,从外周血单核细胞中收集的中性粒细胞在遇到肿瘤时表现出Malat1表达增加,表明Malat1可能在中性粒细胞的肿瘤教育中发挥作用。这使作者更详细地研究了Malat1缺失可能对骨髓细胞产生的内在影响。为确定Malat1 ASO是否能够有效敲低T12原发性肿瘤分离出的TAMs和2208L原发性瘤分离出的MDSCs中的Malat1,在250 nmol/L ASO存在下体外培养72小时。在这两种类型细胞中,Malat1 RNA表达在体外显著降低(图3A和4A)。此外,从T12肿瘤提取的TAMs(图3B)和从2208L肿瘤提取的MDSCs(图4B)在ASO治疗5天后显示出Malat1 RNA表达显著敲低,证实该治疗方案降低了骨髓细胞和肿瘤细胞中Malat1表达。
为确定TAM功能的变化,将从T12肿瘤中分离的TAM与从WT BALB/c小鼠脾脏中分离的CD3/CD28刺激的T细胞在体外培养。250 nmol/L ASO浓度导致60%至80%的TAMs敲低,但T细胞没有敲低,并且当用该浓度的ASO单独培养T细胞时,增殖没有发生变化。T细胞与Malat1缺失TAMs共培养72小时,这增加了细胞增殖,如CFSE表达降低(图3C和D),同时CD8+ T细胞增殖显著增加,而CD4+ T细胞增殖没有变化(图3E和F)。类似地,当从Malat1 RNA表达降低的2208L肿瘤中分离的MDSCs与活化的T细胞共培养时,CD8+ T细胞增殖增加(图4C-F)。
为评估Malat1缺失的髓系细胞对T细胞杀伤能力的影响,在250 nmol/L ASO存在下,将从T12原发性肿瘤分离的TAMs或MDSCs与GFP标记的T12肿瘤衍生细胞系和从JEDI小鼠脾脏分离的GFP特异性T细胞以1:1:1比例孵育,T细胞:TAM:肿瘤细胞5:5:1比例孵育,T细胞∶MDSC:肿瘤细胞1:1:1比例孵育。使用Incucyte每2小时拍摄细胞照片和GFP信号(图3G和4G)。流式细胞术分析残留细胞,在Malat1 ASO处理的TAM共培养物中,细胞死亡标志物Annexin V没有发生变化(图3H)。同样,T细胞中观察到具有细胞毒性T细胞标记物Granzyme B和Perforin的CD8+细胞增加(图3I和J)。Malat1缺失的MDSC共培养中T细胞毒性增加,如Annexin V+肿瘤细胞的显著增加以及Granzyme B+ CD8+ T细胞和Perforin+ CD8 + T细胞增加(图4H–J)。在没有T细胞的情况下,TAMs和MDSCs与肿瘤细胞共培养作为补充对照。从TAM 5:5:1和MDSC 1:1:1共培养物中收集到的上清趋化因子/细胞因子分析显示,其分泌特征与肿瘤细胞相似,如观察到的免疫抑制趋化因子减少,两种细胞类型的共培养物中,Il10显著减少(图3K和4K)。在存在肿瘤细胞的情况下,Malat1 ASO处理的培养物中也观察到Ifnγ分泌减少,这表明Malat1抑制降低了TAMs和MDSCs整体炎性特征,其中包括免疫抑制因子减少。这些结果表明,在TNBC中,随着Malat1敲低,髓系细胞功能发生变化。此外,原代TNBC-TME中Malat1抑制通过降低TAMs和MDSCs对T细胞的抑制作用,有助于创造一个更具有免疫刺激性的环境,这可能会增加T细胞反应。这些结果使作者研究了Malat1 ASO治疗后对TME中T细胞的影响。

图3:Malat1抑制降低TAM免疫抑制功能

图4:Malat1抑制降低MDSC免疫抑制功能
4. Malat1抑制增加了TME中T细胞浸润
一旦确定Malat1敲低对TME中骨髓细胞群的影响,作者使用从T12和2208L原发性肿瘤中分离的TIL来研究Malat1缺失对T细胞浸润的影响,并使用流式分析进行定量(图5A)。在2208L肿瘤中,观察到表达细胞毒性标志物Granzyme B和Ifnγ的CD8+ T细胞数量增加(图5B-D)。CD4+ T细胞群也减少,这与免疫抑制调节性Foxp3+ CD4+ T细胞显著减少相吻合(Tregs,调节性T细胞;图5E和F)。在T12肿瘤中,Granzyme B+ T细胞浸润显著增加,而总体CD8+ T细胞浸润没有变化(图5G和H)。T12肿瘤包含更少的CD4+ T细胞群,并且没有观察到Tregs显著变化(图5I和J)。对肿瘤切片进行CD8α和Foxp3 IHC染色,以确定这些细胞的空间分布。在2208L肿瘤间质中发现许多T细胞,尽管Malat1 ASO处理肿瘤显示CD8α染色增加,与Scramble ASO处理肿瘤相比,在其间质外发现更多的细胞(图5K)。与Scramble相比,Malat1 ASO处理的T12肿瘤中CD8a染色也略有增加(图5K)。Foxp3染色稀疏,然而,定量显示在两种肿瘤模型中,Malat1 ASO治疗后Foxp3减少(图5K)。对原发性肿瘤TIL分析有助于支持Malat1抑制产生更具有免疫刺激性的TME并增加细胞毒性T细胞浸润的结论。为确定Malat1耗竭后免疫刺激性TME增加对肿瘤进展的影响程度,作者在T细胞缺陷小鼠中进行一系列治疗研究。将2208L肿瘤块植入不具有CD8或CD4 T细胞的Nude无胸腺小鼠乳腺脂肪垫中,并用Malat1 ASO或Scramble对照处理。在该T细胞缺陷模型中,尽管ASO治疗显著降低Malat1表达,但治疗组之间的肿瘤生长没有变化。使用CD8α特异性抗体的初步研究成功消融了循环CD8+ T细胞,它显示出治疗组之间原发性肿瘤生长没有显著变化,同时肿瘤中Malat1 RNA表达显著降低。相反,用IgG和Malat1 ASO处理的小鼠肿瘤体积减少,但由于样本量小,这在统计学上并不显著。这些结果强调了TME在小鼠模型中肿瘤反应中的重要性,并且改变免疫微环境,特别是增加T细胞浸润,足以延缓肿瘤进展。
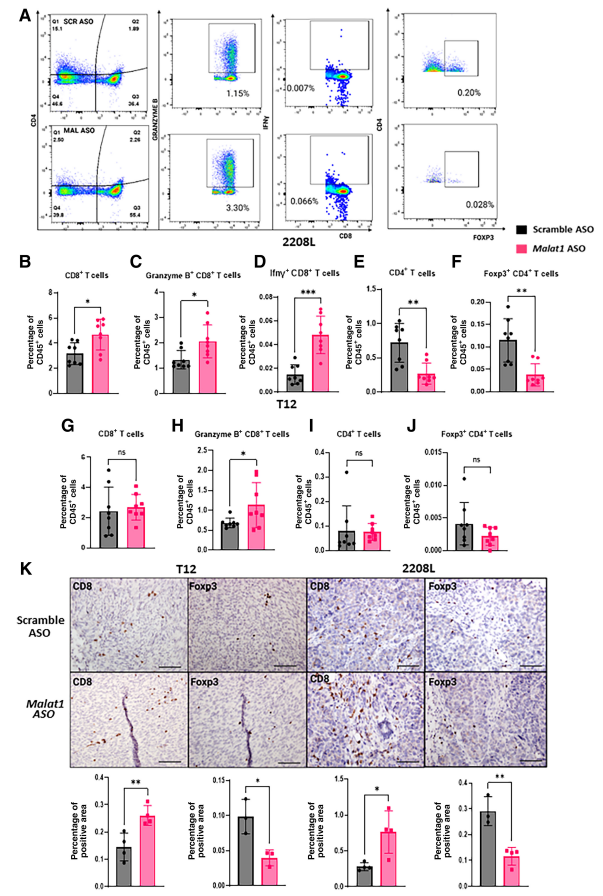
图5:Malat1抑制增加TME中的T细胞浸润
5. T细胞中Malat1抑制增加了细胞增殖和细胞毒性
尽管组织匀浆样品中Ifnγ增加,但T12和2208L肿瘤细胞中Malat1缺失并没有增加细胞的免疫刺激性细胞因子分泌。体内观察到的细胞毒性T细胞浸润增加是否部分是由T细胞内在变化引起的呢?为研究Malat1耗竭对T细胞的影响,作者使用体外培养和共培养实验。通过阴性选择从WT BALB/c小鼠脾脏中分离CD3+ T细胞,并用CD3/CD28活化珠刺激3至5天。在培养的第2天和第4天将Malat1和Scramble ASOs(各500nm)加入孔中。所使用的ASO浓度可以有效将Malat1表达减少至少50%。qPCR分析显示,当用ASO处理T细胞两次时,Malat1 RNA表达显著敲低,培养5天后Malat1消耗更大(图第6A段)。为确定Malat1敲低对T细胞增殖的影响,在接种前用CFSE对T细胞进行染色。3天后,与Scramble ASO处理的T细胞相比,Malat1 ASO处理过的T细胞中CFSE降低(图6B),表明其增殖增加。培养3-5天的Malat1耗竭T细胞的流式分析显示,培养3天后CD8+ T细胞群略有增加,5天后差异不太明显(图6C)。在检查细胞毒性标记物时,发现Granzyme B+和Perforin+ CD8+细胞在培养3天后适度增加,在培养5天后保持不变(图6D和E)。
为进一步研究Malat1抑制对细胞毒性的影响,将从WT JEDI小鼠脾细胞中分离的GFP特异性T细胞与GFP标记的T12细胞以1:1和5:1的效应物:靶目标培养约48小时,并使用Incuyte进行监测。在1:1的效应比下,分析残留的肿瘤细胞,并对Annexin V+ 肿瘤细胞进行定量。在效应比例为5:1时,收集到的残余肿瘤细胞数量可以忽略不计,因此选择通过测量每个孔中剩余的GFP信号来评估细胞毒性。Malat1缺失T细胞显示出肿瘤细胞杀伤增加,Granzyme B和Perforin细胞毒性标记物以5:1比例略有增加(图6F-J)。未用ASO处理的共培养物,连同单独培养的T细胞和单独培养的肿瘤细胞都用作对照组。从这些共培养物中收集到的上清细胞因子分析显示,Malat1 ASO处理的T细胞炎性细胞因子分泌增加,包括肿瘤或髓系细胞中未发现的Ifnγ和Tnfα增加。与骨髓细胞群不同,免疫抑制细胞因子/趋化因子分泌没有显著变化(图6K)。这些发现强调了通过Malat1抑制来提高T细胞细胞毒性的潜力,同时也强调了Malat1在效应T细胞中与骨髓细胞和肿瘤细胞相比所起的不同作用。在T细胞中观察到炎症增加,而在TAMs、MDSCs或肿瘤细胞中没有观察到。用Malat1 ASO处理的T细胞可能在离体环境中用于改善治疗反应。

图6:T细胞中Malat1抑制增加了细胞增殖和细胞毒性
6. Malat1 ASO联合化疗或ICB改善临床前小鼠模型反应
单剂Malat1 ASO治疗对2208 L和T12肿瘤的预期效果,特别是随着时间推移看到的增强免疫刺激效应,使作者研究了将ASO与化疗和ICB等既定临床疗法相结合的潜在益处。植入2208L肿瘤的BALB/c小鼠被随机分为四个单独治疗队列:临床相关剂量为25 mg/kg的Carboplatin与Scramble ASO, 25 mg/kg Carboplatin与Malat1 ASO,10 mg/kg抗PD1与Scramble ASO,10 mg/kg抗PD1与Malat1 ASO。一小群小鼠单独用亚型匹配IgG抗体治疗,作为ICB治疗组的单独对照。小鼠使用既定的治疗方案进行治疗(图7A)。在两个联合治疗组中,原发性肿瘤生长和肿瘤体积均显著延迟,收集到的肿瘤重量显著减少(图7B和C)。尽管没有通过联合治疗实现肿瘤停滞或消退,但能够延长小鼠在高度侵袭性肿瘤中的生存期(图7D和E)。值得注意的是,与IgG对照组相比,用单剂ICB治疗的小鼠没有任何反应,但与Malat1 ASO联合治疗后,小鼠存活时间显著延长。
在这些治疗组中,从原发性肿瘤分离的TIL免疫表型分析概括了单剂治疗后T细胞群变化,细胞毒性Granzyme B+ CD8+ T细胞增加,Tregs减少(图7F-M)。与单剂ASO或化疗治疗组相比,单剂ICB治疗的肿瘤调节性Foxp3+ CD4+ 细胞增加,但Malat1 ASO与ICB联合使用显著降低了这种免疫抑制性T细胞群(图第7I和M)。这些治疗组中的IHC染色支持TIL流式分析中观察到的结果,与单剂治疗相比,在Malat1 ASO联合治疗的肿瘤基质区域内外发现更多的CD8+ T细胞。这些结果突出了将Malat1 ASO与常见临床可用疗法相结合使用的潜力,并且当与正确的分期参数一起使用时,TME中的免疫浸润可能会提高化疗和ICB疗效。
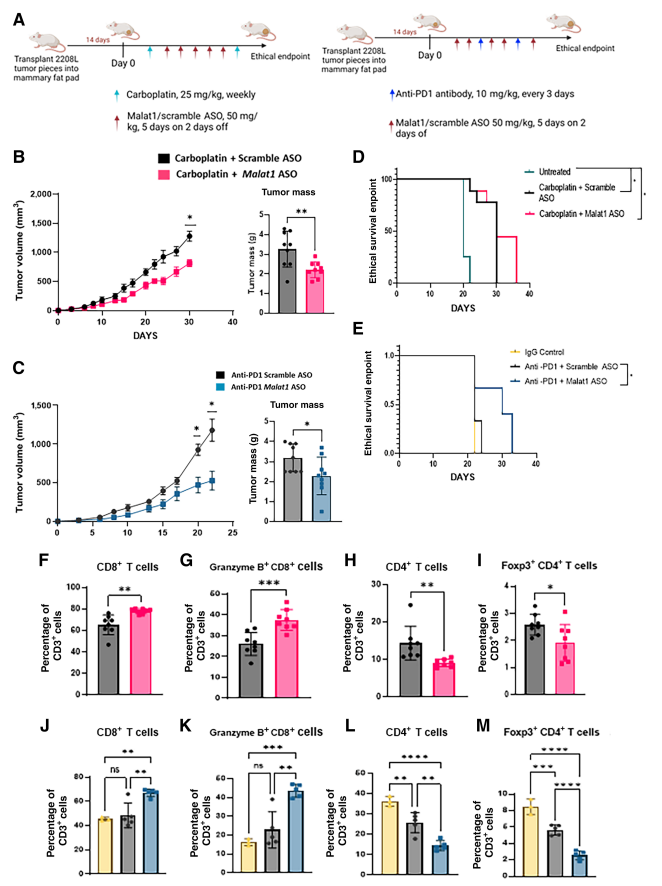
图7:Malat1 ASO联合化疗或ICB改善临床前小鼠模型的反应
结论
本研究利用gappmer ASO成功靶向lncRNA Malat1,并阐明了Malat1缺失在两种不同的体内TNBC模型中的影响。使用Malat1 ASO能够敲低Malat1 RNA表达,导致原发性肿瘤生长延迟、增殖减少和凋亡增加。此外,Malat1抑制减少了免疫抑制性TAM和MDSC以及增加了细胞毒性CD8+T细胞。Malat1 ASO与化疗或免疫检查点阻断(ICB)组合改善了临床前模型中的治疗反应。这些研究强调了Malat1抑制在TNBC中的免疫刺激作用,以及Malat1 ASO与化疗和免疫治疗联合使用的潜力。
实验方法
细胞培养,ASO转染,RT-qPCR,IHC染色,流式细胞术,T细胞增殖试验,单细胞测序
参考文献
Adewunmi O, Shen Y, Zhang XH, Rosen JM. Targeted inhibition of lncRNA Malat1 alters the tumor immune microenvironment in preclinical syngeneic mouse models of triple negative breast cancer. Cancer Immunol Res. 2023 Aug 21:CIR-23-0045. doi: 10.1158/2326-6066.CIR-23-0045. Epub ahead of print. PMID: 37603945.






