乳腺癌转移新机制的关键信号分子——ActA
尽管人们对乳腺癌已经进行了广泛的研究,但乳腺癌仍然是造成女性死亡的主要癌症之一,也是女性中最常见的癌症。乳腺癌的死亡率几乎完全是肿瘤转移的结果。转移性癌症在很大程度上是无法治愈的,是癌症相关死亡的主要原因。转移性微环境有利于转移灶的形成。癌症相关成纤维细胞(CAFs)是通过介导炎症微环境产生适宜转移生态位的关键参与者。成纤维细胞在改变细胞外基质(ECM)的结构和硬度方面也起着核心作用。解决转移生态位的早期变化可以帮助确定抑制转移进展的方法。作者在小鼠自发性乳腺癌肺转移模型中证明,肺成纤维细胞的纤维化改变和重新布线发生在转移前阶段,表明原发肿瘤的全身性影响。激活素A (ActA)是TGFβ超家族成员,从乳腺肿瘤中分泌,其在荷瘤小鼠血液中的水平高度升高。ActA上调肺成纤维细胞中促纤维化因子的表达,导致肺转移前生态位胶原沉积增强。ActA信号在肺转移中具有重要的功能,因为在乳腺癌细胞中靶向ActA可显著减轻肺转移并提高生存率。该文章于2023年10月发表在《Cancer Research》,IF: 11.2。
技术路线
技术路线图
主要研究结果
1. 肺转移与胶原沉积增加有关,从转移前生态位开始
作者之前分析了肺转移不同阶段与转移相关的成纤维细胞的转录组,发现它们激活了与ECM重塑和胶原沉积相关的基因程序。因此,作者着手研究这些基因程序如何在转移生态位的肺成纤维细胞中被激活,以及它们如何影响乳腺癌的转移性复发。作者首先分析了MMTV-PyMT小鼠肺中的胶原沉积,MMTV-PyMT是一种发生自发肺转移的乳腺癌模型。与FVB/n对照小鼠的正常肺相比,使用二次谐波生成(SHG)显微镜观察转移性MMTV-PyMT肺中的纤维胶原(图1A)。为了量化肿瘤诱导的胶原纤维组织变化,作者使用了TWOMBLI插件。分析显示,在有转移的肺中,胶原纤维的面积、长度和密度明显更高(图1B)。有趣的是,先前有报道称,在比较正常乳腺和乳腺肿瘤时,纤维取向从各向同性变为各向异性。作者的研究结果表明,与原发肿瘤相比,不同的ECM调节机制在转移部位起作用。胶原纤维Picrosirius Red染色定量证实,荷瘤小鼠肺中胶原沉积明显增加(图1C,D)。此外,肺部纤维化区域的评分显示,MMTV-PyMT小鼠的肺部与对照组相比,高评分纤维化区域的发生率更高(图1E)。为了证实这些发现不是模型特异性的,作者还分析了转移到肺部的三阴性乳腺癌(4T1癌细胞)可移植模型中的胶原沉积。该分析证实,与正常BALB/c对照小鼠相比,注射4T1后肺转移小鼠肺内胶原沉积明显增多(图1F-H)。因此,肺转移与肺纤维化有关。
考虑到作者之前在肺转移不同阶段的成纤维细胞转录组数据的发现表明胶原沉积的变化是一个早期事件,作者接下来研究了肺转移过程中纤维化变化的时间。因此,作者分析了MMTV-PyMT小鼠在肿瘤进展的不同阶段肺中的胶原含量。与乳腺增生(7-8周龄,未形成明显转移灶)或转移癌(14-16周龄)的MMTV-PyMT小鼠肺相比,正常肺的马氏三色显示,早在肺转移发生前的增生性阶段,肺胶原沉积就发生了显著变化(图1 - l)。有趣的是,与正常相比,胶原沉积的增强在乳腺增生小鼠的转移前肺中最为明显(图1J,L),进一步表明纤维化变化是在可检测的转移病变形成之前的早期事件。
2.肿瘤细胞分泌因子激活肺成纤维细胞的促纤维化程序
接下来,作者着手研究肺中胶原沉积的增强是否与体内荷瘤小鼠肺成纤维细胞中促纤维化基因程序的激活有关。为了能够无偏分离成纤维细胞,作者将MMTV-PyMT小鼠模型与在胶原-1a启动子(Col1a1-YFP)下表达荧光报告基因YFP的转基因小鼠杂交,建立了所有成纤维细胞都被荧光标记的PyMT;Col1a1-YFP转基因小鼠。用流式细胞术从正常Col1a1-YFP小鼠肺、乳腺增生(转移前)的Col1a1-YFP小鼠肺或转移小鼠肺中分离肺成纤维细胞。有趣的是,表达分析显示,从前转移性肺分离的肺成纤维细胞中,促纤维化基因的表达已经上调(Pre-Met LFs;图2A),与正常肺成纤维细胞(NLFs)以及转移相关成纤维细胞(MAFs)相比,从转移肺中分离出来(图2C)。作者将结果整合到由Col1a1、Acta2、Ctgf、Lox、Loxl2、Sparc和Serpine1联合表达组成的“纤维化评分”中,并证实肺Pre-Met LFs和MAFs都以促纤维化基因程序的激活为特征(图2B, D)。
由于在弥散性肿瘤细胞定植之前,乳腺癌早期就出现了肺部胶原沉积的增加,因此作者假设肺成纤维细胞的促纤维化激活可能是由原发肿瘤分泌的因子通过系统性信号传导引起的,从而诱导形成一个适宜的纤维化转移前生态位。为了验证这一假设,作者首先分析了与源自PyMT肿瘤的Met-1细胞分泌因子孵育的NLFs中促纤维化基因特征的表达。该分析显示,与对照组相比,激活的NLFs中多个促纤维化基因的表达明显上调(图2E,F)。由于已知TGF-β信号在伤口愈合、纤维化和肿瘤进展的结缔组织增生反应中对诱导胶原沉积起重要作用,作者还测试了TGF-β信号是否在与癌细胞分泌因子一起培养的NLFs中被激活。事实上,NLFs与肿瘤细胞条件培养基(CM)孵育导致SMAD2和SMAD3磷酸化增加,表明肿瘤分泌因子激活了典型的TGF-β信号通路(图2G)。为了评估肿瘤分泌因子是否通过系统性信号传导影响转移前生态位的肺成纤维细胞,作者分析了荷瘤小鼠血液中分泌因子对肺成纤维细胞活化的影响。将NLFs与荷瘤MMTV-PyMT小鼠或正常FVB/n小鼠的血浆孵育(图2H),并分析促纤维化基因特征的表达。作者发现MMTV-PyMT小鼠血浆中的因子上调了正常肺成纤维细胞中促纤维化基因的表达(图2I)。
作者接下来研究肿瘤分泌因子是否影响成纤维细胞胶原的生成和沉积。为了验证这一点,NLFs与肿瘤细胞分泌因子或对照无血清培养基(SFM)孵育,并允许生成细胞衍生基质(CDM)。成纤维细胞来源的胶原基质的SHG成像显示,与肿瘤细胞CM孵育的NLFs相比,与SFM孵育的NLFs产生了更致密的胶原基质(图2J-L)。综上所述,这些结果表明,肺成纤维细胞被肿瘤分泌因子激活,通过SMAD信号通路上调促纤维化基因的表达,增加胶原沉积。
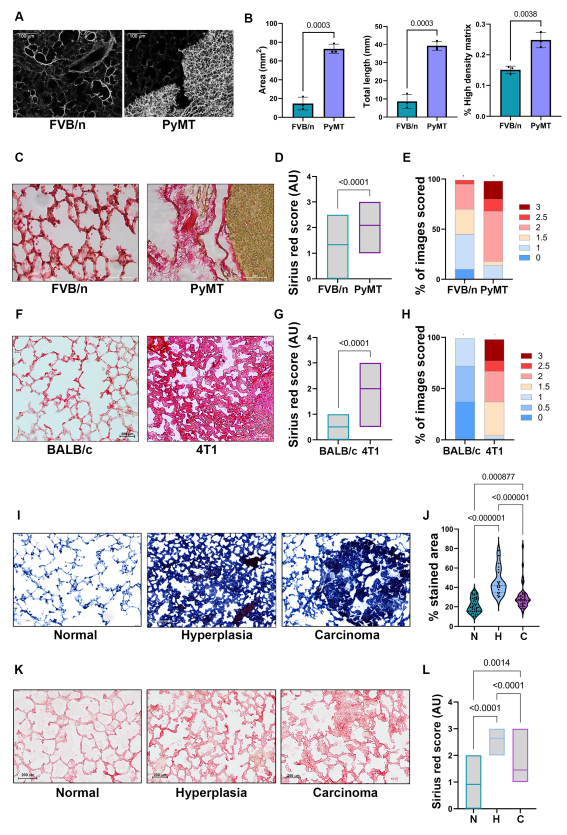
图1 乳腺癌的进展与肺部胶原沉积增强有关
3. ActA在乳腺肿瘤和肺转移中全身性和局部上调
为了确定可能参与肺成纤维细胞活化的全身性肿瘤分泌因子,作者对正常FVB/n小鼠和荷瘤MMTV-PyMT小鼠的血浆进行了蛋白质组学分析(图3A)。作者在蛋白质阵列中确定了MMTV-PyMT小鼠血浆中上调最多的50种蛋白质,并使用VarElect工具对其进行了进一步分析,该工具可以对与特定查询条件相关的基因进行优先排序。使用“胶原合成”作为关键词的分析在高分基因中确定了抑制素β A (INHBA)(图3B)。编码蛋白INHBA是一个亚基,可以与抑制素家族的其他亚基二聚形成功能二聚体,其中一个是激活素a(ActA),一个由两个INHBA亚基组成的二聚体。激活蛋白是TGF-β超家族配体的成员,是已知的纤维化激活因子,因此作者决定进一步研究ActA。

图2 肿瘤激活的肺成纤维细胞表达促成纤维基因并表现出胶原沉积增加
分泌的ActA先前参与促进肿瘤进展和纤维化疾病,并被证明通过SMAD2/3信号通路激活Col1α和其他纤维化相关基因的表达。因此,作者开始评估乳腺癌进展过程中ActA水平的变化。与荷瘤MMTV-PyMT小鼠相比,正常FVB/n小鼠血浆中ActA水平的分析证实,荷瘤小鼠中ActA水平显著升高(图3C)。此外,对单个小鼠血浆样本的纵向分析显示,ActA水平随着疾病进展而增加(图3D)。对正常FVB/n小鼠和荷瘤MMTV-PyMT小鼠乳腺和肺组织中ActA水平的分析进一步证实,荷瘤小鼠两组织中ActA水平均显著高于对照组(图3E,F)。
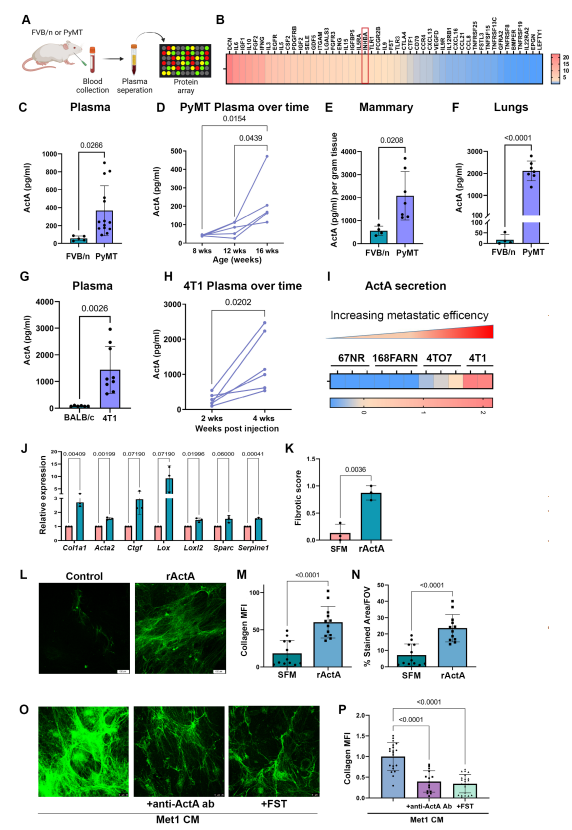
图3 循环ActA水平随着疾病进展而增加
MMTV-PyMT是一种小鼠腔内乳腺癌模型。为了测试ActA的上调是否在其他乳腺癌类型中是一个普遍的机制,作者分析了注射4T1细胞的荷瘤小鼠血浆中ActA的水平。作者发现,与正常BALB/c小鼠相比,原位注射4T1细胞的小鼠血浆中ActA水平升高(图3G),证实该途径在多种乳腺癌亚型中有效。此外,小鼠的纵向随访表明,在可移植模型中,血浆ActA水平也随着疾病的进展而升高(图3H)。
4T1细胞最初是作为一系列转移效率增加的细胞系的一部分建立的,从67NR(非转移)到4T1(高度转移)。有趣的是,在包含4T1细胞系系列质谱数据的公开数据集中对ActA分泌水平的分析显示,ActA分泌增加与转移能力相关(图3I),进一步表明ActA在支持转移进展中的作用。
为了评估ActA是否足以诱导肺成纤维细胞的促纤维化信号,作者将外源性ActA孵育NLFs,并分析其促纤维化基因特征的表达。结果表明,ActA诱导了NLFs中促纤维化基因特征的表达(图3J,K)。此外,与SFM培养的NLFs相比,ActA培养的NLFs产生的CDM显示出更密集的胶原沉积(图3L-N)。为了进一步评估ActA是否有必要增强肺成纤维细胞的胶原沉积,作者用MMTV-PyMT癌细胞分泌因子(Met-1 CM)或Met-1 CM补充ActA的中和抗体或外源性Follistatin (Fst) (ActA的天然拮抗剂)培养NLFs。分析结果显示,当ActA被抑制时,活化的成纤维细胞的胶原沉积显著减少(图3O,P),证实了ActA对于成纤维细胞的促纤维化活化是必要的。
综上所述,这些数据表明,在荷瘤小鼠中,原发性乳腺肿瘤分泌的ActA在局部和全身都有所增加,其水平与肿瘤的进展和转移有关。此外,这些发现表明,在肺成纤维细胞中,肿瘤介导的成纤维信号的诱导是由ActA的分泌促进的。
4. 系统性ActA诱导肺转移前生态位的胶原沉积,促进肺转移性复发
为了评估ActA在诱导肺纤维化转移前生态位中的功能作用,作者使用shRNA转导降低了其在4T1癌细胞中的表达。作者使用了两个单独的敲低(KD) shrna (shActA)和一个乱序控制结构(shScr)。qRT-PCR在mRNA表达水平和ELISA在蛋白分泌水平均证实了ActA的表达KD(图4A,B)。作者初步分析了ActA的KD是否影响原发肿瘤的生长。对原位注射肿瘤的分析显示,虽然ActA KD肿瘤的生长与对照肿瘤相比略有减少(图4C),但在切除时肿瘤体积没有显著差异(图4D)。接下来,作者研究了ActA是否对成纤维细胞激活和早期肺中的胶原沉积具有重要的功能,从而产生纤维化转移前生态位。作者将4T1 ActA KD细胞原位注射到Col1a1启动子下表达YFP的转基因BALB/c小鼠的乳腺中,以促进使用FACS从转移前肺中分离肺成纤维细胞。原位注射后3周,在大转移灶形成之前采集肺(图4E)。值得注意的是,与从对照肿瘤小鼠分离的成纤维细胞相比,原发肿瘤中ActA的KD导致肺成纤维细胞中原纤维化基因的表达急剧降低(由联合纤维化评分确定)(图4F)。同样,通过YFP+细胞的平均荧光强度测量,在KD肿瘤小鼠的肺成纤维细胞中,Col1a1启动子激活显著降低(图4G),暗示ActA信号在肺成纤维细胞的促纤维化激活中起作用。此外,肺组织切片胶原的Masson三色染色证实,与对照肿瘤小鼠相比,ActA KD显著减少了ActA KD肿瘤小鼠肺部胶原沉积(图4H,I)。因此,来自原发肿瘤的系统性ActA在转移前肺中激活肺成纤维细胞向纤维化前表型发展,导致胶原表达和沉积增加。
最后,作者通过对注射ActA KD细胞或对照小鼠进行分析,研究了ActA信号在原发性乳腺肿瘤手术切除后促进肺转移性复发中的功能作用(图5A)。在肿瘤切除前不久和切除后2周抽取血样。虽然血液中残留的ActA表明其他宿主细胞也对全身ActA有贡献,但切除原发肿瘤足以显著降低其血液水平,表明原发肿瘤确实是全身ActA的主要来源(图5B)。值得注意的是,在对照组中,一些小鼠在肿瘤切除两周后血液中ActA水平升高,这表明新出现的肺转移可能已成为系统性ActA的来源。
为了评估ActA抑制对肺转移负荷的影响,作者通过CT成像进行了肺内转移进展成像。原发肿瘤切除两周后的转移负荷分析表明,注射shActA癌细胞的小鼠转移负荷和发病率显著降低(图5C-E)。在每只小鼠死于转移性疾病的终末期,肺组织切片的转移负荷量化显示,注射shActA癌细胞的小鼠转移减少的趋势类似,但没有达到显著性(图5F,G)。重要的是,与它们的转移进展减弱一致,注射ActA KD肿瘤细胞的小鼠的存活率显著提高(图5H)。此外,肿瘤切除前循环中的ActA水平与生存时间呈负相关(图5I)。这些发现证实了肿瘤来源的ActA,作者已经证明它可以诱导纤维化的转移前生态位,在促进肺转移中具有重要的功能,从而降低生存率。
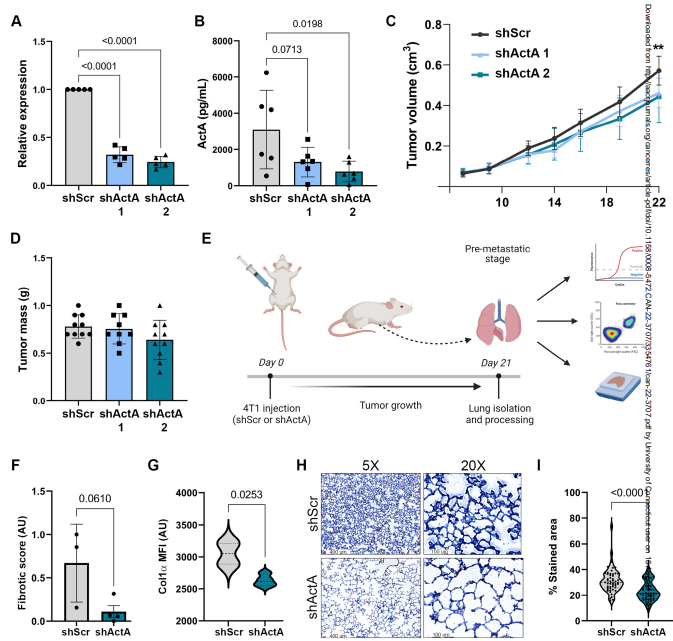
图4 ActA的KD抑制肺转移前生态位的ECM重塑
5. ActA在乳腺癌患者中的表达与肺转移的发生率相关
为了评估ActA在人类乳腺癌转移中的作用,作者使用cBioPortal分析了来自The Metastatic Breast Cancer Project(2020)的乳腺癌转移发生率数据。重要的是,尽管INHBA基因表达水平在无转移和有转移的患者之间没有显著差异(图6A),但患者的器官特异性分层显示,原发肿瘤中INHBA的高表达与肺转移显著相关(图6B),但与其他常见的乳腺癌转移部位,包括肝脏、骨骼、脑/中枢神经系统或区域淋巴结无关(图6C)。表明ActA在促进人类患者转移中也具有肺特异性作用。此外,对TGFβ信号通路其他主要组分在位点特异性转移患者数据集中的表达分析显示,只有INHBA基因表达的增加与肺转移的发生率相关,而该通路的其他组分保持不变(图6D)。该分析进一步表明INHBA表达在肺转移中的核心作用。值得注意的是,肺转移患者中Follistatin (FST)基因也上调。FST是INHBA的拮抗剂配体,作为一种天然的反馈调节途径,已知FST会响应ActA上调而上调。为了进一步研究INHBA表达水平对转移和生存的重要性,作者分析了激素受体阴性和三阴性乳腺癌患者的数据集,并比较了原发乳腺肿瘤中INHBA高表达和低表达患者的无转移生存时间。有趣的是,INHBA的高表达与无转移生存期的显著降低相关(图6E),这表明ActA的上调有助于更快的进展。对包含多种乳腺癌亚型的乳腺癌患者的额外数据集的总生存率分析证实,原发肿瘤中INHBA高表达的患者的总生存率明显低于INHBA低表达的患者(图6F)。但高INHBA水平的患者转移复发的时间显著缩短(图6G)。事实上,单因素Cox回归分析表明,INHBA高表达可以预测无转移生存(HR: 2.385;CI: 1.240-4.588)和总生存期(HR: 1.399;CI: 1.1017-1.925),进一步证实ActA信号在乳腺癌转移进展中起重要作用(图6H)。引人注目的是,使用各种临床参数对无转移生存进行的多变量分析显示,高INHBA表达是该数据集中乳腺癌患者无转移生存的only独立预测因子(图6I)。
综上所述,作者的研究结果表明,ActA从原发性乳腺肿瘤中分泌,并在转移前肺中系统性地诱导成纤维细胞活化,导致促纤维化基因的表达升高和胶原沉积增强。这有助于形成一个适宜的肺转移生态位,导致转移负担增加和预后不良,在转移器官中预防肿瘤诱导的纤维化可能是抑制或预防乳腺癌患者转移复发的有效治疗方法,并暗示ActA是抗转移治疗的潜在靶点。
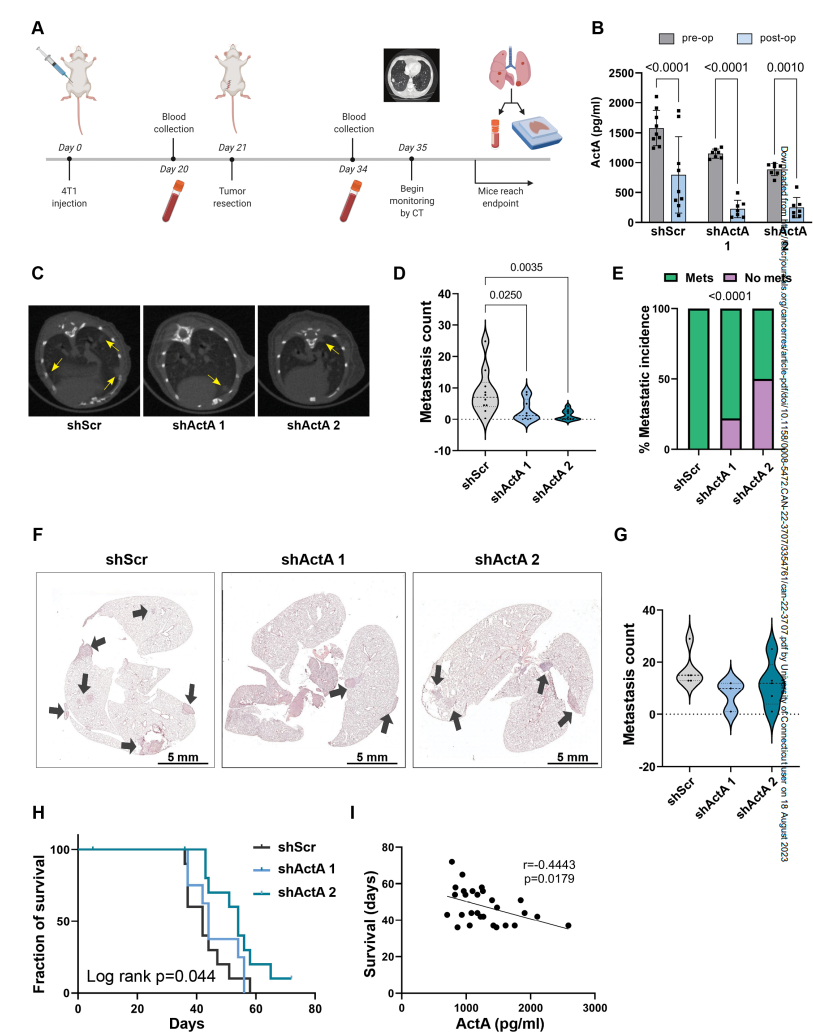
图5 ActA KD抑制肺转移,提高生存率
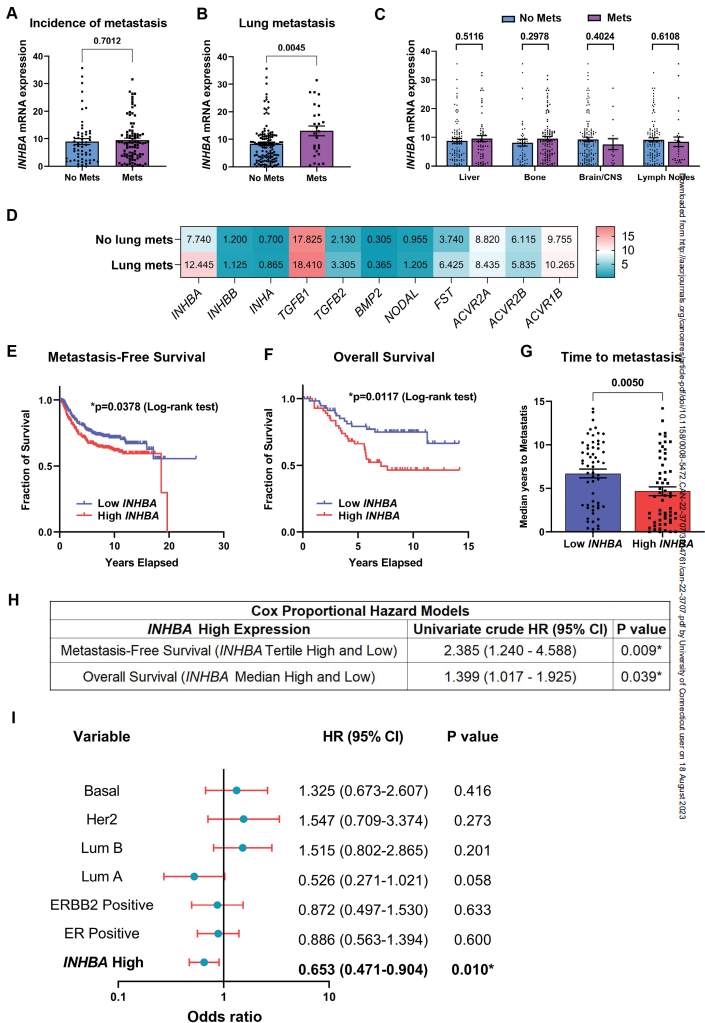
图6 在乳腺癌患者中,ActA表达增加与肺转移增加和生存率降低相关
实验方法
构建细胞和动物模型,成纤维细胞分离,原位注射实验,用CM和重组激活素A (rActA)检测成纤维细胞,血浆蛋白质组学分析,酶联免疫吸附试验(ELISA),Western blot,流式细胞仪分析,实时定量PCR。
参考文献
Cohen N, Mundhe D, Deasy SK, Adler O, Ershaid N, Shami T, Levi-Galibov O, Wassermann R, Scherz-Shouval R, Erez N. Breast Cancer-Secreted Factors Promote Lung Metastasis by Signaling Systemically to Induce a Fibrotic Premetastatic Niche. Cancer Res. 2023 Oct 13; 83(20): 3354-3367. Doi: 10.1158/0008-5472.CAN-22-3707. PMID: 37548552.






