USP1通过去泛素化PARP1来阻止其蛋白酶体降解,从而促进胆管癌的发展
尽管去泛素酶USP1(泛素特异性蛋白酶1)参与了多种癌症的治疗,但它在胆管癌(CCA)中的功能尚未得到研究。在本研究中,作者提供了USP1通过稳定聚(ADP-核糖)聚合酶1(PARP1)促进CCA进展的证据,这与USP1和PARP1在人类 CCA中均上调的观察结果一致。对表达USP1的CCA细胞进行的蛋白质组学和泛素组分析发现,PARP1是USP1的主要底物。事实上,通过一系列免疫荧光、共免疫沉淀(CO-IP)和GST牵引试验验证了它们的直接相互作用,并利用缺失突变体确定了它们的相互作用区域。从机理上讲,USP1清除了PARP1 K197 处的泛素链,阻止了其蛋白酶体降解,从而使PARP1趋于稳定,这是促进CCA体外和体内生长和转移的必要条件和充分条件。此外,作者还发现乙酰转移酶GCN5可在K130处对USP1进行乙酰化,从而增强USP1和PARP1之间的亲和力,进一步提高PARP1蛋白的稳定性。最后,USP1和PARP1都与CCA患者的不良生存率密切相关。这些研究结果表明,PARP1是USP1的新型去泛素化靶点,也是CCA的潜在治疗靶点。本文于2023年10月发表于《cell death & disease》,IF=9。
技术路线
主要实验结果
1. PARP1是CCA中USP1去泛素化酶活性的主要靶标
为了阐明USP1可能参与了CCA的发生和发展,作者首先发现与TCGA数据库中的邻近组织相比,USP1在CCA组织中显著上调(图1A)。接下来,作者建立了过表达USP1的稳定RBE细胞系,并进行了基于质谱仪的总蛋白质组学分析和泛素化特异性蛋白质组学分析(图1B)。结合质谱结果,作者选出了前10个候选蛋白,并用 IP 检测法对它们进行了单独检测。其中,只有PARP1(图1C)验证了与USP1的相互作用。PARP1是一种众所周知的癌症相关蛋白,在许多癌症类型中都会发生PTM(翻译后修饰),因此作者将其作为后续机理研究的重点。
为了进一步验证观察到的USP1-PARP1相互作用,作者在CCA细胞系HuCC-T1、HCCC-9810、RBE和HEK-293T中进行了确证CO-IP试验(图1D-H)。免疫荧光染色证实它们主要共定位在细胞核内,一小部分分布在HuCC-T1、HCCC-9810和RBE 细胞的细胞质中(图1I)。为了获得更高的特异性和灵敏度,作者还使用靶向USP1 和内源性PARP1的一抗以及用特异性检测寡核苷酸标记的二抗进行了近距离连接试验(PLA)。作者在细胞核和细胞质中都观察到了主要的PLA信号(图1J),进一步支持了USP1-PARP1的直接相互作用。使用重组蛋白GST-USP1或无催化活性的突变体GST-USP1 C90S进行的体外GST牵引实验表明,两种纯化蛋白都能与Myc-PARP1结合,而GST本身在无细胞条件下不能与Myc-PARP1结合(图1K),这表明它们的直接相互作用与USP1的酶活性无关。
为了研究USP1和PARP1之间相互作用的特定区域,作者生成了这两种蛋白的截短突变片段(图1L、M),以确定结合位点。作者在HEK-293T细胞中进行的转染实验表明,缺失USP1的201-785和401-785氨基酸会削弱其与PARP1结合的能力,而缺失1-200或1-400氨基酸则没有影响(图1N、O),这表明PARP1结合的关键区域在USP1的401-785氨基酸之间。对PARP1而言,缺失203-1014氨基酸就会失去与USP1的结合,而缺失1-203氨基酸或一系列C端截断则会保留结合,包括缺失476-1014氨基酸;这些措施一起将与USP1结合的关键区域缩小到了PARP1的203-476氨基酸(图1P),该区域包含已知的介导蛋白-蛋白相互作用的BRCT结构域。这些实验划定了每种蛋白质的关键相互结合区域。

图 1:USP1与PARP1相互作用
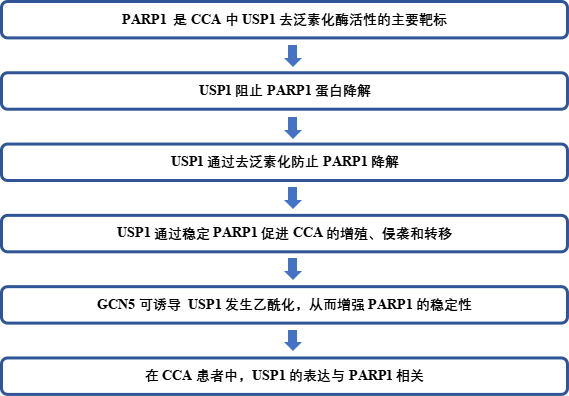
2. USP1阻止PARP1蛋白降解
为了验证USP1通过阻止PARP1降解直接稳定PARP1的假设,作者首先在HEK-293T细胞中以两种剂量水平过表达USP1,并观察到PARP1蛋白水平出现了相应的梯度增加(图2A)。在CCA细胞系中,敲除USP1导致PARP1蛋白水平下降,而 USP1过表达则产生相反的效果。接着,作者发现蛋白酶体抑制剂MG132逆转了USP1 敲除导致的PARP1蛋白水平的降低,但没有逆转USP1过表达导致的PARP1蛋白水平的升高(图2B-D)。相比之下,自噬体途径抑制剂CQ未能逆转USP1敲除对PARP1 的影响(图2B)。通过qRT-PCR分析,作者观察到USP1敲除或过表达对PARP1的 mRNA水平没有任何显著影响(图2E、F)
接着,作者发现USP1敲除介导的PARP1蛋白减少在过表达USP1后几乎完全恢复,但催化活性不高的突变体USP1 C90S则不能(图2G-I)。最后,作者给过表达 USP1或USP1 C90S的RBE细胞施用蛋白质合成抑制剂CHX。只有过表达野生型 USP1才能阻止PARP1蛋白降解(图2J-K)。此外,在HuCC-T1和HCCC-9810细胞中,CHX 处理同样会降低PARP1蛋白水平,而敲除USP1会进一步加剧这种情况(图2L-O)。综上所述,这些结果表明USP1通过防止蛋白体降解对PARP1进行翻译后调控,而这需要USP1的催化活性。
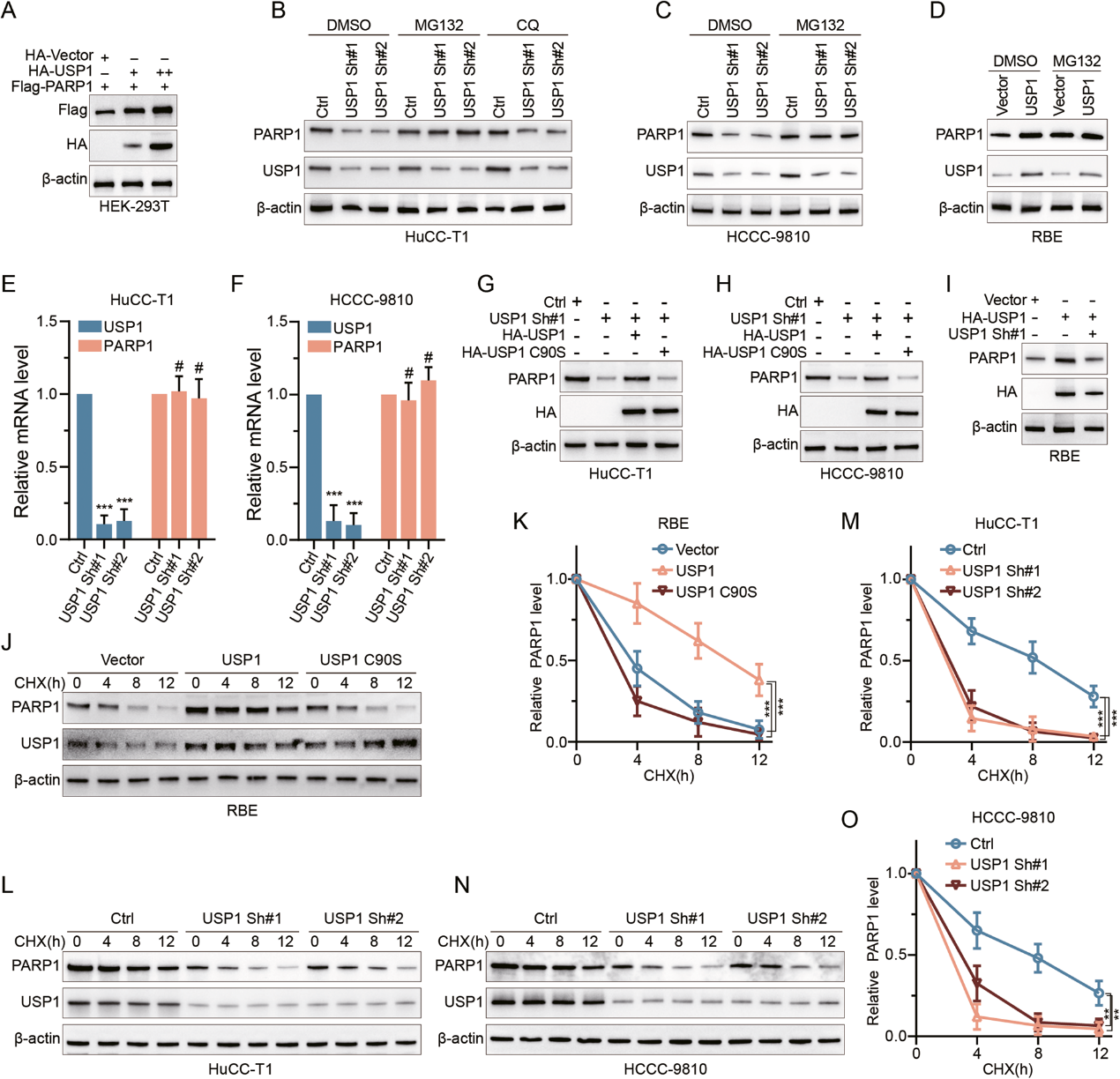
图 2:USP1可增强PARP1的稳定性。
3. USP1 通过去泛素化防止PARP1降解
作者观察到,在HuCC-T1和HCCC-9810细胞中敲除USP1后,PARP1的内源性泛素化水平增加(图3A),这与USP1在CCA中直接去泛素化PARP1的情况一致。相反,转染HA-USP1而非HA-USP1 C90S会导致HEK-293T和RBE细胞中外源性 PARP1泛素化水平下降(图3B)。此外,随着USP1用量的增加,PARP1的泛素化水平同样进一步下降(图3C)。为了确定PARP1是否是USP1直接去泛素化的底物,作者在无细胞条件下将多泛素化的PARP1与纯化的HA-USP1或HA-USP1 C90S共同结合。HA-USP1而不是HA-USP1 C90S 能特异性地去除PARP1的多泛素化链(图 3D)。这些结果共同证实了USP1可直接去泛素 PARP1。
为了确定USP1靶向的PARP1赖氨酸位点,作者对泛素化特异性质谱数据进行了全面分析,观察到Lys-197可能是USP1对PARP1进行去泛素化的重要位点(图3E)。作者还发现,USP1并没有对PARP1-K197R进行泛素化(图3F)。这表明K197 位点是控制PARP1降解的主要USP1泛素化靶点。
通过使用特定的泛素突变体,作者确定USP1能有效地裂解与lys48链接的 PARP1多泛素化,但不能裂解与lys63链接的PARP1多泛素化(图3G)。此外,USP1对与 lys6、lys11、lys27、lys29 和 lys33 连接的PARP1的泛素化影响不大(图3H)。在以泛素链为底物的体内二泛素化形成实验中,作者观察到USP1能够裂解K48链接的二泛素(图3I)。总之,这些研究结果表明,USP1可作为一种针对PARP1上K197的去泛素化酶发挥作用。
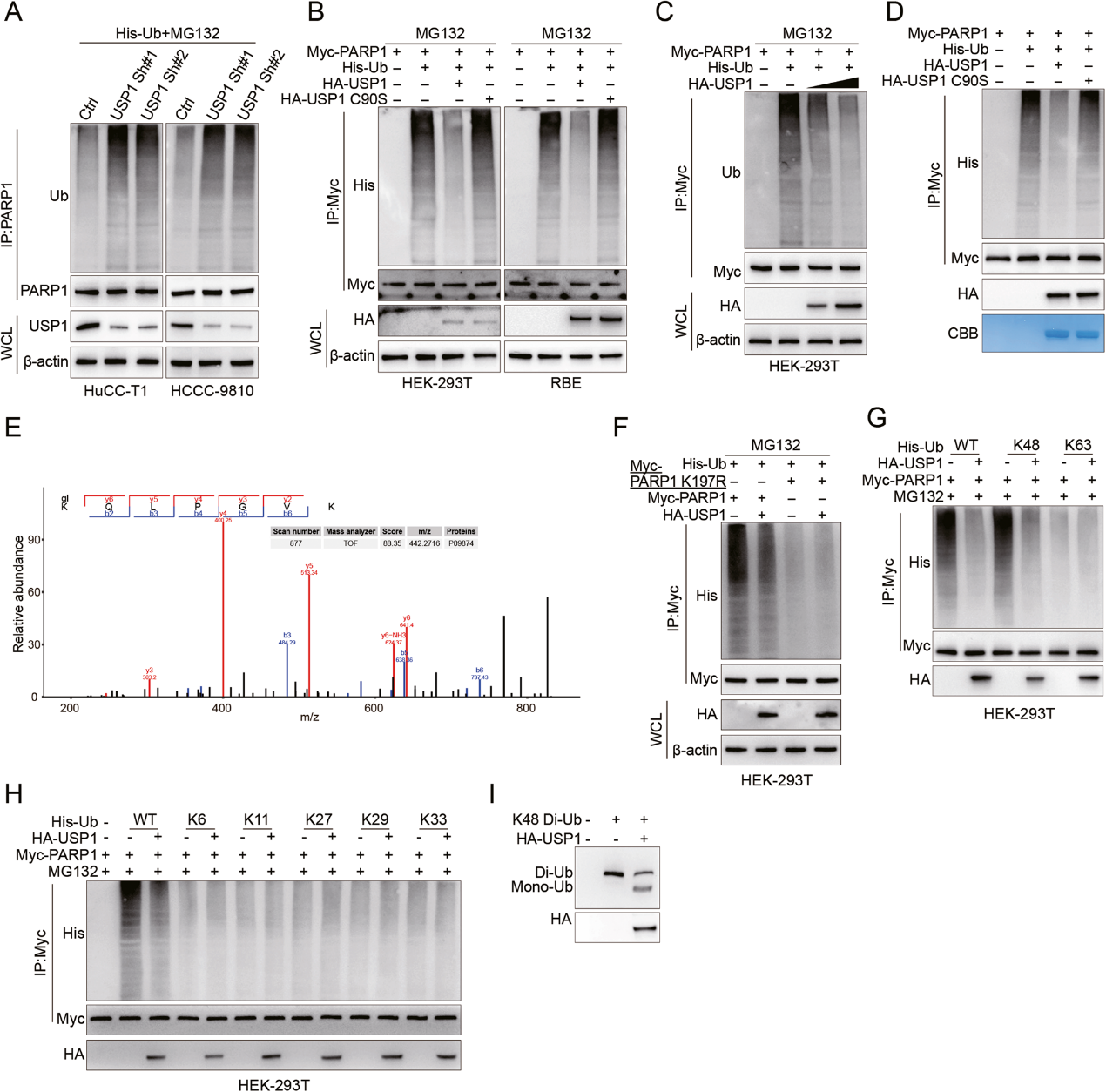
图 3:USP1清除PARP1的K197上与K48链接的泛素链
4. USP1通过稳定PARP1促进CCA的增殖、侵袭和转移
为了评估USP1介导的PARP1调节对CCA表型的功能影响,作者首先在HuCC-T1和HCCC-9810细胞中沉默USP1,结果体外细胞增殖受到抑制。相反,上调USP1 会增加RBE细胞的增殖。重要的是,这两种效应可分别通过过表达或敲除PARP1而逆转(图4A-C)。此外,抑制USP1会阻碍HCCC-9810和HuCC-T1的侵袭,而上调 USP1会促进RBE细胞系的侵袭。同样,通过调节 PARP1 的表达也可以逆转这些情况(图4D-G)。
接下来,作者发现敲除USP1会阻碍HuCC-T1异种移植物的体内生长,而USP1 的过表达则会促进RBE异种移植物的生长。与体外实验类似,这两种结果也可分别通过过表达或敲除PARP1而逆转(图4H-M)。此外,使用实验性尾静脉肺转移方案,USP1 基因敲除导致转移数量减少,而USP1基因过表达导致转移数量增加,这同样分别取决于PARP1基因过表达或基因敲除(图4N,Q)。总之,这些发现表明 USP1 主要通过PARP1在体外和体内促进CCA的增殖和转移。
图 4:USP1通过PARP1促进CCA增殖、侵袭和转移
5. GCN5可诱导USP1发生乙酰化,从而增强PARP1的稳定性
作者接下来询问USP1本身是否受PTM调节。在研究了蛋白质组数据库 PhosphoSitePlus 之后,作者发现USP1具有多个乙酰化位点,包括在不同物种中高度保守的K130(图5A)。用去乙酰化酶抑制剂(TSA/NAM)处理后,IP分析显示在 HuCC-T1和HCCC-9810中USP1的乙酰化显著增加(图5B)。一般来说,包括 P300、GCN5、PCAF、CBP和Tip60在内的五种乙酰转移酶介导了真核生物中约90%的蛋白质乙酰化。使用所有5种乙酰转移酶进行的系统IP实验发现,GCN5是HEK-293T细胞中与USP1仅有的相互作用者(图5C)。这种直接相互作用在CCA细胞中通过IP 和免疫荧光共定位实验得到了证实(图5D、E)。
接下来,作者在HEK-293T细胞中过表达GCN5,观察到USP1乙酰化增加,而用GCN5抑制剂MB-3处理则会减少USP1乙酰化(图5F)。作者通过创建不可乙酰化的USP1-K130R突变体,进一步关注USP1上的K130位点。值得注意的是,在过表达GCN5时,HEK-293T细胞中USP1-K130R突变体的整体乙酰化水平并没有增加(图5G)。与此相一致的是,在HEK-293T和RBE细胞系中过表达乙酰基拟态 K130Q USP1时,与野生型USP1相比,USP1 K130Q与PARP1之间的亲和力更强,PARP1 蛋白水平的增加也更明显(图5H,I),这表明K130乙酰化对USP1的功能有正向调节作用。然后作者发现,与野生型USP1相比,USP1 K130R的过表达导致PARP1泛素化的增加(图5J)。反之亦然,过表达USP1 K130Q会导致PARP1泛素化程度降低(图5K)。此外,在HEK-293T和RBE细胞中,GCN5的共重表达增强了USP1 过表达对PARP1去泛素化的影响(图5L)。最后,利用CHX蛋白合成抑制试验,作者发现与野生型USP1相比,在RBE中过表达USP1 K130Q能显著提高内源性 PARP1蛋白水平的稳定性(图5M,N)。同样,GCN5与USP1共重表达也增强了PARP1蛋白水平的稳定性(图5O,P)。总之,作者的研究结果确定了GCN5是主要的USP1乙酰化酶,其作用是将PARP1和USP1结合在一起。
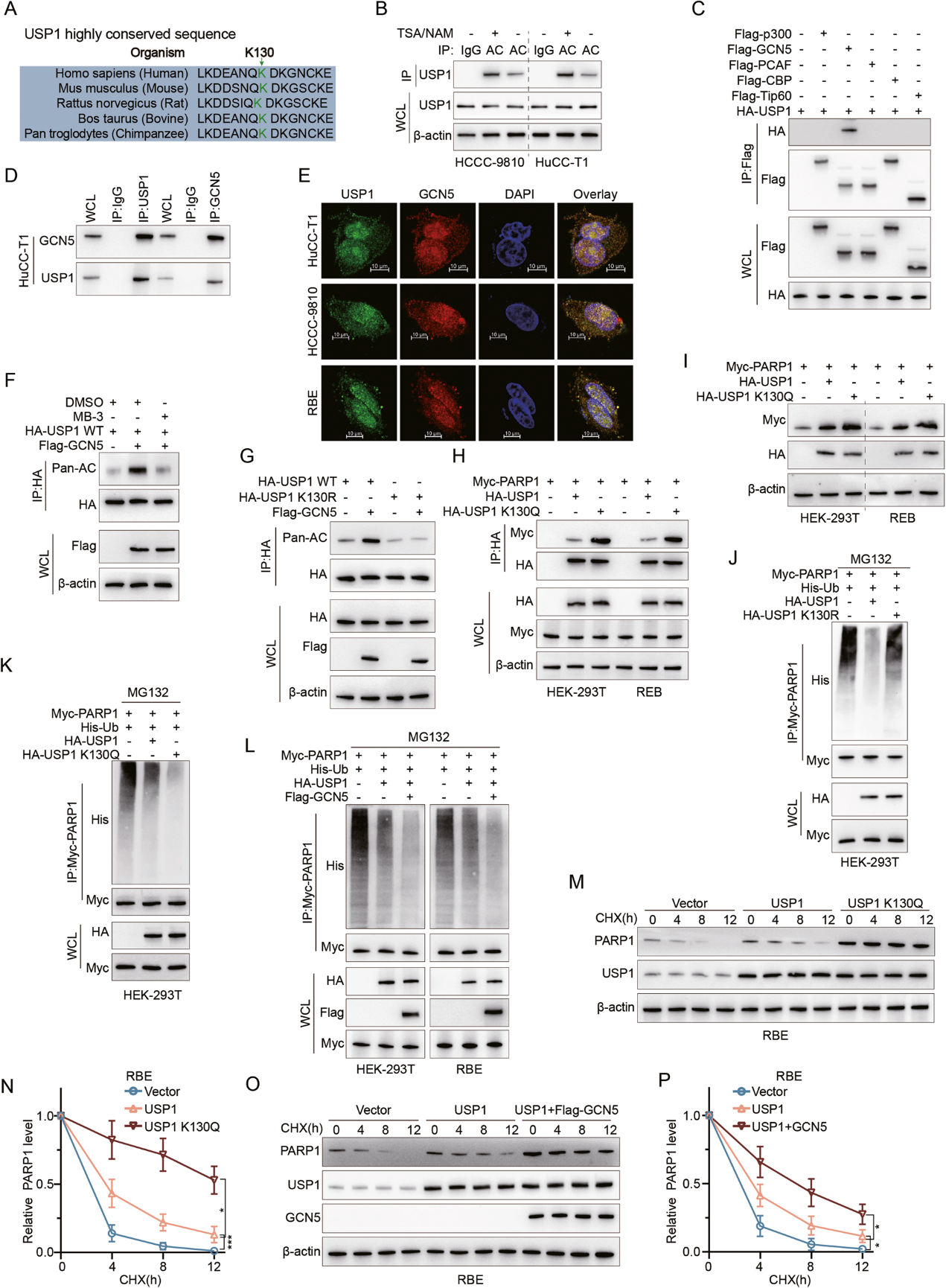
图 5:GCN5诱导USP1乙酰化以加强PARP1的稳定性
6. USP1与PARP1在CCA患者中的表达相关
为了评估USP1-PARP1轴在CCA中的临床意义,作者首先研究了人类CCA样本中USP1和PARP1蛋白表达之间的关系。通过免疫印迹分析,作者观察到CCA样本中USP1和PARP1蛋白水平呈正相关(n = 28,P < 0.0001,Pearson r = 0.3118)(图 6A、B)。随后,对CCA样本(n = 65)进行了USP1和PARP1的IHC染色。图6C 和D展示了USP1和PARP1染色的代表性图像,这两种蛋白之间存在显著的正相关性(Pearson r = 0.0002,P = 0.1987)。Kaplan-Meier 生存分析(n = 65)表明,USP1 或PARP1表达上调与总生存期缩短之间存在显著相关性(图6E、F)。这些发现共同表明,USP1在CCA患者中调控 PARP1,而两者都与不利的预后显著相关。图 6G 显示了本研究的总体设计,它表明GCN5在K130处乙酰化USP1,增强了USP1和 PARP1之间的亲和力,进一步提高了PARP1蛋白的稳定性。

图 6:USP1在CCA组织中富集,其表达与患者的存活率呈负相关
结论
总之,作者的研究结果表明,USP1作为一种去泛素化酶,通过对抗PARP1泛素化介导的降解来调节CCA的生长和转移。此外,作者还证明这一调控机制受GCN5 对USP1乙酰化状态的影响。GCN5-USP1-PARP1轴为乙酰转移酶和去泛素化酶在 CCA发病机制中的作用提供了新的见解,并可能为开发针对这种致命疾病的更好的靶向疗法铺平道路。
常规分子实验
免疫印迹、qRT-PCR、免疫组织化学、免疫荧光、免疫共沉淀、GST下拉试验、体内和体外去泛素化测定、质谱
细胞实验
质粒转染和慢病毒感染、 跨孔检测、细胞克隆检测、细胞凋亡测定、
动物模型及病理实验
邻位连接试验、动物实验
参考文献
Zhang, D.Y., Zhu, Y., Wu, Q. et al. USP1 promotes cholangiocarcinoma progression by deubiquitinating PARP1 to prevent its proteasomal degradation. Cell Death Dis 14, 669 (2023). https://doi.org/10.1038/s41419-023-06172-6






