鼻咽癌细胞通过CD70-CD27相互作用促进调节性T细胞发育和抑制活性
尽管鼻咽癌肿瘤微环境中存在大量CD8+ T细胞浸润,但在临床试验中,抗PD -1免疫治疗的有效率并不理想,受到免疫抑制信号的阻碍。为了了解微环境特征如何改变免疫稳态并限制鼻咽癌的免疫治疗效果,作者在此建立了一个基于公开数据的多中心单细胞队列,包含来自50例患者样本的357206个细胞。作者揭示了鼻咽癌细胞通过CD70-CD27相互作用增强调节性T细胞的发育和抑制活性。CD70阻断可逆转Treg介导的抑制,从而重新激活CD8+T细胞免疫。抗CD70 +抗PD -1治疗在异种移植类器官和人源化小鼠中进行了评估,显示出更好的肿瘤杀伤效果。在机制上,CD70敲除抑制了CD4+ naïve和涉及线粒体完整性、胆固醇稳态和脂肪酸代谢的调节性T细胞中的集体脂质信号网络。此外,ATAC-Seq表明NFKB2通过Epstein-Barr病毒依赖性表观遗传修饰上调CD70的转录水平。作者的研究结果确定CD70+鼻咽癌细胞作为一个代谢开关,强制脂质驱动的发展,功能特化和Tregs的稳态,导致免疫逃避。本研究还表明,CD70阻断可与抗PD -1治疗协同作用,重新激活T细胞对鼻咽癌的免疫。本文于2023年4月发表在《Nature Communications》期刊上,IF=16.6。
技术路线

主要研究结果
1、肿瘤内Treg丰度和激活通过鼻咽癌介导的相互作用进行调节
为了在单细胞分辨率下全面研究鼻咽癌细胞对肿瘤内T细胞的发育和功能动力学的影响,作者建立了一个大规模的队列,包含来自36个鼻咽癌组织并被分成41个亚型的189,750个T细胞,10个配对的鼻咽癌外周血样本和4个来自3个鼻咽癌研究的INP组织(图1a)。在T细胞亚群中,作者鉴定了三种FOXP3+ Treg亚型,即nTregs、rTregs和eTregs,它们具有不同的转录组特征。单细胞轨迹分析推断出两种CD4+ T细胞的发育谱系,其中naïve T细胞在BATF和FOXP3的转录驱动下分化为辅助T细胞或eTregs(图1b, 1c)。
为了了解CD4+ T细胞亚型是如何在TME中发生谱系转移的,作者首先量化了患者中每种亚型的标准化丰度。炎症组织和鼻咽癌外周血样本中含有丰富的CD4+ naïve T细胞和SELL+ nTregs部分,而在TME中,这些部分是有限的(图1d)。在分化的CD4+T细胞亚型中,rTregs和eTregs表现出对TME的偏好,而滤泡辅助T(TFH)细胞和中央记忆T(Tcm)细胞在INP组织中更加丰富(图1d)。然后,为了证实TME中Treg和朴素的CD4+T细胞之间的动态平衡受到损害,作者建立了两个使用eTreg和naïve T细胞特异性信号的多元线性回归模型,以基于NPC Bulk RNA-Seq队列计算Treg免疫抑制活性和T细胞naïveness。基于功能模块,作者阐明了高Treg和低naïve T细胞浸润是NPC患者的恶性标志,并与预后不良相关(图1e,f)。基于scRNAseq信号的CIBERSORTx去卷积进一步证实,在NPC患者中,更高的肿瘤内浸润和Tregs的抑制活性共同导致更差的预后,但与其他临床参数无关。作为TME中最发达的亚型,eTregs在STAT、TGF-β和干扰素信号共同诱导下,表达最高的免疫抑制信号,如CTLA4、LAYN和TNFRSF4,并具有最强的细胞因子通讯、代谢和T细胞抑制活性(图1g,h)。相反,受规范的WNT信号调节的nTregs和rTregs对T细胞的激活、增殖和凋亡的调节作用最小(图1h)。考虑到鼻咽癌中eTreg极化的CD4+T细胞格局,作者假设肿瘤内Treg丰度和抑制活性的共同增加可能是由肿瘤介导的CD4+ naïve T细胞到Treg的发展和Treg的激活共同引起的。
因此,为了阐明Tregs在TME中发展和激活的肿瘤依赖机制,作者建立了CD4+ naïve T细胞与鼻咽癌细胞系C666或正常鼻咽上皮细胞系NP460和NP69(图1i)直接或间接共培养的体外共培养系统。与在无肿瘤细胞和Transwell共培养系统中诱导CD4+ naïve T细胞产生Treg相比,直接共培养系统显示C666细胞增强了从CD4+ naïve T细胞到FOXP3+Treg的极化,并上调了重要的eTreg标志物CTLA4(图1j-l)。通过选择与Treg谱系测定和功能相关的基因面板的qRT-PCR(图1m),以及共培养系统中分泌的免疫抑制因子,包括IL-10、TGF-β和腺苷的ELISA分析(图1n),进一步验证了C666细胞的treg极化和激活作用。总之,转录组分析和功能分析初步表明,鼻咽癌中Tregs的发育和激活受细胞接触而不是细胞因子通讯的调节。

图1 极化CD4+ T naïve-to-Treg的发展和激活是鼻咽癌的肿瘤特异性特征
2、肿瘤限制性CD70通过与CD27相互作用与Treg丰度和激活相关
为了进一步确定CD4+ naïve T细胞、Tregs和NPC细胞之间的确切作用模式,作者使用了两个成熟的程序,CellPhoneDB和CellChat,它们基于scRNA数据评估细胞-细胞相互作用的强度和方向。CD70-CD27信号是鼻咽癌细胞、原始CD4+T细胞和Treg亚型之间最主要的相互作用之一,并以CD70/CD27表达依赖的方式发生(图2a,b)。尽管已发现与Treg发育和功能相关的其他相互作用,包括TIGIT、CD226、4-1BB和LGALS9,但它们似乎在CD4+ naïve T细胞和Treg亚型中都没有上调,在NPC微环境中的eTregs中也没有明显增强。因此,CD70-CD27信号被确定为在CD4+ naïve T细胞、Treg细胞和NPC细胞之间发生的重要的接触相互作用,从而具有调节TME中从头Treg发展和抑制活性的潜力。
CD70-CD27信号是促进Treg增殖的共刺激途径,但CD70-CD27信号在肿瘤浸润性Treg的发生和激活中的确切作用和分子机制尚不清楚。因此,作者最初基于Visium数据分析了鼻咽癌细胞、Tregs和CD70表达之间的空间接近性,其中整合的鼻咽癌scRNA-seq数据作为参考,通过基于锚定的反卷积和细胞定位推断肿瘤和Treg部分。在空间上,Tregs不仅与NPC细胞高度共定位,而且与CD70表达显著相关(图2c, 2d),表明CD70+ NPC细胞在调节近端Tregs中起积极作用。作者进一步通过流式细胞术检测了从新鲜内镜活检中分离的鼻咽癌细胞中的CD70表达,显示大约60%的EPCAM+肿瘤细胞是CD70+,而在EPCAM-浸润的免疫/基质细胞中只有10%的CD70+细胞(图2e)。此外,IHC和IF染色显示原发性鼻咽癌组织中的CD70表达和FOXP3+/CTLA4+ eTreg浸润明显高于非恶性鼻咽淋巴样组织(图2f、g)。
尽管少数效应T细胞、B细胞和树突状细胞在激活后短暂表达CD70,但单细胞分析证实,CD70在TME中的表达高度局限于鼻咽癌细胞(图2h)。作者根据中位CD70表达水平将整合scRNA-seq队列中的患者分为CD70-高和CD70-低两组,结果显示CD70-高的患者含有丰富的rTregs和eTregs,但减少了nTregs和CD4+ naïve T细胞的含量(图2i)。这种现象在原发性鼻咽癌活检qRT-PCR上得到了的证实,cd70-高的患者中Treg谱系和激活标志物FOXP3、IL2RA和CTLA4的表达更高(补充图2h),并根据上述流式细胞术结果进行分层(图2e)。同时,作者发现T细胞的细胞毒性/增殖与Treg分数之间的负相关仅在CD70高的患者中是明显的(图2j),这意味着CD70、Treg和T细胞免疫之间存在反馈回路。
在大量RNA-seq队列中,CD70表达在NPC患者中持续上调,并与较差的生存率相关(图2k, l)。作者进一步发现,C666细胞中CD70+的比例是NP460和NP69细胞的3倍(图2m),从而诱导了CD70-CD27结合时从共培养的CD4+初始T细胞表面切割出更高的可溶性CD27(SCD27)(图2n)。在诱导CD4 + naïve T细胞向Treg分化的时间分辨转录组分析中,计算出的Treg抑制评分随着FOXP3、CTLA4和CD27的表达成比例地增加,而naïve评分在此过程中呈现相反的趋势(图2o)。在大量RNA-seq队列中,作者确定CD70表达与抑制评分呈正相关,与naïve评分负相关(图2p)。这些结果提示CD70+鼻咽癌细胞具有treg极化和激活作用,但它可能双重依赖于鼻咽癌细胞中的CD70+部分和CD4+ naïve T细胞和treg中的CD27+部分。
由于鼻咽癌是一种独特的EBV+头颈部鳞状细胞癌(HNSCC),作者随后探讨了上述CD70+肿瘤细胞与Tregs之间的反馈回路是否存在于其他人类乳头瘤病毒+ (HPV+) HNCs中。通过分析两个独立的HNSCC scRNA-seq队列,作者发现与正常扁桃体微环境相比,rTregs和eTregs在HPV+ HNSCC微环境中没有显著浸润。此外,CD70在HNSCC细胞中的表达极低,也与HNC患者的预后不良无关。这些结果支持CD70介导的Treg免疫抑制是npc特异性的特征,可能不会导致HPV+ HNSCC患者的肿瘤进展或免疫治疗失败这一观点。
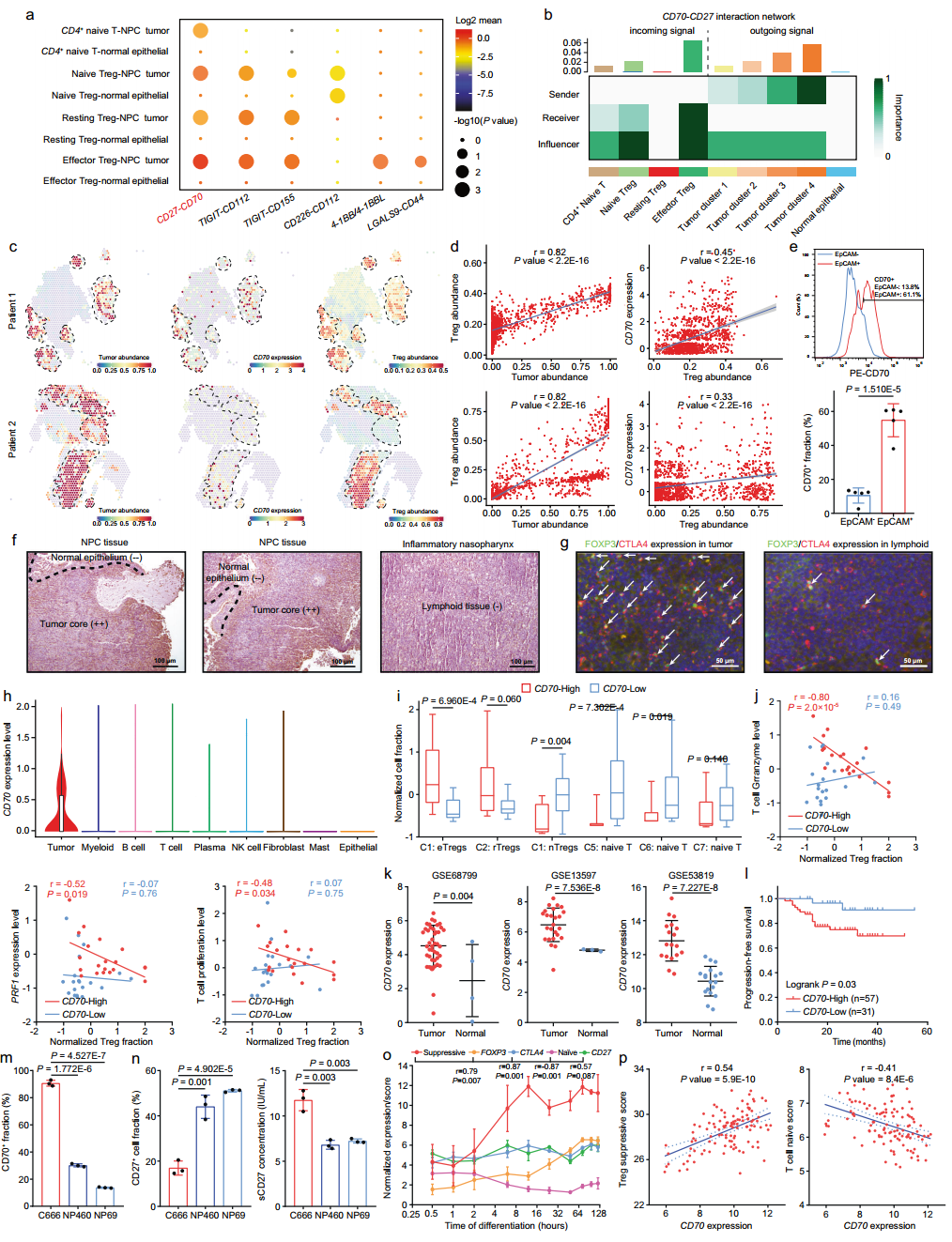
图2 CD70 +鼻咽癌细胞通过与CD4+/CD27+ T细胞相互作用,促进丰富和抑制性Treg浸润
3、在鼻咽癌细胞中敲除CD70可通过抑制Treg的发育和功能来减轻免疫抑制
为了阐明CD70对Treg发育和激活的直接影响,作者用活性重组CD70蛋白处理CD4+ naïve T细胞。激动剂治疗通过CD70-CD27相互作用上调CD4+ naïve T细胞FOXP3和CTLA4的表达,并增加免疫抑制因子的分泌(图3a-d)。随后,作者在C666细胞中进行了CRISPR介导的CD70(CD70-KO)基因敲除,这不影响C666细胞中PD-L1的表达或细胞增殖。然而,CD70-KO通过阻断CD27的相互作用(图3E-G)显著地减少了来自CD4+ naïve T细胞的Treg的发展和激活,并抑制了sCD27、IL-10、TGF-β和腺苷的Treg分泌组(图3g,h)。其他Treg激活标志物包括ICOS、TNFRSF4、4-1BB(由TNFRSF9编码)、GITR(由TNFRSF18编码)和TIGIT的流式细胞仪和qRT-PCR分析进一步证实了Treg抑制活性受损(图3i)。TIGIT是小组中only不受CD70-KO影响的标记,但这一结果与先前的研究一致,即TIGIT在Treg上的表达不受CD70-CD27共同刺激的影响。Treg抑制实验进一步证实了CD70-KO功能抑制了配对CD8+T细胞增殖的Treg抑制活性,这与上述结果相呼应。
考虑到受损Tregs的抑制活性可能会重振CD8+T细胞介导的抗肿瘤免疫,正如大量RNA-Seq数据GSEA分析所分析的那样,作者建立了以CD4+为主的肿瘤-外周血单个核细胞(PBMC)共培养体系。作者发现C666细胞中的CD70-KO大大增强了细胞毒性依赖性肿瘤细胞的死亡(图3j - 1),特别是在与鼻咽癌患者生理T细胞全局相似的共培养系统中,CD4+ T细胞上CD27的表达更高。较高的肿瘤细胞死亡率可能直接归因于CD70- NC C666细胞诱导的共培养CD4+ naïve T细胞和Tregs中CD70共刺激的缺失,而不是共培养系统中的CD4+和CD8+ T细胞。在CD70-KO系统中,CD8+/颗粒酶A+和CD8+/穿孔素+ T细胞组分、TNF-α和IFN-γ分泌以及CD8+ T细胞增殖均升高,PD-1和TIM-3表达降低(图3m-q),这表明受损的Treg抑制活性可以重新激活抗肿瘤CD8+ T细胞。
为了更全面地证明CD70-CD27相互作用对NPC浸润性T细胞的免疫抑制作用,作者设计了CD19+CD70-NC/ CD19+ CD70-KO C666细胞与抗CD19 CAR-T细胞的自体共培养系统。自体共培养系统可以激活CD4+和CD8+ T细胞中的抗原特异性T细胞,并对CD19+ CD70-NC和CD19+ CD70-KO C666细胞进行抗原特异性杀伤。与同种异体共培养系统的结果相比,CD70-KO在自体共培养系统中的C666细胞中持续抑制Treg极化、激活和抑制活性,从而增强抗原特异性T细胞杀伤和细胞毒性。此外,作者通过PBMC连续攻击亲代C666细胞来模拟鼻咽癌进展过程中的渐进性免疫逃逸,建立了免疫耐药的C666细胞。作者发现CD70在免疫耐受细胞中的表达持续上调,验证了CD70+NPC细胞在促进免疫逃避中的积极作用。
此外,缺乏小鼠鼻咽癌细胞系、自发的小鼠模型以及小鼠无法感染EBV一直阻碍着鼻咽癌免疫学和免疫治疗的转化研究。因此,作者建立了移植PBMC的人源化NSG小鼠模型,以研究CD70-KO C666细胞对浸润性Tregs发育和抑制活性的体内影响。与体外结果一致,CD70-KO在免疫缺陷的NSG小鼠中没有改变NPC的体内致瘤性(图3r),但在人源化的NSG小鼠中导致显著的肿瘤缩小(图3s),进一步证实了CD70在抗肿瘤免疫中的抑制作用。但是H&E染色在CD70-NC和CD70-KO肿瘤中的总免疫浸润之间没有显著差异,但CD70-KO肿瘤中FOXP3+Tregs的比例减少且活性受损,从而降低了TME中IL-10和TGF -β的浓度(图3t-v)。因此,CD70-KO肿瘤通过促进细胞毒性细胞因子的释放和防止T细胞耗尽来重振CD8+T细胞的效应谱(图3t,u)。这些结果提示,鼻咽癌患者中治疗性的CD70抑制可能是克服Treg免疫抑制进而激活T细胞免疫的有效策略。
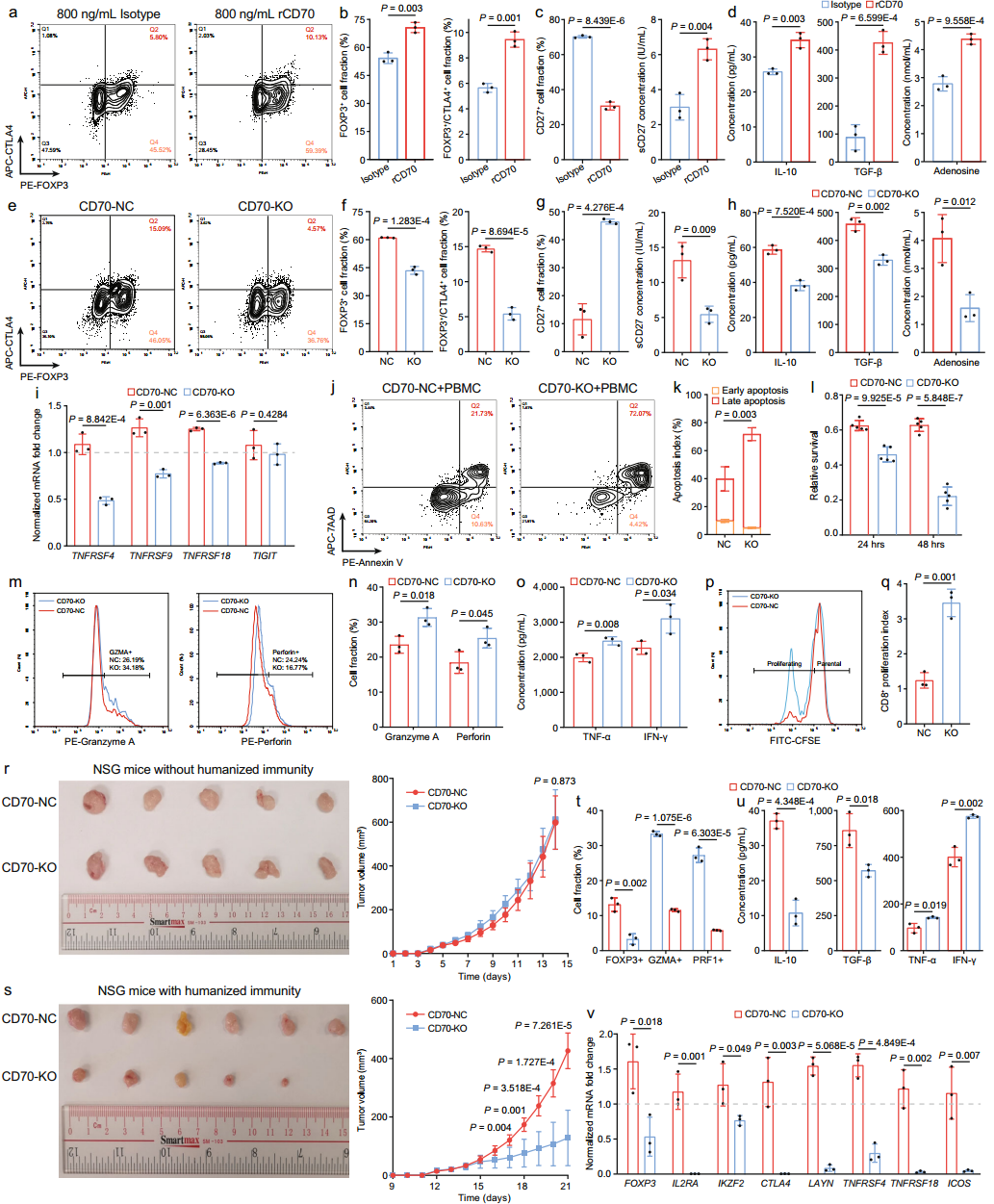
图3 鼻咽癌细胞中CD70基因缺失可恢复Treg抑制活性,增强TME中CD8+ T细胞功能
4、Cusatuzumab在患者衍生模型中增强抗肿瘤免疫并与抗PD-1治疗协同作用
考虑到CD27在T细胞、NK细胞和B细胞上的高表达,在使用CD27阻断时可能导致脱靶效应,CD70已成为一个更有效和安全的靶标,因为它在稳态期间不会在正常组织和造血细胞系上表达。Cusatuzumab是一种人αCD70单克隆抗体,可有效阻断CD70-CD27相互作用及其下游信号通路。到目前为止,cusatuzumab正在多个临床试验(NCT04023526和NCT04150887)中对急性髓系白血病(AML)患者进行评估,并显示出对CD70 +白血病干细胞的有效杀伤效果及可控的不良事件。然而,还没有在临床前的实体瘤中全面描述cusatuzumab的疗效。通过用5 μg/mL cusatuzumab处理C666细胞,作者发现在CD4+ naïve T细胞共培养系统中,Treg发育、活化、分泌免疫抑制因子以及抑制CD8+ T细胞增殖的能力被抑制到与CD70-KO相当的程度(图4a-d)。因此,在PBMC共培养系统中,通过促进CD8+ T细胞的增殖和细胞毒性,cusatuzumab治疗诱导了更高的肿瘤细胞死亡(图4e-i)。作者还评估了在PBMC共培养系统中,CD70封闭性抗体对免疫抑制的抑制作用。C666细胞中的CD70阻断显示了与cusatuzumab治疗相当的肿瘤杀伤和细胞毒性增强效果,进一步证实了CD70抑制在诱导更强的抗肿瘤免疫中是有效的。接下来,在患者来源的原代NPC细胞和自体PBMCs之间的共培养系统中,进一步验证了cusatuzumab的免疫激活作用。与IgG治疗相比,cusatuzumab治疗抑制了Tregs的抑制活性,这反过来激活了CD8+ T细胞的效应子功能,最终导致增强的肿瘤杀伤功效。
在这项研究中,cuatuzumab被证明通过缓解鼻咽癌中Treg的发展和抑制活性来增强T细胞免疫。或者,抗PD-1治疗通过防止T细胞耗尽直接释放CD8+/PD-1+ T细胞的增殖和激活。因此,联合抗CD70和抗PD-1治疗可达到增强抗肿瘤免疫的协同作用。为了研究这种潜在的协同效应,作者首先使用TIDE方法预测CD70高和CD70低的鼻咽癌患者的ICB反应性和T细胞特征。CD70高的鼻咽癌患者预计对ICB阻断更有抵抗力,表现出更低的T细胞毒性和炎症,但T细胞排斥率更高。除NPC外,CD70在其他实体肿瘤如黑色素瘤中也优先表达。一些黑色素瘤研究已经从接受ICB的应答者和无应答者中生成了TME转录组图谱,这些图谱的计算分析表明CD70表达与T细胞功能障碍和较差的ICB结果相关。为了验证CD70在黑色素瘤中的促肿瘤作用,作者在小鼠黑色素瘤细胞系中进行了CD70-KO:B16-F10,以及在C57BL/6J小鼠中原位注射CD70-NC和CD70-KO B16-F10细胞。CD70-KO导致黑色素瘤显著缩小,但作者也观察到CD70-KO对肿瘤的特异性反应,可能是由于小鼠特异性的TME。
在实验上,作者评估了CD70+PD-1在模拟鼻咽癌原发肿瘤生理状态的鼻咽癌器官中的阻断效果。作者从2018年建立的EBV+NPC患者来源的异种移植(Xeno76)中建立了NPC有机化合物,并相应地评估了CD70和PD-L1在Xeno76中的表达水平(图4j)。在有机物-PBMC共培养体系中,抗CD70单药和抗PD-1单药均显著增加肿瘤细胞死亡率,但联合治疗在有机物数量、大小和存活率方面显示出更好的杀瘤效果(图4k-n)。作者进一步比较了联合疗法和单一疗法在移植了Xeno76的PBMC和移植了人源化NSG的NSG小鼠中的体内疗效。一直以来,抗CD70+抗PD1联合治疗在抑制患者来源的异种移植(PDX)生长方面显示出最高的疗效(图4o,p)。同时,肿瘤浸润性Tregs和CD8+细胞毒性T细胞的比例在接受联合治疗后分别显著减少和增加(图4Q),这表明联合抗CD70和抗PD-1治疗获得了通过克服Treg介导的免疫抑制来刺激T细胞免疫的协同效应。

图4 治疗抑制CD70促进抗肿瘤免疫和抗PD-1疗效
5、CD70-CD27信号参与Tregs的脂代谢重编程
Treg是一种有弹性的T细胞亚型,具有很强的组织适应性和分子灵活性,有助于它们在不同的生态系统中存活、稳态和代谢,包括外周、淋巴结、胸腺和肿瘤。由于作者证明了CD70-KO和鼻咽癌细胞中的抑制通过限制Treg的活性来增强抗肿瘤免疫,作者进一步研究了CD70-CD27信号如何影响Treg下游的动态平衡,特别是在NPC的TME中。因此,作者在与CD70-NC和CD70-KO C666细胞共培养的PBMC中应用了额外的3‘scRNA-seq(图5a)。与作者的体外和体内结果一致,CD70-KO降低了nTregs、rTregs和eTregs的丰度,扩大了促炎亚型,包括CD8+细胞毒性T细胞、CD4+TFH细胞和CD4+ naïveT细胞(图5B)。
此外,与CD70-KO C666细胞共培养的PBMCs中的Tregs (KO-Tregs)表现出谱系特异性(FOXP3, IL2RA和SOX4),活化(CTLA4和LAYN)和共刺激(TNFRSF4和TNFRSF9)标记的表达较低,但naïve (SELL)特征标记的表达较高(图5c)。特别是,一些共培养的eTreg转变为脆弱状态,其先前的特征是FOXP3表达保留,但IFN-γ产生异常。然而,在与CD70共同培养的Treg中,PD-1的上调保护了这些细胞免受干扰素诱导的脆弱性,同时保持了功能稳态(图5c)。因此,在抗CD70治疗中加入PD-1阻断后观察到的协同作用也可能通过诱导Treg脆弱性来部分减少免疫抑制。CD70-KO组CD8+细胞毒性T细胞的增殖(MKI67)、细胞毒性(GZMA和LTB)和活化(TNFRSF1B和CD28)标志物的表达增加,而naïve (Tcf7和CCR7)和衰竭(LAYN、LAG3和HAVCR2)标志物的表达降低,进一步证实阻断Tregs的抑制活性促进了CD8+T细胞的增殖、激活和缓解衰竭(图5d)。CD70介导的Treg免疫抑制也阻碍了CD8+细胞毒性T细胞的炎症反应,从而降低了它们的抗肿瘤效果。
为了进一步阐明CD70-CD27信号在Tregs中的下游机制,作者对CD70诱导的Tregs和KO-Tregs进行了GSEA。CD70+C666细胞通过增强由复杂的脂质信号网络驱动的氧化磷酸化(OXPHOS),有效地重新编程共培养的Treg的代谢谱(图5e)。Treg经常需要强健的新陈代谢来维持它们在TME中的发育和抑制活动。特别是,Treg具有高能量驱动的可塑性,因此可以利用不同的代谢资源,包括乳酸、葡萄糖和脂肪酸(FAs),在代谢物缺乏的环境中维持功能平衡。通路分析表明,脂肪酸代谢、胆固醇稳态和线粒体功能是CD70诱导的Tregs中最丰富的信号,最近报道这些信号有助于Treg谱系确定、功能适应和免疫抑制(图5e)。例如,由脂肪酸氧化驱动的OXPHOS增加是TME中Treg发展和抑制活性的标志。同时,上调的解毒和氧化还原稳态保护CD70诱导的Tregs免受OXPHOS和ATP产生的高水平活性氧物种的影响,同时保持线粒体的完整性(图5f)。相反,KO-Tregs由于脂质外流和清除增加以及线粒体完整性丧失而表现出功能动态平衡受损(图5f)。

图5 单细胞分析显示CD70-CD27信号增强Tregs中脂质驱动的OXPHOS
6、线粒体的完整性、胆固醇的稳态和脂肪酸的氧化共同促成了Treg的功能特化
为了从机制上了解CD70诱导的复杂脂质网络如何在鼻咽癌微环境中增强Tregs的功能特化和动态平衡,作者评估了CD70-NC和CD70KO C666细胞共同培养的CD4+T细胞内总脂和关键脂成分(如胆固醇和脂肪酸)的变化。首先,鼻咽癌细胞中CD70的基因缺失和治疗抑制显著降低了共培养的Treg细胞的细胞内总脂质和胆固醇(图6a,b)。其次,从FOXP3-非Tregs、FOXP3+/CTLA4-rTregs到FOXP3+/CTLA4+eTregs,细胞内胆固醇增加,这表明细胞内胆固醇积累与Treg的发展和抑制活性有关(图6c)。在整合的NPC scrna-seq队列中,作者证实eTregs具有更强劲的胆固醇代谢和生物合成,但胆固醇输出较低。
考虑到脂质信号是一个高度复杂的网络,涉及各种代谢物的细微变化,作者进行了基于质谱的代谢组学,以量化共培养CD4+ T细胞中极性分子和脂肪酸的细胞内代谢变化(图6c)。质谱分析显示,CD70-KO组细胞内胆固醇和腺苷持续下降,CD39表达降低(图6d)。同时,增加甘油可以保护Tregs免受脂质累积毒性,后者损害FOXP3的稳定性(图6d)。OXPHOS衍生的代谢物被积极代谢,包括琥珀酸盐、2-羟基戊二酸盐(2-HG)和苹果酸盐,被积极代谢(图6d),这些代谢物之前被报道与Treg发育受损和通过PD-1的表观遗传抑制活性相关。而CD70-NC组、CD70-KO组和CD4+ T组细胞中的柠檬酸盐、天冬氨酸和谷氨酰胺保持不变。脂肪酸组,CD70-KO组总脂肪酸含量明显降低(图6d)。几乎所有细胞内脂肪酸衍生物C4到C26的浓度都降低了,这表明阻断Tregs中CD70-CD27信号通路可能会破坏新生脂肪酸的摄取、合成和氧化。
基于观察到的Tregs在CD70/CD27介导的脂质信号传导中的代谢适应,作者提出线粒体完整性、胆固醇稳态和脂肪酸代谢共同促成了Tregs在NPC微环境中通过CD70-CD27信号传导的代谢优势和功能特化。作者推测CD70作为一个主代谢开关,重新编程CD4+ naïve T细胞和Treg的脂质代谢,以满足这些细胞在恶劣环境中Treg发育、稳态和激活的代谢需求。为了验证作者的假设,作者首先在电镜下发现KO-Tregs的线粒体较少且不健康(图6e),导致海马实验和JC-1染色显示的ATP生成、OXPHOS和线粒体电位减少(图6f-h)。此外,作者评估了Tregs中46个参与脂质合成、运输和氧化的代表性基因的变化,其中超过70%的选定特征受到CD70-CD27信号传导的显著影响(图6i)。
鉴于CD70诱导的Tregs细胞内胆固醇升高,作者首先检查了参与调节胆固醇摄取的LDLR的变化。有趣的是,在CD70诱导的Tregs中,LDLR的表达并未增加,而胆固醇外排相关基因(如SCARB1和SDC1)被发现下调,这表明胆固醇积累是由抑制胆固醇输出引起的。此外,通过甲羟戊酸途径参与胆固醇代谢和Treg稳态的关键调节因子和酶,包括SREBF1、SREBF2、HMGCS1、SOAT1、SOAT2、FNTB、PGGT1B、GGPS1、RAC2和PD-1,促进Treg的发育和维持,也被CD70-CD27信号增强(图6i)。
脂肪酸摄取和重新合成引起的Tregs细胞内脂肪酸积累积极参与IL-2依赖性增殖和TCR依赖性活化。通过BODIPY C12示踪和FAO通路中的三种酶(ACADVL、ACADM和HADHA)水平确定,CD70-KO在共培养的CD4+ T细胞中损害了脂肪酸摄取和氧化。在CD70共培养的CD4+ naïve T细胞中,增加的ACACA而不是FASN,也可能通过重新合成FA促进细胞内脂肪酸积累,从而上调TCR依赖的Treg激活和成熟标记TNFRSF18和CD44(图6i)。如上所述的代谢实验表明,CD70诱导的Treg中积累的脂肪酸库通过线粒体OXPHOS为FAO提供了足够的资源,这些资源持续产生ATP,足以满足Treg功能化和TME中生存的高能量需求。
以前已经证明线粒体复合物III对于Treg抑制活性和增强FAO驱动的OXPHOS是必需的。与线粒体复合体III的完整性和功能相关的UQCRFS1,UQCRQ和CYC1,在由CD70-CD27信号激活的Tregs中上调,与电子显微镜图像协调一致(图6e,i)。作者还发现TCA循环和电子传递链(ETC)中关键调节因子和酶的上调,包括NR4A1、NR4A2、MDH1、MDH2、ECHS1和ECH1(图6i)。其他转录因子,包括STAT5A和cAMP诱导因子,如CREB1和CEBPB,与Tregs的代谢适应性相关,可能确保Tregs在NPC微环境中的功能特化(图6i)。然而,其他几个重要的脂质代谢相关基因,包括SQLE,SCAP,HMGCR,ATF4,CCDC5B,LAGLS3,CTNB1和EGR1,没有差异表达(图6i),表明在肿瘤特异性的神经干细胞内,Tregs中存在一种可替代的和独立于CD70之外的脂质信号。
作者进一步构建了脂质信号模块,其包含基于多元线性回归从qPCR组中选择的15个代表性签名基因,以定量评估单细胞和大量转录组数据集中Tregs和其他CD4+ T细胞中的脂质信号活性。
首先,NPC细胞中CD70的基因去除显著损害了共培养Tregs中的脂质信号传导(图6j)。同时,在整合的NPC单细胞群组中,eTregs具有最高的脂质信号传导活性,超过rTregs、nTregs和其他CD4+亚型,包括TFH细胞、TCM细胞和naïve细胞(图6k)。在时间分辨的Treg分化模型中,脂质信号活性与naïve T细胞至Treg分化期间的Treg抑制评分和CD25表达正相关,与幼稚评分和IL7R表达负相关(图6l)。在大量RNA-seq群组中,脂质信号传导活性与Tregs的抑制活性和NPC患者的不良预后高度相关(图6m,n)。此外,在GTEx的337份全血样本的转录组数据中,15个代表性特征基因与CD70、CD27、FOXP3、CTLA4和CD25之间的相关性得到了独立验证(图6o),表明脂质模块与Treg活性在个体中一致相关。总之,这些发现表明脂质代谢重编程和CD70-CD27信号在谱系确定、稳态和NPC浸润Tregs抑制活性中的密切合作。
为了验证脂质代谢在CD70诱导的鼻咽癌微环境中Treg的发展和激活中的重要性,作者评估了CD70-NC和CD70-KO与去脂微环境共培养时的功能和代谢变化。在去脂共培养系统中,CD70+ NPC细胞不再诱导CD4+ naïve T细胞分化出更高比例的总活化treg,也不再诱导更强的CD8+ T细胞增殖抑制(图6p, q)。在脂质耗尽系统中,CD4+ T细胞与CD70-NC和CD70-KO C666细胞共培养的免疫抑制分泌组谱也没有差异(图6r)。因此,脂质缺失也导致CD70-CD27相互作用不能调节NPC-PBMC共培养系统中的Treg免疫抑制,导致CD70-NC组和CD70-KO组的抗肿瘤免疫增强(图6s)。此外,由于缺乏可被吸收和合成的游离脂,NC-Tregs和KO-Tregs的细胞内总脂质含量保持不变(图6T)。代谢分析进一步表明,即使在CD70-CD27信号活跃的情况下,脂肪缺失时,Tregs的ATP生成、OXPHOS、线粒体完整性和脂肪酸氧化也显著受损(图6u-x)。这些结果成功地证明了CD70CD27相互作用对于促进鼻咽癌浸润性树突状细胞的发育、动态平衡和抑制活性是必不可少的脂代谢。
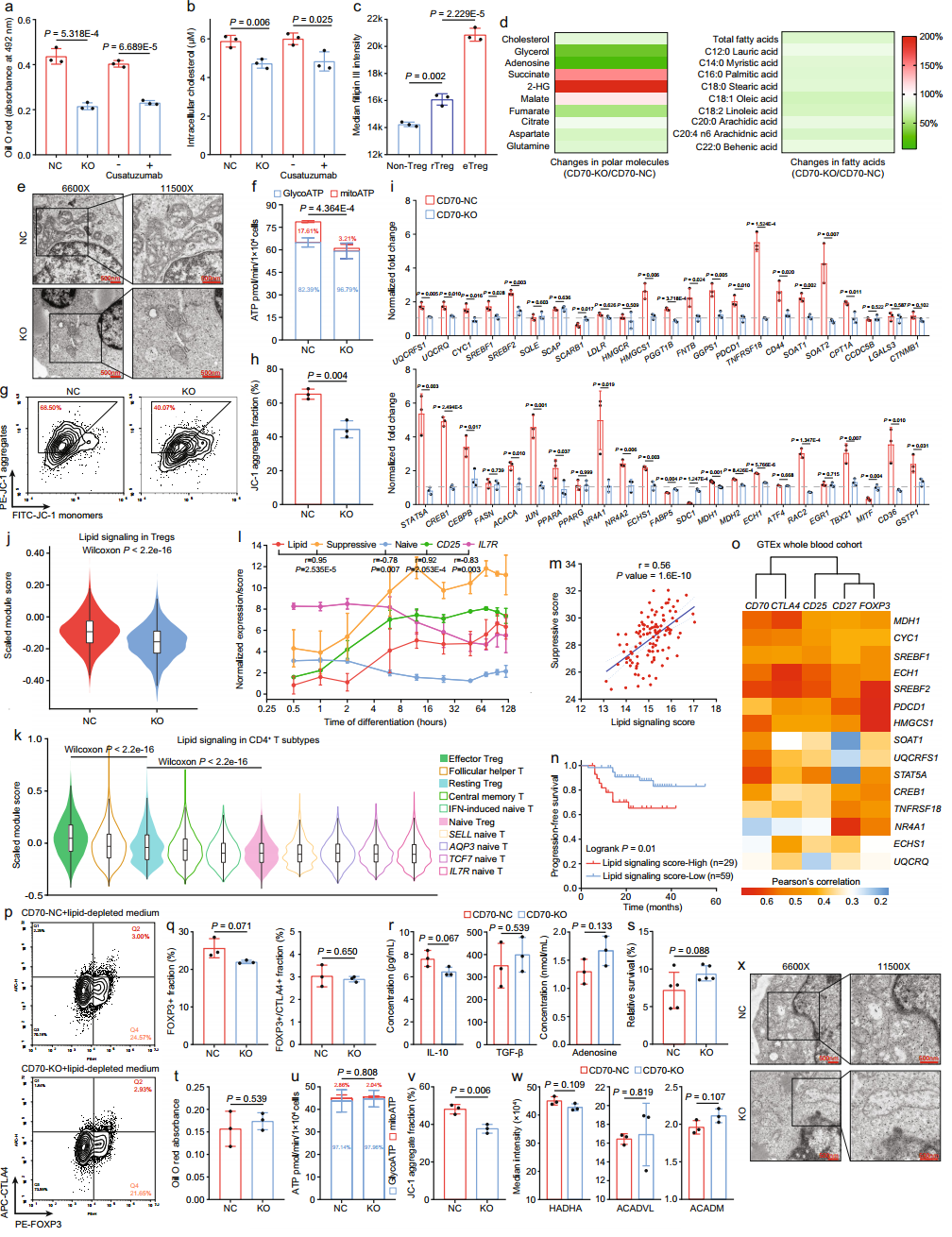
图6 脂质信号促进Treg发育、动态平衡和抑制活性
由于CD70在鼻咽癌组织中的过度表达在临床上经常被观察到,作者想要探讨CD70介导的免疫逃避的上游机制。单细胞分析发现,CD70的转录组水平在EBV+NPC细胞中显著过表达(图7a)。作者证实,与EBV-对应物相比,EBV+ NPC43细胞中的CD70+ 分数更高(图7a)。NPC的EBV感染导致基因组不稳定,因此表观遗传学刺激癌基因的转录以促进肿瘤进展和免疫逃逸。据报道,染色体19上的CD70基因的染色体位点在NPC经常被扩增。因此,为了描述CD70在NPC的过度表达是否是由EBV介导的染色质可及性改变引起的,作者对EBV+ NPC细胞、EBV- NPC细胞和NPE细胞进行了ATAC序列分析。与EBV-和正常对应物相比,EBV+ NPC细胞中CD70启动子区域的染色质可及性增强,使得转录因子结合更有效,从而促进CD70 mRNA转录(图7b)。基于ATAC分析,作者鉴定了在EBV+ NPC细胞中具有最高转录活性的前15个转录因子,其可能以更高的可及性与CD70启动子区域结合(图7c)。在15个转录因子中,作者表征了NFKB2是在两个NPC RNA-seq队列和Visium空间数据中验证的与CD70表达最相关的一个,并且具有与JASPER预测的CD70启动子区域的最高结合分数图(7d,e)。在EBV-感染的淋巴细胞中,还发现NFKB2与CD70高度相关,表明在免疫和上皮细胞中一致的EBV调节的表观遗传学(图7f)。
NFKB2是NF-κB通路的主要调节因子,NF-κB通路被广泛认为是NPC启动和进展的同质驱动因子。NFKB2经常在EBV+ NPC细胞中过表达,而不是在TME中的EBV-肿瘤细胞、NPE细胞、基质细胞和免疫细胞中过表达(图7g),并且先前已经显示促进肿瘤生长和存活。然而,其对NPC免疫逃避的调节作用以及与CD70上调的分子连锁尚未被全面阐明。因此,为了描述NFKB2对CD70转录的调节作用,作者在CD70启动子区域确定了NFKB2独特的结合基序,该基序因EBV感染而增强了可及性(图7b)。因此,作者设计了一个点突变的CD70与荧光素酶结合的基序,并证明了NFKB2可以特异性地和有效地结合到这个位点上,以增强CD70的转录(图7h)。为了进一步验证NFKB2作为CD70转录增强子的作用,作者在C666细胞中进行了NFKB2基因敲除和抑制,显示CD70 mRNA和CD70蛋白持续下降(图7i至7k)。C666细胞中NFKB2的丢失使它们在PBMC共培养系统中对免疫攻击敏感(图7l,m)。这些数据揭示了EBV-NFKB2-CD70轴是鼻咽癌细胞通过上调Treg免疫抑制来逃避免疫监视的重要机制,Treg免疫抑制降低了T细胞免疫。
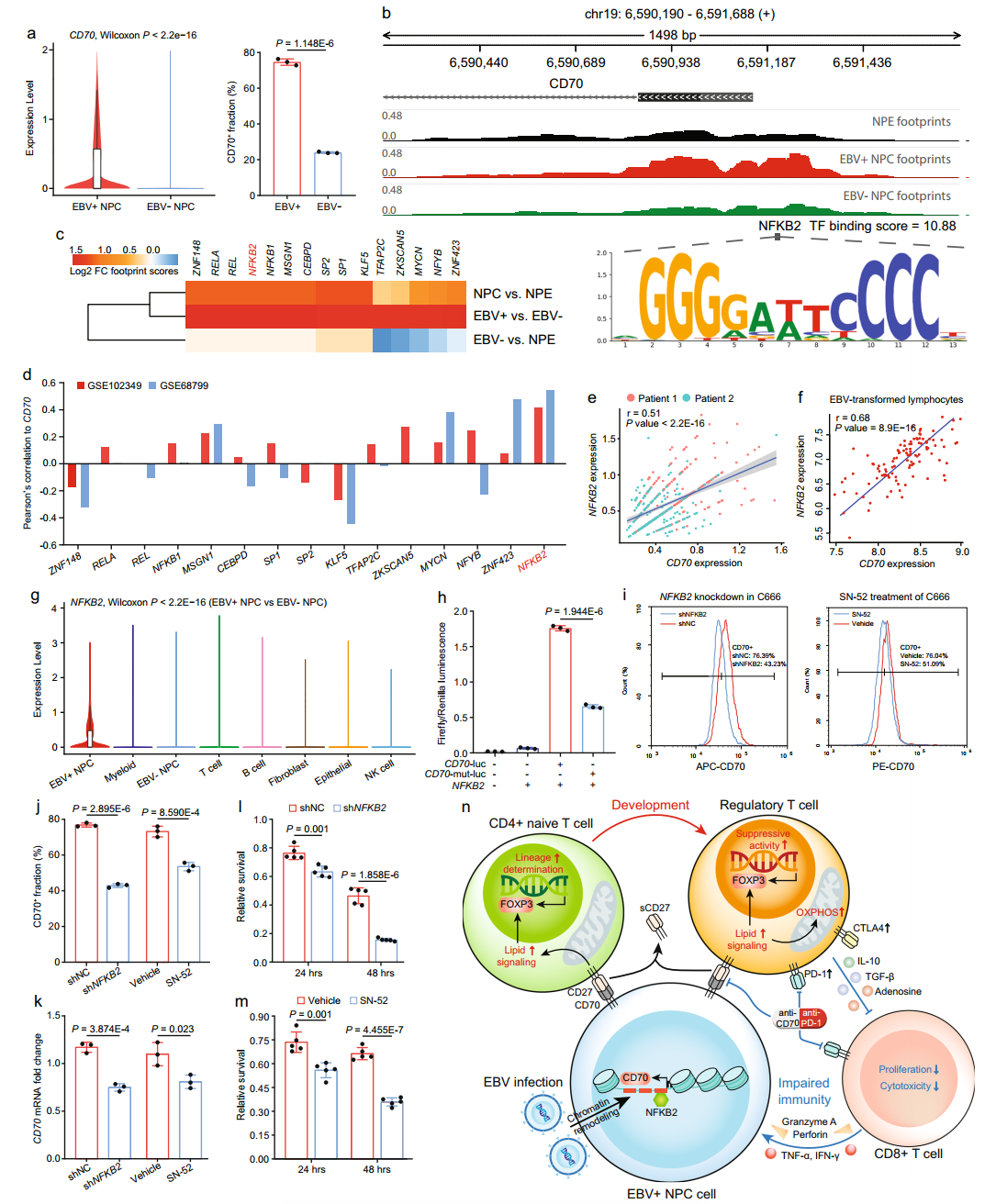
图7 EBV感染增加CD70启动子染色质可及性并通过NFKB2促进CD70转录
总之,作者的多组学驱动的功能研究为在鼻咽癌微环境中如何发展、激活和维持Tregs提供了临床前的见解,并表明CD70抑制是一种治疗上可行的方法,可以克服免疫抑制的TME,协同提高抗PD-1治疗的疗效。抗CD70+抗PD-1联合治疗可能对晚期或耐药鼻咽癌患者产生特殊的益处,优化了这些患者的常规治疗。作者还认为,多组学NPC T细胞队列以及已建立的功能模块,如Treg抑制、T细胞幼稚和Treg脂信号模块,可以应用于其他恶性肿瘤肿瘤浸润性T细胞的免疫抑制和代谢重编程的未来研究,或用于定量评估免疫治疗反应的常规临床应用。最后,这种由CD70-CD27信号诱导的脂质驱动的免疫抑制机制为鼻咽癌患者开辟了CD70靶向精确治疗的新途径,并可能对黑色素瘤患者有效,这取决于他们特定的TME环境。
实验方法
单细胞测序、伪时间发育轨迹、单细胞基因集变异分析(GSVA)、细胞培养、流式细胞术、酶联免疫吸附试验(ELISA)、qRT-PCR、细胞间通讯分析、空间转录组测序和分析、免疫组化(IHC)、免疫荧光(IF)、Treg抑制试验、细胞增殖和存活分析、细胞凋亡分析、CFSE染色和分析、慢病毒包装、小鼠模型的建立及异种移植、GSEA分析、油O红染色和定量、代谢组学、双荧光素酶报告基因测定
参考文献
L. Gong, J. Luo, Y. Zhang, et al. Nasopharyngeal carcinoma cells promote regulatory T cell development and suppressive activity via CD70-CD27 interaction, Nature Communications 14(1) (2023).






